
- •1.3. Равновесный состав газовой атмосферы
- •1.3.1. Общая методика термодинамического анализа и расчета состава газовой фазы
- •Равновесия в системе с – н – о
- •1.3.2. Упрощения расчетов равновесного состава газовой фазы
- •2,2 % Со2; 13,6 % со; 18,6 % н2; 10,9 % н2о; 54,7 % n2.
- •1.3.3. Роль углерода в формировании состава и свойств газовой фазы
Р
Рис. 1.5. Схема
сложного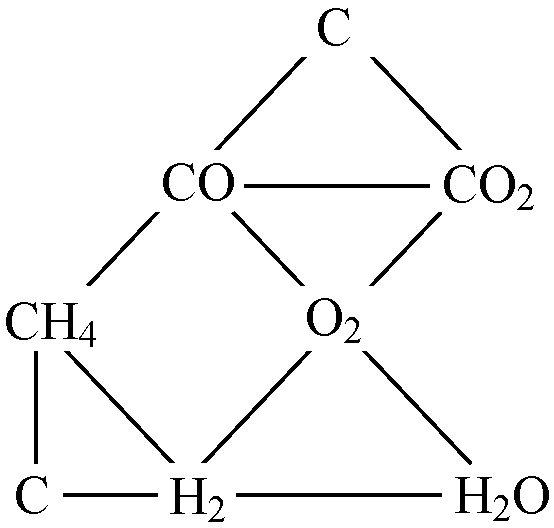
Равновесия в системе с – н – о
ешение.В общем случае при горении
метана образуется сложная газовая
смесь, содержащая все реагенты реакций
(1)–(12) и азот воздуха. При пиролизе
метана или при распаде СО в системе
может появиться твердый углерод. В этом
случае устанавливается сложное равновесие
(рис. 1.5) как сочетание
частных равновесий.
В данной задаче будем считать, что по кинетическим причинам образование твердого углерода заторможено. Равновесия с участием Стврассматривать не будем.
Данная система С – Н – О – Nявляется 4 компонентной (![]() )
и однофазной (n =
1), значит, пятивариантной (
)
и однофазной (n =
1), значит, пятивариантной (![]() ).
Для анализа необходимо знание пяти
независимых параметров. ВыбираемР,Т,
).
Для анализа необходимо знание пяти
независимых параметров. ВыбираемР,Т,![]() ,
,![]() ,
,![]() Тогданеизвестными
оказываются
равновесныедавления
Тогданеизвестными
оказываются
равновесныедавления
![]()
![]()
![]()
![]()
![]()
![]()
![]() .
Система уравнений связи:
.
Система уравнений связи:
![]()
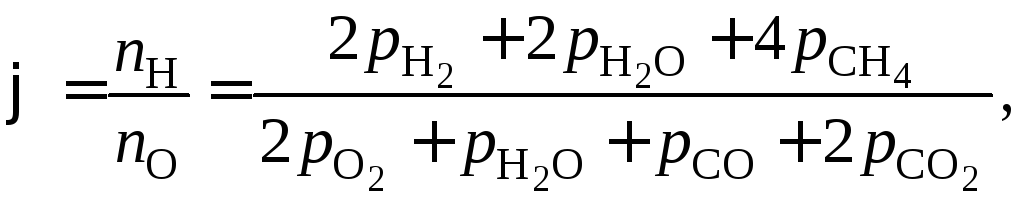
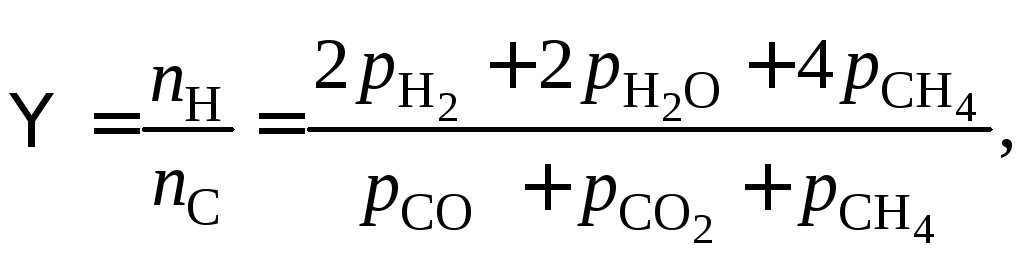
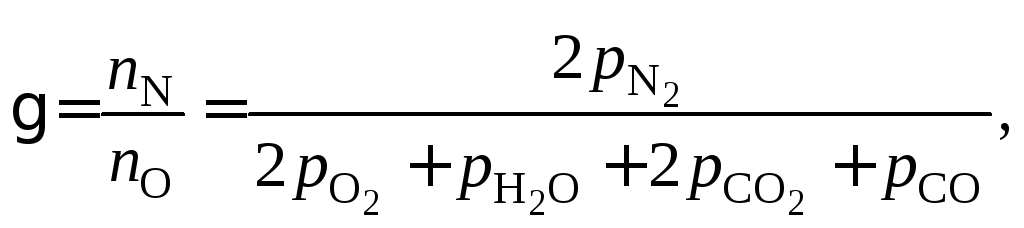

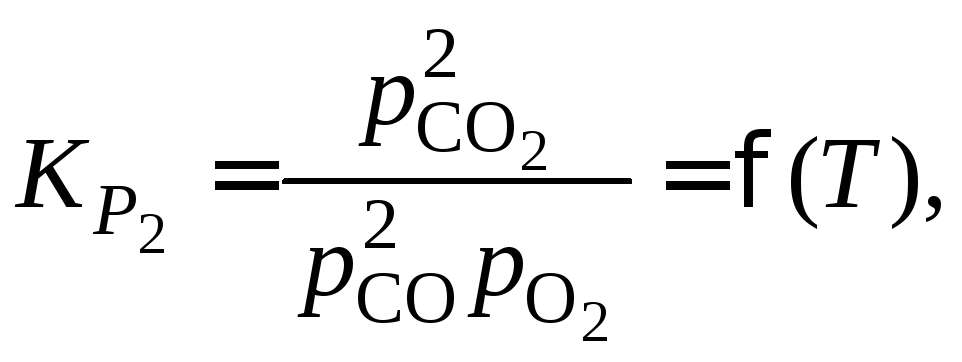
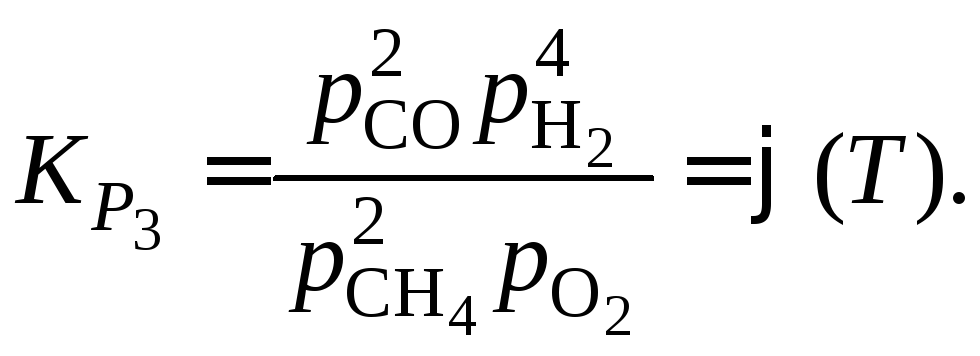
Можно заметить, что возможна запись констант равновесия других 3 реакций. Однако следует проверить: действительно ли выбранные реакции независимы.
Исходное состояние смеси удобно записать
в виде:
![]() .
Тогда концентрационные параметры:
.
Тогда концентрационные параметры:
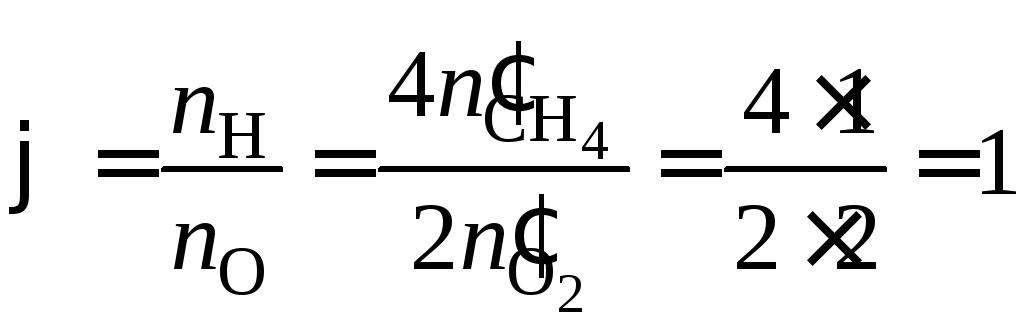 ,
, и
и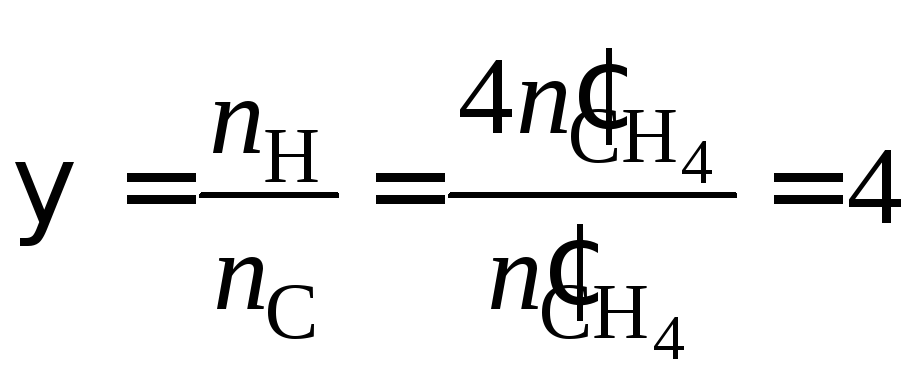 .
.
1.3.2. Упрощения расчетов равновесного состава газовой фазы
Часто содержания компонентов в газовых
фазах металлургических систем – величины
разного порядка. При температурах
пирометаллургических процессов
![]() и
и![]() весьма
малы. Тогда в системе С – Н – О
расчет основан на реакциях (5) и (10). Эти
реакции являются регулирующими состав
в газовых атмосферах при использовании
природного газа или увлажненного дутья
в доменной печи, углеводородного топлива
и других углеродсодержащих материалов
в конвертере и других
металлургических агрегатах и системах.
весьма
малы. Тогда в системе С – Н – О
расчет основан на реакциях (5) и (10). Эти
реакции являются регулирующими состав
в газовых атмосферах при использовании
природного газа или увлажненного дутья
в доменной печи, углеводородного топлива
и других углеродсодержащих материалов
в конвертере и других
металлургических агрегатах и системах.
Р
Рис.
1.6. Равновесные отношения pCO/pCO2
и pH2/pH2O
в газовой смеси
CO –
CO2
–
H2
–
H2O
при различных
температурах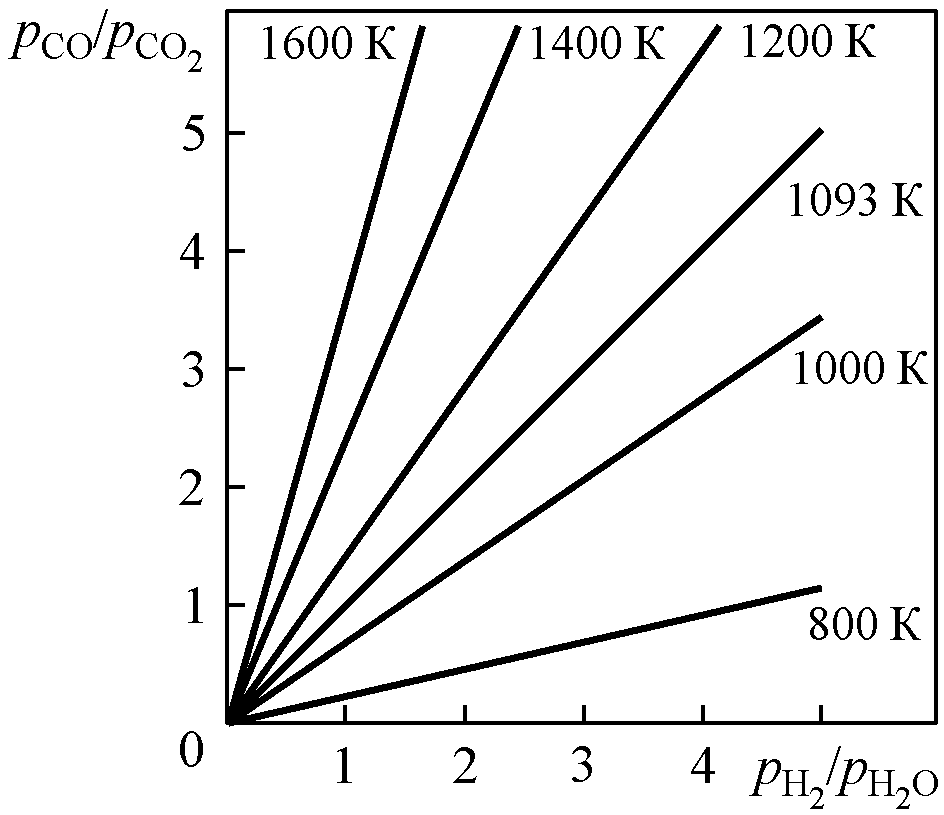
 следует пропорциональность
следует пропорциональность![]() (при введении обозначений
(при введении обозначений![]() и
и![]() ).
Функцию
).
Функцию![]() можно представить графически (рис. 1.6).
Для расчета
можно представить графически (рис. 1.6).
Для расчета![]() применяют уравнение
применяют уравнение![]() ,
полученное из выражения
,
полученное из выражения
![]() при подстановке в него зависимости
при подстановке в него зависимости![]() (см. пример 1.4).
(см. пример 1.4).
Следует отметить,
что представленные
простейшие изотермические зависимости
дают строгую связь отношений
![]() и
и![]() ,
но указывают и на неопределенность
равновесных составов газовых смесей.
Из графика при заданной температуре
и значении
,
но указывают и на неопределенность
равновесных составов газовых смесей.
Из графика при заданной температуре
и значении![]() можно определить равновесное сx
отношение
можно определить равновесное сx
отношение
![]() и наоборот. Зная состав газовой атмосферы
металлургического агрегата или
системы, можно на основе графика решить
вопрос о равновесности газовой фазы и
спрогнозировать протекание процессов
изменения ее состава и свойств.
Если одно из отношений при определенной
температуре на графике не соответствует
другому, то смесь неравновесна. Ее
следует рассматривать как исходную,
и выполнить расчет
равновесного состава сложного газа.
и наоборот. Зная состав газовой атмосферы
металлургического агрегата или
системы, можно на основе графика решить
вопрос о равновесности газовой фазы и
спрогнозировать протекание процессов
изменения ее состава и свойств.
Если одно из отношений при определенной
температуре на графике не соответствует
другому, то смесь неравновесна. Ее
следует рассматривать как исходную,
и выполнить расчет
равновесного состава сложного газа.
Все точки на изотермической прямой
соответствуют состояниям системы
с одним и тем же значением![]() .
Это означает, что различные по составу
двухкомпонентные смеси характеризуются
одинаковым сродством к кислороду и
одинаковыми окислительно-восстановительными
свойствами. При 1093 К, как было
отмечено в примере
1.1,
сродство к кислороду у водорода и СО
одинаково, и это проявляется
на графике равенством отношений (
.
Это означает, что различные по составу
двухкомпонентные смеси характеризуются
одинаковым сродством к кислороду и
одинаковыми окислительно-восстановительными
свойствами. При 1093 К, как было
отмечено в примере
1.1,
сродство к кислороду у водорода и СО
одинаково, и это проявляется
на графике равенством отношений (![]() ),
так как
),
так как
![]() при 1093 К.
При всех других температурах равноценные
по окислительно-восстановительным
свойствам смеси имеют разные составы.
Например, из графика следует, что
смеси Н2– Н2О с
отношением
при 1093 К.
При всех других температурах равноценные
по окислительно-восстановительным
свойствам смеси имеют разные составы.
Например, из графика следует, что
смеси Н2– Н2О с
отношением
![]() при 1400
К соответствует смесь СО – СО2с отношением
при 1400
К соответствует смесь СО – СО2с отношением
![]() .
.
Пример 1.8. Привести методику расчета состава равновесной газовой фазы, образующейся из смеси СО2и Н2в отношении 3:1 при 1400 К. Определить равновесное давление кислорода.
Решение. Записываем уравнение реакции водяного газа (5) и вводим обозначения, характеризующие исходное и равновесное состояния газовой фазы:
![]()
исходный состав, моль 3 1 – –
равновесный состав, моль 3 – x 1 –x x x
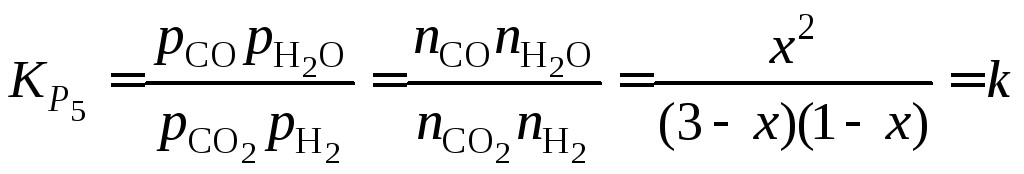 . (1.12)
. (1.12)
Отсюда получаем
квадратное уравнение
![]() .
Константу равновесия
.
Константу равновесия![]() =2,417
при 1400 Квычисляем
из выражения
=2,417
при 1400 Квычисляем
из выражения ![]() .Подставляя
.Подставляя
![]() в уравнение(1.12),
находим х =
0,858. Равновесный состав газа, мол. (об.)
%:
в уравнение(1.12),
находим х =
0,858. Равновесный состав газа, мол. (об.)
%:
![]()
![]()
![]() .
.
Равновесное давление кислорода находим
из выражений для константы равновесия
и
![]() реакции (1):
реакции (1):
![]() ,
,
где константа равновесия
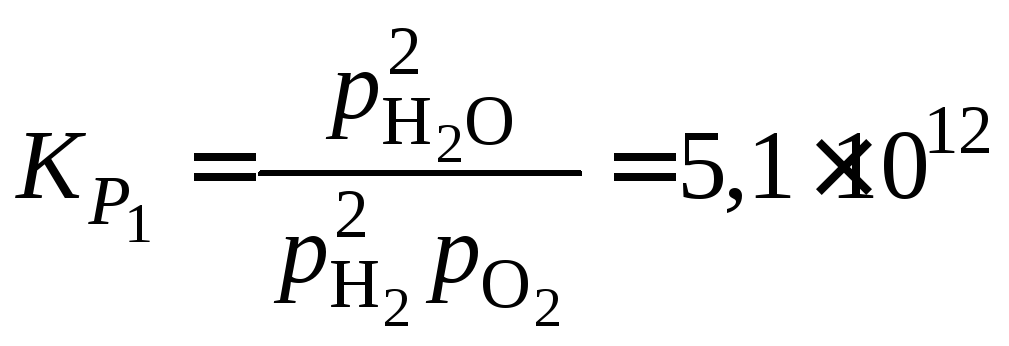 при 1400 К.
при 1400 К.
Тогда
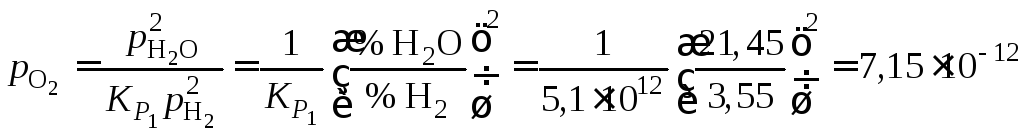 атм.
атм.
Вычисленное значение
подтверждает весьма низкие содержания
молекулярного кислорода в высокотемпературной
газовой фазе системы
![]() .
.
Пример 1.9.Рассчитать состав равновесной газовой фазы, образующейся из смеси природного газа и воздуха, подаваемой в нагревательную печь в соотношении 1:5. Температура печи поддерживается постоянной и равной 1600 К. ДавлениеР=1 атм. Вычислить равновесные давления кислорода и метана в газовой смеси.
Исходный состав природного газа: 83 об. % СН4; 16 об. % С2Н6; 1 об. % N2. Состав воздуха: 21 об. % О2; 79 об. % N2.
Решение. Считаем, что содержания СН4, С2Н6и О2в равновесной смеси ничтожно малы. АзотN2не реагирует, и его количество в равновесной и исходной смесях одно и то же.
Тогда равновесие определяется реакцией водяного газа (5). При указанных упрощениях необходимо вычислить 4 неизвестные величины, определяющие содержание компонентов, указанных в уравнении(5).
Выражаем константу равновесия через количество молей реагентов
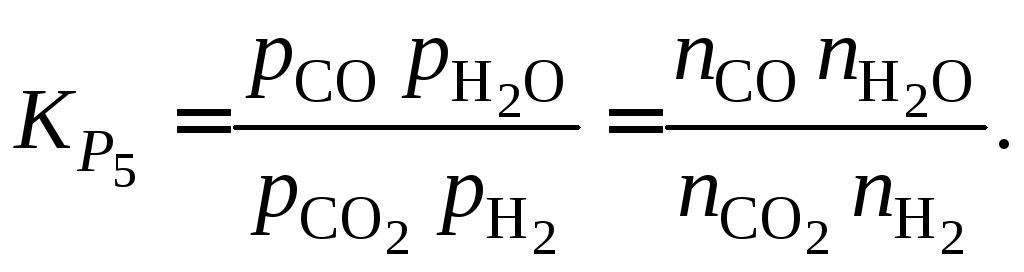
Записываем еще три необходимые уравнения на основе материального баланса по каждому элементу в газовой фазе:
![]()
![]()
![]()
«Штрих» относится к исходному составу газовой смеси.
В расчете на 1 моль природного газа исходная смесь содержит:
![]() моль;
моль;![]() моль;
моль;![]() моль;
моль;![]() 3,96 моль.
3,96 моль.
Тогда
![]() (1.13)
(1.13)
![]() (1.14)
(1.14)
![]() .(1.15)
.(1.15)
Из выражения
![]() (см. пример 1.8) для
(см. пример 1.8) для![]() К
К
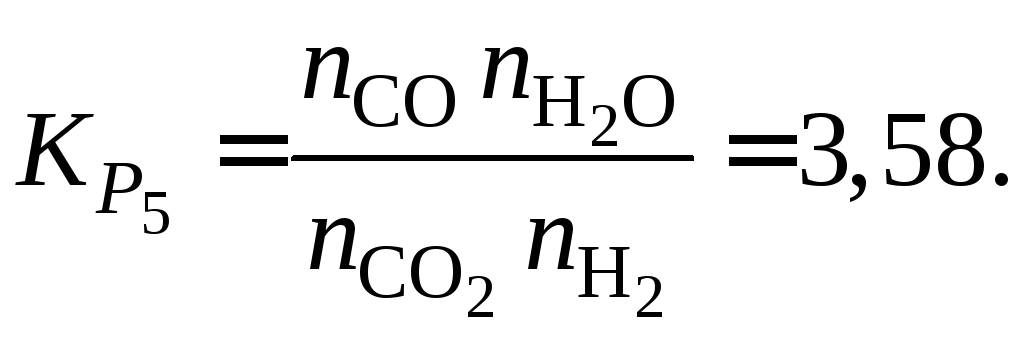 (1.16)
(1.16)
Решение системы 4 уравнений (1.13–1.16) возможно на ЭВМ. Можно также после преобразований получить и решить квадратное уравнение:
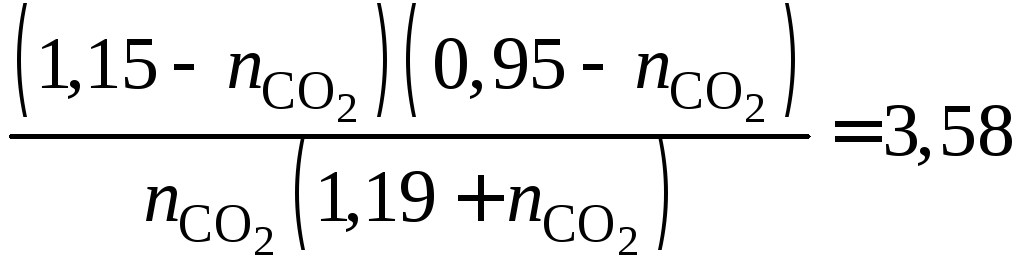 ,
,
из которого
![]() моль.
Количества остальных реагентов из
уравнений (1.13–1.16):
моль.
Количества остальных реагентов из
уравнений (1.13–1.16):![]() ;
;![]() ;
;![]() моль.
С учетом
моль.
С учетом![]() моль мольные доли
газов равновесной смеси равны:
моль мольные доли
газов равновесной смеси равны:
![]()
и соответствуют мольному (объемному) составу (%) смеси:
