
- •1.3. Равновесный состав газовой атмосферы
- •1.3.1. Общая методика термодинамического анализа и расчета состава газовой фазы
- •Равновесия в системе с – н – о
- •1.3.2. Упрощения расчетов равновесного состава газовой фазы
- •2,2 % Со2; 13,6 % со; 18,6 % н2; 10,9 % н2о; 54,7 % n2.
- •1.3.3. Роль углерода в формировании состава и свойств газовой фазы
1.3. Равновесный состав газовой атмосферы
1.3.1. Общая методика термодинамического анализа и расчета состава газовой фазы
Может быть рекомендована следующая последовательность анализа и расчета:
– оценка вариантности системы и определение числа параметров, необходимых для термодинамического описания и расчета;
– выбор параметров в качестве независимых; качественный анализ их влияния на равновесное состояние системы; определение значений независимых параметров;
– определение числа неизвестных (вычисляемых) переменных и составление системы уравнений связи между переменными;
– решение системы уравнений, представление состава газовой смеси в мольных (объемных) процентах;
– анализ результатов расчета; определение характера изменений в системе при ее переходе от исходного (неравновесного) в равновесное состояние при различных условиях.
Вариантность системы определяется с помощью правила фаз Гиббса
![]() ,
,
где f – число степеней свободы системы, вариантность системы;k– число независимых компонентов;n– число фаз.
Число независимых компонентов находится из разности
![]() ,
,
где
![]() –
общее число веществ в системе;
–
общее число веществ в системе;![]() –
число независимых реакций между ними.
–
число независимых реакций между ними.
Установлено, что для систем, представленных реакциями (1)–(12), число kсовпадает с числом элементов в системе.
Частные равновесия (1) и (2) относятся к
двухкомпонентным (Н – О
и С – О)
и однофазным (![]() ),
а значит, трехвариантным системам (
),
а значит, трехвариантным системам (![]() ).
).
Частные равновесия (8)–(10) (система C – О)
относятся к двухкомпонентным и двухфазным
(![]() ),
а значит, бивариантным системам (
),
а значит, бивариантным системам (![]() ).
).
Частные равновесия (3)–(7) (система
C – Н – О
в отсутствии твердого углерода) относятся
к трехкомпонентным и однофазным (![]() ),
а значит, четырехвариантным системам
(
),
а значит, четырехвариантным системам
(![]() ).
).
Частные равновесия (11) и (12) (система
C – Н – О
при наличии твердого углерода) относятся
к трехкомпонентным и двухфазным (![]() ),
а значит, трехвариантным системам (
),
а значит, трехвариантным системам (![]() ).
В данном случае это означает, что для
описания равновесного состояния этих
систем необходимо знать значения трех
независимых параметров.
).
В данном случае это означает, что для
описания равновесного состояния этих
систем необходимо знать значения трех
независимых параметров.
В качестве независимых параметров практически всегда задаются температурой Ти давлениемР. При необходимости дополнительными переменными являются концентрационные параметры. В качестве независимых могут быть заданы некоторые равновесные переменные, к значениям которых должна приходить система по требованию расчетчика.
Концентрационные параметры отражают соотношения между количествами элементов в смеси, неизменные при любых состояниях системы. Они должны быть достаточно просто найдены из исходного состава смеси и выражены через искомые равновесные переменные.
Значения всех других переменных не
могут быть заданы произвольно; они
определены величинами заданных
независимых параметров. Эти переменные
в общем случае представляют в виде
равновесных давлений газов в определенных
соотношениях – уравнениях связи. Число
уравнений связи должно быть равно числу
искомых равновесных переменных. Система
уравнений связи при большом их числе
решается с помощью ЭВМ. Вычисленные
равновесные давления газов![]() затем пересчитываются на объемные
(мольные) проценты газов в смеси.
затем пересчитываются на объемные
(мольные) проценты газов в смеси.
Пример 1.5.Составить систему уравнений связи между переменными для расчета состава газовой смеси в системе Н – О при заданных значенияхРиТи указанном исходном составе системы. Показать, в каких вариантах результаты расчета должны совпадать и различаться.
Исходный состав газа: а) только
![]() б) эквивалентные количества
б) эквивалентные количества
![]() и
и
![]() ;
в)
;
в) ![]() и
и
![]() в
объемном отношении 2:1; г) эквимолярные
количества Н2,
О2
и
в
объемном отношении 2:1; г) эквимолярные
количества Н2,
О2
и ![]()
Решение. Пренебрегаем наличием в системе атомов Н, О и радикалов ОН, НО2, Н2О2. Тогда система должна быть представлена реакцией горения (1).
Для данной трехвариантной системы (![]() )
в качестве независимых параметров
выбираемР,Ти
)
в качестве независимых параметров
выбираемР,Ти![]() ,
где
,
где![]() и
и![]() – количества (моль) элементов в системе.Параметры
– количества (моль) элементов в системе.Параметры
![]()
![]()
![]() оказываются неизвестными переменными.
Система уравнений связи:
оказываются неизвестными переменными.
Система уравнений связи:
![]() (1.9)
(1.9)
 (1.10)
(1.10)
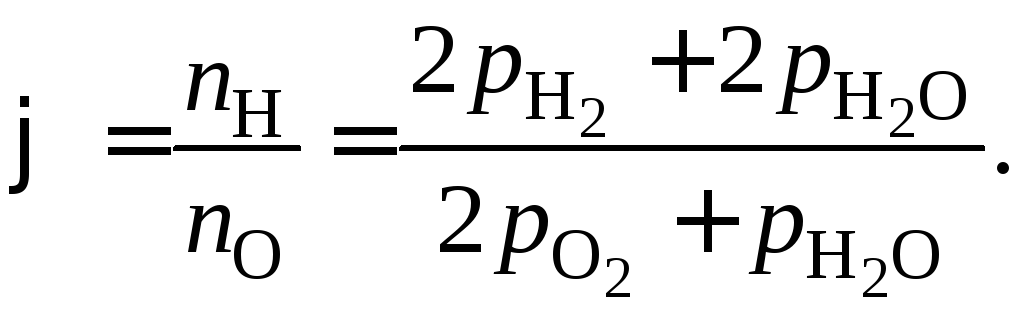 (1.11)
(1.11)
В уравнении (1.11)
![]()
![]() и
и![]() .
После подстановки в правые части этих
выражений
.
После подстановки в правые части этих
выражений![]() и сокращения в полученной дроби
и сокращения в полученной дроби![]() числителя и знаменателя на
числителя и знаменателя на![]() получаем (1.11). Одинаковость состава
смесей и различия в составах обусловлены
параметром
получаем (1.11). Одинаковость состава
смесей и различия в составах обусловлены
параметром![]() .
.
Варианты: а)
![]() = 2; б)
= 2; б)![]() = 1; в)
= 1; в)![]() = 2; г)
= 2; г)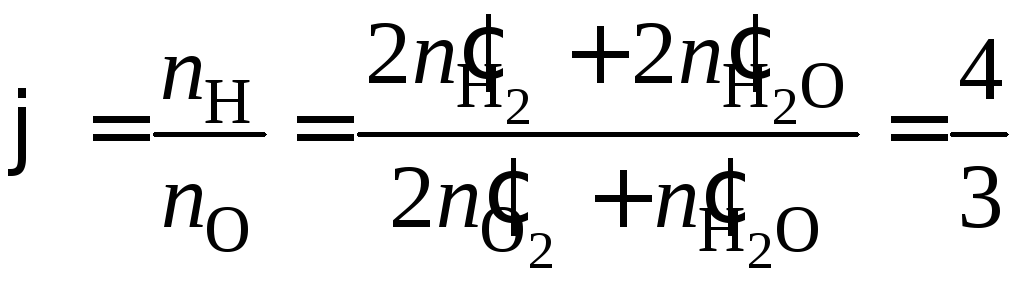 .
Учтено, что исходные количества веществ
в варианте
г) равны
.
Учтено, что исходные количества веществ
в варианте
г) равны
![]() .
«Штрих» относится
к исходному составу газовой смеси.
Значит равновесный
состав смесей вариантов а) и в) одинаков
и отличается от составов смесей других
вариантов.
.
«Штрих» относится
к исходному составу газовой смеси.
Значит равновесный
состав смесей вариантов а) и в) одинаков
и отличается от составов смесей других
вариантов.
Пример 1.6.Составить систему уравнений связи между переменными для расчета при заданных значенияхРиТравновесного состава газовой смеси, полученной нагреванием равных объемов водорода и воздуха. Состав воздуха принять: 20 об. %О2 и 80 об. %N2. Вычислить значения необходимых для расчета концентрационных параметров.
Решение. Данная система может быть представлена реакцией горения (1).
При наличии азота система является
трехкомпонентной и однофазной, поэтому
![]() .
В качестве 4 независимых параметров
выбираемР,Ти два концентрационных
параметра
.
В качестве 4 независимых параметров
выбираемР,Ти два концентрационных
параметра![]() и
и![]() .Тогда параметры
.Тогда параметры
![]()
![]()
![]() и
и ![]() оказываются неизвестными (вычисляемыми)
переменными. Система уравнений связи:
оказываются неизвестными (вычисляемыми)
переменными. Система уравнений связи:
![]()
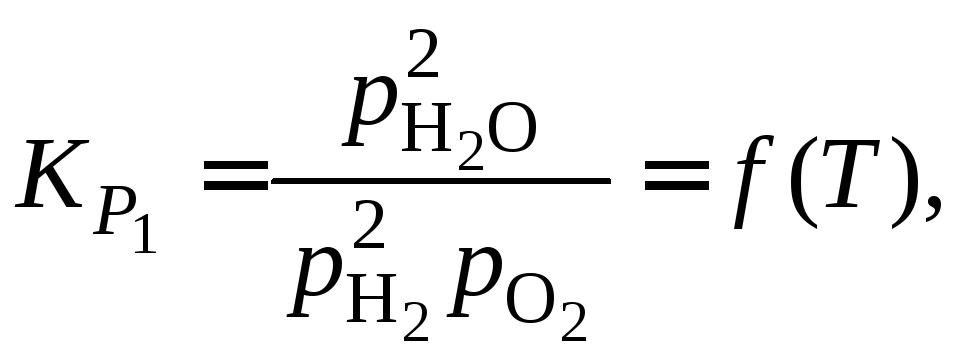
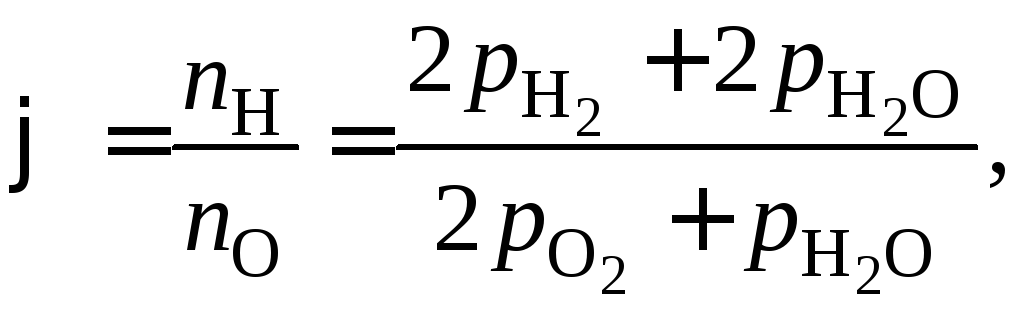
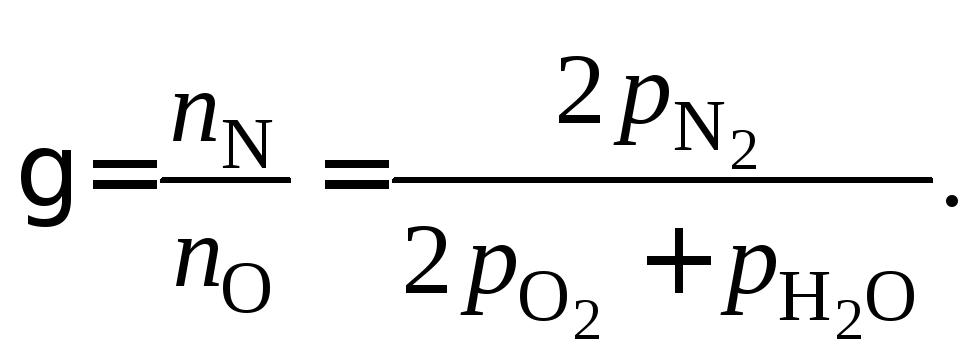
Отношение объемов газов в исходной смеси равно:
![]() .
.
«Штрих» относится к исходному составу газовой смеси.
При расчете (для удобства) на 2 моль (1 + 0,2 + 0,8) смеси концентрационные параметры равны:
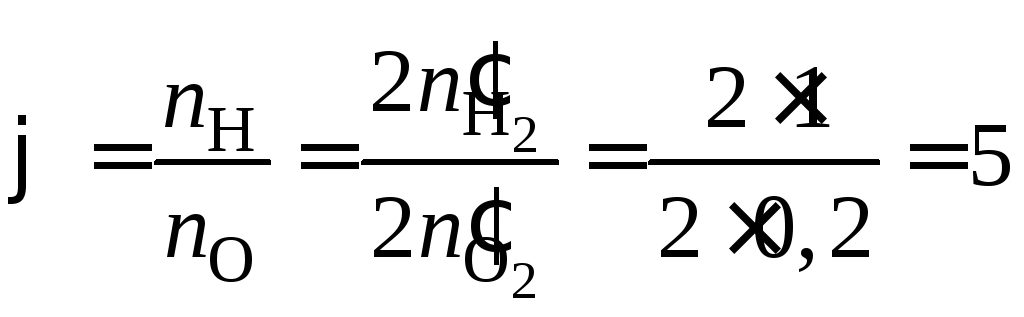 ,
,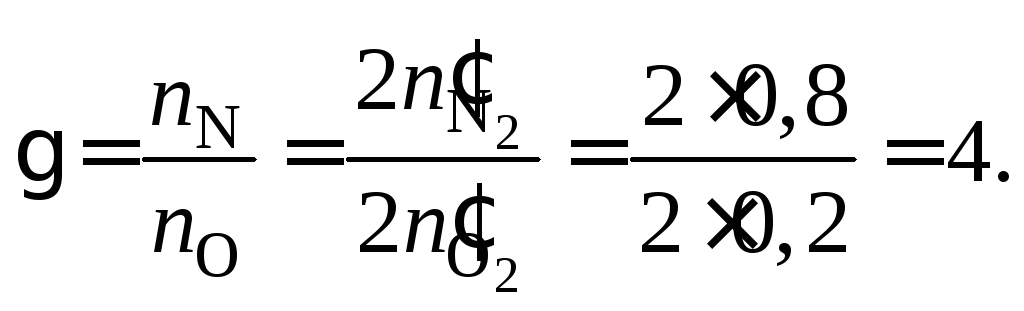
Пример 1.7.Составить систему уравнений связи между переменными для расчета при заданных значенияхРиТравновесного состава газовой смеси, полученной в результате горения смеси метана с воздухом в объемном отношении 1:10. Состав воздуха принять: 20 об. %О2 и 80 об.%N2. Вычислить значения необходимых для расчета концентрационных параметров.
