
Титриметрія_2015 Cтуд
.pdfОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ. МЕТОД НЕЙТРАЛІЗАЦІЇ.
Перелік питань з методу кислотно-основного титрування, що виносяться на розгляд на практичних заняттях
1.Теорії кислотно-основної взаємодії (Льюиса, Ареніуса, Франкліна, Бренстеда-Лоурі).
2.Кислотно-основні рівноваги у водних розчинах. Константи рівноваги (константи кислотності, основності протолітів та константа автопротолізу води).
3.Розрахунок концентрації водневих іонів у водних розчинах кислот, основ та солей.
4.Буферні розчини, механізм буферування та буферна ємність. Фізіологічні буферні розчини.
5.Класифікація титриметричних методів аналізу. Основні вимоги, що висуваються до реакцій у цих методах.
6. Метод кислотно-основного титрування (область застосування, |
переваги та |
обмеження). |
|
7.Криві кислотно-основного титрування. Точка еквівалентності та точка кінця титрування.
8.Індикатори в методах кислотно-основного титрування. Принцип вибору індикатора.
9.Фактор еквівалентності та молярна (атомна) маса еквіваленту речовини. Закон еквівалентних співвідношень.
10.Способи розрахунку концентрації речовини у розчині (молярна нормальна та процентна концентрація, титр).
11.Способи приготування робочих розчинів у методі кислотно-основного титрування.
12.Помилки кислотно-основного титрування. Причини виникнення та способи їх розрахунку. Індикаторні помилки.
13.Визначення констант дисоціації слабких кислот та основ методом рН-метричного титрування.
14.Розрахунок мольних часток слабких протолітів при різних значеннях рН та побудова діаграм рівноваг.
Контрольні запитання для самопідготовки
1.Назвіть основні типи протолітів. Поясніть різницю між сильними та слабкими електролітами.
2.В чому суть протолітичної теорії кислот і основ Бренстеда-Лоурі?
3.Дайте визначення термінам: титрування, точка еквівалентності, хімічний еквівалент, фактор еквівалентності та молярна маса еквівалента у кислотно-основному титруванні?
4.Що таке спряжена кислотно-основна пара? Напишіть рівняння реакції іонізації амоніаку гідрохлоридною кислотою, вкажіть спряжену гідрохлоридній кислоті основу та спряжену амоніаку кислоту?
5.Що таке буферний розчин? Які він має властивості, для чого застосовується? Наведіть рівняння для розрахунку рН буферного розчину.
6.Яку мінімальну концентрацію протоліту у водному розчині можна визначити методом кислотно-основного титрування?
1
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
7.Яка мінімальна відносна похибка визначення концентрації речовини титриметричним методом?
8.Що таке первинні та вторинні стандартні розчини? Вкажіть способи приготування стандартних розчинів сильних кислот (HCl, H2SO4) та лугів (NaOH, KOH).
9.Перерахуйте вимоги, що висуваються до первинних стандартних речовин.
10.Як приготувати робочий розчин лугу, що не містить карбонат-іонів? Яким чином встановити його нормальність? Наведіть відповідні рівняння реакцій і вкажіть фактори еквівалентності для реагуючих речовин.
11.В яких координатах будують криві кислотно-основного титрування?
12.Які фактори і яким чином впливають на величину стрибка титрування та положення точки еквівалентності на кривих кислотно-основного титрування?
13.Що таке точка еквівалентності і точка кінця титрування? Чи завжди точка еквівалентності співпадає зі значенням точки кінця титрування?
14.Які речовини використовують для індикації точки кінця титрування у методі нейтралізації?
15.Кислотно-основні індикатори (принцип дії, інтервал переходу, показник титрування, приклади)?
16.*На скільки мають відрізнятися значення констант кислотності, щоб можна було титриметрично визначити вміст декількох кислот у їх еквімолярній суміші або провести ступінчасте титрування багатоосновної кислоти? Зобразіть схематично
криву титрування суміші 0,01 М хлороводневої, 0,01 М ацетатної (рКа= 4,76) та 0,01 М бензоатної (рКа= 4,21) кислот 0,01 М розчином натрій гідроксиду.
Вправи для самопідготовки
1.Молекулярна та іонна форма індикатора мають різне забарвлення у водному розчині. При якому співвідношенні концентрацій цих форм можна побачити початок і кінець зміни забарвлення розчину? У яких кількостях, як правило, слід додавати індикатор до розчину, що титрується? Поясніть чому.
2.У який колір забарвлені водні розчини наведених нижче індикаторів при рН 7,0: а) метиловий оранжевий (рТ 4,0); б) метиловий червоний (рТ 5,0); в) фенолфталеїн (рТ 9,0)? Наведіть структурні формули протонованої та депротонованої форм даних органічних реагентів.
3.Який колір при рН 4,5 матиме розчин індикатору бромтимолового синього, молекулярна форма якого має жовте забарвлення, а іонна – синє? Константа дисоціації індикатору: Ка = 1.10-7. Відповідь підтвердить розрахунками.
4.Чому за звичайних умов кислотно-основного титрування не слід використовувати індикатори з рТ< 4 та рТ> 10?
5.Зобразіть схематично криві титрування розчину 0,10 М карбонатної кислоти (рКа1= 6,35; рКа2 = 10,32) розчином 0,10 М їдкого лугу та 0,10 М розчину натрій карбонату розчином 0,10 М хлороводневої кислоти.
2

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
6.Розташуйте номери кривих титрування розчинів протолітів у порядку збільшення сили кислот (а) і основ (б). Вважати, що концентрації речовин в усіх випадках однакові.
pH |
а |
|
pH |
|
б |
|
|
12 |
|
|
7 |
|
|
|
|
|
|
|
3 |
|
|
|
|
10 |
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
5 |
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
||
6 |
|
|
|
|
|
|
|
4 |
2 |
|
3 |
|
|
|
|
4 |
|
2 |
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
|
1 |
2 |
3 |
|
||||
|
|
|
|
VHCl, мл |
|||
|
|
VNaOH, мл |
|
|
|
|
7.Розташуйте наведені криві титрування одноосновної кислоти їдким лугом у порядку збільшення концентрації кислоти у розчині. Вважати, що концентрація робочого розчину лугу в усіх випадках однакова. Знайдіть графічно точки еквівалентності,
наведіть формулу для розрахунку вмісту кислоти у розчині. |
|
|
|
||||||
|
а |
|
|
б |
|
|
|
в |
|
pH |
|
pH |
|
|
|
pH |
|
|
|
12 |
|
12 |
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
10 |
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
8 |
|
|
|
8 |
|
|
|
6 |
|
6 |
|
|
|
6 |
|
|
|
4 |
|
4 |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
3 |
6 |
9 |
4 |
8 |
12 |
16 |
3 |
6 |
9 |
|
|
VNaOH, мл |
|
|
|
VNaOH, мл |
|
|
VNaOH, мл |
8.Виведіть формули для розрахунку мольних часток окремих протолітичних форм карбонатної кислоти. Розрахуйте значення мольних часток кожної протолітичної форми карбонатної кислоти у розчині в інтервалі значень рН від 1 до 12 та побудуйте діаграму рівноваг. Для карбонатної кислоти рКа1= 6,35; рКа2 = 10,32.
9.Нормальність розчину NaOH встановили за двоводною оксалатною кислотою, що втратила деяку кількість кристалізаційної води внаслідок вивітрювання. Розчин лугу застосовували потім для визначення концентрації розчину азотної кислоти. Яка (позитивна чи негативна) помилка титрування при цьому виникла?
10.*Робочий розчин натрій гідроксиду, який містить домішку натрій карбонату,
застосували для встановлення нормальності розчину хлороводневої кислоти. Для цього використали два різні індикатори: фенолфталеїн і метиловий оранжевий. Який з наведених вище індикаторів краще використати для отримання більш точних результатів?
11. *На рисунку наведені криві титрування двох розчинів, що містять суміш слабкої та сильної кислот:
* Завдання підвищеної складності
3

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
pH
12
10
2
8
6 1
4
2 
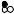



2 4 6 8
VNaOH, мл
Вкажіть який із двох стрибків на кожній кривій відповідає титруванню сильної, а який – слабкої кислоти? Знайдіть графічно положення точок еквівалентностей. Вкажіть, у якому з двох розчинів вміст сильної кислоти менший. Який розчин містить більш слабку кислоту?
Тестові завдання
1. Яка із наведених кислот буде утворювати внаслідок іонізації найслабшу супряжену основу? Обґрунтуйте відповідь спираючись на довідникові данні. Вважати, що дисоціація відбувається за першою стадією. Константи дисоціації Н2S рКа1 та рКа2
становлять 6,99 та 12,89, відповідно. Для H2CO3 рКа1= 6,35; рКа2 = 10,32; H2C2O4 − рКа1= 1,25; рКа2 = 4,27; H3PO4 − рКа1= 2,12, рКа2= 7,21, рКа3 =12,36. Константа основності амоніаку рКb= 4,76.
a) Н2S; |
б) H2CO3; |
в) H2C2O4; |
г) H3PO4; |
д) NH4+; |
е) H2PO4-. |
2. Якій із наведених основ відповідає найсильніша супряжена кислота? Обґрунтуйте відповідь спираючись на довідникові данні. Для аніліну C6H5N рКb= 9,38 та аміаку NH3
рКb= 4,76. Для H3PO4 рКа1= 2,12, рКа2= 7,21, рКа3 =12,36. H2C2O4 − рКа1= 1,25; рКа2 = 4,27; H2CO3 − рКа1= 6,35; рКа2 = 10,32.
a) C6H5N; |
б) NH3; |
в) H2PO4- ; |
г) HPO4-; |
д) HC2O4- ; |
е) CO32-. |
3. Які з наведених речовин є амфолітами у водних розчинах? |
|
a) Na2CO3; |
б) NH4Cl; |
в) NaHC2O4; |
г) NH4СN; |
д) CH3COOH; |
е) CH3COONH4. |
4. Які з наведених сумішей мають буферні властивості? |
|
a) СH3COONa + NaOH; |
б) CH3COOH + CH3COONa; |
в) H3PO4 + NaH2PO4; |
г) NaCl + Na2CO3; |
д) NH4Cl + HCl; |
е) K2HPO4 + KH2PO4. |
5. Який з наведених нижче індикаторів придатний для найбільш точного визначення
0,10 М нарію ацетату титруванням 0,10 |
М розчином хлороводневої кислоти? Для |
СН3СООН: рКа= 4,76. |
|
а) метиловий фіолетовий (рТ 2,5); |
б) метиловий оранжевий (рТ 4,0); |
4
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
в) бромкрезоловий синій (рТ 4,6); |
г) фенолфталеїн (рТ 9,0); |
д) жодний з наведених. |
|
6. Який з наведених нижче індикаторів придатний для найбільш точного титрування
0,20 М розчину метиламіну CH3NH2 |
(pKb= 3,28) 0,10 М робочим розчином |
хлороводневої кислоти? |
|
а) тимолфталеїн (рТ 9,8); |
б) феноловий червоний (рТ 7,6); |
в) бромфеноловий синій (рТ 4,2); |
г) нільський блакитний (рТ 10,5); |
д) жодний з наведених.
7. Який об’єм води треба додати до 200 мл 0,400 М розчину лугу, щоб отримати 0,200 М
розчин лугу. |
|
|
а) 200 мл; |
б) 400 мл; |
в) 500 мл. |
8. Яку з наведених нижче формул слід використати для розрахунку рН 0,10 М розчину
натрій цитрату (Na3Cit) ? |
|
а) рН = ½ (pK1 + pK2) |
в) рН = 7 + ½рК1 + ½ lgCсолі |
б) pH = ½ pK1 – ½lgCсолі |
г) рН = 7 + ½рК3 + ½ lgCсолі |
9.Чому дорівнює фактор еквівалентності пірофосфатної (H4P2O7) кислоти при титруванні їдким лугом з метилоранжем (рТ 4,0), якщо для пірофосфатної кислоти рКa1= 0,85, рКa2=
1,96, рКa3= 6,54, рКa4= 9,40. |
|
|
|
|
|
а) 1; |
б) 2; |
в) 3; |
г) ½. |
10. |
Титр розчину сульфатної кислоти дорівнює 0,00201 г/мл. Яка молярність цього |
|||
розчину? Мr Н2SО4 = 98,07. |
|
|
|
|
|
а) 0,100; |
б) 0,0400; |
в) 0,0200; |
г) 0,0800. |
11. |
Розрахуйте титр 0,10 |
М розчину ортофосфатної кислоти, |
якщо її відтитрували з |
|
індикатором метиловим червоним (рТ 5,0). Для ортофосфатної кислоти рКа1= 2,12, рКа2=
7,21, рКа3 = 12,36. Мr Н3PО4 = 98 г/моль. |
|
|
||
|
а) 0,0049 г/мл; |
б) 0,0098 г/мл; |
в) 0,0023 г/мл; |
г) 0,0033 г/мл. |
12. |
Яку молярну концентрацію гідроксид-іонів має розчин калій гідроксиду з рН 11,7? |
|||
|
а) 1·10-2 М; |
б) 5·10-3 М; |
в) 2·10-12 М; |
г) свій варіант. |
13. |
Чому дорівнює рН 1,00·10-2 М розчину амоніаку (рКb= 4,76) ? |
|||
|
а) 1,40; |
б) 12,6; |
в) свій варіант. |
|
14. |
Суміш розчинів амоній хлориду та натрій хлориду розбавили водою у 10 разів. Як |
|||
при цьому змінилося рН розчину? Для NH3.H2O pKb = 4,76. |
|
|||
|
а) зменшилось на 1,0; |
б) збільшилось на 1,0; |
||
|
в) зменшилось на 0,50; |
г) збільшилось на 0,50; |
||
|
д) залишилось без змін. |
|
|
|
15. |
Досліджуваний розчин розбавили водою у 100 разів. Після розбавлення рН розчину |
|||
зменшилось на одиницю. Яка з наведених нижче сполук знаходилась у розчині ? |
||||
|
а) NH3. Н2О; |
|
б) HCl; |
|
|
в) KH2PO4; |
|
г) CH3COOH; |
|
|
д) NaOH; |
|
е) KCl. |
|
5

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
16. Для нейтралізації 0,552 г органічної кислоти витрачено 20,0 мл 0,200 М розчину їдкого натру. Яка органічна кислота знаходиться у розчині?
а) цитратна – C 6H8O7; |
б) нітробензойна – C 7H5NO4; |
в) бензойна – C 7H6O2; |
г) саліцилова – C 7H6O3. |
17. 0,10 Н. Розчин оксалатної кислоти (рКа1= 1,25, рКа2= 4,27) титрують розчином натрій гідрооксиду з індикатором феноловим червоним (рТ= 8,0). Які з наведених речовин будуть присутні у розчині в точці кінця титрування, а які − в точці еквівалентності?
а) Na2C2O4 + NaOH; |
б) NaHC2O4; |
в) Na2C2O4 + NaHC2O4; |
г) H2C2O4 + NaHC2O4; |
д) Na2C2O4. |
|
18. Криві титрування яких речовин, на вашу думку, зображені на рисунках. Відповідь аргументуйте.
|
|
І |
|
|
|
|
ІІ |
|
|
pH |
|
|
|
|
pH |
|
|
|
|
12 |
|
|
|
|
12 |
|
|
|
|
11 |
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
|
|
|
VNaOH, мл |
|
|||||
|
|
V |
, мл |
|
|
|
|
|
|
|
|
|
NaOH |
|
|
|
|
|
|
а) слабкої кислоти; |
|
б) сильної кислоти; |
|
||||||
в) слабкої основи; |
|
г) сильної основи. |
|
|
|||||
Розрахункові задачі
1. Розрахуйте значення рН та рОН для сильних кислот:
а) 2,0·10-4 M HNO3; б) 4,0·10-8 M HNO3; в) 0,020 M H2SO4; г) 1,0·10-9 M HCl; 2. Розрахуйте значення рН та рОН для сильних основ:
а) 2,0·10-4 M NaOH; б) 3,0·10-7 M KOH; в) 0,020 M Ba(OH)2; г) 0,050 M KOH;
3.Розчин NaOH має рН 12,0. У скільки разів його треба розбавити водою, щоб одержати розчин з рН 9,70 ?
4.Розрахуйте значення рН 0,1 М розчину натрій бензоату (для бензойної кислоти
С6Н5СООН pKa= 4,21); 0,05 М розчину піридиній хлориду (для піридину С6Н5N рКb= 8,82); 0,25 М розчину H3AsO4; 0,02 M Na2HAsO4, а також суміші 0,1 М Na2HAsO4 і 0,2 М NaH2AsO4 (для H3AsO4 рКа1 = 2,22, рКа2 = 6,98, рКа3 = 11,53).
5.Значення рН розчину ацетатної кислоти становить 3,5. Яка концентрація ацетатної кислоти у розчині? На скільки відсотків ця кислота дисоційована?
6.Значення рН 0,2 М розчину первинного аміну R-NH2 становить 8,42. Чому дорівнює рКb аміну?
7.Який об’єм розчину NaOH з концентрацією 0,100 моль/л необхідно додати для нейтралізації 20,0 мл розчину HСl з концентрацією 11,0 г/л ?
8.Для визначення концентрації розчину HCl взяли 3,0 мл цього розчину і відтитрували його стандартним 0,50 М розчином KOH. На титрування витратили 14,2 мл стандартного розчину. Яка концентрація розчину HCl ?
6
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
9.Розрахуйте значення рН розчину, отриманого при змішуванні 20,0 мл 0,150 М розчину NaCN та 12,0 мл 0,0950 М розчину HCl. Як зміниться рН цього розчину якщо його розбавити водою у 100 раз? Для HCN рКа= 9,21.
10.Розрахуйте значення рН розчину, отриманого змішуванням 11,0 мл 0,100 М розчину
Na2HAsO4 та 17,0 мл 0,100 М розчину HCl. Як зміниться рН цього розчину якщо його розбавити водою у 10 разів? Для H3AsO4 рКа1 = 2,22, рКа2 = 6,98, рКа3 = 11,53.
11.Як зміниться рОН 200 мл 0,01 М NH4OH при додаванні до нього 100 мл 0,02 М розчину NaOH ?
12.Розрахуйте рН розчину отриманого змішуванням рівних кількостей сильної кислоти з рН 3 та сильної основи з рН 12.
13.Розрахуйте рН розчину, що містить 10,0 г/л пропіонатної кислоти C2H5COOH (рКа = 4,87; Mr = 74,08), якщо її на 75% нейтралізували розчином лугу.
14.До 0,100 М розчину пірофосфатної кислоти H4P2O7 (рКa1= 0,85, рКa2=1,96, рКa3=6,54, рКa4=9,40) додали 0,1 М розчину лугу до рН 6,20. Вкажіть сполуку чи сполуки, що утворились у розчині. Розрахуйте співвідношення рівноважних концентрацій домінуючих протолітичних форм.
15.Який об’єм (мл) необхідно відібрати із наведених нижче комерційних розчинів для приготування 250 мл 0,10 М розчину відповідної сполуки, з метою її подальшої стандартизації:
a) 70,0 % HClO4 (ρ=1,668г/см3); |
г) 99,5% CH3COOH (ρ=1,051 г/см3); |
б) 69,0 % HNO3(ρ=1,409г/см3); |
д) 28,0% NH3 (ρ= 0,898 г/см3). |
в) 85,0% H3PO4 (ρ= 1,689г/см3); |
|
16. Розрахуйте, яку наважку (г) кожної з наведених нижче речовин потрібно зважити на аналітичних терезах для приготування наступних розчинів:
а) 250 мл 0,100 М KOH; |
г) 0,0100 л 0,200 М Na2SO4; |
б) 1,0 л 0,0275 М K2Cr2O7; |
д) 200 мл 0,900 % NaCl. |
в) 500 мл 0,0500 М CuSO4; |
|
17.Розрахуйте молярну, нормальну та відсоткову концентрації наступних розчинів:
а) Н2SO4 (11,0 г в 250 мл розчину); б) NaОН (7,00 г в 500 мл розчину);
в) AgNO3 (25,0 г в 1,00 л розчину).
18.Чому дорівнює рН 0,6% розчинів: а) NH4Cl (для NH3 рКb = 4,8); б) KCN (для HCN
pKa=9,2).
19.Який об’єм 92,0 % розчину сульфатної кислоти треба взяти для приготування 50,0 мл 0,01 Н. розчину цієї кислоти?
20.Розрахуйте молярну та нормальну концентрацію бури у розчині, який використовують для встановлення нормальності хлороводневої кислоти, якщо титр бури дорівнює 0,03051 г/мл.
21.Скільки мл розчину сульфатної кислоти з титром за натрій гідроксидом 0,00294 г/мл треба взяти для того, щоб приготувати 500,0 мл 0,0500 Н. розчину цієї кислоти? Для
H2SO4 fекв = ½;Мr H2SO4 = 98,07 22. Розрахуйте титри:
а) 0,01 М розчину кальцію гідрооксиду; б) 0,10 Н. розчину фосфатної кислоти, якщо її нормальну концентрацію встановлено
титруванням з фенолфталеїном (рТ= 9,0) та з метилоранжем (рТ=4,0). Для фосфатної кислоти рКа1 = 2,12, рКа2 = 7,21, рКа3 = 12,4.
7
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
23.Розрахуйте який об’єм 0,1500 Н. розчину їдкого лугу буде витрачено на титрування 20,00 мл розчину сульфатної кислоти з титром 0,007714 г/мл?
24.Яка маса фосфатної кислоти була у розчині, якщо на її титрування з фенолфталеїном (рТ = 9,0) було витрачено 15,00 мл 0,20 М розчину лугу?
25.Скільки мілілітрів 0,120 М розчину хлороводневої кислоти треба витратити для повної нейтралізації 0,2500 г Na2CO3? (Для Н2СО3, рКа1=6,35; рКа2= 10,32).
26.На титрування розчину 0,5200 г технічного препарату оксалатної кислоти
H2C2O4·2H2O було витрачено 25,00 мл 2,000 % розчину їдкого натру? Розрахуйте процентний вміст чистої оксалатної кислоти у препараті.
27.Розрахуйте значення рН розчину, який було отримано змішуванням
а) 37,0 мл 0,10 М розчину NaOH та 25,0 мл 0,080 М розчину HCl; |
|
б) 100,0 мл HCl з ТHCl/NaOH= 0,07300 г/мл та 100,0 мл розчину NaOH |
з ТNaOH/HCl |
=0,004000 г/мл; |
|
в) 50,00 мл HCl з ТHCl/NaOH=0,02695 г/мл та 25,00 мл розчину NaOH з |
ТNaOH/H2SO4 |
=0,05400 г/мл; |
|
г) 10,0 мл 3,00 % розчину HCl та 10,0 мл 3,30 % NaOH. |
|
28. Гранично допустима концентрація (ГДК) HСl у повітрі становить 5,00 мг/м3. 10 м3 повітря цеху заводу по виробництву хлороводню пропустили через 1000,0 мл води. З отриманого розчину відібрали 20,0 мл та відтитрували стандартним 0,0150 М розчином KOH. На титрування витратили 2,15 мл стандартного розчину KOH. Скільки мг HCl знаходилось у 1 м3 повітря?
29.Який відсотковий вміст натрій гідрокарбонату у суміші NaНСO3 і Na2СO3, якщо на титрування наважки суміші 0,2234 г з фенолфталеїном (рТ=9,0) витрачено 20,0 мл 0,0500 Н. розчину хлороводневої кислоти.
30.На титрування суміші хлороводневої та фосфатної кислот з індикатором метилоранжем (рТ= 4,0) витрачено 25,00 мл 0,100 М розчину лугу, а з індикатором фенолфталеїном (рТ = 9,0) − 30,00 мл цього ж лугу. Розрахуйте масу кожної кислоти у розчині. Для фосфатної кислоти рКа1 = 2,12, рКа2 = 7,21, рКа3 = 12,4.
31.На титрування розчину натрій карбонату та натрій гідрокарбонату з індикатором фенолфталеїном (рТ 9,0) витрачено 10,00 мл, а з метилоранжем (рТ 4,0) − 25,00 мл 0,10
Н. розчину хлороводневої кислоти. Скільки грамів NaHCO3 та Na2CO3 знаходиться у розчині?
32.На титрування розчину суміші NaНСO3 і Na2СO3 з фенолфталеїном (рТ 9,0) було витрачено 10,00 мл 0,10 М розчину НСl. Цей же розчин титрували далі з метилоранжем (рТ 4,0), причому загальний об’єм витраченої на титрування НСl
становив 25,00 мл. Скільки грамів NaНСO3 і Na2СO3 було у розчині? Для карбонатної кислоти рКа1= 6,35, рКа2 = 10,32.
33.З яким із наведених нижче індикаторів титрування 0,10 М розчину натрій цитрату
0,10 М розчином хлороводневої кислоти за рівнянням: Na3Cit + HCl = Na2HCit + NaCl, буде найбільш точним, якщо для цитратної кислоти: рКa1 = 3,13, рКa2 = 4,66, рКa3 = 6,40? Фенолфталеїн (рТ 9,0), метиловий червоний (рТ 5,0), алізариновий червоний (рТ 4,4), бромкрезоловий пурпурний (рТ 6,0) чи лакмус (рТ 7,0).
34.Який з наведених нижче індикаторів найбільше придатний для точного титрування 0,10 М розчинів арсенатної кислоти та її солей 0,10 М розчином їдкого лугу за кожним з рівнянь:
H3AsO4 + NaOH = NaH2AsO4 + H2O; |
Na2HAsO4 + NaOH = Na3AsO4 + H2O; |
NaH2AsO4 + NaOH = Na2HAsO4 + H2O; |
H3AsO4 + 2NaOH = Na2HAsO4+ 2H2O; |
8
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
H3AsO4 + 3NaOH = Na3AsO4+ 3H2O
Для H3AsO4 рКa1 = 2,22, рКa2 = 6,98, рКa3 = 11,40.
Фенолфталеїн (рТ 9,0), метиловий червоний (рТ 5,0), алізариновий червоний (рТ 4,4), бромкрезоловий пурпурний (рТ 6,0) , лакмус (рТ 7,0), феноловий червоний (рТ 7,6), жодний з наведених.
35.Оберіть один чи декілька індикатори, які можна використовувати при титруванні 0,10
Мрозчину хлороводневої кислоти 0,10 М розчином їдкого натру у присутності 0,10 М амоній хлориду?
а) тимоловий синій (рТ 8,8); |
б) метиловий фіолетовий (рТ 2,5); |
в) алізариновийчервоний (рТ 4,4); |
г) нільський блакитний (рТ 10,5); |
д) феноловий червоний (рТ 7,6). |
|
36.20,0 мл 0,200 М розчину натрій гіпоброміту (NaBrO) відтитрували 0,200 М розчином хлороводневої кислоти з індикатором метиловим оранжевим (рТ 4,0). Розрахуйте помилку титрування у відсотках. Для HBrO рКа= 8,60.
37.20,0 мл 0,200 М розчину ацетатної кислоти (рКа= 4,8) відтитрували 0,200 М розчином їдкого лугу з індикатором феноловим червоним (рТ 7,6). Розрахуйте помилку титрування у відсотках.
38.Які наважки Na2HPO4 і КH2PO4 треба взяти для приготування 100 мл буферного розчину з рН 7,4 та з загальною концентрацією 0,2 моль/л. Для фосфатної кислоти рКа1 = 2,12, рКа2 = 7,21, рКа3 = 12,38.
39.Розрахуйте індикаторну помилку титрування 10,0 мл 0,100 М розчину хлороводневої кислоти 0,100 М розчином натрій гідроксиду з індикатором метиловим оранжевим
(рТ 4,0).
40.Чи можна відтитрувати 0,10 М водний розчин натрій ацетату 0,10 М розчином соляної кислоти з задовільною точністю (індикаторна помилка титрування не перевищує помилку визначення об’єму титранту 0,2 %), використовуючи як індикатор метиловий червоний (рТ 5,0). Відповідь бажано підтвердити розрахунками. Для ацетатної кислоти: рКа= 4,76.
41.Розрахуйте помилку титрування (у відсотках) 0,1 М розчину фосфатної кислоти
(рКа1= 2,12, рКа2= 7,21, рКа3= 12,38) розчином їдкого лугу з індикаторами: а) метиловим оранжевим (рТ= 4,0); б) фенолфталеїном (рТ= 9,0).
Завдання до практикуму
1. Задачу для рН-метричного визначення вмісту ацетатної кислоти у розчині отримали в мірній колбі ємністю 100,0 мл та довели дистильованою водою до мітки. Аліквотну частину розчину (25,00 мл) перенесли в стакан та, постійно перемішуючи за допомогою магнітної мішалки, відтитрували 0,10 М робочим розчином лугу порціями по 0,20 мл. Побудували криву титрування розчину оцтової кислоти у координатах ∆рН/∆V–V NaOH та за максимумом на одержаній кривій знайшли точку еквівалентності (Vт.е.). Вміст ацетатної кислоти у розчині задачі розрахували за формулою:
m, г = |
СNaOH |
×Vт.е. × MrCH |
3 |
COOH ×V |
ал |
|
10 ×V заг |
|
|
|
|
|
|
|
|
|
Результат аналізу виявився невірним. Вкажіть всі можливі причини.
2. За даними титрування ацетатної кислоти робочим розчином лугу побудували криву рНметричного титрування та визначили значення точки еквівалентності (Vт.е.). У діапазоні
9

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
0,1Vт.е.–1,8V т.е. побудували залежність у координатах pH − lg V Vт.−е. V . Значення рКа знайшли
т.е.
по відрізку, що відсікає ця крива на осі ординат при lg V Vт.-е. V = 0
т.е. .
Розраховане значення рКа виявилось неправильним. Поясніть чому.
3. Для встановлення нормальності розчину їдкого лугу за гідрохлоридною кислотою у чотири конічні колби на 200 мл внесли по 20,0 мл 0,100 н. розчину хлороводневої кислоти. Робочий розчин хлороводневої кислоти готували з фіксаналу. Далі, у кожну конічну колбу додали 1-2 краплини розчину метилового оранжевого з рТ 4,0, і відтитрували розчином їдкого лугу до появи рожевого забарвлення індикатора. Об’єм розчину лугу, витраченого на титрування HCl у першій колбі становив 10,0 мл, у другій − 9,8 мл, у третій − 10,2 мл та 15,4 мл у четвертій колбі. Нормальність робочого розчину лугу розрахували за формулою:
N |
|
= |
VHCl × N HCl |
= |
0,1× 20 |
= 0,175 н. |
NaOH |
|
|
||||
|
|
VNaOH |
11,4 |
|
||
|
|
|
|
|||
Розрахована концентрація лугу виявилась помилковою. Зазначте чинники (не менше трьох), які вплинули на точність визначення нормальності розчину лугу. Запропонуйте
способи покращення результату визначення.
4. Для встановлення концентрації розчину хлороводневої кислоти за бурою бюретку заповнили розчином HCl. В конічну колбу об’ємом 200 мл додали 25,0 мл 0,1000 н. розчину бури. Робочий розчин бури готували розчиненням точної наважки (g) нещодавно перекристалізованої бури у дистильованій воді об’ємом (V). Нормальність
бури розраховували за формулою N Na2 B4O7 ×10 H 2O = |
g ×1000 |
Далі, в конічну колбу |
|
|
. |
||
|
|||
|
V × MrNa2 B4O7 ×10 H 2O |
|
|
внесли 1-2 краплини індикатору фенолфталеїну з рТ 9,0, і відтитрували розчин бури гідрохлоридною кислотою до повного знебарвлення індикатору. Встановили об’єм HCl, витраченої на титрування розчину бури. Нормальність HCl розрахували за формулою:
N HCl = N Na2 B4O7 ×10 H 2O ×VNa2 B4O7 ×10 H 2O VHCL
Результат аналізу виявився невірним. Вкажіть всі можливі причини.
5. *Для оцінки вмісту домішки натрій карбонату у натрій гідрокарбонаті методом кислотно-основного титрування відібрали наважку технічного препарату гідрокарбонату масою 0,2500 г розчинили в 25,00 мл води, перенесли у конічну колбу, додали 2-3 краплини фенолфталеїну (рТ 9,0) та відтитрували 0,10 н. розчином кислоти до досягнення точки еквівалентності (V1). Відсотковий вміст натрій карбонату у препараті розрахували за формулою:
ωNa2CO3 |
,% = |
N HCl ×V1 × MrNa 2CO 3 |
||
g ×10 |
× 2 |
|||
|
|
|||
Результат аналізу виявився невірним. Вкажіть причини.
10
