
Титриметрія_2015 Cтуд
.pdf
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
Отримаємо сумарне рівняння:
6Е |
т.е. |
= E1 + 5Е2 + 0,059 lg |
[Fe3 +][MnO4 |
−][H +]8 |
. |
|
|
||||
|
|
[Fe2 +][Mn 2 +] |
|||
За стехіометрією реакції в точці еквівалентності рівноважні концентрації реагуючих компонентів можна записати як:
[Fe2+] = 5[MnO4-] та [Fe3+] = 5 [Mn2+].
Після підстановки у вираз під логарифмом наведених вище рівноважних концентрацій реагуючих компонентів і відповідних скорочень маємо:
Ет.е. = |
Е1 + 5Е2 |
+ |
0,059 |
|
5[Mn 2 +][MnO4 |
−][H +]8 |
= |
E1 + 5E2 |
+ |
0,059 |
|
+ 8 |
||||
|
|
lg |
|
|
|
|
|
|
|
|
lg[H |
] |
||||
6 |
6 |
5[MnO |
− |
][Mn |
2 + |
] |
6 |
6 |
||||||||
|
|
|
|
|
4 |
|
|
|
|
|
|
|
||||
(Зверніть увагу: вираз під логарифмом не є константою рівноваги реакції!)
Е0 3+ 2 + + 5Е0 − + +
Відповідь: Ет.е. = Fe / Fe MnO 4 ,8 H / Mn 2
6
+ |
0,059 |
lg[H +]8 . Для |
наведеної |
окисно- |
|
||||
6 |
|
|
|
|
відновної реакції потенціал в точці еквівалентності залежить від значень стандартних окисно-відновних потенціалів напівреакцій, кількості електронів, що беруть участь в окисновідновній реакції та рН розчину.
Приклад 3. Розчин феруму(ІІ) титрують розчином калій перманганату при рН=0. Обчислити інтервал зміни потенціалу, коли розчин недотитровано та перетитровано на 0,1% (величину стрибка титрування). E0 Fe3+/Fe2+ = 0,77B; E0 MnO4-, 8H+/Mn2+ = 1,52B.
Розв'язок. Запишемо рівняння окисно-відновної реакції у іонній формі: 5Fe2+ + MnO4- + 8H+ ↔ 5Fe3+ + Mn2++ 4H2O
До досягнення точки еквівалентності, концентрація іонів MnO4- у реакційній суміші наближається до 0, отже, потенціал системи обумовлюватиметься окисно-відновною парою Fe3+/Fe2+. Запишемо рівняння Нернста для відповідної напівреакції:
Fe3+ +1 е= Fe2+
Е = Е0 Fe 3+ / Fe |
2+ + |
0,059 |
lg |
[Fe3+ |
] |
|
[Fe2+ |
] |
|||
|
1 |
|
|||
Оскільки у рівняння входить співвідношення концентрацій іонів феруму, замість концентрацій можна підставити процентне співвідношення. За умов, коли розчин недотитровано на 0.1 %, у розчині знаходяться: 0,1% Fe2+ і 99,9% Fe3+ . Потенціал системи за таких умов дорівнюватиме:
Е = Е0 |
|
|
+ |
0,059 |
lg |
[Fe3+ ] |
= 0,77 + |
0,059 |
lg |
99,9 |
= 0,95В |
|
|
|
|
|
|
||||||
1 |
3+ / Fe |
2+ |
1 |
|
[Fe2+ ] |
1 |
0,1 |
|
|||
Fe |
|
|
|||||||||
31

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
Аналогічно, коли розчин перетитровано, концентрація іонів Fe2+ прямує 0 і потенціал системи обумовлюється окисновідновною парою MnO4-/Mn2+ . Запишемо рівняння Нернста для цієї напівреакції:
MnO4- + 8H+ + 5е= Mn2++ 4H2O
Е = Е0 MnO4 |
− ,8 H + / Mn 2 + + |
0,059 |
lg |
[MnO4 |
− ][H + ]8 |
|
[Mn 2+ ] |
||||
|
5 |
|
|||
Cпіввідношення рівноважних концентрацій іонів мангану можна замінити на їх процентне співвідношення у розчині. За умов, коли розчин перетитровано на 0,1 %, у розчині знаходиться: 0,1% MnO4- і 100,0 % Mn2+. Потенціал системи за таких умов дорівнюватиме:
Е2 |
= Е0 |
|
|
|
|
+ |
0,059 |
lg |
[MnO4 |
− ][H +]8 |
= 1,52 + |
0,059 |
lg |
0,1×18 |
= 1,48В |
||
|
+ |
|
2+ |
|
|
|
2+ |
|
|
|
|||||||
|
− |
,8 H |
/ Mn |
5 |
|
[Mn |
] |
5 |
100 |
|
|||||||
|
MnO4 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Отже, інтервал зміни потенціалу розчину лежить в межах від Е1=0,95 В до Е2=1,48 В. Відповідь: Інтервал зміни потенціалу розчину (стрибок титрування) буде спостерігатися у діапазоні потенціалів +0,95 ÷ +1,48 В.
Приклад 4. Наважку руди масою 0,2133 г розчинили в суміші гідрохлоридної та
нітратної кислот. Ферум, що містився у пробі відновили до Fe2+, а потім відтитрували 0,1117 н. розчином КMnO4, якого витратили 17,20 мл. Знайдіть відсотковий вміст Феруму у руді.
Розв'язок. Запишемо рівняння окисно-відновної реакції у іонній формі: 5Fe2+ + MnO4- + 8H+ ↔ 5Fe3+ + Mn2++ 4H2O
відсотковий вміст Феруму у руді розраховуємо за формулою:
% |
|
= |
N KMnO |
4 |
×VKMnO |
4 |
× ЕFe |
×100% |
= |
0,1117×17,20×55,84 ×100 |
= 50,44% |
Fe |
|
|
|
1000×0,2133 |
|||||||
|
|
1000 g |
|
|
|||||||
|
|
|
|
|
|
|
|
|
де g – маса наважки руди, г; NKMnO4 - нормальність розчину калій перманганату; VKMnO4- об’єм розчину калій перманганату, витрачений на титрування, мл. ЕFe – молярна маса
еквіваленту феруму. Оскільки в реакції окиснення ферум (II) бере участь один електрон:
Fe3+ + 1 е= Fe2+, то Е |
Fe |
= |
Ar |
= 55,84 |
|
||||
|
1 |
|
||
|
|
|
||
Відповідь: Відсотковий вміст Феруму у руді складає 50,44 %.
Приклад 5. На титрування наважки 0,1133 г хімічно чистої оксалатної кислоти, у середовищі сульфатної кислоти, витратили 20,75 мл розчину калій перманганату. Знайдіть: а) нормальність КMnO4; б) титр КMnO4; в) титр КMnO4 за Ферумом.
Розв'язок. Запишемо рівняння окисно-відновної реакції у іонній формі та рівняння відповідних напівреакцій:
MnO4- + C2O42- + 8H+ ↔ Mn2++ 2CO2 + 4H2O
MnO4- + 8H+ + 5е= Mn2++ 4H2O
32

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
2СО2 +2 е = С2О42-
Відсотковий вміст речовини розраховують формулою:
% |
= |
N KMnO |
4 |
×VKMnO |
4 |
× ЕH |
2 |
C |
2 |
O |
4 |
×100% |
|
|
1000 g |
|
|
|
|
|
|
||||
|
H 2C 2O 4 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
де g – маса наважки оксалатної кислоти, г; NKMnO4 - нормальність розчину калій перманганату; VKMnO4- об’єм розчину калій перманганату, витрачений на титрування, мл. ЕН2С2О4 – молярна маса еквіваленту оксалатної кислоти. Після математичних перетворень маємо формулу для розрахунку нормальної концентрації калій перманганату:
N |
|
= |
|
1000 × g |
= |
1000 × |
0,1133 |
= 0,0867н. |
||
KMnO 4 |
|
|
× E |
|
|
× 63,03 |
||||
|
V |
KMnO |
H 2C2O4 |
20,75 |
|
|||||
|
|
|
|
4 |
|
|
|
|
||
Оскільки у реакції |
окиснення оксалатної кислоти беруть участь два електрони, молярна |
||||||||||
маса |
еквіваленту |
|
|
Н2С2О2 буде дорівнювати ½ молярної маси кислоти : |
|||||||
Е |
= |
M(H2C2O4 ×2H2O) |
=63,03 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||
Н2С2O4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розрахуємо титр калій перманганату: |
|
|
|
||||||||
|
|
|
T |
KMnO 4 |
= |
N KMnO 4 |
× E KMnO 4 |
= |
0,0867 × 31,61 |
1 = 0,0027 г / мл |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
1000 |
1000 |
|
||||
Оскільки в реакції відновлення калій перманганату беруть участь 5 електронів, молярна
маса |
еквіваленту калій перманганату дорівнюватиме 1/5 його молярної маси |
|||
|
|
M(KMnO ) |
|
|
Е |
= |
4 |
|
=31,61 |
5 |
|
|||
KMnO |
|
|
|
|
4 |
|
|
|
|
Розрахуємо титр перманганату калію за Ферумом. Для цього спочатку запишемо реакцію окиснення ферум(II) калій перманганатом:
5Fe2+ + MnO4- + 8H+ ↔ 5Fe3+ + Mn2++ 4H2O
Титр калій перманганату за ферумом у наведеній реакції розраховується за формулою:
T |
KMnO 4 |
/ Fe |
= |
N KMnO 4 |
× E Fe |
= |
0,0867 × 55,84 |
= 0,0049 г / мл |
|
|
|
||||||
|
1000 |
|
1000 |
|
||||
де: NKMnO4 - нормальність розчину калій перманганату; ЕFe- атомна маса еквіваленту феруму. Оскільки в реакції окиснення ферм(II) до ферум(III) бере участь один електрон, атомна маса еквіваленту Fe дорівнюватиме атомній масі цього елементу.
Е = |
Ar (Fe) |
=55,84 |
Fe |
1 |
|
|
|
Відповідь: а) NКMnO4=0,0867 н.; б) TКMnO4=0,0027 г/мл; в) TКMnO4/Fe=0,0049 г/мл.
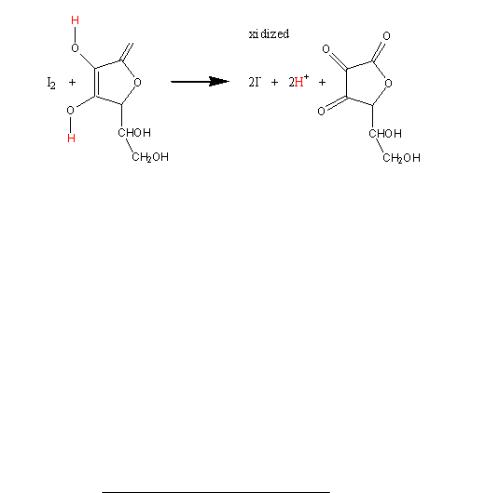
Приклад 6. Обчислити масову частку аскорбінової кислоти у 25,00 мл водного розчину (ρ = 1,0 г/см3), якщо до нього додали 10,00 мл 0,1142 н розчину I2, надлишок якого відтитрували 9,40 мл 0,0910 н розчину натрій тіосульфату .
Розв'язок. Запишемо рівняння реакцій, що лежать в основі визначення:
33
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
2S2O32- + J2 = 2I- + S4O62-
Розрахунок вмісту аскорбінової у дослідженому розчині проведемо за методом залишків, використовуючи закон еквівалентів. Кількість еквівалентів аскорбінової кислоти у розчині дорівнює кількості еквівалентів йоду, яка з нею прореагувала. Щоб знайти цю величину віднімемо від кількості еквівалентів йоду, що додали у реакційну суміш, кількість еквівалентів йоду, що залишилась після взаємодії з аскорбіновою кислотою. Остання величина дорівнює кількості еквівалентів натрій тіосульфату, що була витрачена на титрування залишку йоду. Розрахунок вмісту аскорбінової кислоти в розчині (у г) проводимо за формулою :
|
( N I |
2 |
×VI |
2 |
- N Na |
2 |
S |
2 |
O |
×VNa |
2 |
S |
2 |
O |
) × Е |
аск.к − ти |
|
mаск.к − та = |
|
|
|
|
|
3 |
|
|
3 |
|
= |
||||||
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|||
= (0,1142 ×10,0 - 0,0910 ×9,40) ×88,06 =
0,0252г
1000
де, Nȷ2.Vȷ2 - кількість еквівалентів йоду, що додали у розчин NS2O3.VS2O3 – кількість еквівалентів тіосульфату, що прореагував з надлишком йоду; Еаск.к-ти - молярна маса
еквіваленту аскорбінової кислоти, що дорівнює ½ її молярної маси, оскільки у реакції окисненявідновлення кислоти беруть участь 2 електрони.
Еаск.к - ти = |
M (аск.к − ти) |
= 88,06 |
|
||
2 |
Тепер, обчислимо масову частку аскорбінової кислоти в розчині. Оскільки об’єм дослідженого розчину 25,00 мл, а ρ =1 г/см3 , маємо:
ωаск.к - ти(%) = |
m(аск.к - ти) ×100 |
×100 = 0,0252 ×400 = 10,08% |
|
||||
|
25,00 |
|
|
||||
Відповідь: Масова частка аскорбінової кислоти в розчині ω аск. к-ти = 10,08% |
|||||||
Таблиця 1. Приклади деяких окисновідновних індикаторів |
|
||||||
|
|
|
|
|
|
|
|
Індикатор (Ind) |
|
|
|
|
Колір Indox |
Колір Indred |
EoIndox/Indred, В |
Індиго тетрасульфат |
|
|
|
синій |
безбарвний |
0,36 |
|
Метиленовий синій |
|
|
|
синій |
безбарвний |
0,53 |
|
Дифеніламін |
|
|
|
|
фіалковий |
безбарвний |
0,75 |
Дифеніламін сульфокислота |
|
червоно-фіалковий |
безбарвний |
0,85 |
|||
Тріс (2,2’-біпіридин) ферум |
|
блідоблакитний |
червоний |
1,12 |
|||
Фероїн |
|
|
|
|
блідоблакитний |
червоний |
1,15 |
Тріс (5-нітро-1,10-фенантролін) ферум |
|
блідоблакитний |
Червоно-фіалковий |
1,25 |
|||
34
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
Рекомендована література
1. Основы аналитической химии. Задачи и вопросы: Учебное пособие для вузов. /В.И.Фадеева, Ю.А.Барбалат, А.В.Гармаш и др. Под ред. Ю.А.Золотова – М.: Высш. шк.,
2004. – С. 156–165.
2. А. К. Бабко, И. В. Пятницький. Кількісний аналіз. – К.: Вища школа, 1974. – С. 250–
302.
3. Є.М.Дорохова, Г.В.Прохорова. Задачі та запитання з аналітичної хімії: Навч. посібник.
– К.: Видавничо-поліграфічний центр „ Київський університет“, 2001. – С. 91–113.
4. Основы аналитической химии. Кн.2. Методы химического анализа: Учеб. для вузов / Ю.А.Золотов, Е.Н.Дорохова, В.И. Фадеева и др. Под ред. Ю. А. Золотова – М.: Высш.
шк., 2002. – С. 82–96.
5.Д. Скуг, Д. Уэст, Основы аналитической химии. – М.: Мир, 1979. – Т. 1. – С. 321–414.
6.А. Т. Пилипенко, И. В. Пятницкий. Аналитическая химия. – М.: Химия, 1990. – С. 369–
439.
7. Контрольні запитання з кількісного аналізу для самостійної роботи студентів другого курсу хімічного факультету /Під ред. В.В.Сухана. – К.: КДУ, 1989. – С. 24–31.
8. Методичні вказівки до лабораторних робіт з аналітичної хімії для студентів другого курсу хімічного факультету / За заг. ред. О.А.Запорожець – К.: Видавничо-поліграфічний центр „ Київський університет”, 2005. – С. 10–15.
35

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
МЕТОДИ ОСАДЖЕННЯ ТА КОМПЛЕКСОУТВОРЕННЯ
Перелік питань з методів осадження та комплексоутворення, що виносяться на розгляд на семінарських заняттях
1.Методи комплексоутворення: меркуриметрія, комплексонометрія. Поняття про комплексони, комплексон III (трилон Б).
2.Протолітична рівновага етилендіамінтетраацетатної кислоти (ЕДТА) у водних розчинах, особливості комплексоутворення з катіонами металів.
3.Стійкість комплексів металів з ЕДТА, константи стійкості комплексних сполук - термодинамічні, концентраційні, умовні.
4.Робочий розчин методу трилонометрії. Металохромні індикатори - їх загальна характеристика, особливості дії. Визначення індивідуальних іонів металів у суміші за допомогою Трилону Б на прикладі визначення магнію(II) і кальцію(II). Застосування комплексонометрії у методах прямого, зворотнього титрування та за методом витіснення. Визначення загальної твердості води.
5.Загальна характеристика методів осадження. Меркурометрія. Аргентометрія. Робочі розчини методу аргентометрії, способи встановлення їх концентрацій.
6.Визначення хлоридів за методами Мора, Фольгарда, Фаянса (з адсорбційними індикаторами) – суть методів, індикатори, іони, що заважають, особливості застосування в аналізі реальних об’єктів.
7.Аргентометричне визначення галогенідів та псевдогалогенідів.
Контрольні запитання для самопідготовки
1.Перерахуйте основні вимоги до реакцій, що використовуються в методі комплексоутворення.
2.Які титранти використовують у методі комплексоутворення?
3.Розкрийте суть меркуриметричного визначення іонів: робочий розчин, індикатори. Які іони можна визначати цим методом? Напишіть відповідні рівняння реакцій.
4.Які органічні реактиви називаються комплексонами? Охарактеризуйте їх будову і властивості.
5.Які способи встановлення точки кінця титрування існують в методі комплексонометрії?
6.За допомогою діаграм розподілу охарактеризуйте протолітичні рівноваги етилендіамінтетраацетатної кислоти (ЕДТА) у водному розчині.
7.Як готують робочий розчин Трилону Б?
8.Які індикатори використовують в комплексонометрії? Опишіть принцип їх дії на прикладі еріохромчорного Т.
Рис 1
9. Розкрийте суть трилонометричного визначення іонів металів, принцип вибору умов титрування (рН розчину, індикатор).
36

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
10.На прикладі магнію та кальцію продемонструйте можливість комплексонометричного визначення катіонів металів у їх суміші. Які підходи для цього використовують?
11.Чим обумовлена загальна твердість води? Суть комплексонометричного визначення загальної твердості води: рН розчину, індикатор, рівняння реакцій, що лежать в основі. Навести формулу розрахунку загальної твердості води.
12.Чому при комплексонометричному визначені іонів металів необхідно застосовувати буферні розчини?
13.† Що таке зворотнє титрування в методі комплексонометрії? У яких випадках застосовують зворотнє титрування? Напишіть рівняння відповідних реакцій.
14.*Що таке титрування за методом витіснення? У яких випадках застосовують цей метод титрування в комплексонометрії? Наведіть приклади та відповідні рівняння реакцій.
15.Які речовини можна визначати комплексонометрично прямим, а які - зворотнім титруванням? Навести приклади.
16.Які фактори впливають на величину стрибка на кривій комплексометричного титрування? Як можна збільшити цей стрибок? Відповідь обґрунтувати.
17. Яким вимогам мають відповідати реакції осадження, що використовують в об’ємному аналізі?
18.Як впливають температура, добуток розчинності, іонна сила розчину, концентрація розчинів на величину стрибка кривої осаджувального титрування?
19.Назвіть найбільш поширені методи осаджувального титрування і охарактеризуйте їх.
20.Як приготувати робочий розчин в методі аргентометрії? Чи потрібно його стандартизувати? Напишіть відповідні рівняння реакцій.
21.Для визначення яких іонів застосовується метод Мора? Назвіть робочий розчин та індикатор методу. Напишіть рівняння реакцій, що лежать в основі визначення хлоридів за цим методом.
Рис 2
22.Які аніони та катіони заважають визначенню хлоридів за методом Мора? Поясніть чому?
23.Для визначення яких іонів застосовується метод Фольгарда? Назвіть робочі розчини та індикатор цього методу. Напишіть рівняння реакцій, що лежать в основі визначення хлоридів за методом Фольгарда.
24.У чому полягають переваги та недоліки методу Фольгарда у порівнянні з методом Мора?
25.На чому ґрунтується використання адсорбційних індикаторів в аргентометрії? Назвіть такі індикатори, наведіть їх формули. Як відбувається визначення хлоридіонів за методом Фаянса? Напишіть відповідні рівняння реакцій.
Рис 3
† Запитання підвищеної складності
37
ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
26.Суть безіндикаторного методу осаджувального титрування.
27.Порівняйте переваги та недоліки методів меркурометрії та аргентометрії.
Вправи для самопідготовки
1.Напишіть структурні формули таких реагентів: дифенілкарбазиду, дифенілкарбазону, комплексону ІІІ, диметилгліоксиму, 8-гідроксохіноліну, еріохромчорного Т?
2.Опишіть принцип дії індикатору дифенілкарбазиду при меркуриметричному визначення хлоридів.
3.Які індикатори можна застосовувати при визначенні хлоридів титруванням робочим розчином Hg(NO3)2? На чому ґрунтується принцип їх дії?
4.Чому комплексонометричне визначення іонів алюмінію (ІІІ) проводять методом зворотнього титрування?
5.Чому при комплексонометричному визначенні твердості води в точці еквівалентності колір індикатору еріохромчорного Т змінюється з винно-червоного на синій? При якому рН проводять визначення? Відповідь обгрунтуйте.
6.Напишіть рівняння реакцій утворення комплексних сполук ЕДТА з катіонами Сa(II), Fe(III), Zr(IV). Чому дорівнює молярна маса еквіваленту Трилону Б при титруванні цих іонів?
7.Чи можна визначати окремо Ca2+ та Mg2+ у суміші комплексонометричним методом? Якщо так, то за яких умов? Напишіть рівняння відповідних реакцій. Який іон металу утворюватиме комплекс з ЕДТА в менш лужному середовищі? Значення логарифмів констант стійкості комплексів металів з ЕДТА, lgK: 10,59 (Ca2+); 9,12 (Mg2+).
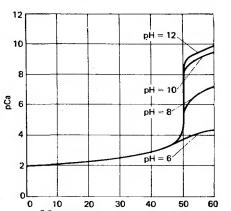
8.Пояснити, чому вигляд кривої титрування водного розчину Са2+ трилоном Б так залежить від рН розчину (рис)?
Рис. Криві титрування 0,010 М розчину Ca2+ 0,010 М розчином трилону Б.
Об’єм 0,010 М трилону Б, мл
9.Чи можна визначити окремо іони Fe3+ та Ni2+ у суміші комплексонометричним методом? Якщо так, то за яких умов? Напишіть рівняння відповідних реакцій. Який із іонів металу утворюватиме комплекс з ЕДТА в більш кислому середовищі? Значення логарифмів констант стійкості комплексів металів з ЕДТА, lgK: 24,23 (Fe3+); 18,62 (Ni2+).
38

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
10.Чи можна комплексонометрично визначити кожний з іонів, при їх сумісній присутності? Відповідь обґрунтуйте. Який іон металу утворюватиме комплекс з ЕДТА в більш кислому середовищі? Значення логарифмів констант стійкості комплексів металів з ЕДТА, lgK: 24,23 (Fe3+); 16,31 (Co2+); 10,59 (Ca2+); 27,4 (Bi3+); 18,04 (Pb2+); 16,26 (Zn2+); 9,12 (Mg2+); 16,5 (Al3+).
а) Fe3+, Co2+, Сa2+; б) Bi3+, Pb2+;
в) Zn2+, Mg2+; г) Fe3+, Ca2+;
д) Fe3+, Al3+, Mg2+.
11.Чому комплексонометричне визначення більшості катіонів із зарядом 3+ та 4+ проводять у кислому середовищі?
12.Як визначити SO42-, PO43-, С2О42-, використовуючи як титрант Трилон Б? Напишіть відповідні рівняння реакцій.
13.Чому дорівнює молярна маса еквіваленту Трилону Б при визначенні загальної твердості води? Мr (Na2H2Y) = 336,21.
14.Значення логарифмів констант стійкості комплексів деяких іонів металів з ЕДТА мають такі значення lgK: 24,23 (Fe3+); 16,5 (Al3+), 16,26 (Zn2+); 18,8 (Cu2+); 14,04 (Mn2+). У яких з наведених нижче сумішах можна визначити кожний метал окремо комплексонометричним титруванням, регулюючи рН середовища? Відповідь пояснити.
а) Al3+ та Zn2+; |
б) Cu2+ та Al3+; |
в) Fe3+ та Zn2+; |
г) Fe3+ та Mn2+; д) Zn2+ та Cu2+. |
|
|
16. При титруванні яких з наведених нижче розчинів (варіанти1 та 2) величина стрибка титрування буде найбільшою, якщо титрант - розчин Hg2(NO3)2? Відповідь поясніть. (
Ks0 (Hg2Cl2) = 1,3 · 10-18; Ks0 (Hg2Br2) = 5,8 · 10-23; Ks0 (Hg2I2) = 4,5 · 10-29).
Варіант 1: |
а) 0,01 н NaCl |
б) 0,1 н NaCl |
в) 1 н NaCl; |
Варіант 2: |
а) 0,1 н NaCl |
б) 0,1 н NaBr |
в) 0,1 н NaI |
17. Розчини наведених нижче іонів металів (варіанти 1 та 2) титрують Трилоном Б. При титруванні якого розчину величина стрибка титрування буде найбільшою, а якого – найменшою? Значення логарифмів констант стійкості комплексів металів з ЕДТА, lgK:
16,26 (Zn2+); 18,80 (Cu2+); 9,12 (Mg2+):
Варіант 1. |
0,01 М розчини (рН=10): а) MgSO4 б) CuSO4 в) ZnSO4; |
||
Варіант 2. |
Розчин ZnSO4 : а) 0,1 М |
б) 0,05 М |
в) 0,01 М. |
18.У якому порядку будуть випадати осади при аргентометричному визначенні суміші, що містить іони Cl– , Br– , I– однакової концентрації? Намалюйте схематично криву титрування цієї суміші, позначте осі. ( Ks0 (АgCl) = 1,78 · 10-10; Ks0 (АgBr) = 5,3 · 10-13;
Ks0 (АgI) = 8,3 · 10-17).
19.Чи можна визначати хлориди за методом Фольгарда за умов, що зазначені нижче: а) у присутності HNO3(конц.), C2О42-, AsO43-, I-;
39

ОБ’ЄМОМЕТРИЧНІ МЕТОДИ АНАЛІЗУ
б) у присутності солей Hg(II); в) у присутності карбонат-іонів; г) у лужному середовищі;
д) у присутності солей Cu2+ та H2SO4. е) у присутності фосфат-іонів.
Запитання до практикуму
1.Для визначення загальної твердості пробу води розбавили до 100 мл дистильованою водою, додали індикатор еріохромчорний Т до утворення червоного забарвлення і відтитрували робочим розчином Трилону Б до зміни забарвлення в синій колір. Розрахунок провели за формулою:
= N тр. ×Vтр. ×1000
H
Vводи
Результат виявився невірним. У чому полягає помилка визначення?
2.Вміст хлориду у газованій воді, одержаної шляхом насичення природної води діоксидом вуглецю, визначали так: відібрали піпеткою певний об’єм води,
нейтралізували до рН 9,0 додали розраховану кількість К2CrO4 і відтитрували розчином AgNO3. Вміст Сl- розрахували за формулою:
B(г) = N AgNO3 ×VAgNO3 × ECl -
Vводи
Результат аналізу виявився хибним. Поясніть чому.
3.При визначенні вмісту бромід іонів відібрали аліквотну частину задачі об’ємом 10,00 мл, додали 10 мл розчину нітратної кислоти, додали 10,00 мл робочого розчину
AgNO3 та 1-2 мл краплину розчину залізо-амонійних галунів. Вміст колби відтитрували стандартним розчином NH4SCN до появи червоного забарвлення розчину. Вміст Br- (г) розраховували за формулою:
B(Br - ) = |
V |
зад. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- ) ×10 - 3 |
|
× |
С |
AgNO |
|
×V |
AgNO |
|
- C |
NH |
|
SCN |
×V |
NH |
|
|
× M (Br |
|||
|
|
|
|
|
|
||||||||||||||
|
Vал. |
|
|
3 |
|
3 |
|
4 |
|
4 |
SCN |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Результат аналізу виявився хибним. Поясніть чому.
4.Для визначення загальної твердості води до проби об’ємом 50,00 мл додали буферний розчин до рН = 10, додали індикатор еріохромчорний Т і відтитрували робочим розчином трилону Б до зміни забарвлення з вишневого на синій. Розрахунок твердості води провели за формулою: H = Nтр. ×Vтр. ×50 . Результат виявився хибним. В чому помилка?
5.Визначення хлориду меркуриметричним методом виконували так. Наважку досліджуваної речовини розчинили у воді і довели об’єм до 100,0 мл. Аліквотну частину (20,00 мл) перенесли у конічну колбу, додали 80 мл дистильованої води, 5 краплин 2%-ного етанольного розчину дифенілкарбазону, 10 мл HNO3 (1:1) і
40
