
L01-MolecPhys [Режим совместимости]
.pdf
06.09.2012
Основы молекулярной физики и термодинамики Лекция № 1
Молекулярно-кинетическия теория идеальных газов
Курс физики: учеб. пособие для вузов / Т. И. Трофимова. - М.: Издательский центр
"Академия", -11-е изд., стер. , 2006. - 560 с
2Статистический и термодинамический методы
•Процессы, изучаемые молекулярной физикой,
являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями,
изучаются с помощью статистического метода.
•Термодинамика имеет дело с термодинамической
системой – т.е. совокупностью макроскопических тел,
которые взаимодействуют и обмениваются энергией,
как между собой, так и с другими телами (внешней
средой). Основа термодинамического метода –
определение состояния термодинамической
системы.
1

06.09.2012
3 Опытные законы идеального газа
• Закон Бойля – Мариотта: Для данной массы газа при
постоянной температуре произведение давления газа
на его объем есть величина постоянная.
pV const |
(1.1) |
• при Т = const, m = const
• Законы Гей-Люссака: 1) объем данной массы газа при
постоянном давлении изменяется линейно с
температурой:.
V V0 (1 t) |
(1.2) |
• при p = const, m = const
4 Опытные законы идеального газа
• 2) давление данной массы газа при постоянном
объеме изменяется линейно с температурой.
p p0 (1 t) |
(1.3) |
|||
• при V = const, m = const. |
|
|||
• V0 и p0 – объем и давление при 0 ºC, |
|
|||
• α = 1/273.15 К–1, t – температура в ºС. |
|
|||
T t |
1 |
|
|
|
|
|
|||
|
|
|
||
V1 |
T1 |
(1.4) |
||
V |
T |
|
||
2 |
2 |
|
|
|
• при p = const, m = const
2

06.09.2012
5Опытные законы идеального газа
p1 |
|
T1 |
(1.5) |
|
p |
||||
|
T |
|
||
2 |
|
2 |
|
•при V = const, m = const
•Индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре
Закон Авогадро. 1 моль любого газа при одинаковых
температуре и давлении занимает одинаковый объем. По определению, 1 моль различных веществ содержит
одно и то же число молекул, называемое постоянной Авогадро:
NA = 6.022 1023 моль–1.
6Опытные законы идеального газа
•Закон Дальтона: давление смеси идеальных газов
равно сумме парциальных давлений р1, р2, …, рn
входящих в нее газов.
•Парциальное давление – давление, которое производил бы газ, входящий в состав газовой смеси,
если бы он один занимал объем, равный объему смеси
при той же температуре
•Уравнение Клапейрона – Менделеева. В соответствии
с законами Бойля – Мариотта и Гей-Люссака для одной
и той же массы газа в двух произвольных состояниях
можно получить
p1V1 p2V2 .
T1 T2
3

06.09.2012
7Опытные законы идеального газа
pV |
B const. |
(1.6) |
|
T |
|||
|
|
•Выражение (1.6) является уравнением Клапейрона, в
котором В – газовая постоянная, различная для разных
газов
•Менделеев объединил уравнение Клапейрона с
законом Авогадро, отнеся уравнение к 1 моль газа,
использовав молярный объем Vm. Согласно закону Авогадро, при одинаковых р и Т молярные объемы Vm
различных газов одинаковы, поэтому постоянная В
будет одинаковой для всех газов. Эта общая для всех
газов постоянная обозначается буквой R и называется
универсальной или молярной газовой постоянной.
8Опытные законы идеального газа
pVm RT |
(1.7) |
• Уравнению (1.7) удовлетворяет лишь идеальный газ, и
оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона–
Менделеева
• От уравнения (1.7) для 1 моль газа можно перейти
уравнению для произвольной массы газа. Если при
некоторых заданных давлении и температуре 1 моль газа занимает молярный объем Vm, то при тех же
условиях масса m газа займет объем, m V M Vm
• где М – молярная масса (масса 1 моль вещества).
4

06.09.2012
9 Опытные законы идеального газа
• Уравнение Клапейрона–Менделеева для массы m газа
будет
|
pV |
|
m |
|
RT RT, |
(1.8) |
||||
|
|
M |
||||||||
|
|
|
|
m |
|
|
|
|||
• |
где |
|
|
– количество вещества |
||||||
|
M |
|||||||||
|
|
|
|
|
|
|
R |
|
||
• |
Вводя постоянную Больцмана k |
|||||||||
NA |
||||||||||
|
|
|
|
|
|
|
|
|||
• Уравнение состояния (1.7) можно записать в виде
p RT kNAT nkT Vm Vm
10 |
Опытные законы идеального |
||||
|
|
газа |
|
||
|
• |
где |
NA |
n |
– концентрация молекул |
|
|
||||
|
|
|
V |
|
|
|
|
|
m |
|
|
|
• |
Таким образом, из уравнения |
|||
|
|
p nkT |
(1.9) |
||
• следует, что давление идеального газа при данной температуре пропорционально концентрации его
молекул (или плотности газа)
5

06.09.2012
11Основное уравнение молекулярнокинетической теории идеальных газов
•Выделим на стенке сосуда
некоторую элементарную
площадку ∆S (рис. 66) и
вычислим давление, оказываемое на эту площадку
•При каждом соударении молекула, движущаяся
перпендикулярно площадке
передает ей импульс
Рис. 66
m0v ( m0v) 2m0v
•где m0 – масса молекулы, v – ее скорость. За время ∆t
площадки ∆S достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием ∆S и высотой v∆t (см. рис. 66) Число этих молекул равно n∆Sv ∆t (n – концентрация молекул)
12Основное уравнение молекулярнокинетической теории идеальных газов
•Число ударов молекул, движущихся в заданном направлении, о площадку ∆S будет
16 n Sv t.
•При столкновении с площадкой эти молекулы
передадут ей импульс
P 2m0v 16 n Sv t 13 nm0v2 S t
•Тогда давление газа, оказываемое им на стенку
сосуда,
p |
P |
|
1 nm v2. |
(1.10) |
|
|
|||||
|
t S |
|
3 |
0 |
|
|
|
|
|
||
6
06.09.2012
13Основное уравнение молекулярнокинетической теории идеальных газов
•Если газ в объеме V содержит N молекул, движущихся
со скоростями v1, v2, … vN, то целесообразно рассматривать среднюю квадратичную скорость
|
1 |
N |
|
|
vкв |
vi2 , |
(1.11) |
||
|
||||
|
N i 1 |
|
||
•характеризующую всю совокупность молекул газа.
Уравнение (1.10) с учетом (1.11) примет вид
p |
1 nm |
v |
2 . |
(1.12) |
|
|
3 |
0 |
кв |
|
|
|
|
|
|
|
|
•Выражение (1.12) называется основным уравнением
молекулярно-кинетической теории идеальных газов.
14Основное уравнение молекулярнокинетической теории идеальных газов
•Учитывая, что n VN , получим
pV |
1 Nm |
v |
2 , |
|
|
(1.13) |
|||
|
3 |
|
0 |
кв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV |
2 |
N |
m0 |
vкв |
2 |
|
2 |
E, |
(1.14) |
3 |
|
2 |
|
3 |
|||||
|
|
|
|
|
|
|
|||
•где Е – суммарная кинетическая энергия
поступательного движения всех молекул газа
7

06.09.2012
15Основное уравнение молекулярнокинетической теории идеальных газов
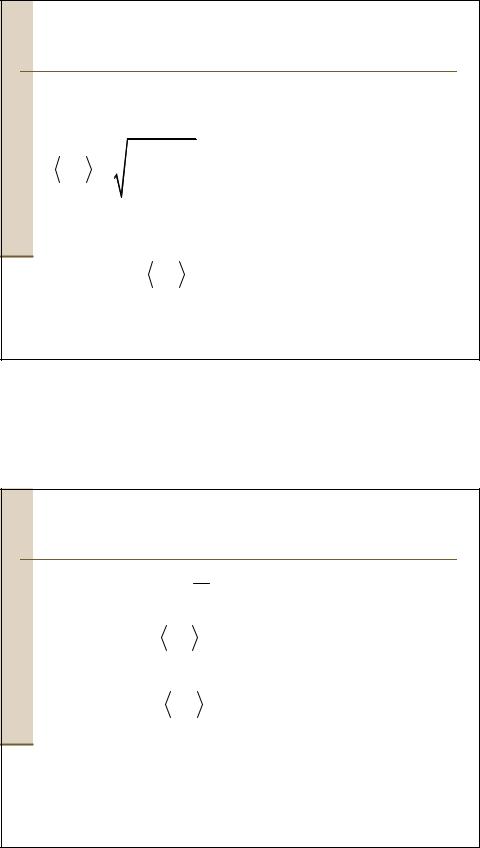
• Так как масса газа m = Nm0 , то уравнение (1.13)
можно переписать в виде
pV 13 m vкв
vкв 2 .
2 .
• Для 1 моля газа m =M (M – молярная масса), поэтому
pVm 13 M  vкв
vкв 2 ,
2 ,
•где Vm – молярный объем
•С другой стороны, по уравнению Клапейрона–
Менделеева, pVm =RT (где R – универсальна газовая
постоянная, а Т – абсолютная или
термодинамическая температура). Таким образом:
16Основное уравнение молекулярнокинетической теории идеальных газов
RT 1 M v |
2 |
, |
• откуда |
|
|
3 |
кв |
|
|
|
|
3RT |
|
|
|
|
|
v |
. |
|
(1.15) |
|
|
|
|
|
|||
кв |
M |
|
|
|
|
|
|
|
|
|
|
• Так как |
M m0 N A , где m0 – масса одной молекулы, |
||||
•а NA – постоянная Авогадро (число молекул в одном моле), то из уравнения (1.15) следует, что
v |
|
|
3RN |
|
3kN , |
(1.16) |
|
|
|
|
|||||
кв |
|
m0 NA |
m0 |
|
|||
|
|
|
|
||||
где |
k |
R |
– постоянная Больцмана. |
|
|||
|
|
||||||
|
|
NA |
|
|
|||
8

06.09.2012
17Основное уравнение молекулярнокинетической теории идеальных газов
•С учетом равнений (1.14) и (1.16), средняя
кинетическая энергия поступательного движения одной молекулы идеального газа
0 |
|
E |
|
m0 |
vкв |
2 |
|
3 |
kT , |
(1.17) |
N |
|
2 |
|
2 |
||||||
|
|
|
|
|
|
|
|
•пропорциональна термодинамической температуре и зависит только от нее.
•Таким образом, термодинамическая температура
является мерой средней кинетической энергии
поступательного движения молекул идеального газа,
и формула (1.17) раскрывает молекулярно-кинетическое толкование температуры
18Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
•По молекулярно-кинетической теории, как бы ни
изменялись скорости молекул при столкновениях,
средняя квадратичная скорость молекул с массой m0
в газе, находящемся в состоянии равновесия при постоянной температуре (Т = const), остается
постоянной и равной
vкв 3kT .
m0
dN(v) |
f (v)dv, |
|
N |
|
|
f (v) dN(v) . |
Рис. 67 |
|
|
Ndv |
|
9

06.09.2012
19Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
•Применяя методы теории вероятностей, Максвелл
нашел функцию
f(v) – т.е. закон распределения молекул по скоростям:
|
m |
3/2 |
2 |
|
m0v2 |
|
f (v) 4 |
0 |
|
v |
e |
2kT . |
(1.18) |
|
||||||
|
2 kT |
|
|
|
|
|
f (v)dv 1.
0
•Скорость, при которой функция распределения
молекул идеального газа по скоростям максимальна,
называется наиболее вероятной скоростью
20Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
|
|
d |
|
|
|
|
|
|
|
m0v2 |
|
|
m0v |
2 |
|
m0v2 |
|
|
|
|
v2e |
2kT |
|
2v 1 |
|
e |
2kT 0. |
||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2kT |
|
||
|
|
dv |
|
|
|
|
|
|
|
|||||||
|
|
v |
|
|
|
2kT |
|
2RT |
|
|
|
(1.19) |
||||
|
|
в |
|
|
|
|
|
|
m0 |
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||
|
v |
|
|
vdN (v) vf (v)dv. |
|
|
||||||||||
|
N |
|
|
|||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
0 |
|
0 |
|
|
|
|
||||
v |
|
|
8kT |
|
|
|
8RT . |
(1.20) |
|
|||||||
|
m |
|
|
Рис. 68 |
||||||||||||
|
|
|
|
|
|
|
M |
|
|
|
||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
10
