- •Модели атомов
- •Строение
- •Двойственная природа электрона
- •Принцип Паули
- •Правило Гунда
- •Многоэлектронные атомы
- •Изменение свойств атомов по периодам и группам псэ
- •Ковалентная связь. Метод валентных связей
- •Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
- •3) По заряду внутренней сферы.
- •Природа химической связи в комплексных соединениях
- •Природа водородной связи
- •Свойства
- •Водородная связь в нуклеиновых кислотах и белках
- •Водородная связь в полимерах
- •1) Методы титриметрии:
- •Названия полимеров
- •Полимеризация и поликонденсация
- •Реакции в цепях полимеров
- •50.51.52.53. Основы химической термодинамики. Термохимия
- •II закон термодинамики имеет ясный физический смысл только тогда, когда его применяют к любой ограниченной системе.
- •3.2.2. Зависимость скорости реакции от концентрации реагентов
- •3.2.4. Механизмы химических реакций
- •Осмотический закон Вант-Гоффа.
- •Коллоидные растворы.
- •Применение гальванических элементов. Понятие эдс.
- •Классификация электродов.
- •Электрохимические источники тока.
- •Устройство и принцип действия, применение щелочных аккумуляторов.
- •70. Коррозия металлов.
- •Типы коррозии.
- •Механизмы коррозионных разрушений.
- •Виды электрохимической коррозии металлов с водородной и кислородной деполяризацией катода.
- •Методы защиты металлов от коррозии.
3.2.4. Механизмы химических реакций
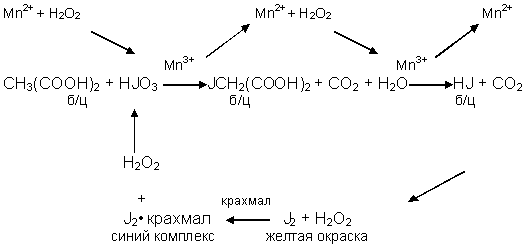
Под механизмом химических реакций понимается последовательность протекания простейших стадий реакции. Классификация химических реакций по механизмам протекания представлена на рис. 36.
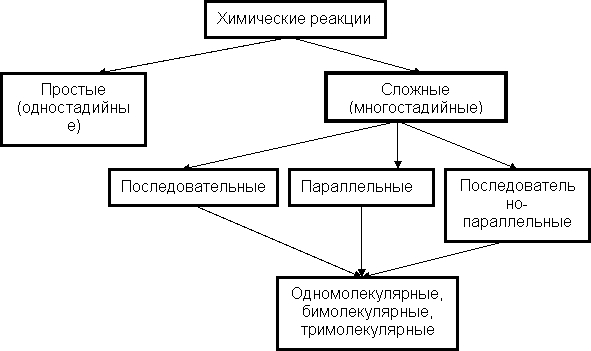
Рис. 36. Классификация химических реакций по механизму протекания
Число молекул реагентов, принимающих участие в элементарной стадии реакции, называется молекулярностью реакции. Одностадийные реакции с молекулярностью более трех неизвестны.
Простые (одностадийные) реакции протекают через образование активированного комплекса, порядок реакции совпадает с молекулярностью, а кинетическое уравнение процесса – с законом действующих масс. К реакциям подобного типа относятся реакции:
–
диссоциации 2HJ →
H2 +
J2, ![]() ;
;
–
соединения NO + O3 =
NO2 +
O2, ![]()
К сложным реакциям относятся реакции, протекающие последовательно или параллельно через несколько стадий. Скорость реакции будет определять самая медленная (лимитирующая) стадия процесса. Например, реакция разложения N2O5, 2N2O5 = 4NO2 + O2 протекает через несколько стадий:
N2O5 ↔ NO2+ NO3 (быстрая стадия);
NO2 + NO3 → NO2 + NO + O2 (медленная стадия);
NO + NO3 ↔ 2NO2 (быстрая стадия).
Лимитирующей
является вторая (бимолекулярная) стадия
процесса: ![]() ,
порядок реакции в данном случае (n = 1 + 1
= 2) совпадает с молекулярностью суммарной
реакции разложения N2O5,
однако такое равенство не всегда имеет
место.
,
порядок реакции в данном случае (n = 1 + 1
= 2) совпадает с молекулярностью суммарной
реакции разложения N2O5,
однако такое равенство не всегда имеет
место.
В последнее время все больше внимания уделяется периодическим процессам (колебательным реакциям). Такие периодические процессы характеризуются колебаниями концентраций некоторых промежуточных соединений и, соответственно, скоростей этих стадий процесса. Реакции были открыты в середине прошлого века Б.П. Белоусовым (Россия).
Примером подобных процессов является реакция окисления малоновой кислоты СН3(СООН)2 избытком перекиси водорода Н2О2 в присутствии иодат ионов JO3– и ионов марганца Mn2+, играющих роль катализатора, а также индикатора – крахмала. На рис. 37 представлена схема протекания этого процесса.
|
|
|
Рис. 37. Схема колебательной реакции окисления малоновой кислоты
В ходе реакции окраска раствора периодически меняется: желтая, темно-синяя, бесцветная, – затем цикл повторяется. Колебания прекращаются после полного окисления малоновой кислоты. Изменение окраски связано с периодическим изменением концентрации: JO3–, J2, J2∙крахмал. Период колебаний зависит от концентрации веществ и температуры процесса.
Механизм протекания колебательных реакций очень сложен и объясняется на основе термодинамически необратимых процессов.
В начале прошлого века российские ученые Н.А. Шилов и Н.Н. Семенов разработали теорию цепных реакций. Такие реакции встречаются часто: горение топлива в двигателях внутреннего сгорания, реакции полимеризации, реакции, протекающие в атмосфере и пр.
Цепные реакции начинаются со стадии инициирования, т. е. образования активных частиц (свободных радикалов), которые представляют собой осколки молекул, имеющих неспаренные электроны: Cl*, O*, HS* и др. Свободные радикалы образуются при воздействии на систему света, тепла, излучения высокой энергии, либо в ходе экзотермических процессов (горение органического топлива в двигателях внутреннего сгорания). Появление свободных радикалов называется стадией зарождения цепи. Далее идет рост цепи – радикалы взаимодействуют с молекулами, образуя продукты реакции и новые радикалы. Процесс заканчивается обрывом цепи, когда радикалы, взаимодействуя друг с другом или с молекулами, образуют другие нейтральные молекулы.
57.58.59.
Понятия о катализе
Наиболее мощным способом интенсификации химических процессов является применение катализаторов.
Катализаторы – это вещества, которые ускоряют химические процессы, но при этом не испытывают превращений в ходе реакции. Явление изменения скорости реакции под действием таких веществ называется катализом.
Как правило, катализаторы обладают селективным, т. е. избирательным действием, подбирая вид катализатора, можно изменить ход протекания реакции.
Например, этанол С2Н5ОН в присутствии оксидов алюминия и тория разлагается на этилен С2Н4 и воду:
С2Н5ОН ![]() С2Н4 +
Н2О,
С2Н4 +
Н2О,
в присутствии никеля, железа, серебра или меди – на ацетальдегид СН3СОН и водород:
С2Н5ОН![]() СН3СОН
+ Н2.
СН3СОН
+ Н2.
Сущность
действия катализаторов очень сложна и
до конца не изучена. Предполагается,
что в каталитических процессах снижается
энергия активации реакции ![]() (см.
рис. 35), так как в присутствии катализатора
образуются другие промежуточные
активированные комплексы, которые
требуют меньшей энергии образования,
чем в реакциях, протекающих без
катализатора. Многие молекулы исходных
веществ, энергия которых была недостаточна
для активных столкновений в обычных
реакциях, в присутствии катализатора
становятся активными. Следовательно,
(см.
рис. 35), так как в присутствии катализатора
образуются другие промежуточные
активированные комплексы, которые
требуют меньшей энергии образования,
чем в реакциях, протекающих без
катализатора. Многие молекулы исходных
веществ, энергия которых была недостаточна
для активных столкновений в обычных
реакциях, в присутствии катализатора
становятся активными. Следовательно, ![]() .
Катализаторы увеличивают скорость
реакции
.
Катализаторы увеличивают скорость
реакции ![]() ,
но не влияют на термодинамику процесса,
т. е. не изменяют величины
,
но не влияют на термодинамику процесса,
т. е. не изменяют величины ![]() и
и ![]() .
На активность катализатора влияют промоторы –
вещества, при добавлении в небольших
количествах которых, эффективность
действия катализатора повышается,
икаталитические
яды –
вещества, снижающие каталитическую
активность.
.
На активность катализатора влияют промоторы –
вещества, при добавлении в небольших
количествах которых, эффективность
действия катализатора повышается,
икаталитические
яды –
вещества, снижающие каталитическую
активность.
Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одном фазовом состоянии (газ, жидкость).
Пример, промышленное получение серной кислоты.
Реакция окисления: 2H2SO3 + O2 = 2H2SO4 – протекает медленно, она заменяется на быстрые каталитические реакции, где катализатором является NO:
O2 + 2NO = 2NO2, NO2 + H2SO3 = H2SO4 + NO.
Таким образом, гомогенные каталитические реакции протекают через образование промежуточных соединений, в которых участвует катализатор.
Многие природные и физиологические процессы, катализируемые ферментами, протекают по механизму гомогенного катализа: расщепление белков, дегидратация СО2 из крови и т. д.
При гетерогенном катализе катализатор и реагенты находятся в разных фазовых состояниях, чаще всего катализатор – твердое вещество, и реакция протекает на поверхности катализатора. Скорость такой реакции зависит от площади поверхности катализатора, поэтому последний часто наносят на вещества с развитой поверхностью – подложку (пористые угли, силикаты и пр.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через образование активных промежуточных соединений, которые представляют собойповерхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий (подвод реагентов в зону реакции, адсорбция на поверхности катализатора, собственно химическая реакция, десорбция), в которых участвуют и промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор – не расходуется.
Гетерогенный катализ в промышленности применяется при получении аммиака, азотной и серной кислот, водорода и пр. К наиболее распространенным катализаторам относятся: Pt,Ni, Pd, CuO, V2O5, Al2O3, SiO2 и др. Применение каталитических процессов обеспечивает экономию сырья и энергии, а также решает экологические задачи. Например, катализаторы применяют для доокисления токсичных выхлопных газов в двигателях внутреннего сгорания до нетоксичных компонентов:
CnHm +
qO2 ![]() nCО2 + m/2Н2О,
nCО2 + m/2Н2О,
2NO
+ 2CO ![]() N2 +2CO2 +
690 кДж (в качестве катализатора используется
металлическая вата из нержавеющей стали
или сплавы никеля).
N2 +2CO2 +
690 кДж (в качестве катализатора используется
металлическая вата из нержавеющей стали
или сплавы никеля).
3.2.6. Необратимые и обратимые реакции, химическое равновесие
Все химические реакции делятся на две группы: необратимые и обратимые.
Необратимые реакции протекают в одном направлении, до полного израсходования одного из реагирующих веществ, обязательное условие их протекания – удаление продуктов реакции из сферы реакции (в виде газа, нерастворимого соединения или слабого электролита).
Пример:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2↑ + 2H2O.
Обратимые реакции протекают в двух взаимно противоположных направлениях, реакция не идет до конца, т. е. ни одно из реагирующих веществ не расходуется полностью, реакция идет до определенного предела, называемого химическим равновесием.
Рассмотрим обратимый процесс: H2 + J2 ↔ 2HJ.
В
начальный момент времени (![]() ) концентрации
исходных веществ равны:
) концентрации
исходных веществ равны: ![]() ,
а концентрация продуктов реакции
отсутствовала:
,
а концентрация продуктов реакции
отсутствовала: ![]() =
0. При этих условиях реакция протекает
только в прямом направлении, кинетическое
уравнение имеет вид:
=
0. При этих условиях реакция протекает
только в прямом направлении, кинетическое
уравнение имеет вид:
![]() .
(41)
.
(41)
Скорость обратной реакции в начальный момент времени равна нулю:
![]() .
(42)
.
(42)
В
ходе прямой реакции концентрации
водорода и иода непрерывно
уменьшаются, в соответствии с этим
пропорционально снижается скорость
прямого процесса. Одновременно с этим
нарастает концентрация продукта реакции
HJ и в момент времени ![]()
![]() ≠
0. Появляются условия, определяющие
протекание обратной реакции, кинетическое
уравнение обратного процесса имеет
вид:
≠
0. Появляются условия, определяющие
протекание обратной реакции, кинетическое
уравнение обратного процесса имеет
вид:
![]() .
(43)
.
(43)
По
мере нарастания концентрации иодоводорода HJ
увеличивается скорость обратной реакции,
в момент времени ![]() ,
когда скорости прямой и обратной реакции
выравниваются:
,
когда скорости прямой и обратной реакции
выравниваются:
![]() ,
(44)
,
(44)
наступает динамическое химическое равновесие системы.
Химическое равновесие – это такое состояние системы, при котором скорости прямого и обратного процессов равны, а концентрации всех веществ, участвующих в процессе, перестают изменяться и называются равновесными.
Состояние
равновесия характеризует тот предел,
к которому в данных условиях обратимая
реакция протекает самопроизвольно, ![]() →
0.
→
0.
В формуле (44) выразим скорости реакций через равновесные концентрации реагирующих веществ:
![]() .
(45)
.
(45)
Перенесем константы в одну сторону уравнения, а равновесные концентрации – в другую:
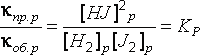 .
(46)
.
(46)
Отношение
констант скоростей прямого и обратного
процессов тоже представляет собой
постоянную величину, которая называется
константой равновесия данного
равновесного процесса ![]() .
Для равновесного процесса, протекающего
при постоянной температуре, в общем
случае: mA + nB ↔ pC + qD,
константа равновесия выразится
уравнением:
.
Для равновесного процесса, протекающего
при постоянной температуре, в общем
случае: mA + nB ↔ pC + qD,
константа равновесия выразится
уравнением:
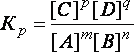 ,
(47)
,
(47)
где ![]() –
равновесные концентрации продуктов
реакции;
–
равновесные концентрации продуктов
реакции; ![]() –
равновесные концентрации исходных
веществ,
–
равновесные концентрации исходных
веществ, ![]() –
стехиометрические коэффициенты в
уравнении реакции.
–
стехиометрические коэффициенты в
уравнении реакции.
Константа равновесия является количественной характеристикой равновесного процесса:
– для
необратимых реакций, прошедших до
конца, ![]() →
→![]() ,
так как концентрация продуктов
реакции значительно больше концентрации
исходных веществ;
,
так как концентрация продуктов
реакции значительно больше концентрации
исходных веществ;
– при
полном отсутствии химического
взаимодействия, ![]() ,
так как концентрация исходных веществ
значительно превосходит концентрацию
продуктов реакции.
,
так как концентрация исходных веществ
значительно превосходит концентрацию
продуктов реакции.
В случае гетерогенных равновесных процессов в выражение константы равновесия входят только концентрации тех веществ, которые находятся в газовой или жидкой фазе.
Пример: CO2(Г) + С(К) ↔ 2СО(Г),
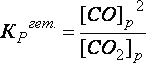 .
(48)
.
(48)
Константа равновесия реакции связана с изменением энергии Гиббса процесса зависимостью:
![]() .
(49)
.
(49)
Уравнение
(49) справедливо для любой температуры,
но чаще применяется для стандартных
условий: 25 °С (298 К). При подстановке
значения газовой постоянной (![]() =
8,314 Дж/ моль∙К) и стандартной температуры
уравнение (49) примет вид:
=
8,314 Дж/ моль∙К) и стандартной температуры
уравнение (49) примет вид:
![]() .
(50)
.
(50)
Это
уравнение позволяет, зная значение ![]() ,
вычислять константу равновесия и,
наоборот, по экспериментально найденному
значению
,
вычислять константу равновесия и,
наоборот, по экспериментально найденному
значению ![]() определять
определять ![]() .
.
Смещение химического равновесия, принцип Ле Шателье
Состояние химического равновесия зависит от ряда факторов: концентрации реагирующих веществ, температуры, давления в системе. Если условия изменяются, система выходит из состояния равновесия, при этом скорости прямой и обратной реакций изменяются не пропорционально. Через некоторое время равновесие устанавливается при новых внешних условиях.
Переход из одного равновесного состояния в другое, отвечающее новым внешним условиям, называется сдвигом или смещением химического равновесия.
В 1884 г. Ле Шателье (Франция) сформулировал принцип, определяющий влияние различных факторов на равновесные системы.
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие (изменить концентрацию веществ, температуру или давление), то в результате протекающих в ней процессов равновесие сместится в том направлении, что оказанное воздействие уменьшится.
60.
Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.Содержание [убрать]
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]() Для бинарного
раствора, состоящего из компонентов А
и В (компонент А считаем растворителем)
удобнее использовать другую формулировку:
Для бинарного
раствора, состоящего из компонентов А
и В (компонент А считаем растворителем)
удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
![]() На поверхности
оказывается меньше способных испаряться
молекул растворителя, ведь часть места
занимает растворённое вещество.
На поверхности
оказывается меньше способных испаряться
молекул растворителя, ведь часть места
занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Второй закон Рауля
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Понижение температуры кристаллизации растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
![]()
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
![]()
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Криоскопическая и эбулиоскопическая константы
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов
Законы
Рауля не выполняются для растворов
(даже бесконечно разбавленных), которые
проводят электрический ток — растворов
электролитов. Для учёта этих отклонений
Вант-Гофф внёс в приведённые выше
уравнения поправку — изотонический
коэффициент i, неявно у![]()
![]()
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Свойства растворов
Все растворы обладают некоторыми свойствами, которые практически зависят только от соотношения числа частиц компонентов раствора и не зависят от природы частиц. Общие свойства раствора – это свойства идеального раствора.
Идеальным называется раствор, образованный компонентами, имеющими строго одинаковые размеры частиц и строго одинаковую энергию межмолекулярного взаимодействия.
Основными законами, описывающими свойства растворов, являются: закон Генри, законы Рауля (1-й, 2-ой, 3-ий), осмотический закон Вант-Гоффа. Следует отметить, что эти законы выполняются только для разбавленных растворов.
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузией называется свойство вещества равномерно распределяться по всему предоставленному ему объему. Скорость диффузии (скорость выравнивания концентрации по объему) в газах велика, в твердых телах при обычных температурах диффузия длится годы. В растворах диффузия протекает за десятки часов, для небольших порядка литра объемов раствора.
Если в сосуд налить концентрированный раствор, а сверху добавить чистый растворитель, то начнется процесс диффузии, как растворителя, так и растворенного вещества до полного выравнивания концентрации по всему объему.
Можно создать условия, когда диффузия идет только по растворителю. Для этого разделим раствор и чистый растворитель пленкой, через которую могут проходить только молекулы растворителя. Такие пленки называются полупроницаемыми мембранами.
Процесс односторонней диффузии растворителя через полупроницаемую мембрану называется осмосом.
При односторонней диффузии растворителя в раствор, объем последнего начинает увеличиваться, что влечет за собой увеличение гидростатического давления, которое препятствует диффузии растворителя. При некотором давлении наступает равновесие: сколько молекул растворителя проникло в раствор, столько же выталкивается из него увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану, называется осмотическим давлением.