
- •Модели атомов
- •Строение
- •Двойственная природа электрона
- •Принцип Паули
- •Правило Гунда
- •Многоэлектронные атомы
- •Изменение свойств атомов по периодам и группам псэ
- •Ковалентная связь. Метод валентных связей
- •Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
- •3) По заряду внутренней сферы.
- •Природа химической связи в комплексных соединениях
- •Природа водородной связи
- •Свойства
- •Водородная связь в нуклеиновых кислотах и белках
- •Водородная связь в полимерах
- •1) Методы титриметрии:
- •Названия полимеров
- •Полимеризация и поликонденсация
- •Реакции в цепях полимеров
- •50.51.52.53. Основы химической термодинамики. Термохимия
- •II закон термодинамики имеет ясный физический смысл только тогда, когда его применяют к любой ограниченной системе.
- •3.2.2. Зависимость скорости реакции от концентрации реагентов
- •3.2.4. Механизмы химических реакций
- •Осмотический закон Вант-Гоффа.
- •Коллоидные растворы.
- •Применение гальванических элементов. Понятие эдс.
- •Классификация электродов.
- •Электрохимические источники тока.
- •Устройство и принцип действия, применение щелочных аккумуляторов.
- •70. Коррозия металлов.
- •Типы коррозии.
- •Механизмы коррозионных разрушений.
- •Виды электрохимической коррозии металлов с водородной и кислородной деполяризацией катода.
- •Методы защиты металлов от коррозии.
II закон термодинамики имеет ясный физический смысл только тогда, когда его применяют к любой ограниченной системе.
Функции системы, которые связаны с работой и говорящие о направлении процесса, называются термодинамическими потенциалами.
Критерием для суждения о направлении процессов в изолированных системах может служить изменение энтропии ΔS. Однако на практике большинство процессов протекает в неизолированных системах и связано с теплообменом и изменением объема. Поэтому для неизолированных систем необходимо иметь другие критерии.
Для процессов, протекающих при постоянных Т и V, применяется изохорно-изотермический потенциал (свободная энергия Гельмгольца F):
ΔF = U - T · S.
Для процессов, протекающих при постоянных Т и р, критерием, определяющим направление течения процесса, будет являться другая термодинамическая функция - изобарно-изотермический потенциал (свободная энергия Гиббса G):
ΔG = H - T · S.
Критерии обратимости и необратимости процессов, при которых совершается только работа расширения
|
Условия, при которых протекает процесс |
Обратимый равновесный процесс |
Необратимый процесс |
|
U, S - const |
ΔU = 0 |
ΔU < 0 |
|
V, U - const |
ΔS = 0 |
ΔS > 0 |
|
T, V - const |
ΔF = 0 |
ΔF < 0 |
|
T, p - const |
ΔG = 0 |
ΔG < 0 |
54.55.56.
О
принципиальной возможности протекания
химических реакций судят по величине
изменения свободной энергии системы ![]() .
Однако этого недостаточно, чтобы
предсказать реальную возможность
химического процесса, определить
скорость реакции, ее механизм, а также
управлять процессом.
.
Однако этого недостаточно, чтобы
предсказать реальную возможность
химического процесса, определить
скорость реакции, ее механизм, а также
управлять процессом.
Например, термодинамическая вероятность окисления водорода до газообразной воды
Н2(Г) +
1/2О2(Г) =
Н2О(Г),
![]() =
–228,3 кДж/моль
=
–228,3 кДж/моль
значительно выше, чем вероятность реакции окисления оксида азота (II)
NO(Г) +
1/2О2(Г) =
NO2(Г), ![]() =
–35,1 кДж/моль.
=
–35,1 кДж/моль.
В то же время первая реакция при комнатной температуре практически не протекает, и смесь водорода с воздухом может храниться в этих условиях длительное время, вторая же реакция при тех же условиях протекает мгновенно. Таким образом, для полного описания химического процесса необходимо знать закономерность протекания его во времени. Скорость и механизм химических реакций изучает химическая кинетика.
3.2.1. Скорость химических реакций
Различают гомогенные и гетерогенные химические реакции.
Гомогенные – это реакции, протекающие между веществами, находящимися в однородной среде, т. е. между ними нет границы раздела (газовая фаза, жидкая фаза). Реакции протекают равномерно по всему объему системы:
2NaOH(Ж) + H2SO(Ж) = Na2SO4(Ж) + 2Н2О(Ж).
Гетерогенные – это реакции в неоднородной среде, протекающие между веществами, находящимися в разных фазовых состояниях (твердое и жидкое вещество, газообразное и твердое вещество и пр.). Такие реакции протекают только на поверхности раздела фаз, образующих эту систему:
CaCO3(Т) + 2HCl(Ж) = CaCl2(Ж) + CO2(Г) + Н2О(Ж).
Под
скоростью химической реакции ![]() понимается
изменение количества вещества (моль)
в единицу времени в единице реакционного
пространства. Для
гомогенных реакций реакционное
пространство – объем,
понимается
изменение количества вещества (моль)
в единицу времени в единице реакционного
пространства. Для
гомогенных реакций реакционное
пространство – объем, ![]() , моль/л∙ед.
времени, гетерогенных – площадь
поверхности раздела фаз,
, моль/л∙ед.
времени, гетерогенных – площадь
поверхности раздела фаз, ![]() ,
моль/м2∙ед.
времени.
,
моль/м2∙ед.
времени.
Так как отношение количества вещества к единице объема называется концентрацией вещества (С, моль/л), то скорость гомогенного процесса равна изменению концентрации чаще исходных веществ во времени:
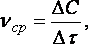 (36)
(36)
где ![]() –
средняя скорость реакции,
моль/л∙ед. времени;
–
средняя скорость реакции,
моль/л∙ед. времени; ![]() –
изменение концентрации исходных
веществ, моль/л;
–
изменение концентрации исходных
веществ, моль/л; ![]() –
время протекания процесса, с, мин и
пр.
–
время протекания процесса, с, мин и
пр.
Скорость реакций зависит от ряда факторов: природы реагирующих веществ, их концентрации, температуры и давления процесса, наличия в системе катализатора, а в случае гетерогенных реакций – от состояния поверхности раздела фаз.
