
- •© ННГАСУ, 2003
- •1. Основы термодинамического и молекулярно-кинетического методов исследования
- •1.1. Исходные положения термодинамики и молекулярной физики
- •1.2. Масса и размеры молекул
- •1.3. Основные понятия термодинамики
- •Рис. 1.2. График равновесного цикла
- •1.4. Разреженный газ как термодинамическая система
- •1.4.1. Экспериментальные газовые законы
- •Рис. 1.4. График изобарического процесса в координатах {V,T}. Сплошная линия – процесс при давлении р1, пунктир соответствует процессу при давлении р2.
- •Рис. 1.5. График изохорического процесса в координатах {p,Т}. Сплошная линия – процесс при объеме V1, пунктир соответствует процессу при объеме V2.
- •Тренировочное задание
- •1.4.2. Уравнение состояния идеального газа
- •Ответы на вопросы тренировочного задания, сформулированные на стр. 11
- •От уравнения (1.7), записанного для одного моля газа
- •1.4.3. Примеры решения задач на уравнение состояния газа
- •Задача 1
- •Задача 2
- •Дано:
- •Дано:
- •1.5. Основное уравнение молекулярно-кинетической теории
- •Давление молекул на стенку сосуда. Давление согласно определению равно силе, с которой газ воздействует на площадку единичной площади, перпендикулярно площадке:
- •Величина суммарной силы воздействия молекул на площадку по III закону Ньютона равна суммарной силе, действующей на систему молекул со стороны площадки. Следовательно, сила может быть найдена по II закону Ньютона для системы материальных точек:
- •1.6. Замечание о средней квадратичной скорости. Распределение Максвелла молекул по скоростям
- •1.7. Закон равнораспределения энергии по степеням свободы. Внутренняя энергия идеального газа
- •1.8. Примеры решения задач
- •Задача 1
- •Задача 2
- •2. Термодинамический подход
- •2.1. Первое начало термодинамики
- •2.1.1. Работа, производимая термодинамической системой
- •Рис. 2.1. Схема вычисления работы при расширении газа
- •Рис. 2.2. Работа системы при ходе процесса
- •2.1.2. Количество теплоты и теплоемкость
- •2.1.3. Применение первого начала термодинамики к изопроцессам в идеальном газе
- •Для равновесных процессов, протекающих в газах, элементарная работа, производимая газом против внешних сил, состоит в работе расширения (2.1), поэтому первое начало термодинамики может быть записано в виде:
- •2.2. Адиабатический процесс
- •2.3. Второе начало термодинамики
- •2.3.1. Термодинамические циклы. Цикл Карно
- •2.3.2. Понятие об энтропии
- •3. Реальные газы. Фазовый переход жидкость - газ
- •3.1. Реальные газы. Уравнение Ван-Дер-Ваальса
- •3.2. Изотермы Эндрюса
- •3.3. Исследование уравнения Ван-Дер-Ваальса
- •3.4. Переход жидкости в пар
- •3.5. Примеры решения задач
- •Дано:
- •4. Зачетная контрольная работа № 2
- •4.1. Варианты домашних зачетных заданий
- •4.2. Приложение. Задачи, включенные в варианты зачетной контрольной работы № 2
- •Литература

18
1.6. Замечание о средней квадратичной скорости. Распределение Максвелла молекул по скоростям
Выше мы говорили о средней энергии теплового движения молекул. Дело в том, что молекулы движутся неупорядоченно, т.е. их скорости имеют не только случайные направления, но и величину. Спрашивается: какой смысл
имеет величина υ2, если разные молекулы имеют разные значения скорости? Если газ содержит N молекул и занимает объем V, то концентрация
молекул равна n=N/V. Предположим, что N1 молекул имеют величину скорости, равную υ1, N2 молекул - скорость υ2 …Nk молекул - значение скорости υk. Естественно, что N1 + N2 + … +Nk =N. В таком случае число молекул первой группы N1', достигающих площадки ∆S за время ∆t, будет равно:
N1′ = 16 NV1 υ1∆S∆t .
Та же величина для молекул второй группы будет N2′ = 16 N2υ2 ∆S∆t / 6 , и так далее до молекул k-й группы, из которых достигнет площадки за время ∆tNk′ = 16 Nkυk ∆S∆t / 6 . Изменение импульса молекулы каждой группы также будет
различным: 2 m0υ1, 2 m0υ2, …, 2 m0υк. Поэтому суммарное изменение импульса следует записать в виде суммы:
∆P = ∆P1 + ∆P2 +... + ∆Pk = 2m0 (υ1 N1′ +υ2 N2′ +... +υk Nk′) = 13 mV0 (N1υ12 + N2υ2 2 +... + Nkυk 2 )∆t ,
то есть вместо формулы (1.12) получим выражение:
p = 13 mV0 [N1υ12 + N2υ2 2 +... + Nkυk 2 ].
Учитывая, что n=N/V и сравнивая полученное выражение с формулой (1,12), придем к выводу, что под υ2 следует понимать сумму:
(υкв )2 = |
N υ 2 |
+ N υ 2 |
+... + N |
υ |
2 |
|
N |
1 |
|
2 |
|
N |
2 |
|
2 |
|
N |
k |
|
2 |
. |
(1.14) |
1 1 |
2 2 |
k |
k |
|
= |
|
υ1 |
|
+ |
|
υ2 |
|
+... + |
|
υk |
|
||||||
|
N |
|
|
|
N |
|
N |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|||||||
Таким образом, при упрощенном выводе формулы (1.12) мы заменили реальные скорости частиц некоторой средней скоростью, которая согласно только что полученной формуле является средней квадратичной скоростью, квадрат которой равен среднему арифметическому квадратов скоростей всех молекул газа. В частности, если имеется только 2 молекулы, движущиеся со
скоростями υ1 и υ2 (k=2, N1=N2=1, N=2), υ2=(υ21+υ22)/2.
Средняя энергия теплового движения молекул равна кинетической энергии молекулы, движущейся со средней квадратичной скоростью.
В действительности молекулы могут иметь не дискретные, а непрерывные значения скоростей. Следовательно, в реальности число групп k молекул,
имеющих разные скорости, бесконечно велико k→∞. В этом случае относительные доли числа молекул N1/N, N2/N, …, имеющих соответствующие скорости, следует заменить аналогичной величиной dF(υ):
dF(υ) = dNN(υ) ,

19
которая равна числу молекул, имеющих величину модуля скорости большую υ-dυ, и меньшую υ+dυ, деленную на полное число частиц. Понятно, что чем больше величина dυ, тем больше dF(υ): dF(υ)=f(υ) dυ, где f(υ) - функция, характеризующая распределение молекул по величине скорости.
Сучетом сказанного формула (1.14) в этом случае может быть переписана
ввиде (сумма преобразуется в интеграл):
(υкв )2 = |
1 |
∫υ2 dN(υ) = ∫υ2 dF(υ) = ∫0∞υ2 f (υ) dυ , |
(1.15) |
|
N |
||||
|
|
|
причем интегрирование проводится по всем возможным значениям модуля скорости.
В случае идеального газа, находящегося в тепловом равновесии, функция f(υ) была получена Дж.. Максвеллом и имеет вид:
|
µ |
|
3 / 2 |
|
|
µυ2 |
|
2 |
, |
|
|
|
|
|
|
||||
f (υ) = 4π |
|
|
|
− |
υ |
|
|||
|
|
exp |
|
|
|||||
|
2πRT |
|
|
|
2RT |
|
|
|
|
где µ - молярная масса газа, а T - равновесная температура. Таким образом, величина (υкв)2 для одноатомного идеального газа определится значением интеграла2
|
2 |
|
µ |
|
3 / 2 |
∞ |
4 |
|
|
µυ |
2 |
|
|
3RT |
. |
|
|
∫0 υ |
|
|
|
|
dυ = |
||||||||
(υкв ) |
|
= 4π |
|
|
|
|
− |
|
|
|
|||||
|
|
|
|
exp |
|
|
|
µ |
|||||||
|
|
|
2πRT |
|
|
|
|
|
2RT |
|
|
||||
Таким образом, средняя квадратичная скорость молекул одноатомного газа равна:
υкв = 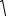
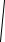 3RTµ .
3RTµ .
Далее мы получим этот результат элементарными методами, что показывает справедливость упрощенного подхода, примененного при выводе основного уравнения молекулярно-кинетической теории.
Сопоставление с уравнением Клайперона - Менделеева.
Воспользовавшись тем, что концентрация молекул n=N/V, основное уравнение молекулярно-кинетической теории можно записать в виде:
pV = 23 Nε .
Сравнивая это выражение с уравнением состояния идеального газа (1.11), приходим к выводу, что:
ε= 32 mµ RTN .
Сдругой стороны, число молекул газа можно выразить через число молей
ичисло Авогадро: N=νNа= mµ Nа. Поэтому для средней кинетической энергии
молекул получим формулу:
2 при вычислении интеграл можно преобразовать к интегралу Пуассона
∫0∞ exp(−aυ2 ) dυ =1/ 2
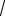 π / a
π / a
