
- •© ННГАСУ, 2003
- •1. Основы термодинамического и молекулярно-кинетического методов исследования
- •1.1. Исходные положения термодинамики и молекулярной физики
- •1.2. Масса и размеры молекул
- •1.3. Основные понятия термодинамики
- •Рис. 1.2. График равновесного цикла
- •1.4. Разреженный газ как термодинамическая система
- •1.4.1. Экспериментальные газовые законы
- •Рис. 1.4. График изобарического процесса в координатах {V,T}. Сплошная линия – процесс при давлении р1, пунктир соответствует процессу при давлении р2.
- •Рис. 1.5. График изохорического процесса в координатах {p,Т}. Сплошная линия – процесс при объеме V1, пунктир соответствует процессу при объеме V2.
- •Тренировочное задание
- •1.4.2. Уравнение состояния идеального газа
- •Ответы на вопросы тренировочного задания, сформулированные на стр. 11
- •От уравнения (1.7), записанного для одного моля газа
- •1.4.3. Примеры решения задач на уравнение состояния газа
- •Задача 1
- •Задача 2
- •Дано:
- •Дано:
- •1.5. Основное уравнение молекулярно-кинетической теории
- •Давление молекул на стенку сосуда. Давление согласно определению равно силе, с которой газ воздействует на площадку единичной площади, перпендикулярно площадке:
- •Величина суммарной силы воздействия молекул на площадку по III закону Ньютона равна суммарной силе, действующей на систему молекул со стороны площадки. Следовательно, сила может быть найдена по II закону Ньютона для системы материальных точек:
- •1.6. Замечание о средней квадратичной скорости. Распределение Максвелла молекул по скоростям
- •1.7. Закон равнораспределения энергии по степеням свободы. Внутренняя энергия идеального газа
- •1.8. Примеры решения задач
- •Задача 1
- •Задача 2
- •2. Термодинамический подход
- •2.1. Первое начало термодинамики
- •2.1.1. Работа, производимая термодинамической системой
- •Рис. 2.1. Схема вычисления работы при расширении газа
- •Рис. 2.2. Работа системы при ходе процесса
- •2.1.2. Количество теплоты и теплоемкость
- •2.1.3. Применение первого начала термодинамики к изопроцессам в идеальном газе
- •Для равновесных процессов, протекающих в газах, элементарная работа, производимая газом против внешних сил, состоит в работе расширения (2.1), поэтому первое начало термодинамики может быть записано в виде:
- •2.2. Адиабатический процесс
- •2.3. Второе начало термодинамики
- •2.3.1. Термодинамические циклы. Цикл Карно
- •2.3.2. Понятие об энтропии
- •3. Реальные газы. Фазовый переход жидкость - газ
- •3.1. Реальные газы. Уравнение Ван-Дер-Ваальса
- •3.2. Изотермы Эндрюса
- •3.3. Исследование уравнения Ван-Дер-Ваальса
- •3.4. Переход жидкости в пар
- •3.5. Примеры решения задач
- •Дано:
- •4. Зачетная контрольная работа № 2
- •4.1. Варианты домашних зачетных заданий
- •4.2. Приложение. Задачи, включенные в варианты зачетной контрольной работы № 2
- •Литература

44
В табл. 3.2 приведены данные о критических температурах, давлениях и объемах для некоторых веществ.
Критические параметры некоторых веществ |
Т а б л и ц а 3.2 |
|||
|
||||
Вещество |
Tk, ˚С |
Pk, атм |
|
Vk, см3/моль |
Вода |
374 |
218 |
|
57,6 |
Хлор |
144 |
76 |
|
124,0 |
Углекислый газ |
31 |
73 |
|
96,0 |
Кислород |
-118 |
51 |
|
74,3 |
Азот |
-147 |
33,5 |
|
90,0 |
Водород |
-240 |
12,80 |
|
65,0 |
Гелий |
-268 |
2,26 |
|
58,0 |
Из этой таблицы, в частности, следует, что при температурах, больших 374˚C, вода не может существовать в жидком состоянии, какое бы давление мы на нее ни оказывали. Для получения сжиженных газов, их следует предварительно охлаждать до температуры ниже критической и установка должна создавать давление порядка pк.
3.3. Исследование уравнения Ван-Дер-Ваальса
Преобразуем формулу (3.1), раскрыв скобки и умножив обе части равенства на V2/p:
V 3 + aV |
−bV 2 − ab |
= |
|
RTV 2 |
, |
|
||||
|
|
|||||||||
p |
|
|
|
p |
|
|
p |
|
||
далее расположим слагаемые в порядке убывающих степеней V: |
|
|||||||||
V 3 −V 2 |
|
RT |
|
|
a |
V − ab = 0 . |
(3.3) |
|||
b + |
|
+ |
||||||||
|
|
|||||||||
|
|
p |
|
|
p |
p |
|
|||
|
|
|
|
|
||||||
Полученное выражение является кубическим уравнением относительно объема5.
Зададимся некоторой определенной температурой T и для нее построим график, выражающий связь V и p по формуле (3.3). Будем давать p, например 1атм, 1, 5, 2, 2,5 атм и.т.д. Подставляя вместо p его значения, будем получать кубическое уравнения с численными коэффициентами (a, b, R - табличные данные, T - заданная температура). Если для V получится один вещественный корень, соответствующий данному p, на графике будет точка с координатами (p,V). Если при решении уравнения окажутся три вещественных корня, данному давлению будут соответствовать три возможных объема (V1, V2, V3) и кривая, изображающая графически уравнение (3.3), очевидно, будет иметь перегибы. В результате изотерма Ван-Дер-Ваальса примет вид, изображенный
5 Кубическое уравнение всегда имеет ровно три корня. Поскольку коэффициенты уравнения действительны, один корень всегда будет действительным, а два других, в зависимости от значения коэффициентов уравнения, будут либо действительными, либо комплексно сопряженными. Поскольку объем – действительная величина, в последнем случае будет иметься только один корень, обладающий физическим смыслом.
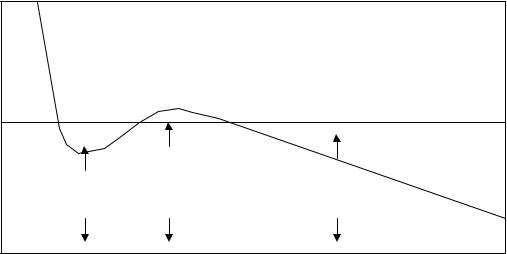
45
на рис. (3.4). Ее участок 1-2 соответствует такому же участку, полученному экспериментальным путем на изотерме Эндрюса. Это состояние ненасыщающего пара. Участок 2-3 на опыте получается в виде прямой, на изотерме же Ван-дер-Ваальса - кривая 2-2'-3'-3. Несовпадение этого участка графика с опытными данными не является неожиданным, так как он соответствует состоянию насыщающего пара, для которого формула Клайперона - Менделеева неприменима (уравнение Ван-дер-Ваальса есть подправленная форма уравнения состояния идеального газа). Однако участки 2- 2' и 3-3' при известных условиях могут быть получены на опыте и только участок 2'-3' экспериментально неосуществим. Если осторожно сжимать сначала ненасыщенный пар, а затем после достижения его насыщения (точка 2) продолжать сжатие, при отсутствии в нем ионов и пылинок, которые являются центрами конденсации, можно получить участок 2-2', соответствующий пресыщающему пару. Его давление не может превысить p1; достигнув его, пресыщающий пар начинает бурно конденсироваться, давление падает до pн и
p |
4 |
|
|
|
|
2΄ |
2 |
|
3 |
|
|
|
|
|
|
|
3΄ |
|
|
|
p2 |
p1 |
pн |
|
|
|
1 |
0 |
|
|
V |
|
|
Рис. 3.4. Изотерма Ван-Дер-Ваальса |
|
дальше (до точки 3) не изменяется. Если постепенно уменьшать давление на сжатую жидкость и продолжать осторожно приподнимать поршень в цилиндре, достигнув при этом давления, соответствующего точке 3', то можно несколько
перегреть или <<растянуть>> жидкость и получить экспериментально участок изотермы 3'-3. При достижении газом точки 3' поршень отрывается от жидкости, давление от значения p2 возрастает до значения pн вследствие интенсивного парообразования. Участок 3-4 характеризует жидкую фазу.
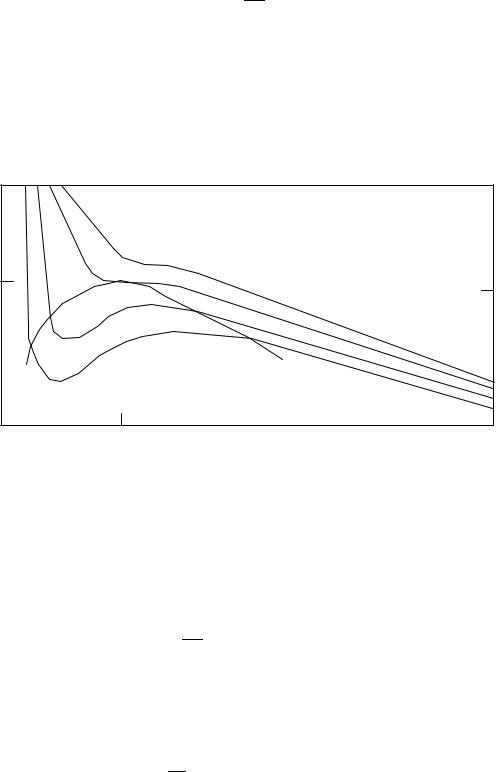
На рис. (3.5) показан ряд изотерм Ван-дер-Ваальса, построенных для различных температур. Изотерма Tк соответствует критической температуре. Изотермы, расположенные выше нее (для более высоких температур), характеризуются тем, что вещество при этих температурах остается в газообразном состоянии и ни при каком давлении не может быть обращено в жидкость. Для точки K можно найти значение V к, подставив в уравнение (3.3)
|
|
|
|
|
|
|
|
|
46 |
|
|
|
|
|
|
|
|
значения критического давления pк |
и |
|
критической температуры T. В этом |
||||||||||||||
случае формула принимает вид: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
3 |
|
|
2 |
|
|
RTkV |
2 |
|
a |
|
ab |
= 0 . |
(3.4) |
|||
V |
−V |
|
+ |
|
|
V − |
|||||||||||
|
|
b |
|
pk |
|
+ |
pk |
pk |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
С другой стороны, любое кубическое уравнение, имеющие корни V1, V2, |
|||||||||||||||||
V3, можно записать в виде: |
(V-V1)(V-V2)(V-V3)=0. |
|
|
(3.5) |
|||||||||||||
|
|
|
|
||||||||||||||
Но для точки K все три корня сливаются в один, т.е. V |
1=V2=V3=Vк |
и |
|||||||||||||||
последнее соотношение принимает вид: |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
(V-Vk)3=0. |
|
|
|
|
|
|||||
р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рк |
|
К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
Vk |
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
Рис. 3.5. Изотермы Ван-Дер-Ваальса, соответствующие температурам, близким к |
|||||||||||||||||
|
|
|
|
|
|
критической |
|
|
|
|
|
||||||
Раскрывая скобки, его можно привести к виду: |
|
|
|
||||||||||||||
|
|
V3-3VkV2+3VkV-Vk3=0. |
|
|
(3.6) |
||||||||||||
Так как уравнения (3.4) и (3.6) являются тождественными, их |
|||||||||||||||||
коэффициенты при одинаковых степенях неизвестных должны быть равны. |
|||||||||||||||||
Поэтому можно записать: |
RTk |
|
|
|
|
|
a |
|
|
|
|
|
ab =Vk3 . |
|
|
||
b + |
= 3Vk ; |
|
= 3Vk |
= 3Vk2 ; |
(3.7) |
||||||||||||
|
pk |
|
|
|
|
|
pk |
|
|
|
|
|
pk |
|
|
|
|
Эти уравнения связывают между собой шесть величин. Зная три из них, |
|
||||||||||||||||
остальные три можно найти. Например, можно теоретически подсчитать |
|||||||||||||||||
критические параметры Vк, pк, Tк |
по известным a, b, R. И, наоборот, зная Vк, pк, |
||||||||||||||||
Tк, можно найти постоянные Ван-дер-Ваальса a и b: |
|
|
|
||||||||||||||
|
|
|
|
|
b = Vk |
, |
a = 3Vk2 pk . |
|
|
(3.8) |
|||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
Характерно, что критический объем оказывается равным утроенной |
|||||||||||||||||
постоянной b. Однако эти соотношения являются приближенными. |
В |
||||||||||||||||
некоторых таблицах критических параметров значение критического объема не |
|||||||||||||||||
приводится. Поэтому приведем выражение параметров Ван-Дер-Ваальса a и b |
|||||||||||||||||
через pк, Tк: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
47 |
|
|
|
|
|
|
|
|
RT |
27R2T 2 |
|
|
||
|
b = |
k , a = |
|
k |
. |
(3.9) |
||
|
|
|
||||||
|
|
|
8 pk |
64 pk |
|
|
||
|
|
|
|
|
|
|
Т а б л и ц а 3.3 |
|
Удельная теплота парообразования воды при разных температурах |
||||||||
t, ˚C |
0 |
|
50 |
|
100 |
|
200 |
|
r, М Дж/кг |
2,49 |
|
2,38 |
|
2,26 |
|
1,94 |
|
Предлагаем вам получить эти выражения из (3.7) самостоятельно.
3.4. Переход жидкости в пар
Переход жидкости в парообразное состояние возможен двумя путями:
•посредством испарения;
•посредством кипения.
Испарение жидкости происходит только с поверхности и при любой температуре. Кипение возникает во всей массе жидкости и при строго определенной температуре, зависящей только от рода жидкости и давления, под которым она находится.
Как происходит процесс испарения? Молекулы жидкости связаны между собой силами взаимодействия. Чтобы молекула могла вырваться из жидкости, необходимо, чтобы энергия ее поступательного движения была достаточна для преодоления сил взаимодействия молекул.
Так как в жидкости скорости молекул распределены согласно распределения Максвелла, в ней всегда присутствует определенное число молекул, обладающих достаточно большой кинетической энергией, которые в основном и покидают жидкость при испарении. Этим объясняется охлаждение жидкости при испарении. Таким образом, для превращения жидкости в пар без изменения температуры необходимо затратить определенное количество теплоты. Количество теплоты, необходимое для превращения единицы массы жидкости в пар, называется удельной теплотой парообразования r.
Величина r зависит от природы жидкости и температуры; для воды эта величина приведена в табл.3.4.
Если жидкость находится в замкнутом сосуде, число молекул, вылетевших из нее и находящихся в парообразном состоянии вблизи поверхности жидкости, постепенно возрастает. Молекулы пара при своем беспорядочном движении залетают обратно в жидкость. По мере увеличения числа молекул пара возрастает и количество молекул, залетевших обратно в жидкость. В некоторый момент наступит динамическое равновесие: число молекул, вылетевших из жидкости за некоторое время, сделается равным числу молекул, залетевших обратно в жидкость. В этом случае говорят, что пар насытил пространство.
Опыт показывает, что ненасыщающие пары подчиняются газовым законам (т.е.законам идеального газа).

48
Ненасыщающие пары газовым законам не подчиняются. Давление
(упругость) насыщающего пара данной жидкости зависит только от температуры.
При изотермическом сжатии насыщающего пара его давление не изменяется, только часть пара переходит в жидкое состояние; при расширении, наоборот, часть жидкости переходит в пар и давление вновь остается прежним. Для осмысления материала предлагаем вам указать на рис. 3.2 участок изотермы, соответствующий этим процессам (правильный ответ вы можете найти в сноске6). Если же в пространстве, где находится пар, нет больше этой жидкости, пар становится ненасыщающим (попробуйте найти такой участок на графике 3.2, а затем проверить правильность ваших понятий, прочитав сноску7). При охлаждении насыщающего пара часть его выделяется в виде жидкости, давление же оставшегося пара соответствует той упругости, которую он должен иметь при пониженной температуре (такие процессы Вы можете найти и указать на рис. 3.3 и проверить себя, прочитав сноску8). Давление насыщающего водяного пара в зависимости от температуры приведено в табл.
3.4.
Кипение - это парообразование, происходящее во всем объеме жидкости.
При заданном давлении жидкость кипит при определенной температуре, которая повышается, если внешнее давление увеличить.
Сравнивая температуры кипения воды у подножия горы и на ее вершине, можно заметить, что вода кипит при различных температурах. Если в сосуде над поверхностью воды, взятой при комнатной температуре, постепенно разрежать воздух, можно добиться того, что вода закипит. При достаточном вакууме вода может закипеть при˚C0. Таким образом, вода закипает при такой температуре, при которой упругость ее насыщающих паров становится равной внешнему давлению. Такой же вывод можно сделать и для всякой другой жидкости.
Как это можно объяснить? В воде всегда имеется растворенный воздух, который выделяется в виде мельчайших пузырьков, обычно оседающих на стенках и дне сосуда. Пузырьки наполнены насыщающим водяным паром. Если нагревать жидкость до такой температуры, при которой упругость пара в пузырьке сделается хотя бы на ничтожную долю больше внешнего давления, пузырек начинает расти, наполняться насыщающим паром и затем всплывает на поверхность воды; начинается кипение.
Влажность воздуха определяется содержанием в воздухе водяного пара. Это понятие часто встречается на практике, и поэтому мы перечислим здесь смысл основных терминов, связанных с этим понятием.
Абсолютная влажность характеризует массу водяного пара в единице объема воздуха и на практике часто измеряется в г/м3.
6Отмеченные процессы соответствуют движению влево и вправо по участку 3-2.
7Это участок кривой 2-1.
8Такие процессы соответствуют переходу с одного прямолинейного участка 3-2 на такой же участок, лежащий под ним, то есть переходу на изотерму, соответствующую меньшей температуре.

49
Т а б л и ц а 3.4 Давление водяного пара, насыщающего пространство при разных температурах
t, ˚C |
pн, Па |
t, ˚C |
pн, Па |
t, ˚C |
pн, Па |
-5 |
400 |
8 |
1070 |
40 |
7335 |
0 |
609 |
9 |
1145 |
50 |
12302 |
1 |
656 |
10 |
1225 |
60 |
19817 |
2 |
704 |
12 |
1145 |
70 |
31122 |
3 |
757 |
14 |
1596 |
80 |
47215 |
4 |
811 |
16 |
1809 |
90 |
69958 |
5 |
870 |
20 |
2328 |
1010 |
101080 |
6 |
932 |
25 |
3165 |
150 |
486240 |
7 |
1025 |
30 |
4229 |
200 |
1549890 |
Упругость водяного пара p (или его парциальное давление) измеряется в ех же единицах, что и давление воздуха – pв. При расчете влажности атмосферного воздуха температура газа практически всегда бывает заметно меньшей критической температуры для воды (Tк=374˚C). В этом случае максимальное давление Ван-дер-Ваальсовского пара p1 (см. рис. 3.3) достаточно сильно отличается от давления насыщающего пара pн. С другой стороны добавочные члены, введенные в уравнение состояния газа Ван-дер-Ваальсом, становятся существенными на участке 2-2', вблизи точки максимума изотермы (см. рис. 3.3). На участке изотермы 1-2 влияние поправок Ван-дер-Ваальса для атмосферного пара мало и, следовательно, параметры даже насыщающего
водяного пара при атмосферных температурах можно с достаточной точностью рассчитывать, используя уравнение состояния идеального газа.
Относительная влажность (w) - это отношение упругости водяного пара к упругости пара (pн), насыщающего воздух при данной температуре:
f = p 100% (измеряется в процентах).
pн
Температура точки росы (τ)} - это температура, при которой влажный воздух, если его изобарически охладить, становится насыщенным водяным паром. На поверхности любого тела, имеющего температуру, меньшую или равную температуре точки росы окружающего воздуха, происходит конденсация водяного пара (стекла очков запотевают при входе в теплое помещение в морозную погоду).
Влажность воздуха измеряется приборами, которые называются гигрометрами и психрометрами. Простейший психрометр состоит из двух термометров, один из которых имеет увлажненную поверхность. Вследствие зависимости интенсивности испарения от степени насыщения воздуха парами воды разность показаний сухого и влажного термометров тем больше, чем меньше влажность. Величину влажности определяют при этом по разности этих температур с помощью специальной психрометрической таблицы. В настоящее время имеется ряд радио- и лазерных методов измерения влажности воздуха.
