
ПЗ 4 БиоЭнергетика
.docx
Модуль 2. Динамическая биохимия.
Тема 4. Метаболизм веществ и энергии в клетке. Принципы биоэнергетики.
-
Общая характеристика обмена веществ в организме. Метаболизм, катаболизм, анаболизм. Центральный метаболизм и вторичный метаболизм.
-
Биохимическая термодинамика.
-
Пути и механизмы преобразования энергии в живых системах. Принципы биоэнергетики.
Вопросы для самоподготовки
-
Охарактеризуйте катаболические, анаболические, амфиболические пути обмена веществ, их значение и взаимосвязь.
-
Что понимают под внешним и промежуточным обменом, центральным и вторичным метаболизмом, главными и специфическими метаболическими путями?
-
Каким образом анаболические и катаболические процессы разделены в живой клетке?
-
Приведите классификацию живых организмов по особенностям метаболизма (по источникам питания и использованию атмосферного кислорода).
-
Что является предметом изучения биоэнергетики? Какие особенности термодинамического описания биохимических процессов Вы знаете?
-
Какие реакции называют эндергоническими, а какие – экзергоническими? В чем состоит биохимический смысл сопряжения этих процессов в живых организмах?
-
Может ли эндергоническая реакция быть экзотермической и наоборот экзергоническая — эндотермической? Почему?
-
В каких случаях можно утверждать, что самопроизвольными могут быть только экзотермические процессы?
-
Как найти тепловой эффект биохимической реакции, если имеются данные о количественном составе равновесных смесей при различных температурах?
-
В каких условиях изменение свободной энергии Гиббса в биохимической реакции совпадает со стандартным ∆Gº? В каких случаях ∆Gº оказывается больше, а в каких меньше, чем ∆Gº?
-
Почему изменение G, свободной энергии реакции, катализируемой ферментом в живой клетке, обычно отличается от изменения G стандартной свободной энергии той же самой реакции?
-
Законы биоэнергетики Скулачева. Живые клетки – открытые термодинамические системы. Упорядоченность биологических систем.
-
Почему АТФ является термодинамически неустойчивым соединением, имеет большую энергию связи? Роль адениловой системы в энергетике клетки.
-
Перечислите основные макроэргические соединения, образуемые в организме.
-
В чем проявляется высокая биохимическая активность «высокоэнергетических» соединений и чем она обусловлена?
-
Понятие об энергетическом заряде и энергетической эффективности роста.
Вопросы, задачи и упражнения для самоконтроля
-
Можно ли отрицательные значения тепловых эффектов микробиологического синтеза (экзотермичность) рассматривать как потерю энергии, полученной клеткой при катаболизме? Почему?
-
Почему в системе, в которой энергетические уровни реагентов и продуктов реакции одинаковы, все же может протекать реакция, в результате которой в растворе, в котором первоначально присутствовали только реагенты, устанавливается равновесие между реагентами и продуктами реакции?
-
Почему при гидролизе глюкозо-1-фосфата ∆Gº′ = -21 кДж/моль-1, а для гидролиза глюкозо-6-фосфата – лишь -13.9 кДж/моль-1? Дайте объяснение исходя из положения фосфатной группы в молекуле глюкозы.
-
Вычислить ΔG0′ для изомеризации диоксиацетонфосфатата в глицеральдегид-3-фосфат, если в состоянии равновесия при 25°С (298 К) и рН 7,0 отношение концентрации глицеральдегид-3-фосфата к диоксиацетонфосфату составляет 0,0475. Вычислить ΔG при концентрации диоксиацетонфосфата, равной 2·10–4 М, и концентрации глицеральдегид-3-фосфата – 3·10–6 М.
-
Отношение концентраций АТФ и АДФ для активно дышащей дрожжевой клетки равно приблизительно 10. Определите, при каком соотношении 3-фосфоглицерата и 1,3-дифосфоглицерата в клетке фосфоглицераткиназная реакция:
1,3-дифосфоглицерат4- + АДФ3- → 3-фосфоглицерат3- + АТФ4-
будет смещена в сторону синтеза 1,3-дифосфоглицерата, если при 25°С
ΔG0′ = -4,75 ккал*моль-1.
-
Константы равновесия ферментативного превращения L-аспартата с образованием фумарата и иона аммония при при 39ºС и 29ºС равны соответственно 1,60
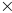 10-2
и 0,74
10-2
и 0,74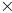 10-2.
Вычислите величины Gº
и Sº
для реакции, протекающей при температуре
39ºС.
10-2.
Вычислите величины Gº
и Sº
для реакции, протекающей при температуре
39ºС.
-
Какая из реакций, приведенных ниже, может быть сопряжена с образованием АТФ из АДФ и Фн:
а) 1.3-бифосфоглицерат + Н2О → 3- фосфглицерат + Фн; ∆Gº′ = -47,5 кДж/моль-1
б) фруктозо-6-фосфат + Н2О → фруктоза + Фн; ∆G0′ = -13,9 кДж/моль-1
