
- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
Цели и задачи курса «Общая химическая технология» Объект изучения курса.
Цель курса - знакомство с химическим производством –сложной химико –технологической системой, а также рассмотрение общих проблем анализы и синтеза химических производств.
Задачи курса – общее знакомство с химическим производством, его структурой и компонентами; изучение основ химических производств и реакторов; освоение общих методов анализа и синтеза химического производства как химико- технологической системы; знакомство с некоторыми конкретными химическими производствами, на примере которых предметно демонстрируется теоретические положения курса.
Значительное место уделяется физико- химическим и технологическим аспектам анализа процессов в химическом производстве, в химических реактора и организации химико- технологических процессов.
Объектом изучения в курсе являются химические производство, как система взаимосвязанных процесстов.
Что такое технология. Химическая технология как предмет изучения: Объект, цель и методы исследования.
Технология –совокупность знаний о способах и средствах обработки материалов, подразделяется на механическую, изучающую обработку материалов без изменения их состава и химическую, изучающую обработку и переработку материалов, связанную главным образом с изменением их состава.
Химическая технология – естественно прикладная наука о способах и процессах производство продуктов, осуществляется с участием химических превращений, технически, экономически и социально целесообразным путем.
Химическая технология как наука имеет:
-Объект ( предмет) изучения – химическое производство ( способы и процессы переработки исходных веществ в полезные продукты).
-Цель изучения – создание целесообразных способов производства необходимых человеку продуктов.
-Методы исследования- эксперимент, моделирование и системный анализ.
Как естественная наука химическая технология изучает материальное явления и объекты.
Классификация химической технологии.
Химическую технологию классифицируют по различным признакам: по характеру технологических процессов; по используемому сырью или потребительским продуктом и т.д.
По отраслям химическую технологию разделяют на две группы:
А. Неорганическая химическая технология:
1. Основные неорганический синтез (пр-во кислой, щелочной и т.д.)
2. Тонкий неорганический синтез (пр-во реактивов редких элементов, лекарств и т.д.)
3. Ядерно- химическая технология (пр-во мат- ов ядерно- химического комплекса, радиоактивных препаратов и т.д)
4. Металлургия ( черная и цветная)
5. Технология электрохимических производств;
6. Технология силикатов
Б. Органическая химическая технология.
1. Переработка нефти и газа (отчистка, первичн.разделения)
2. Нефтехимический синтез (пр-во оргинич.продуктов)
3. Основной органический синтез (пр-во органич.производств)
4. Биотехнология
5. Тонкий органический синтез (препараты, реактивы, лекарства)
6. Высокомолекулярная технология (полимеры, пластмассы)
7. Технология переработки растительного и животного сырья.
Химическое производство. Основное название многофункциональность. Требования к организации.
Химическое производство- совокупность процессов и операций переработки сырья в необходимые продукты с использование химических превращений осуществляемых в предназначенных для этого машинах и аппаратах.
Основное назначение химического производства- получение продукта, при этом химического производства яв- ся многофункциональным, то есть включает в себя подготовку сырья; его переработку; выделения основного продукта; санитарную очистку и утилизацию отходов; подготовку вспомогательных материалов и водоподготовку; энергосистему; систему правления.
Требования к химическому производству.
1.Получение и производство необходимого продукта.
2.Экологическая безопасность.
3.Безопасность и надежность эксплуатации оборудования.
4.Максимальное использование сырья и энергии.
5.Максимальная производительность труда.
Общая структура химического производства.
1.Подготовка сырья –включает предварительную обработку сырья ( измельчение, отчистка от примесей и т.д.)
2.Переработку сырья- в результате образуется основной продукт производства
3.Выделение основного продукта- из образовавшегося в результате переработки сырья смол.
4.Санитарная счистка и утилизация отходов- перевод токсичных составляющих в безвредные; выделение полезных веществ.
5.Энергетическая система- обеспечивает распределение энергии по стадиям производства и ее возвращение после использования в проработке сырья.
6.Вспомогательные материалы- для обеспечения протекающих процессов (сорбенты, регуляторы кислотности и т.д.)
7.Водоподготовка- растворитель, теплоноситель и т.д.
8.Система управления- обеспечивает контроль за состояние производства, защиту от аварии и т.д. (АСУТП)
Компоненты химического производства.
Переменные компоненты- постоянно потребляются или образуются в производстве; к ним относят:
1-сырье поступающих на ререработку;
2-вспомогательные материалы;
3-продукты- основной и дополнительной, как результат переработки сырья;
4-отходы производства;
5-энергия, обеспечивающая функционирование производства.
Постоянные компоненты- заключается в производство (оборудование, конструкции) или участвуют в нем ( персонал) на весь или почти весь срок существования производства.
Включают:
1-аппаратуру (аппараты, машины, емкости, трубопроводы и т.д.);
2-устройство контроля и управления;
3-стоительные конструкции (здания, сооружения);
4-обслуживающий персонал (рабочие; и т.д.)
В компоненты производства не входят элементы инфраструктуры, как не участвующие непосредственно в производстве, не необходимые для его функционирования.
Состав химического производства.
Состав химического производства обеспечивают его функционирование как производственной единицы.
В него входит:
1-собственно химическое производство;
2-хранилища сырья, продуктов и других материалов;
3-система организации транспортировки сырья, продуктов, вспомогательных материалов, промежуточных веществ, отходов;
4-дополнительные здания и сооружения.
5-обслуживающий персонал производственного подразделения.
6-система управления, обеспечения и безопасности.
Химико- технологический процесс. Видя отдельных процессов и операций выделяемых в совокупном химико- технологическом процессе.
Совокупность операций и процессов переработки сырья в продукты называют технологическим процессом.
Химико- технологический процесс- последовательность химических и физико- химических процессов целенаправленной переработки исходных веществ в продукт.
В совокупном химико- технологическом процессе выделяют несколько видов отдельных процессов и операций, для проведения которых предназначены соответствующие аппараты им машин. Их подразделяют на основные и вспомогательные.
Основные:
1.Механические и гидрохимические процессы ( перемен вращение, деформация и т.д.)
2.Теплообменные процессы. (нагрев, плавление, испарение)
3.Химические процессы (изменение хим. состава веществ)
Вспомогательные процессы:
1.Энергетические процессы (преобразование энергии)тепло --> энергия
2.Информационно- управляющие процессы (обработка информации, синтез управляющих сигналов)
В ходе химико- технологического процесса осуществляют подготовку исходных реагентов к проведению химических реакций, путем перевода их в наиболее реакционно способное состояние и затем, в результате химической реакции из подготовленных исходных реагентов получают смесь продуктов (целевых и побочных) и непрореагировавших веществ, которую затем разделяют.
Технологический режим. Оптимальные условия ведения химико- технологического процесса. Технологическая схема процесса.
Технологическим режимом- называют совокупность параметров, определяющих условия работы аппарата или системы аппаратов.
Создавая технологический процесс, необходимо помнить что конечной целью является оптимальное решение с технико-экономической точки зрения.
В этой связи оптимальное условие веления химико- технологического процесса- это сочетание основных параметров (температуры, давления, состава исходной реакционной смеси, катализатор и т.д.), позволяющие получить наибольший выход продукта с высокой скоростью и обеспечить наименьшую себе стоимость.
Единичным процессы протекают в различных аппаратах, которые соединены в технологическую схему процесса.
Классификация химических реакций, лежащих в основе промышленных химико- технологических процессов.
В химической технологии используют различные виды классификации химических реакций.
1.По фазовому составу: гомогенные и гетерогенные.
Различают двухфазные системы: «г-ж», «г-г», «ж-т», «ж-ж», «т-т» и различные варианты трехфазных систем.
2.По механизму осуществления реакции: простые (одностадийные) и сложные (многостадийные) реакции: параллельные, последовательные, последовательно- параллельные.
3.По молекулярности: сколько молекул участвуют в элементарном акте (1,2 или3)
4.По порядку: по данному веществу и общему или суммарному порядку реакции.
Порядок реакции по данному веществу- показатель степени при концентрации этого вещества в кинетическом уравнении: r=kcana =cnв
Величина na+nв+… - называется общим или суммарным порядком реакции.
5.По присутствии катализатора: каталитические и некаталитические.
6.По тепловому эффекту: экзо- и эндотермические.
Показатели химического производства и химико- технологического процесса: технические показатели.
Технические показатели- определяют качество химико- технологического процесса.
1.Производительность (мощность) производства- количество получаемого продукта, или количество перерабатываемого сырья в единицу времени:
П=G/t П-производительность; G- кол-во полученного продукта или перерабатываемого сырья за время t.
2.Расходный коэффициент- показывает количество затраченного сырья, материалов или энергии на производство единицы продукта. Он не отражает эффективность использования расходуемых компонентов.
3.Выход продукта- отношение реального получаемого количества продукта из используемого сырья к максимальному количеству продукта, которая теоретически можно получить из того же количества сырья.
4.Интенсивность процесса- количество перерабатываемого сырья или обрабатываемого сырья или образуемого продукта в единице объема времени. Характеризует интенсивность процесса в аппарате и совершенство его организации.
5.Удельные капитальные затраты- затраты на оборудование, отнесенные к единице его производительности. Этот показатель характеризует эффективность организации процесса в отдельных аппаратах и в производстве в целом, совершенство используемых конструкций.
6.Качество продукта- определяет его потребительские свойства и товарную ценность.
Оценивается разными характеристиками такими как: содержание (состав и количество) примесей; физические и химические показатели; внешний вид и размеры; цвет; запах и прочее.
Показатель химического производства и химико- технологического процесса: экономический показатель, техноэкономического показателя.
Экономические показатели определяют экономическую эффективность производства. Они включают:
1.Себестоимость продукции- суммарные затраты на получение единицы продукции.
Общая структура себестоимости С:
C=(∑ЦiGi+k3k+3t)/Gn
где Цi и Gi – соответственно цена и количество израсходованного сырья, энергии, материалов на производства продукта в количестве Gn; Зк- капитальные затраты; k- коэффициент окупаемости капитальных затрат (исходя, отнесенная на время производства продукта. В среднем k=0,15 в расчете на годовую производимость); Зт – оплаты труда.
2.Производительность труда- количество продукции, производимой в единицу времени в пересчете на одного работающего характеризует эффективность производства относительно затрат труда. Экономические показатели рассчитывают на основе технических показателей, причем технические показатели (производительность, расходные коэффициенты, удельные капитальные затраты), которые можно представить в денежном выражении называют техноэкономическим показателем.
Показатели химического производства и химико- технологического процесса: эксплуатационные показатели.
Эксплуатационные показатели- определяют влияние отклонений от регламентированных условий и состояний, возникающих при работе производства, на показатели процесса, возможность управления им. Они включают:
1.Надежность-характеризует среднее время безаварийной работы, либо число аварийных остановок оборудования или производства в целом за определенный отрезок времени.
Этот показатель зависит от качества используемого оборудования и правильности его эксплуатации и обслуживания.
2.Безопасность функционирования- вероятность нарушений приводящих к нанесению вреда или ущерба обслуживающему персоналу, оборудованию, окружающей среде и населению.
3.Чувствительность к нарушениям режима и изменению условий эксплуатации- определяется отношением изменения эксплуатационных показателей к этим отклонениям.
4.Управляемость и регулируемость- характеризуют возможность поддержания показателей процесса в допустимых пределах.
Эксплуатационные показатели определяют величину допустимых изменений условий процесса и управляющих параметров, обеспечивающих процесса и управляющих параметров, обеспечивающих поддержание показателей процесса в допустимых условиях.
Они так же учитывают взаимовлияние управляющих параметров и сложность управления.
Показатели химического производства и химико- технологического процесса: Социальные показатели.
Социальные показатели- определяют комфортность работы на данном производстве и его влияние на окружающую среду.Они включают:
1.Безвредность обслуживания- оцениваются сопоставлением санитарно- гигиенических условий для обслуживающего персонала с соответствующими нормами по загазованности, запыленного, уровню шума и т.д.
2.Степень автоматизации и механизации- определяется ручного и тяжелого труда в производстве.
3.Экологическая безопасность- степень воздействия производства на окружающую среду и экологическую обстановку в регионе.
Классификация химических процессов
1 Физико- химические признаки
1.1.Тип химической реакции
1.1.1.прямое химическое взаимодействие.
1.1.2.с химическим воздействием (каталитическая реакция).
1.1.2.с физическим воздействием (свет, электрич.ток и т.д)
1.2.Термодинамические показатели
1.2.1.тепловой эффект (эндо и экзотермический процесс)
1.2.2.обратимость (необратимая и обратимая реакция)
1.3.Кинетические характеристики
1.3.1 Схема превращения (простая реакция; сложная реакция: параллельная схема; последовательная схема; включающая обе схемы)
1.3.2.Кинетическая модель (виды кинетической модели)
2.Физические признаки
2.1.Фазовый состав реагентов
2.1.1.число участвующих фаз с реагентами (однофазный процесс; многофазный процесс.
2.1.2.состояние фаз (газ; жидкость; твердое).
Сочетание разных признаков проявляется в особенностях, свойствах химического процесса.
Стехиометрические уравнения.
Стехиометрические уравнения показывают в каких соотношениях в-ва вступают в химическое взаимодействие.
Общий вид стехиометрического уравнения:
VAA+VAB+…=VRR+VSS+…, (1)
Где A,B- исходные вещества; R,S- продукты: VA VR VR VS-стехиометрические коэффициенты.
Стехиометрические уравнения (1) устанавливает соотношение между количеством превратившихся веществ:
(NAO-NA)/VA=(NBO-NB)/VB=(NR-NRо)/VR=(NS-NSО)/VS (2)
Где NAO,NBO,NRO,NSO- исходное кол-во компонентов A,B,R,S [моль]; NA,NB,NR,NS- кол-во тех же компонентов после превращения[моль]; (NAO-NA),(NBO-NB)-кол-во превратившихся(израсходованных) в-в A и B; (NR-NRO), (NS-NSO)- кол-во образовавшихся продуктов R и S [моль].
Поскольку стехиометрическое уравнение устанавливает соотношение между количеством превратившихся в-в оно является балансовым и предназначено для расчета состава реагирующей смеси после химического превращения, то есть для расчета материального баланса реакционных процессов.
Простые и сложные химические превращения.
Если превращение протекает по нескольким направлениям, то стехиометрических уравнений всегда (1)
VA A+VB B+….=VR R+VR S (1) будет несколько.
Простая реакция описывается одним стехиометрическим уравнением. Сложная реакция – несколькими.
Пример простой реакции-окисление диоксида серы: SO2 + 0,5O2=SO3-одна схема (направления)
Пример сложной реакции -окисление метанола:
Первая схема: 2CH3OH+O2=2CH2O+2H2O
Вторая схема: 2CH3OH+3O2=2CO2+4H2O
Здесь вид превращения определяется количеством стехиометрических уравнений (т.е. количеством схем превращения)
Однако, простыми и сложными реакции могут быть также по механизму их протекания (одностадийный и многостадийные)
С этой точки зрения окисление диоксида серы-многостадийная реакция , сложная по механизму , но простая по схеме превращения.
Стехиометрические уравнения показывают соотношения количеств реагирующих в-в, но не отвечают действительно протекающим взаимодействиям, хотя и могут совпадать, например, для простых по механизму реакции.
Алгебраическая форма стехиометрических уравнений.
Стехиометрическое уранение: VaA+VbB+….= VRR+VsS+….
Как уравнение , связывающее количество прореагировавших веществ, для простой по схеме превращения реакции можно представить в алгебраической форме:
 ViAi=0
ViAi=0
(1)
Vi<0 для веществ которые расходуются и Vi>0 – которые образуются.
Ai-вещества участвующие в реакции
Vi- стехиометрический коэффициент вещества
Если в реакции ионной смеси присутствуют инертные в-ва то для них Vi=0.
Для сложной реакции стехиометрические уравнения в алгебраической форме имеют вид:…
 ViAi=0,
j=1,2
(2)
ViAi=0,
j=1,2
(2)
j- индекс(номер) стехиометрического уравнения .
Vij- стехиометрический коэффициент i-го в-ва в j-м уравнении.
Vij=0-если вещество не входит в j-е уравнение.
Из уравнений (1) получают соотношения между кол-во превратившихся в-в
(N1-N10)/V1=(N2-N20)/V2=……..=(Ni-Ni0)/V1=const
(3)
N10… исходное кол-во компонентов [моль]
N1… кол-во компонентов после превращения [моль]
Исходные компоненты убывают (Ni-Nio)<0, продукты образуются ( Ni-Nio)>0
Базисная система стехиометрических уравнений.
Число стехиометрических уравнений
Т.к. стехиометрические уравнения-уравнения алгебраические то их система должна быть определённой, т.е. число уравнений должно быть равно числу веществ.
Для определения состава прореагировавших в-в необходимо следующее количество уравнений У.
У=B-(Э-1) (1)
Где B-число участвующих в превращении в-в исходных и конечных
Э- число элементов из которых состоят эти в-ва.
В ОВР соблюдается баланс по электронам, поэтому уравнение(1) принимает вид:
У=В-Э (2)
Уравнения для обменных (1) и окислит-восстановит (2) реакций определяют число стехиометрических уравнений, которые делают возможным расчёт состава прореагировавшей смеси.
Однако следует учитывать, что в число Э могут входить не только химические элементы, но и устойчивые в реакции группы (радикалы). Это актуально, особенно в органической химии.
Базисная система стехиометрических уравнений : стехиометрически независимые уравнения; Выбор системы стехиометрических.
Система алгебраических уравнений имеет решение, если уравнения, входящие в нее линейно независимы и число уравнений равно числу неизвестных
Исходя из этого: определения состава реагирующей смеси возможно в случае использования только стехиометрически независимых уравнений.
Базисная система стехиометрических уравнений, однозначно и полно описывающая процесс, должна содержать число стехиометрически независимых уравнений, определяемое уравнениями: Y=B-(Э-1) (1) и Y=B-Э (2), Где Y- количество уравнений; B- число веществ; Э- число элементов. В этом случае принципиально не важно, какие уравнения использованы. Возможность выбора любых стехиометрических уравнений для расчета образующихся веществ позволяет для удобства использовать такие, в каждом из которых одно и тоже вещество является исходным. Используют систему уравнений, в левые части которых входит исходное вещество.
Степень превращения, выходит и избирательность
Степень превращения X отношение количества превратившегося исходного вещества (NO- N) к его первоначальному количеству NO например для А по реакции XA=NAO-NA/ NAO (1)
гдеNA количество А после превращения.
Выход Е продукта показывает долю всего вещества, при худящуюся на образование данного продукта например, для R: ER=NA→R/NAO (2)
NA->R -это кол-во А превратившегося в R.
Избирательность (селективность) S процесса показывает, какая доля превращающегося исходного вещества расходуется на образование заданного продукта. Например для R:
SR=(NA→R)/(NAO-NA) (3) Из выражений (1), (2) и (3) можно получить
ER=SR XA (4)
Селективность процесса и выход продукта характеризуют эффективность химического процесса по использованию сырья получения нужного продукта.
Тепловой эффект реакции. Термохимические уравнения.
Изменение химического состава реагирующей смеси приводит к изменению ее теплосодержания дэльта Нт, которое рассчитывают через энтальпии образования компонентов (дэльта Нт) обр (следствие из закона Гесса):
∆HT=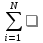 Vi(∆H)обрi
(1)
Vi(∆H)обрi
(1)
При этом необходимо помнить, что Qp=-дельтаНт (2) где Qp- тепловой эффект реакции [Дж]- термохимия, дэльта Нт – изменение энтальпии реакции [Дж] – гермодинамики.
∆HT<0;Qp>0-реакция экзотермическая;
∆HT>0;Qp<0-реакция эндотермическая
Тепловой эффект реакции входит в запись термохимического уравнения, представляющего собой стехиометрическое уравнение с указанием его теплового эффекта:
VAA+VBB+…..= VКК+Vss+…..+Qp(или ±∆H)
Знание теплового эффекта реакции необходимо для определения тепловых явлений в технологического процесса.
Количество выделившейся(поглощённой )теплоты qp зависит от колипревращенного вещества дельта N:
qp=Qp∆NA/VA
Направленность реакции
Химический процесс процесс принципиально осуществим, если реакция протекает с уменьшением энергии Гиббса G.
Возможность протекания реакции определяется из следующих условий:
при ∆GT,P<0 протекании реакции возможно
при ∆GT,P>0 протекании реакции невозможно
при ∆GT,P=0 реакционная система находится в равновесии ,(1)
Где дельта G,P – изменение энергии Гиббса при превращении исходных веществ в продукты при температуре T и давленииP.
По уравнению
∆G0T,P= i(∆G0298)обрi
i(∆G0298)обрi
где (∆G0298)обрi→стандартная энергия Гиббса образования исходных веществ и продуктов ( в справочниках дана)
Использование условий (1) позволяет определить возможность получения желаемого продукта.
Другое использование условий (1) – нахождение возможности предоставить протекания нежелательных реакций.
Химическое равновесие. Принцып Ле Шателье
Химическое равновесие, при котором скорость прямой и обратной реакций равны определяют из условия дельтаGP,T=0, где дельтаGP,T – изменении энергии Гиббса при превращении исходных веществ в продукты при температуре T и давлении Р.
Энергия Гиббса зависит от состава реакционной смеси по уравнениям:
∆GP,T=∆G0T+RTln iVi
iVi
∆GP,T=∆G0T+RTln iVi
(2) где
iVi
(2) где
 iVi
;
iVi
; iVi
- соответственно произведения концентрайии
и парциальных давлений компонентов в
степенях равных их стехиометрическим
коэффициентам в уравнении реакции.
iVi
- соответственно произведения концентрайии
и парциальных давлений компонентов в
степенях равных их стехиометрическим
коэффициентам в уравнении реакции.
При химическом равновесии состав смеси и концентрация компонентов являются равновесными, т.к. дельтаGT0= дельтаНт0-ТдельтаSTo (3) и учитывая (1) выражение (2) можно записать следующим образом:
∆HT0-T∆S0T=-RTln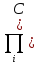 iVi)равн
iVi)равн
(4)
индекс «равны» означает, что это
равновесные концентрации. Т.о. KP=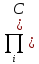 iVi)равн
(5) есть константа равновесия с учетом(4)
Kp=eхр(∆S0T
/R)*exp(-∆H0T/RT)
(6) выражение (6) справедливо для идеальных
смесей. Для неидеальных смесей используют
уравнение:
iVi)равн
(5) есть константа равновесия с учетом(4)
Kp=eхр(∆S0T
/R)*exp(-∆H0T/RT)
(6) выражение (6) справедливо для идеальных
смесей. Для неидеальных смесей используют
уравнение:
Kp=Kpo*exp(-∆H0T/RT)=Kpoexp(Qp/Aг) (7) где KPo-предэкспоненциальной множитель. Изменение хим равновесия достигают изменением внешних условий. Направленность влияния определяют принципом Ле Шателье: Если на систему, находящуюся в равновесии, оказывается воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшается
Схема превращения. Скорость превращения и скорость реакции.
Схема превращения показывает реальные взаимодействия в реагирующей системе. Она может быть представлена системой химических уравнений протекающих реакций или графически.
Схема превращений состоит из частых реакций или этапов. Схема превращения необходима для предсказания и объяснения динамического изменения в ней химических превращений.
Скорость превращения вещества Wi< 0- вещество расходуется, для продуктов Wi> 0- вещество образуется.∑ ViAi=0
Из уравнения реакции в алгебраической форме вытекает, что
∆Ni/Vi=const
где дельта Ni- количество превращенного вещества; Vi – стехиометрический коэффициент. Отсюда иWi/Vi=const и это отношение называется скоростью реакции r: r=Wi/Vi (1) скорость реакции r всегда положительна
Кинетическая модель реакции.
Зависимость скорости реакции ос условий ее протекания называют кинетическим уравнением или кинетической моделью реакции
Для элементарной реакции А+В =R =…, то есть протекающей в одну стадию, кинетическое уравнение
стоится на основе закона действующих масс: r=kCA*CB (1) где k- константа скорости реакции; СА и СВ – соответственно концентрации компонентов AиВ.
Однако закон действующих масс применим строго только к элементарной реакции состоят из ряда последовательных взаимодействий (стадий).
В общем виде кинетических уравнений представляют в виде: r=kf(C) (2), в котором на скорость реакции влияют все компоненты реакции.
По мере протекания сложной реакции компонентов кинетических уравнений вида (2) будет равно количеству частных реакций в общей схеме превращения. То есть это уравнение описывает скорость частной необратимой реакции в сложной схеме уравнения.
Константа скоростей реакции k зависит от температуры I и энергии активации Ea по уравнению
k=k0exp(-Ea/RT)
Аррениуса: ,(3) где k0 – предэкспоненциальный множитель, связанный с вероятным числом соударений;
R- универсальная газовая постоянная.
Иногда кинетическое уравнение представляют эмпирического зависимостью (формальная кинетическая): r=kCnA
где n – порядок реакции по компоненту A.
Кинетическая модель простой обратимой реакции.
Простая обратимая реакция A <–>R фактически представляет собой сложную, в которой протекают два частных превращения: A –>R (прямая реакция) и R –>A (обратная реакция).
Скорость реакции r1 и обратной r2 реакций; r=r1-r2 (1) отсюда если обе реакции первого порядка то
r1=k1CA и r2=k1CR. Тогда:
r=k1CA-k2CR=k1CA[1-k2CR/k1CA]
(2) С учетом того, что константы равновесия
kp
и константы скорости прямой k1
и обратной k2
реакций связаны между собой Kp=k1/k2
(3) и того, что выражение k1
cA
в (2) это скорость прямой реакции, выражение
(2) можно записать в общем виде:
r=ri[1-1/Kp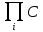 iVi](4)
где
iVi](4)
где iVi
- выражение закона действующих масс в
уравнении равновесия в приложении к
текущим концентрациям ( например для
реакции VA
A+VB
B
<–>VR
R+VS
S…
iVi
- выражение закона действующих масс в
уравнении равновесия в приложении к
текущим концентрациям ( например для
реакции VA
A+VB
B
<–>VR
R+VS
S…
Kp,C=(CVpRCVsS…../
CVaACVbB…..)= iVi)равн
(5)
iVi)равн
(5)
Скорость тепловыделения
Скорость тепловыделения q, подобно скорости превращения веществ wi, определяет количество теплоты выделяющейся в реакции в единицу времени в единицы реакционного пространства ( единица объема, единица поверхности).
Величина q зависит от скорости r и теплового эффекта Qp реакции: q=Qp*r
(1)
Скорость тепловыделения при протекании
сложной реакции определяется суммированием
тепловыделения всех j-ых
частных реакций: q=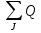 pj*ri
pj*ri
(2) гдеQpj –тепловыделение j-ой реакции;
ri- скорость j-ой реакции.
29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
Химический реактор- устройство, аппарат для проведения химических превращений ( химических реакций)
Химический реактор понятие обобщенное, относыщееся к реакторам, башням, автоклавам, камерам, печам, контактным аппаратом, полимеризаторам, дожигателям, гидрогенезаторам, окислителям и другим аппаратам, названия которых происходит из-за их назначения или внешнего води.


 Емкостной
реактор (1)
– оснащен мешалкой, которая перемешивает
реагенты, помещенные внетрь аппарата.
Температурный режим поддерживают с
помощью теплоносителя (Т), циркулирующего
в рубашке реактора или во встоенном
теплообменнике. После проведения реакции
продукты выгружают, и после очистки
реактора цикл повторяется.
Емкостной
реактор (1)
– оснащен мешалкой, которая перемешивает
реагенты, помещенные внетрь аппарата.
Температурный режим поддерживают с
помощью теплоносителя (Т), циркулирующего
в рубашке реактора или во встоенном
теплообменнике. После проведения реакции
продукты выгружают, и после очистки
реактора цикл повторяется.
Процесс периодический.
Емкостной реактор протечный (2) – в нем реагенты непрерывно проходят через реактор. Газ барботирует через жидкость.
Процесс непрерывный
Колонный реактор (3) – аналогичен емкостному проточному («) однако у них отношение высоты к диаметру составляет 4 -в (вемкостных-1) . В заимодействие газа и жидкости такое же как в реакторе (2).
Процесс непрерывный насадочный реактор(4) оснащен кольцами Рашига –насадкой Н. В взаимодействует газ г и жидкость ж. Жидкость стекает по насадке, а газ движется между элементами насадки.
30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
Реакторы этих типов используют в основном для взаимодействия газа г с твердым ТВ реагентом.
 В
данном реакторе твердый реагент
неподвижен. Газообразный или жидкий ж
реагент непрерывно проходит через него.
В
данном реакторе твердый реагент
неподвижен. Газообразный или жидкий ж
реагент непрерывно проходит через него.
Процесс- периодически по твердому веществу.


 Реакторы
(2-4)
модифицированы так, что и по ТВ реактору
процесс
непрерывный.
Реакторы
(2-4)
модифицированы так, что и по ТВ реактору
процесс
непрерывный.
В реакторе (2) твердый реагент двигается вдоль вращающегося, наклонно установленного цилиндрического реактора. Газ движется навстречу ТВ реагенту.
В реакторе (3) ТВ реагент просыпается через реактор навстречу подающемуся газу.
В реакторе (4) газ подается снизу под большим давлением так, что твердые частицы оказываются во взвешенном состоянии образуя псевдо ожженной или кипящий «слой, оседающей некоторыми» свойствами жидкости.
31.Трубчатый реактор. Трубчатый реактор типа печь.
Многослойный реактор.
Трубчатый реактор (1) по виду подобен кожухо-трубному теплообменнику. Через трубки, в которых протекает реакция, проходят газообразные г или жидкие ж реагенты. Обычно в трубки загружен катализатор К.
Температурный режим обеспечивает циркуляцией теплоносителя Т в межтрубном пространстве. Режим работы непрерывный.
Трубчатый реактор (2) применяют осуществления высокотемпературных гомогенных реакций, в том числе в вязкой жидкости (например, пиролиз тяжелых углеводородов)
Часто такие реакторы называют печами. Процесс непрерывный
Многослойный реактор(3) предусмотрен для проведения в нем газожидкостных процессов, между несколькими слоями твердого вещества, выполняющими, например, роль катализатора. Процесс непрерывный
