
- •1 Аннотация
- •2 Введение
- •3 Технико- экономическое обоснование
- •4 Технологическая часть
- •4.1. Выбор толщины покрытия
- •4.2 Выбор и обоснование технологической схемы гальванопокрытия, вида применяемых электролитов
- •4.3 Выбор и обоснование основного оборудования для гальванопокрытия
- •4.4 Расчёт фондов времени работы оборудования
- •4.5 Материальные расчеты
- •4 Список литературы
- •Содержание
4.5 Материальные расчеты
4.5.1 Расчет расхода химикатов
Общий расход химикатов складывается из расхода на единовременное приготовление электролита, расхода на работу .
Расчёт расхода химикатов на единовременное приготовление электролита.
Расход химикатов на приготовление считается по верхнему пределу концентрации
mхим, кг, и рассчитывается по формуле
mхим=
![]() ,
(4.23)
,
(4.23)
где С – концентрация химиката, г/л;
nв – число ванн, шт.;
Расход химикатов для ванны матового никелирования
m(NiSO4∙7Н2О)
=
![]() =
750 кг
=
750 кг
m(Na2SO4∙10Н2О)
=
![]() =
300 кг
=
300 кг
m(H3BO3)
=
![]() =
120 кг
=
120 кг
m(NiCl2∙6Н2О)
=
![]() =
60кг
=
60кг
Расчёт расхода химикатов на работу за год
Расчет расхода химикатов на работу Qхимкг/год, рассчитывается по формуле
Qхим
=
![]() ,
(4.24)
,
(4.24)
где rхим = 0,115 – удельная норма расхода электролита;
Ccр – средняя концентрация, г/л;
S – годовая программа по покрываемой поверхности; м2.
Расчет расхода химикатов на работу для ванны матового никелирования
Q(NiSO4∙7Н2О)
=
![]() =
750 кг/год
=
750 кг/год
Q(Na2SO4∙10Н2О)
=
![]() =
314 кг/год
=
314 кг/год
Q(H3BO3)
=
![]() =
113 кг/год
=
113 кг/год
Q(NiCl2∙6Н2О)
=![]() =
47 кг/год
=
47 кг/год
Расход блескообразующих добавок на разложение
m=![]() ,
(4.25)
,
(4.25)
где g– расход блескообразующей добавки, г;
I– ток, подаваемый на ванну, А.
m(хлорамин
Б)=![]() =
49 кг ( 98 кг для двух автоматов)
=
49 кг ( 98 кг для двух автоматов)
m(1,4-бутилдиол)=![]() =26.5
кг (53 кг
для двух автоматов)
=26.5
кг (53 кг
для двух автоматов)
m(прогресс)=![]() =10
кг (20 кг для двух автоматов)
=10
кг (20 кг для двух автоматов)
Аналогично рассчитываем для других ванн с учетом норм расхода электролита для различных операций.
Таблица 3 Расход химикатов на никелирование для двух автоматов.
|
Наимено- вание операции |
Компонен-ты |
Концент- рация, г/л |
Удель- ный расход, л/м2 |
Расход химикатов, кг | ||||
|
На при-готов-ление |
На рабо-ту |
Всего |
|
итого | ||||
|
Химичес-кое Обезжири-вание |
Обезжириватель «КХ» |
5-7 |
0,4 |
14 |
73 |
|
|
|
|
Электро-химичес-кое Обезжири-вание |
Обезжириватель «КХ» NaOH |
5-7
5-10 |
0,4 |
21
30 |
73
91 |
|
|
|
|
Активация |
H2SO4
|
60-80
|
0,4 |
158 |
849 |
|
|
|
|
Никелиро-вание матовое |
NiSO4∙7Н2О Na2SO4∙ ∙10Н2О H3BO3 NiCl2*6H2O |
180-250 80-100
25-40 7-20 |
0,115 |
1500 600
240 120 |
750 314
113 47 |
|
|
|
|
Никелиро-вание блестящее
|
NiSO4∙7Н2О H3BO3 NiCl2*6H2O Хлорамин Б 1,4-бутилдиол “Прогресс” |
250-300 30-40 10-15 1-2 0,2-3,0 0,1-0,2 |
0,115 |
900 120 75 6 9 0.6 |
959 122 78 5 5.6 0.5 |
|
|
|
4.5.2 Расчет расхода анодов
Расход анодов складывается из расхода на единовременную загрузку и расхода на покрытие.
Расчет расхода анодов для электрохимического обезжиривания
Используем листовые катоды (нержавеющая сталь марки 12Х18Н9Т). Принимаем соотношение Sa:Sk, как 1:1. Выбираем параметры катода ширина 130, высота 1150, толщина 5.
Количество анодов
![]() ,
необходимое для ванны электрохимического
обезжиривания:
,
необходимое для ванны электрохимического
обезжиривания:
![]() ,
(4.26)
,
(4.26)
![]() (шт)
(шт)
По конструкционным соображениям принимаем 4 шт.
Объем одного анода
![]() :
:
![]() ,
(4.27)
,
(4.27)
![]() дм3
дм3
Масса анодов
![]() :
:
![]() ,
(4.28)
,
(4.28)
где
![]() -
плотность стали,
-
плотность стали,![]() =
7,86 г/cм3.
=
7,86 г/cм3.
![]() г
= 23,5 кг ( 47 кг для двух автоматов)
г
= 23,5 кг ( 47 кг для двух автоматов)
Расход анодов для двух автоматов на
работу
![]() :
:
![]() ,
(4.29)
,
(4.29)
где
![]() -
норма расхода нерастворимых катодов
[ГОСТ 5582-50],
-
норма расхода нерастворимых катодов
[ГОСТ 5582-50],![]() =
1,27 г/м2.
=
1,27 г/м2.
![]() 154
кг
154
кг
Расчет расхода анодов для ванн никелирования
Применяем растворимые кусковые аноды, помещенные насыпью в перфорированные титановые корзины. Никелевые листы рубятся на куски размерами 25*25*10 мм. Титановые корзины обычно имеют размеры: ширина 100-300 мм, толщина 50мм и длина, равная рабочей высоте катодной подвески. Корзины имеют титановый каркас из проволоки или пластин с приваренной к нему титановой сеткой или перфорированными листами. Корзина снаружи обёртывается хлориновой тканью или бельтингом. Соотношение Sa:Sк нужно брать 1:1-2:1 или меньше, учитывая высокую развитость реакционной способности анодных кусков принимаемSa:Sк=2:1 ,
Sк = 73,8дм2
Принимаем корзину: 1150*130*50 (рабочая высота 1100 мм)
Объем корзины
![]() :
:
![]() дм3
дм3
Количество корзин
![]() вычисляется по формуле
вычисляется по формуле
![]() ,
(4.30)
,
(4.30)
![]() шт
шт
По техническим соображениям принимаем 10 корзин.
Масса одной корзины
с анодами ![]() ,кг, вычисляется по формуле
,кг, вычисляется по формуле
![]() ,
(4.31)
,
(4.31)
где ρ – насыпная плотность никеля, кг/дм3[практические замеры].
![]() кг
кг
Масса всего никеля в ваннах
матового никелирования![]() ,
кг, вычисляется по формуле
,
кг, вычисляется по формуле
![]() ,
(4.32)
,
(4.32)
![]() кг
кг
Для двух автоматов
m=820*2=1640 кг
Расход анодов на работу
![]() :
:
![]() ,
(4.33)
,
(4.33)
Расчет расхода анодов на никелирование матовое
![]() кг ( 3952 кг для двух автоматов)
кг ( 3952 кг для двух автоматов)
Расчет расхода анодов на никелирование блестящее
![]() кг ( 820 кг для двух автоматов)
кг ( 820 кг для двух автоматов)
![]() кг (2166 кг для двух автоматов)
кг (2166 кг для двух автоматов)
Таблица 4 Расход анодов для двух автоматов
|
Наименование операции |
На загрузку, кг |
На работу, кг |
Всего, кг |
|
Электрохимическое обезжиривание |
47 |
154 |
201 |
|
Никелирование матовое |
1640 |
3952 |
5592 |
|
Никелирование блестящее |
820 |
2166 |
2986 |
4.5.3 Расчет расхода воды
Вода расходуется на приготовление растворов, работу, электролиз, испарение.
4.5.3.1Расход воды на приготовление g, кг, рассчитывается по формуле
g(H2O)=Vэл-та · γ · nв – gхим (4.34)
где γ – плотность раствора, кг/дм3;
gхим – суммарная масса всех химикатов на приготовление
электролита, кг.
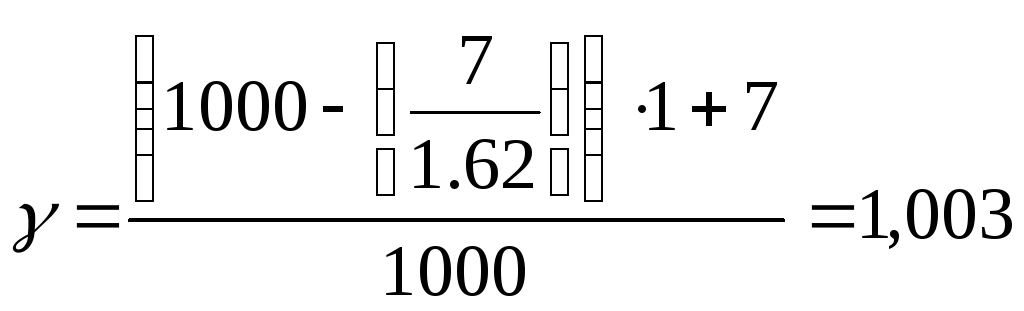
Расход воды на приготовление раствора для ванны химического обезжиривания:
Плотность раствора, г/л, рассчитывается по формуле
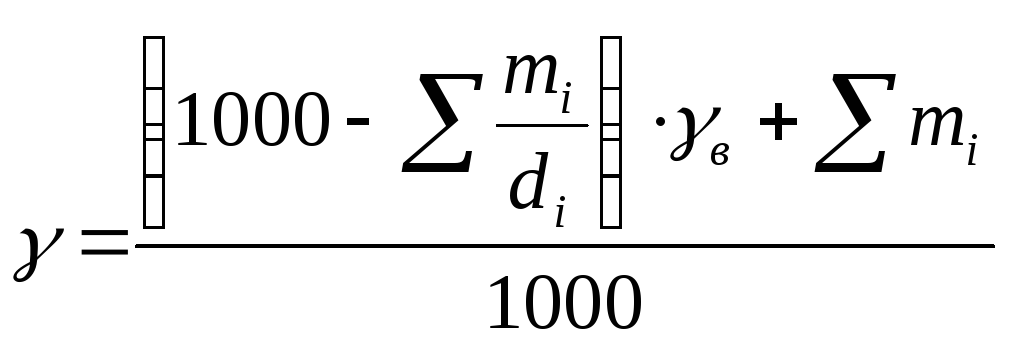 (4.35)
(4.35)
где в– плотность воды, г/см3;
mi – концентрация компонента, г/л;
di – плотность компонента, г/см3;
 г/см3
г/см3
gхим= 7*986 = 6.9 кг
![]() кг = 1м3( 2 м3 для двух
автоматов)
кг = 1м3( 2 м3 для двух
автоматов)
Расход воды на приготовление раствора для ванны электрохимического обезжиривания
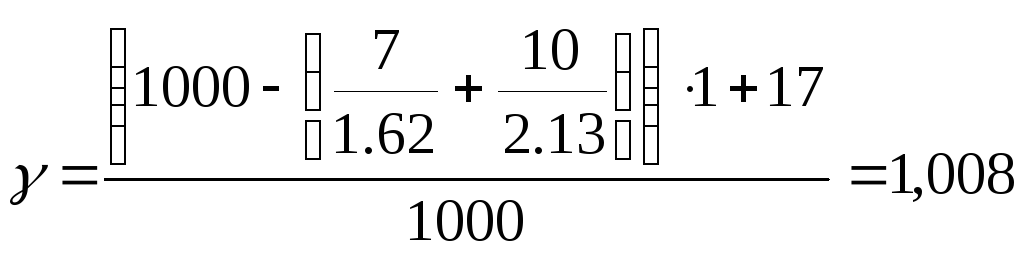 г/см3
г/см3
gхим= 17 *1500 =25,5 кг
![]() =1,5 м3( 3м3для двух
автоматов)
=1,5 м3( 3м3для двух
автоматов)
Расход воды на приготовление раствора для ванны активации
 г/см3
г/см3
gхим= 80*986 =78,9 кг
![]() =0,9 м3 ( 1,8 м3
для двух автоматов)
=0,9 м3 ( 1,8 м3
для двух автоматов)
Расход воды на приготовление раствора для ванны матового никелирования
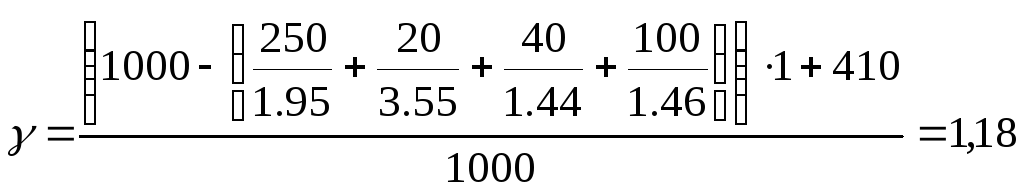 г/см3
г/см3
gхим= 410*1500=615 кг
![]() =2,3 м3(4,6 м3для двух автоматов)
=2,3 м3(4,6 м3для двух автоматов)
Расход воды на приготовление раствора для ванны блестящего никелирования
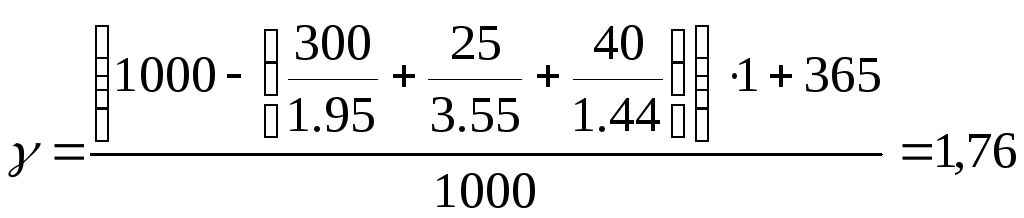 г/см3
г/см3
gхим= 365*1500=547,5 кг
![]() = 2,1 м3( 4,2 м3для двух
автоматов)
= 2,1 м3( 4,2 м3для двух
автоматов)
4.5.3.2 Расход воды на работу
Расчитывается только для первой ванны
(химического обезжиривания), так как в
неё детали поступают сухие, а выходят
смоченные водой
![]() Раб,
кг, расчитывается по формуле
Раб,
кг, расчитывается по формуле
![]() Раб=
ρSγ-(
с1+с2+с3….+сn)
ρS(4.36)
Раб=
ρSγ-(
с1+с2+с3….+сn)
ρS(4.36)
где ρ- норма выноса электролита 1м2обрабатываемых деталей , л/м2
S– годовая программа ванны, м2
( с1+с2+с3….+сn)- концентрация компонентов, кг/л.
![]() Раб=0,2
Раб=0,2![]() 30318
30318![]() 1,003-0,007
1,003-0,007![]() 0,2
0,2![]() 30318
=6039 кг/год =6,04 м3/год
30318
=6039 кг/год =6,04 м3/год
4.5.3.3 Расход воды на испарение с зеркала электролита
g’(H2O) = 45,6 · (P1–P2) ·CВ ·Fэл ·TД ·n/Pб, (4.37)
где Р1 - давление насыщенного пара при температуре электролита, [9]
P2
=
![]() ,
(4.38)
,
(4.38)
X = 70 – степень влажности воздуха;
CВ – частный коэффициент, зависящий от скорости движения воздух
(для гальванических цехов равен 0,71);[4].
Рб = 1013гПа, барометрическое давление
Fэл – поверхность зеркала электролита, м2;
Fэл = Lвнутр·Wвнутр (4.39)
Дл ванны матового никелированя (500С )
P2
=
![]() = 93,3 гПа
= 93,3 гПа
Fэл =0 ,61 · 1,7 = 1,04 м2;
g’(H2O)=![]() =10765,2
л/год = 11м3/год
=10765,2
л/год = 11м3/год
(22 м3/год для двух автоматов)
Для ванны блестящего никелирования(550С)
.
P2
=
![]() = 87,5 гПа
= 87,5 гПа
g’(H2O)=
![]() =5084
л/год = 5,1 м3/год
=5084
л/год = 5,1 м3/год
(10,2 м3/год для двух автоматов)
Аналогично расчитываем для остальных ванн. Результаты сводим в таблицу.
4.5.3.4Расход воды на электролиз
Расход
воды на электролиз
![]() ,
кг рассчитывается по формуле
,
кг рассчитывается по формуле
![]() =I∙Тэф∙qн
О∙Вт∙Кз∙n/100000
(4.40)
=I∙Тэф∙qн
О∙Вт∙Кз∙n/100000
(4.40)
где I – сила тока на ванну,А
Тэф- эффективный фонд времени работы ванны, ч
qн О- электрохимический эквивалент воды, г/А∙ч
Вт- выход по току для электролиза воды, %
Кз- коэффициент загрузки ванны
n- число однотипных ванн
Для электрохимического обезжиривания
Кз=(70/609) · 100% =11,5%=0,115
![]() =221∙3814∙0,336∙100∙0,115∙1/100000=32,6
л/год = 0,033 м3/год
=221∙3814∙0,336∙100∙0,115∙1/100000=32,6
л/год = 0,033 м3/год
(0,066 м3/год для двух автоматов)
4.5.3.5 Расход воды на унос с выделяющимися газами
Объём выделяющегося за год водорода
и кислорода ,
![]() ,
,![]() , л/год, приведённый к нормальным
, л/год, приведённый к нормальным
условиям рассчитывается по формуле
![]() (4.41)
(4.41)
де
![]() -
сила тока, А;
-
сила тока, А;
![]() -
эффективный годовой фонд работы ванны,
ч;
-
эффективный годовой фонд работы ванны,
ч;
![]() -
электрохимический эквивалент водорода,
л/А∙ч;
-
электрохимический эквивалент водорода,
л/А∙ч;
![]() -
выход по току для водорода (в долях);
-
выход по току для водорода (в долях);
![]() -
число однотипных ванн;
-
число однотипных ванн;
![]() -
коэффициент использования ванны (в
долях).
-
коэффициент использования ванны (в
долях).
Объём
газов при условиях электролиза
![]() ,
л/год, рассчитывается по формуле
,
л/год, рассчитывается по формуле
 (4.42)
(4.42)
где
![]() =101,3кПа.;
=101,3кПа.;
![]() =
2730К;
=
2730К;
![]() -
давление газов при условиях электролиза
за вычетом давления водяных
-
давление газов при условиях электролиза
за вычетом давления водяных
паров при температуре процесса.
Расход воды с уходящими газами
![]() ,
кг/год, рассчитывается по формуле
,
кг/год, рассчитывается по формуле
![]() (4.43)
(4.43)
где
![]() -
удельная масса насыщенного водяного
пара на 1 л газа над раствором
-
удельная масса насыщенного водяного
пара на 1 л газа над раствором
при температуре процесса, кг/м3.
Для ванны электрохимического обезжиривания( 250C)
![]() =
40,5 м3/год
=
40,5 м3/год
![]() =
20,3 м3/год
=
20,3 м3/год
![]() 0=
40,5+20,3=60,7 м3/год
0=
40,5+20,3=60,7 м3/год
![]() ,
,
при 25 0С![]() =
0,02304 кг/м3[9]
=
0,02304 кг/м3[9]
![]() (3,14 кг/год для двух автоматов)
(3,14 кг/год для двух автоматов)
Для ванны матового никелирования (50 0C)
Ni2++ 2e=NiBT= 95-98%
2H+ + 2e = H2 BT= 5-2%
![]() =
35.7 м3/год
=
35.7 м3/год
![]() ,
,
при 50 0С![]() =
0, 083 кг/м3[9]
=
0, 083 кг/м3[9]
![]() (7.7 кг/год для двух автоматов)
(7.7 кг/год для двух автоматов)
Для ванны блестящего никелирования ( 55 0С)
![]() =
17,4 м3/год
=
17,4 м3/год
![]() ,
,
при 55 0С![]() =
0, 104 кг/м3[9]
=
0, 104 кг/м3[9]
![]() (4,8 кг/год для двух автоматов)
(4,8 кг/год для двух автоматов)
Расход воды на промывки
Одноступенчатая промывка после ванны химического обезжиривания
Удельный расход
воды в ванне промывки ![]() :
:
![]() ,
(47)
,
(47)
где ![]() - удельный вынос раствора с поверхности
деталей [4];
- удельный вынос раствора с поверхности
деталей [4];
![]() -
концентрация наиболее опасного компонента
в ванне, г/л;
-
концентрация наиболее опасного компонента
в ванне, г/л;
![]() -
концентрация наиболее опасного компонента
в промывочной воде, г/л.
-
концентрация наиболее опасного компонента
в промывочной воде, г/л.
Годовой расход
воды в ванне промывки ![]() :
:
![]() (48)
(48)
![]() л/м2
л/м2
![]() л/год
л/год
Каскадная (теплая и холодная) противоточная промывка после ванны электрохимического обезжиривания
Удельный расход
воды при таком типе промывки ![]() :
:
![]() (49)
(49)
![]() л/м2
л/м2
Годовой расход
воды при таком типе промывки ![]()
![]() ,
(50)
,
(50)
![]() л/год
л/год
Холодная каскадная противоточная промывка после ванны активации
Удельный расход
воды при таком типе промывки ![]()
![]() (51)
(51)
![]() л/м2
л/м2
Годовой расход
воды при таком типе промывки ![]()
![]() ,
(52)
,
(52)
![]() л/год
л/год
Ванна улавливания после блестящего никелирования
Удельный расход
воды в ванне улавливания ![]() :
:
![]() ,
(53)
,
(53)
где Св.у. - концентрация в ванне улавливания, г/л.
Годовой расход
воды в ванне улавливания ![]() :
:
![]() ,
(54)
,
(54)
![]() л/м2
л/м2
![]() л/год
л/год
Зная объем воды в ванне улавливания, рассчитываем сменяемость этой ванны m=g/Vв.у. (55)
m=4869/1737=3 раза
Холодная каскадная противоточная промывка после ванны улавливания
![]() л/год
л/год
Ванна теплой промывки перед сушкой
![]() л/год
л/год
Таблица 5 Общий расход воды
|
Наименование |
Расход воды, л/год. | |||||
|
операции |
на приготовление |
на работу |
на испарение |
на электролиз |
на унос с газами |
на промывку |
|
| ||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Обезжиривание химическое |
1182 |
9580 |
6483 |
27 |
- |
- |
|
Промывка |
- |
- |
- |
- |
- |
85928 |
|
Электрохимическое обезжиривание |
1206 |
- |
6483 |
|
9 |
- |
|
Промывка (каскад) |
- |
- |
- |
- |
- |
29766 |
|
Активация |
1073 |
- |
2191 |
- |
- |
- |
|
Промывка (каскад) |
- |
- |
- |
- |
- |
48608 |
|
Никелирование матовое |
5329 |
- |
26973 |
- |
1,3 |
- |
|
Никелирование блестящее |
2838 |
- |
12739 |
- |
3,8 |
- |
|
Улавливание |
- |
- |
- |
- |
- |
4869 |
|
Промывка (каскад) |
- |
- |
- |
- |
- |
51557 |
|
Промывка |
- |
- |
- |
- |
- |
1719 |
|
Итого: |
11628 |
9580 |
54869 |
|
14,1 |
222447 |
3.7 Энергетические расчеты
3.7.1 Расчет напряжения на ванне
Ванна электрохимического обезжиривания
Напряжение на
ванне
![]() ,
вычисляется по формуле
,
вычисляется по формуле
![]() ,
(56)
,
(56)
где
![]() -
потенциал анода, В;
-
потенциал анода, В;
![]() (57)
(57)
![]() потенциал
равновесного кислородного электрода
в растворе обезжиривания, В;
потенциал
равновесного кислородного электрода
в растворе обезжиривания, В;
![]() -
перенапряжение выделения кислорода,
В;
-
перенапряжение выделения кислорода,
В;
![]() -
потенциал катода, В;
-
потенциал катода, В;
![]() , (58)
, (58)
![]() -
потенциал равновесного водородного
электрода в растворе обезжиривания, В;
-
потенциал равновесного водородного
электрода в растворе обезжиривания, В;
![]() перенапряжение
выделения водорода, В;
перенапряжение
выделения водорода, В;
![]() -
падение напряжения в электролите, В;
-
падение напряжения в электролите, В;
Падение напряжения
в электролите
![]() ,
В, вычисляется по формуле
,
В, вычисляется по формуле
![]() , (59)
, (59)
![]() средняя
плотность тока, А/дм2,
средняя
плотность тока, А/дм2,
![]() ;
;
![]() межэлектродное
расстояние, см;
межэлектродное
расстояние, см;
![]() удельная
электропроводность, Ом-1
см-1;
удельная
электропроводность, Ом-1
см-1;
Кг – коэффициент газонаполнения;
![]() - падение напряжения
в электродах, В;
- падение напряжения
в электродах, В;
(этой составляющей можно пренебречь, так как она незначительна)
Так как на катоде идет процесс выделения H2, а на аноде O2, то разность потенциалов катода и анода есть напряжение разложения воды при температуре обезжиривания 600С.
Напряжение
разложения воды при температуре 60С
![]() ,
вычисляется по формуле
,
вычисляется по формуле
![]() ,
(60)
,
(60)
где
![]() напряжение
разложения воды при 250С,
В;
напряжение
разложения воды при 250С,
В;
![]() =1,23
В;
=1,23
В;
![]() -
изменение энтропии при стандартных
условиях,
-
изменение энтропии при стандартных
условиях,
![]() ;
;
z – число электронов;
F – число Фарадея, Кл;
Энтропия для этой реакции при стандартных условиях
![]() ,
(61)
,
(61)
![]()
При 600С:
![]() В
В
Перенапряжение выделения водорода:
![]() ,
(62)
,
(62)
где a и b - константы в уравнении Тафеля;
j - плотность тока, А/ см2;
j=1,53 А/дм2
для стали
![]() ;
;![]() [10].
[10].
![]() В
В
Перенапряжение выделения кислорода:
![]() ,
(63)
,
(63)
где a и b - константы в уравнении Тафеля;
j - плотность тока, А/ дм2.
для стали
![]() ;
;![]() [10].
[10].
![]() В
В
Так как с увеличением температуры на 10С перенапряжение уменьшается на 2 мВ, то при 600С:
![]() В
В
![]() В
В
![]() , (64)
, (64)
![]() В
В
Расчет удельной электропроводности.
![]() , (65)
, (65)
Эквивалентная
концентрация компонентов раствора
![]() вычисляется
по формуле
вычисляется
по формуле
![]() ,
(66)
,
(66)
![]() ,
,
![]() ,
,
![]() .
.
Суммарная концентрация компонентов:
![]()
Эквивалентная
электропроводность для каждого из
компонентов раствора при суммарной
концентрации
![]() при 250С
при 250С
![]() 156,3
Ом-1г-экв∙см2
[1];
156,3
Ом-1г-экв∙см2
[1];
![]() 45,5
Ом-1г-экв∙см2
[1];
45,5
Ом-1г-экв∙см2
[1];
![]() 72
Ом-1г-экв∙см2
[1].
72
Ом-1г-экв∙см2
[1].
Для 600С:
![]()
![]() 156,3∙[1+0,019(60-25)]=260,24
Ом-1г-экв∙см2
156,3∙[1+0,019(60-25)]=260,24
Ом-1г-экв∙см2
![]() 45,3∙[1+0,02(60-25)]=77,01
Ом-1г-экв∙см2
45,3∙[1+0,02(60-25)]=77,01
Ом-1г-экв∙см2
![]() 72∙[1+0,02(60-25)]=122,4
Ом-1г-экв∙см2
72∙[1+0,02(60-25)]=122,4
Ом-1г-экв∙см2
Удельная
электропроводность отдельных компонентов
в смешанно растворе
![]() вычисляется
по формуле
вычисляется
по формуле
![]() ,
(67)
,
(67)
![]() Ом-1∙м-1
Ом-1∙м-1
![]() Ом-1∙м-1
Ом-1∙м-1
![]() Ом-1∙м-1
Ом-1∙м-1
Удельная
электропроводность раствора
![]() вычисляется по формуле:
вычисляется по формуле:
![]() +
+![]() (68)
(68)
![]() 0,16+0,04+0,01=0,21
Ом-1∙м-1
0,16+0,04+0,01=0,21
Ом-1∙м-1
Падение напряжения в электролите
![]() =1,2
В
=1,2
В
Падение напряжения в электродах и контактах
![]() 0,15[(0,5-(-0,5)+1,2]=0,33
В
0,15[(0,5-(-0,5)+1,2]=0,33
В
Напряжение на ванне электрохимического обезжиривания:
![]() 2,2+1,4+0,33=3,93
В
2,2+1,4+0,33=3,93
В
Расчет напряжения на ванне матового никелирования
Напряжение на ванне матового никелирования:
![]() , (69)
, (69)
![]() для растворимых
анодов можно воспользоваться величинами
поляризаций, т. е.
для растворимых
анодов можно воспользоваться величинами
поляризаций, т. е.
![]()
![]()
По поляризационным кривым нашли:
φк=-0,72 В [11];
φа=0,3 В [11];
![]() 15
см.
15
см.
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]()
![]()
Эквивалентная
электропроводность для каждого из
компонентов раствора при суммарной
концентрации
![]() при 250С
при 250С
![]() 15,07
Ом-1г-экв∙см2[1];
15,07
Ом-1г-экв∙см2[1];
![]() 66,2
Ом-1г-экв∙см2[1];
66,2
Ом-1г-экв∙см2[1];
![]() 17,5
Ом-1г-экв∙см2[1];
17,5
Ом-1г-экв∙см2[1];
![]() 36,7
Ом-1г-экв∙см2[1].
36,7
Ом-1г-экв∙см2[1].
Для 500С:
![]() 15,07∙[1+0,02(50-25)]=22,61
Ом-1г-экв∙см2
15,07∙[1+0,02(50-25)]=22,61
Ом-1г-экв∙см2
![]() 66,2∙[1+0,02(50-25)]=99,3
Ом-1г-экв∙см2
66,2∙[1+0,02(50-25)]=99,3
Ом-1г-экв∙см2
![]() 17,5∙[1+0,0164(50-25)]=24,68
Ом-1г-экв∙см2
17,5∙[1+0,0164(50-25)]=24,68
Ом-1г-экв∙см2
![]() 36,7∙[1+0,02(50-25)]=55,05
Ом-1г-экв∙см2
36,7∙[1+0,02(50-25)]=55,05
Ом-1г-экв∙см2
Удельная
электропроводность отдельных компонентов
в смешанно растворе
![]() вычисляется
по формуле
вычисляется
по формуле
![]() ,
,
![]() =0,03
Ом-1∙м-1
=0,03
Ом-1∙м-1
![]() =0,02
Ом-1∙м-1
=0,02
Ом-1∙м-1
![]() =0,04
Ом-1∙м-1
=0,04
Ом-1∙м-1
![]() =0,06
Ом-1∙м-1
=0,06
Ом-1∙м-1
Удельная
электропроводность раствора
![]() вычисляется по формуле:
вычисляется по формуле:
![]() +
+![]()
![]() 0,03+0,02+0,04+0,06=0,15
Ом-1∙м-1
0,03+0,02+0,04+0,06=0,15
Ом-1∙м-1
Падение напряжения в электролите
![]() ,
,
![]()
![]()
![]() =1,53
В
=1,53
В
Падение напряжения в контактах
![]() 0,15[(0,3-(-0,72)+1,53]=0,38
В
0,15[(0,3-(-0,72)+1,53]=0,38
В
Падение напряжения в перфорации корзины:
![]() (70)
(70)
![]() =0,6
В
=0,6
В
Напряжение на ванне матового никелирования:
![]() =(0,3-(-0,72))+1,53+0,4+0,6=3,55
В
=(0,3-(-0,72))+1,53+0,4+0,6=3,55
В
Расчет напряжения на ванне блестящего никелирования
Напряжение на ванне блестящего никелирования:
![]() , (71)
, (71)
![]()
φк=-0,76 В [11];
φа=0,35 В [11];
![]() 15
см.
15
см.
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() 0,11
Ом-1∙м-1
0,11
Ом-1∙м-1
Падение напряжения в электролите
![]() ,
,
![]()
![]()
![]() =4,8
В
=4,8
В
Падение напряжения в контактах
![]() 0,15[(0,35-(-0,76)+4,8]=0,9
В
0,15[(0,35-(-0,76)+4,8]=0,9
В
Падение напряжения в перфорации корзин:
![]() =1,5
В
=1,5
В
Напряжение на ванне блестящего никелирования:
![]() (0,35-(-0,76))+4,8+0,9+1,5=8,31
В
(0,35-(-0,76))+4,8+0,9+1,5=8,31
В
3.7.2 Расчет джоулева тепла
Ванна электрохимического обезжиривания
![]()
![]() ,
(72)
,
(72)
где
![]() напряжение
на штангах ванны, В;
напряжение
на штангах ванны, В;
 тепловое
напряжение разложения для электрохимических
превращений на электродах гальванической
ванны;
тепловое
напряжение разложения для электрохимических
превращений на электродах гальванической
ванны;
 выход
по току для электрохимических превращений
на электродах гальванической ванны;
выход
по току для электрохимических превращений
на электродах гальванической ванны;
Тепловое напряжение
![]() , (73)
, (73)
где
![]() изменение
энтальпии для данного электрохимического
превращения;
изменение
энтальпии для данного электрохимического
превращения;
![]() , (74)
, (74)
![]()
Пересчитываем
![]() при
600С
по формуле
при
600С
по формуле
![]() ,
,
где
![]() -
теплоемкость веществ, ккал/г;
-
теплоемкость веществ, ккал/г;
![]() -
молекулярная вес вещества, г;
-
молекулярная вес вещества, г;
![]() -
разность температур, К;
-
разность температур, К;
![]() - энтальпия вещества
при 298С;
- энтальпия вещества
при 298С;
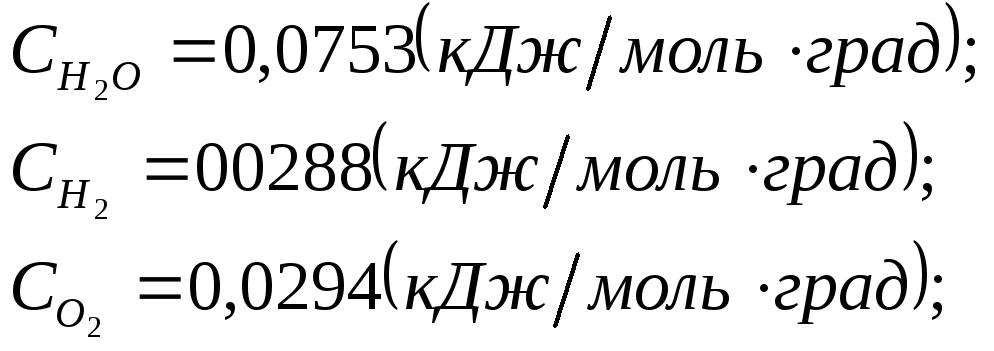
Для воды:
![]() ,
,
Для водорода:
![]() ,
,
Для кислорода:
![]() .
.
Изменение этальпии системы:
![]() , (75)
, (75)
![]()
Тепловое напряжение разложения воды:
![]()
Количество теплоты, выделившееся за 1час работы:
![]() 3,6∙162∙1(3,93-1,33∙1)=1516
кДж/ч
3,6∙162∙1(3,93-1,33∙1)=1516
кДж/ч
Расчёт джоулева тепла ванн никелирования
В электрохимической системе ванн никелирования происходят следующие процессы:
К: Ni2+ +2е → Ni Вт=95-98%
2H+ + 2е → Н2 Вт=2-5%
А: Ni – 2е → Ni2+ Вт=100%
Σ: а) Ni2+
↔ Ni2+
В![]() ≈В
≈В![]() =95-98%
=95-98%
б) Н2SO4+Ni → NiSO4+H2 Вт=2-5%
Расчёт джоулева тепла гальванической ванны Qт, кДж/час, ведём по формуле
![]() (76)
(76)
где J – сила тока на ванне, А;
UВ – напряжение на гальванической ванне, В;
Ет – тепловое напряжение разложение для электрохимических превращений на электродах гальванической ванны,В.
Ет=![]() ,
(77)
,
(77)
где ΔН – изменение энтальпии реакции, кДж/моль.
Для реакции Н2SO4+Ni → NiSO4+H2
ΔНН2SO4= -811,9 кДж/моль
ΔНNiSO4= -891,4 кДдж/моль
ΔНNi=0; ΔНН2=0 [1]
ΔНр-ции=Σ ΔНкон- Σ ΔНисх (78)
ΔНр-ции=-891,4+811,9=-79,5 кДж/моль
Ет=![]() =0,41
=0,41
для ванны матового никелирования
Qт = 3,6∙144∙1(3,55-0,41∙0,05)=1830 кДж/ч
для ванны блестящего никелирования
Qт = 3,6∙371∙1(8,31-0,41∙0,05)=11071 кДж/ч
