
-
Механизм переноса энергии в комплексах лантанидов.
Вначале 1990-х годов, Лен ввел термин «антенна» - обозначающий поглощение, перенос энергии, последовательных выбросов с участием различных поглощающих (лиганды) и излучающих (ионы лантанидов) компонентов в люминесцентных комплексах лантаноидов, которые работают как преобразователи света молекулярных устройств (LMCDs). Этот двухступенчатый процесс возбуждения позволяет добиться большого возбужденного состояния степени заполнения используя дозы света (Дж/см2) четырех-пяти порядков ниже чем те, которые требуются для голых ионов и позволяет преодолеть слабые поглощения ионов лантаноидов. Рис.4. показывает на примере эрбия, упрощенную схему энергетических уровней, иллюстрирующую процесс передачи энергии. После оптического возбуждения в ближнем УФ синглет лиганда возбужденного состояния S1 может либо распадаться в основное состояние S0, или до триплетного состояния Tn через механизм межсистемного пересечения (МСП) путем усиления эффекта тяжелого атома. Возбужденные триплеты впоследствии могут заполнить верхние уровни ионов лантаноидов через перенос резонансной энергии (RET). После быстрого возбужденного состояния наступает релаксация иона, радиационный распад (2S +1)Гj →(2S +1)Гj, дает излучение Ln3+ в ИК-области спектра.

Рис 4. Схема Яблонски, иллюстрирующая двухступенчатый процесс возбуждения эрбия в комплексе гидроксихинолина. Пунктирные стрелки обозначают безызлучательный механизм релаксации.
В упрощенной модели, общий (или абсолютный) квантовый выход Фtot сенсибилизированной люминесценции комплексов лантаноидов может быть записан:
Фtot = ηISCηETФLn = ηsensФLn = ηsens τobs/ τrad (1)
где ФLn является внутренним квантовым выходом для прямого возбуждения ионов лантанидов, ηISC представляет эффективность межсистемного процесса пересечения и ηET является эффективностью 3ππ* - Ln передачи (лиганд-металл).
Эти последние условия могут быть объединены в эффективный параметр чувствительности ηsensФLn, строго ограниченный несколькими конкурентными безызлучательными процессами распада при излучении иона лантаноида, и зависящий от соотношения между константами скорости излучения(кrad = 1 / τrad) и процессами дезактивации возбужденного состояния (кobs = 1 / τobs). τobs – наблюдаемое время распада ИК-области спектра соединения лантаноида, а τrad – это «природное» радиационное время жизни данного иона лантаноида при отсутствии безызлучательной дезактивации. Только общий квантовый выход Фtot и время жизни люминесценции τobs могут быть непосредственно измерены и их значения найдены в литературе, тогда как другие члены уравнения (3) часто трудно определить, и представлены, в большинстве случаев, только грубые значения. Таким образом, световой поток люминесцентных материалов на основе комплексов лантаноидов существенно зависит от: (I) поглощения антенного блока, (II) эффективности двухступенчатого 1S*→3T*→Ln* процесса сенсибилизации и (III) эффективности люминесценции иона металла, влияющей на время жизни излучения [9].
4. Комплексы неодима, иттербия и эрбия с 8-гидроксихинолином
В настоящее время используют бидентатные и полидентатные комплексы на основе хинолина (рис.5).

Рис.5. Некоторые производные хинолина, используемые для подготовки люминесцентных комплексов с ионами лантанидов.
Ранее предполагалось, что гидроксихинолин с трехвалентным металлом образует трис-хелатную октаэдрическую структуру LnQ3. Однако в дальнейшем появились предположения об иной стехиометрии комплексов с 8-гидроксихинолином (HQ) и его производных. В результате синтеза, основанного на добавлении этанольного раствора HQ к раствору нитрата лантанида в воде, получают продукт, который осаждается после добавления небольшого избытка раствора аммиака, и соответствует соотношению металл-лиганд как 1:3.
В дальнейшем было показано, что в результате реакции получаются смеси различных комплексов, вместо одного продукта. Например, один из полученных комплексов содержит три иона лантаноидов, перекрытых Q лигандами («тримерные» комплексы общей формулой Ln3Q8+). Он и является преобладающим продуктом при использовании 8-гидроксихинолина и 5-хлор-8-гидроксихинолина в качестве лигандов. Также, вместо них, используют лиганды 5,7-дигалоген-гидроксихинолина (H5, 7XQ, X = Cl, Br, I). В результате получается смесь димерных трис [Ln(5,7XQ)3(H2O)2]2 (состоит из двух трис комплексов, связаных водородными связями) и тетракис (NH4[Ln(5,7XQ)4]) комплексов в соотношении металл-лиганд как 1:3 и 1:4 соответственно. Данное соотношение было получено применением различных путей синтеза, при добавлении ацетата аммония и избытка лиганда в ацетоне к раствору хлорида лантаноида (Рис 6) .
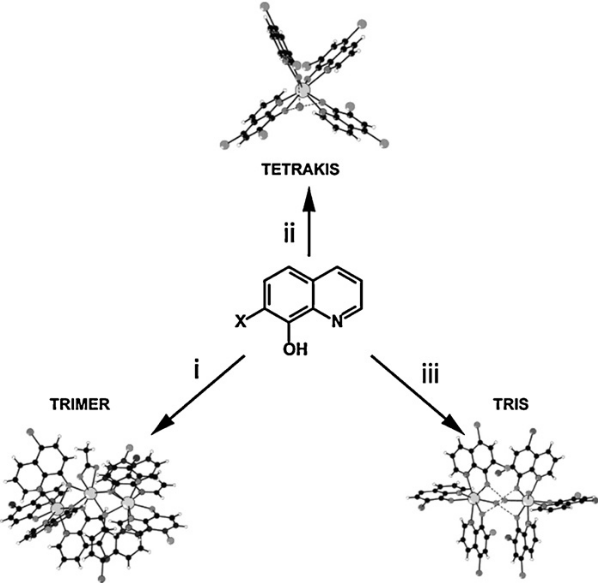
Рис.6. Схема синтеза для получения комплексов лантаноидов с гидроксихинолином: (I)"тримерные" виды формируются только тогда, когда X = H, при отсутствии небольших катионов. (II) тетракис виды могут быть сформированы, когда X = H или галоген. Противоионы Na+ дают чистый вид. NH4+ дает смесь. (III) Трис виды формируются Х = галоген и с наименьшим количеством катионов, насколько это возможно.
Были проведены исследования по приготовлению и характеристике соединений лантаноидов (Er, Yb, Nd,) с HQ и H5,7XQ (X = Cl, Br) лигандами (рис. 5 (1)). В результате этих исследований, были отделены безводные, нейтральные и чистые продукты, пригодные для переработки в оптических устройствах, четко определенными методами синтеза. В зависимости от условий реакции, были получены три разных вида нейтральных комплексов эрбия с высокими выходами, как это кратко в (рис. 7) [10].

Рис.7. Реакционная схема соли эрбия с лигандами гидроксихинолина.
Видимо небольшие различия в условиях реакции производят различные продукты: (I) безводный, "чистый" трехъядерный комплекс Er3Q9 получается, когда Q – незамещенный лиганд, депротонированный NH3 либо в воде, либо смеси этанол/вода; (II) трис-димерных комплексов, где мононуклеарный блок состоит из [Er(5,7XQ)3(H2O)2] [X = Cl и Br], где ион восьмикоординирован тремя депротонированными лигандами и двумя молекулами воды, полученными тем же методом, что и (I); (III) тетракис мононуклеарные комплексы [Er(5,7XQ)2(H5,7XQ)2Cl] [X = Cl и Br], где депротонированы только два из четырех скоординированных лигандов, получают путем смешивания хлорида эрбия с H5,7XQ в органических растворителях (CH3CN/CH3OH 4:1) без добавления основания. Различное поведение гидроксихинолина и 5,7-галогензамещенной позволяет описать электронные и стерические эффекты, вызванные наличием галогензаместителей в феноксидном кольце [11].
Как показано, трехядерные и трис типы достигаются октакоординацией вокруг иона лантанида, в то время как тетракис комплексы принимают довольно необычное координационное число 7 (координация обеспечивается двумя бис-хелатными, двумя монодентатными лигандами и одним хлоридом). Структурный признак показывает, что в трехъядерной молекуле Er3Q9 каждый металл представляет собой искаженную анти-призматическую геометрию с двумя внешними металлами, соединенными четырьмя атомами азота и четырьмя атомами кислорода. В то время как внутренний эрбий координируется азотом и семью атомами кислорода. Способность Q выступать в качестве мостикового лиганда позволяет ионам эрбия достичь предпочтительного координационного числа 8, также в присутствии только трех молекул лиганда на ион. Результаты спектроскопии и данные масс-электроскопии (ESI) Er3Q9 в растворе показывают, что трехъядерная структура сохраняется в растворе.
С другой стороны, образование мононуклеарных трис видов вместо трехядерных комплексов при использовании дигалоген - замещенных лигандов 8-гидроксихинолина является следствием стерических затруднений из-за атома галогена в 7 положении гидроксихинолинового кольца, которое предотвращает переходный механизм.
Тетракис комплексы, где два лиганда в анионной форме, а остальные являются "цвиттер-ионными" (рис. 8), были полученные в отсутствии основания, благодаря повышенной кислотности дигалоген - замещенных 8-гидроксихинолинов (в связи с наличием электроноакцепторных групп особенно в 5-положении фенокси-кольца) по отношению к некоторой незамещенной, так, чтобы частичное депротонирование лиганда происходило немедленно при добавлении соли Er3+. Можно предположить, что формирование "цвиттер-ионных" комплексов из реакционной смеси в нейтральных условиях подвергается конкурентоспособному прототропному равновесию между различными формами хинолина (рис. 8), сильно зависящими от присутствия ионов металлов. Эти равновесия включают как хинолиниум (H25,7XQ+) и хинолинат (5,7XQ-) ионы вместе с цвиттер-ионной формой лиганда, хотя кислый характер иона лантанида, вероятно, сдвигает равновесие к протонированной форме. Таутомерная перегруппировка нейтрального хинолина в комплексе, вероятно, предпочтительней из-за сильной кислоты Льюиса Ln3+ для анионного донора атомов кислорода [12].

Рис.8. Структура тетракис комплекса [Er(5,7CLQ)2(Н5,7ClQ)2Cl] [57], когда два лиганда в анионной форме и два в виде цвиттер-ионов. Пунктирная линия показывает водородную связь.
Аналогично реакциям, описанным на рис. 7, были получены соответствующие комплексы гидроксихинолина с Nd3+ и Yb3+. Соединения, полученные в воде, а именно трехъядерный и трис-комплексы, были отделены как чистые продукты с высокими выходами. Привлекает внимание то, что тетракис комплексы неодима, а также других металлов, относящихся к первой половине ряда лантаноидов (Ce-Eu) не были получены. Тетракис комплексы можно получить, только начиная с середины ряда, с иона Gd3+, находящегося на границе между «легкими» и "тяжелыми" лантаноидами. Такое поведение описывает эффект "лантаноидного сокращения". На самом деле ионы лантаноидов в первой половине ряда имеют большие ионные радиусы и предпочитают координационное число выше, чем 7, которые содержатся в тетракис комплексах.
Вскоре, после доказательства существования "чистой" трехъядерной структуры 8-хинолинолата Ln3+, сообщили о синтезе и структурных характеристиках Ho3Q9·HQ, который изоструктурен Er3Q9. Методика проведения синтеза для получения данного соединения удивительно отличалась от тех, которые описаны выше, взаимодействием 8-гидроксихинолина с металлическим гольмием в присутствии металлического стронция и металлической ртути при 190◦C в вакууме в потоке 1,3,5-три-трет-бутилбензола (рис. 9).

Рис.9. Синтез соединения Ho3Q9 · HQ.
Этот псевдо-твердый метод синтеза, на основе прямой реакции металлов в основном состоянии с лигандом HQ при повышенной температуре в присутствии инертного потока, также был применен для получения гетеробиметаллических комплексов Ln2CaQ8 (Ln = Nd, Eu) и LaCo2Q7. Похожей трехъядерной структурой лантаноидов / щелочноземельных гетеробиметаллических комплексов с лигандом H2MeQ, и общей формулой [Ln2Mg (2MeQ)8] (Ln = Eu, Gd, Tb, Er), полученных перегруппировкой между двумя 2MeQ-комплексами Ln3 + и Mg2 + при 200 - 300°C в потоке 1,2,4,5-тетраметилбензола (TMБ). Однако, при использовании этого метода синтеза, образуются побочные продукты, т.к. синтез тяжело контролировать [13].
