
MolBiol_sivolob
.pdf
Сиволоб А.В. Молекулярна біологія
Функціональне значення кепу є багатоплановим:
•Захист 5'-кінця від деградації: особливість зв'язку між пер-
шими двома нуклеотидами робить цей зв'язок непомітним для екзонуклеаз.
•Участь в інших реакціях процесингу: СВС стимулює сплайсинг першого інтрона та поліаденілування 3'-кінця (див. нижче).
•Транспорт мРНК у цитоплазму здійснюється завдяки взає-
модії СВС з ядерною порою: саме своїм 5'-кінцем мРНК виштовхується в цитоплазматичний простір.
•Ініціація трансляції: саме кеп є первинною точкою збирання рибосоми та інших елементів ініціації білкового синтезу (розділ 8).
Сплайсинг
Узагальнену схему інтрона зображено на рис. 7.3. На кінцях переважної більшості інтронів розташовані стандартні динуклеотиди GU та AG, що містяться у складі певних консенсусних послідовностей. Ближче до 3'-кінця, перед піримидинзбагаченим треком довжиною ~15 нуклеотидів існує ще один консенсус, до складу якого обов'язково входить аденіновий нуклеотид. Цей А є точкою розгалуження (branch point), яка виконує особливу роль.
5'-сплайс сайт |
Y-збагачений |
3'-сплайс сайт |
трек |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5' |
Y A G |
|
G U R A G U |
C U R |
A |
Y |
Y A G |
N |
3' |
|
5'-екзон |
|
інтрон |
|
|
|
|
|
3'-екзон |
||
|
|
|
|
|
|
|||||
|
|
|
|
Точка |
|
|
|
|||
|
|
|
|
розгалуження |
|
|||||
Рис. 7.3. Узагальнена схема послідовності нуклеотидів інтрона
Сплайсинг інтрона полягає у двох послідовних хімічних реакціях трансестерифікації (заміни одного фосфодіефірного зв'язку на інший), які показано на рис. 7.4.
1. Аденіновий нуклеотид у точці розгалуження має підвищену реакційну здатність (унаслідок особливостей просторової структури інтрона, які розглядатимуться нижче). 2'-ОН група його рибози здійснює
204

Розділ 7. Процесинг еукаріотичних МРНК
нуклеофільну атаку фосфату в 5'-сплайс сайті – на межі між лівим екзоном та інтроном. У результаті зв'язок між цим фосфатом і 3'-кінцевим нуклеотидом екзона замінюється на зв'язок між фосфатом і 2'-ОН групою аденінового нуклеотиду – у 5'-кінцевій частині інтрона утворюється так зване ласо (lariat).
2. ОН-група, що залишилася на 3'-кінці першого екзона атакує фосфодіефірний зв'язок у 3'-сплайс-сайті. Цей зв'язок розривається, замінюючись на зв'язок між двома екзонами.
5'-екзон |
|
A |
|
|
3'-екзон |
|||
2' |
|
OH |
||||||
|
pGU |
|
|
AGp |
|
|||
|
|
p |
|
p |
|
|
||
|
|
|
|
|
||||
|
|
|||||||
|
A |
pGU |
|
|
|
|
2' |
|
|
AGp |
|
||
|
|
|
||||
|
OH p |
|
p |
|
|
|
|
|
|
|
|||
|
|
|||||
A AG-OH
Рис. 7.4. Дві стадії сплайсингу
Оскільки кількість фосфодіефірних зв'язків не змінюється, реакція трансестерифікації є ізоенергетичною і не потребує АТР як джерела енергії. Але безумовно, обидві реакції сплайсингу потребують каталізу, і, на відміну від інших реакцій, що розглядалися досі, каталіза-
торами сплайсингу не виступають білкові ферменти.
Сплайсосома: механізм сплайсингу
Обидві реакції сплайсингу здійснюються у складі спеціальної мультимолекулярної структури – сплайсосоми (spliceosome), яка зв'язана з CTD
іутворюється на кожному інтроні за участю самої пре-мРНК, білків
іособливих молекул маленьких ядерних РНК (small nuclear RNA, snRNA).
205

Сиволоб А.В. Молекулярна біологія
Маленькі ядерні РНК, які синтезуються РНК-полімеразою ІІ на відповідних генах, згрупованих у кластери, відіграють ключову роль
у визначенні просторової структури, формуванні та функціонуванні сплайсосоми. У сплайсингу беруть участь п'ять типів маленьких ядерних РНК (довжиною 100–200 нуклеотидів): U1, U2, U4, U5 та U6.
Маленькі ядерні РНК, які існують у клітині у вигляді комплексів зі специфічними білками, мають певну просторову структуру за рахунок утворення комплементарних подвійних спіралей – шпильок. Завдяки комплементарному спарюванню з консенсусними послідовностями інтрона відбувається їхня взаємодія з пре-мРНК та іншими маленькими ядерними РНК. Наприклад, РНК U2 впізнає консенсус у зоні розгалу-
ження, причому згаданий аденіновий нуклеотид залишається неспа-
реним – “випетльовуюється” між сусідніми парами основ (рис. 7.5). Саме ця обставина визначає його особливий конформаційно-напруже- ний стан і, як наслідок, підвищену реакційну здатність.
Оскільки подвійні спіралі РНК у сплайсосомі короткі, вони потребують додаткової стабілізації. Крім того, під час збирання та функціонування сплайсосоми певні спіралі мають бути зруйновані й замінені на інші. Обидві операції забезпечуються білками сплайсосоми. Отже,
роль білків сплайсосоми зводиться до:
•розкручування подвійних спіралей РНК АТР-залежними геліказами;
•стабілізації подвійних спіралей і загальної просторової структури сплайсосоми білками зі специфічною спорідненістю до РНК;
•регуляції сплайсингу – блокування чи підсилення ефективності збирання сплайсосоми на даному інтроні білками-регулято-
рами сплайсингу (SR, Splicing Regulators).
U2
3'
|
A-U-G-A-U-G |
5' |
|
||||||
|
|
|
|
|
|
|
|
|
|
5' |
U-A-C-U-A C |
|
3' |
||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
Точка |
A |
Інтрон |
|||||
|
|
|
|
|
|
|
|||
|
|
розгалуження |
|
|
|||||
Рис. 7.5. Схема структури маленької ядерної РНК U2 у комплексі з зоною розгалуження інтрона
206

Розділ 7. Процесинг еукаріотичних МРНК
Загальний сценарій збирання та роботи сплайсосоми схематич-
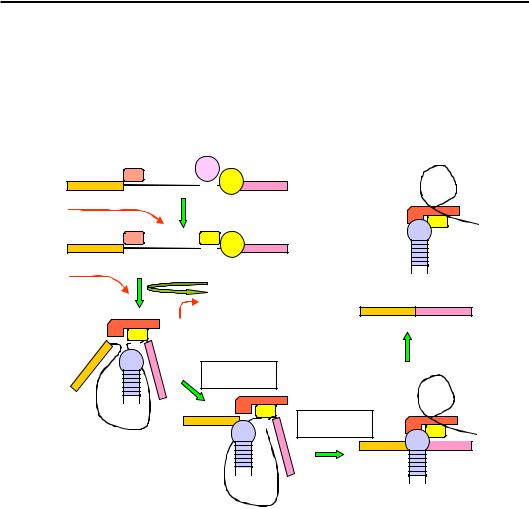
но зображено на рис. 7.6. Після синтезу 5'-кінцевої зони інтрона, вона впізнається маленькою ядерною РНК U1 за рахунок комплементарного спарювання між U1 і 5'-сплайс сайтом (U1 при цьому зв'язана з відповідними білками). Далі в міру синтезу пре-мРНК зона розгалуження впізнається специфічним білком ВВР (Branch point Binding Protein, позначається також як SF1 у ссавців). 3'-Кінцева зона інтрона та Y-збагачений трек упізнаються допоміжним білком U2АF (U2 Auxiliary Factor), який далі сприяє заміні ВВР на РНК U2. Зв'язування U2 (яке, власне, визначає точку розгалуження, див. рис. 7.5) потребує АТР-залежного руйнування певних подвійних спіралей у складі цієї молекули. На наступних стадіях збирання та перебудов сплайсосоми (рис. 7.6) також відбувається АТР-залежне руйнування частини подвійних спіралей і заміна їх іншими.
Після зв'язування U2, на завершальному етапі збирання, з інтроном взаємодіє потрійний комплекс U4-U5-U6: U4 при цьому звільнюється, а U6 витісняє U1, взаємодіючи з 5'-кінцевою зоною інтрона. Крім того, U6 взаємодіє з U2, сприяючи наближенню 5'-сплайс-сайта до точки розгалуження. Додатково структура стабілізується маленькою ядерною РНК U5, яка взаємодіє з 3'-кінцем першого екзона та іншими елементами сплайсосоми.
Після формування сплайсосоми здійснюється її структурна перебудова (АТР-залежне розплітання частини подвійних спіралей геліказами), результатом якої є безпосереднє наближення 5'-сплайс сайта до точки розгалуження: виникають умови для першої реакції трансестерифікації з утворенням ласо (див. також рис. 7.4). Хімічна перебудова інтрона викликає нову перебудову просторової структури сплайсосоми: за рахунок одночасної взаємодії з U5 наближуються один до одного кінці екзонів, що створює умови для другої трансестерифікації. На останньому етапі від двох уже з'єднаних екзонів АТР-залежним шляхом (порушення комплементарних взаємодій) видаляється комплекс інтрона з маленькими ядерними РНК.
Отже, сплайсосома працює як АТР-залежна молекулярна машина. Структурні перебудови машини забезпечують перегрупування елементів – субстратів реакцій сплайсингу. Каталіз обох реакцій сплайсингу здійснюється молекулами РНК. Механізм каталізу є таким самим, як для білкових ферментів (див. розділ 2). Наприклад, для першої реакції активний центр формується зоною розгалуження інтрона й маленькими ядерними РНК U2 та U6. Просторова структура активного центру жорстко утримує субстрати – 5'-сплайс сайт і точку розгалу-
207
Сиволоб А.В. Молекулярна біологія
ження – у певній взаємній орієнтації та забезпечує підвищену реакційну здатність аденінового нуклеотиду, який можна розглядати одночасно і як субстрат у збудженому проміжному стані, і як компонент активного центру. У хлоропластах сплайсинг відбувається за механізмом так званого самосплайсингу (self-splicing), тобто без участі білків і маленьких РНК: мРНК сама набуває просторової структури, яка має каталітичну активність щодо власного сплайсингу.
Екзон 1 U1 |
BBP |
U2AF |
Екзон 2 |
|
5' |
A |
3' |
|
|
АТР |
|
|
U6 |
U2 |
U1 |
U2 |
|
U5 |
|
U2AF |
|
|
||
|
A |
|
|
АТР
U6 U2
A
U5
U6•U4•U5
U1, U4
АТР
АТР
Реакція 1
АТР |
U6 |
U2 |
Реакція 2 |
U6 U2 |
|
U5 |
A |
||
|
|
|
|
|
|
|
|
|
U5 |
АТР
Рис. 7.6. Схема збирання сплайсосоми та її функціонування
За аналогією з білковими ензимами, молекули РНК, які мають каталітичну активність, називають рибозимами. Одним із таких рибозимів є сплайсосома. Зазвичай каталітична активність рибозима (як і у випадку сплайсосоми) залежить від білків, які виконують допоміжні функції, стабілізуючи структуру активного центру. Вважається, що на ранніх етапах добіологічної еволюції головними (або єдиними) біологічними макромолекулами були молекули РНК (так званий РНК-світ), оскільки це єдиний тип макромолекул, що можуть одночасно виконувати роль носіїв спадкової інформації та виступати каталізаторами.
208

Розділ 7. Процесинг еукаріотичних МРНК
Пізніше більш стабільні молекули ДНК перебрали на себе роль носіїв інформації, а різноманітніші за просторовою структурою білки – роль каталізаторів. Але в кількох важливих випадках (і сплайсинг – не єдиний приклад) рибозими виявилися еволюційно консервативними.
Сплайсосоми утворюються на інтронах пре-мРНК (і на CTD РНК-полімерази) послідовно під час транскрипції – майже відразу після синтезу сплайс-сайтів вони впізнаються відповідними елементами (рис. 7.7). При цьому СВС, що зв'язаний з кепом, підсилює ефективність зв'язування U1 у першому 5'-сплайс-сайті – напевно, шляхом прямої взаємодії; вплив СВС на сплайсинг наступних інтронів послаблюється.
CBC |
U2AF |
Екзон 2 |
Екзон 1 |
||
U1 |
U2 |
U1 |
Екзон 1 Екзон 2 |
U2AF Екзон 3 |
|
U1 |
U2 |
U1 |
Рис. 7.7. Послідовне збирання сплайсосом на інтронах під час транскрипції
Швидкість збирання сплайсосом визначається швидкістю транскрипції. З іншого боку, зі сплайсосомою взаємодіють фактори елонгації транскрипції – наявність сплайс-сайта сприяє прискоренню руху полімерази. Такий процес синтезу РНК та її сплайсингу продовжується до того моменту, поки у складі пре-РНК не з'являється специфічна послідовність – сигнал термінації.
Поліаденілування мРНК і термінація транскрипції
Сигнал термінації транскрипції та поліаденілування (так званий polyA-сигнал) складається з двох елементів послідовності: консенсус AAUAAA і розташована в ~20 нуклеотидах нижче від нього U- або G/U-збагачена послідовність (рис. 7.8). Перший елемент упізнається гетеротетрамерним білком CPSF (Cleavage-Polyadenylation Specificity
209
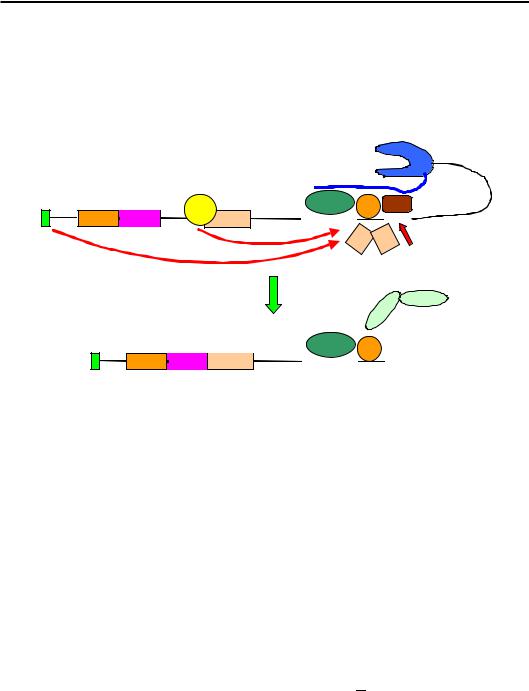
Сиволоб А.В. Молекулярна біологія
Factor). Три із чотирьох субодиниць фактора є компонентами базального фактора транскрипції TFIID – вони переносяться на CTD після ініціації, і далі полімераза несе їх на собі, доки вони не зустрінуть сигнал. Другий елемент polyA-сигналу впізнається фактором розрізання РНК СstF (Cleavage stimulation Factor). Взаємодія обох факторів з РНК є кооперативною – вони підсилюють зв'язування одне одного.
CBC Екзон 1 Екзон 2 |
U2AF |
Екзон 3 |
CPSF |
PAP |
CstF |
|
|
AAUAAA |
G/U |
||
|
|
|
|
CF 1
|
2 |
F |
|
C |
|
Розріз
|
|
|
P |
PABP |
|
|
|
|
AAAAA |
|
|
|
|
B |
|
||
|
A |
A |
|
A |
|
|
P |
|
|
||
|
A |
|
|
A |
|
CPSF |
|
|
|
|
A |
PAP |
|
|
|
A |
|
AAUAAA |
|
|
AAAAAA |
||
|
|
|
|||
Рис. 7.8. Впізнання polyA-сигналу та поліаденілування мРНК
Після первинного впізнання polyA-сигналу, поки РНК-полімераза продовжує синтез РНК за сигналом (до 1000 нуклеотидів), до мультибілкового комплексу, що збирається на polyA-сигналі, долучаються polyA-полімераза (РАР), ще два фактори розрізання (Сleavage Factors) CF 1 і 2 та, можливо, інші білки. Збирання комплексу стимулюється зв'язаним з кепом СВС, а також сплайсосомою на останньому інтроні – сплайсинг останнього інтрона та розрізання / поліаденілування РНК здійснюються одночасно і стимулюють одне одного. Зокрема, білок U2AF, який знаходиться на останньому інтроні, взаємодіє з РАР.
У межах другого елемента послідовності polyA-сигналу знаходиться консервативний динуклеотид СА, в якому й відбувається розрізання (сleavage) РНК. Від якої конкретно активності залежить це розрізання, залишається невідомим. До 3'-кінця, що виник внаслідок розрізу, РАР (за стимулюючої дії CPSF) приєднує один за одним 100–200 аденінових нуклеотидів. З polyA-хвостом, що зростає, відразу зв'язується специфічний білок РАВР (PolyA Binding Protein), який підвищує процесивність РАР (рис. 7.8).
210
Розділ 7. Процесинг еукаріотичних МРНК
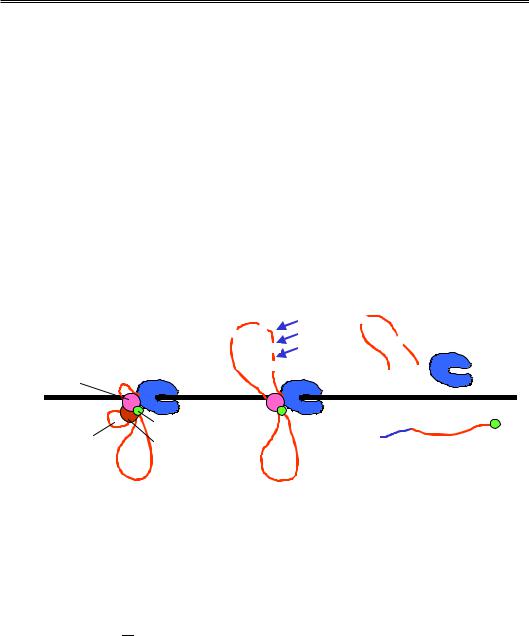
Розрізання / поліаденілування РНК є тригером термінації транскрипції (рис. 7.9). Напевно, упізнання polyA-сигналу та розрізання / поліаденілування факторами, зв'язаними з РНК-полімеразою, індукує конформаційні зміни в полімеразному комплексі, які приводять до зниження спорідненості полімерази до ДНК та / або транскрипту. Крім того, процес розрізання та поліаденілування синхронізовані з так званою котранскрипційною деградацією РНК нуклеазами нижче від polyA-сигналу. Механізми активації такої деградації не з'ясовані, але швидке руйнування транскрипту має стимулювати дисоціацію полімеразного комплексу. Термінація транскрипції іноді потребує також інших регуляторних елементів послідовності. Одні з них можуть знаходитись у межах останнього інтрона та стимулювати / блокувати впізнання polyA-сигналу, інші – нижче від polyA-сигналу й зумовлювати паузи в роботі полімерази, які сприяють термінації.
|
|
Контранскрипційна |
|
|
деградація |
Комплекс на |
RNAP |
|
polyA-сигналі |
|
|
Останній |
CBC |
polyA |
|
||
інтрон |
Сплайсосома |
|
|
|
Рис. 7.9. Синхронізація поліаденілування і термінації транскрипції
Узагальнену схему будови зрілої еукаріотичної мРНК, яка звільняється з полімеразного комплексу, транспортується в цитоплазму і використовується як матриця для білкового синтезу, зображено на рис. 7.10. Між кепом і початком кодуючої ділянки (стартовим кодоном – найчастіше AUG) розташована 5'-кінцева зона, що не транслюється (5' UTR – UnTranslated Region). За кодуючою ділянкою, що закінчується одним із стоп-кодонів, і перед polyA-послідовністю розташована 3'-кінцева зона, що не піддається трансляції. Обидві зони, що не транслюються, містять важливі елементи послідовності, які використовуються для регуляції білкового синтезу (розділ 8).
211

Сиволоб А.В. Молекулярна біологія
Кеп |
Кодуюча ділянка |
|
5‘ UTR |
AUG |
UAA 3‘ UTR polyA |
Рис. 7.10. Схема будови мРНК
Майже єдиним винятком серед інших еукаріотичних мРНК є гістонові мРНК, які не піддаються сплайсингу (гістонові гени не містять інтронів) і поліаденілуванню 3'-кінця. Термінація транскрипції гістонових генів залежить від двох сигнальних елементів послідовності РНК: один утворює шпильку (як у прокаріотів, див. розділ 5), інший спарюється з маленькою ядерною РНК U7; між цими елементами індукується розріз. Аналогічно відбувається термінація транскрипції маленьких ядерних РНК, які також не піддаються поліаденілуванню.
Альтернативний сплайсинг
Пре-мРНК, що синтезується під час транскрипції, може піддаватися сплайсингу та поліаденілуванню різними альтернативними шляхами: кілька екзонів на початку чи всередині гена можуть вирізатися з транскрипту, останній може обрізатися та піддаватися поліаденілуванню за рахунок використання polyA-сигналу всередині одного з інтронів тощо. У результаті утворюються різні молекули мРНК, що містять різні набори екзонів і, відповідно, кодують різні білки. Багатокомпонентність (і необхідність кооперації між компонентами) сплайсосоми та системи розрізання / поліаденілування дозволяє здійснювати тонку регуляцію утворення мРНК певного типу за рахунок зміни транскрипційної активності генів, що кодують ті чи інші компоненти машинерії процесингу, зміни концентрацій компонентів, їхньої хімічної модифікації.
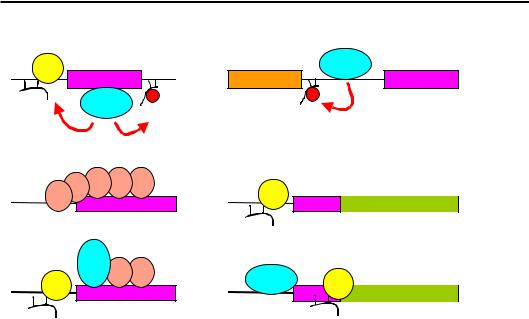
Ключова роль у визначенні шляху сплайсингу належить білкамрегуляторам сплайсингу (SR). Досить часто регулятор специфічно зв'язується з певною послідовністю нуклеотидів усередині екзона та стимулює впізнання сплайс-сайтів по обидва боки від нього (рис. 7.11, а). Зрозуміло, що в разі відсутності регулятора такий екзон буде вирізано разом з інтронами, що його фланкують.
212
Розділ 7. Процесинг еукаріотичних МРНК
U2AF |
екзон |
|
а |
екзон |
SR |
г |
|
|
|
|
екзон |
||
U2 |
SR |
|
U1 |
|
U1 |
|
|
|
|
|
|||
|
|
SR |
б |
U2AF |
|
д |
|
|
|
|
|
|
|
|
|
|
|
U2 |
|
|
|
SR |
SR |
в |
SR |
U2AF |
е |
U2AF |
|
|
|
|
||
|
|
|
|
|
||
U2 |
|
|
|
|
U2 |
|
Рис. 7.11. Кілька варіантів участі сплайсинг-регуляторів, що зв'язуються всередині екзона (а, б, в) або інтрона (г, д, е),
увизначенні шляху сплайсингу
Увипадку негативної регуляції зв'язування регулятора утруднює впізнання сплайс-сайтів. Наприклад, взаємодія з регулятором ініціюється всередині екзона, молекули білка кооперативно зв'язуються поруч одна
зодною і врешті-решт блокують 3'-сплайс-сайт (рис. 7.11, б). Замість заблокованого сприймається наступний такий сайт, і екзон вирізається
змолекули разом із двома інтронами, що його фланкують. За наявності іншого регулятора, який також упізнає специфічну послідовність в екзоні, процес зростання білкового комплексу зупиняється, і 3'-сплайс- сайт стає вільним для впізнання елементами сплайсосоми (рис. 7.11, в).
Сплайсинг-регулятори можуть також мати сайти |
зв'язування |
в інтронах, впливаючи на ефективність збирання |
сплайсосоми |
(рис. 7.11, г). Регулятор може блокувати, наприклад, 3'-сплайс-сайт: якщо така блокада відсутня, сайт розпізнається (рис. 7.11, д), за наявності регулятора сприймається інший 3'-сплайс-сайт усередині екзона – у складі мРНК залишається скорочений екзон (рис. 7.11, е).
Вибір шляху утворення кінцевого мРНК-продукту часто залежить також від альтернативного вибору polyA-сигналів, які можуть бути присутніми не лише нижче останнього екзона, а й усередині інтронів.
213
