
MolBiol_sivolob
.pdf
Розділ 6. Транскрипція: Еукаріоти
Це забезпечує динамізм активації: енхансосома не є фіксованою, а збирається / розбирається в певні моменти.
Активаційні домени ТФ і коактиватори мають, у свою чергу, спорідненість до медіатору та базальних факторів транскрипції. Результатом такої взаємодії є ефективне збирання преініціаторного комплексу на базальному промоторі (рис. 6.12). Слід зауважити, що певні компоненти мультибілкових комплексів, які збираються на промоторах, можуть, навпаки, блокувати ініціацію транскрипції – тоді їх називають репресорами та корепресорами.
|
Енхансер |
|
|
Проксимальні |
|
|
Кодуюча |
|
|
|
|
|
елементи |
ТАТА |
ділянка |
|
|||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|



 Активатори
Активатори
AD AD AD AD AD |
|
|
+ |
TFIIB TFIID |
|
|
||
Коактиватори |
TFIIA |
|
TFIIE |
||
|
RNAPII
TFIIF |
TFIIH |
Енхансер |
Медіатор |
|
Проксимальні
елементи
Рис. 6.12. Схема збирання комплексу активації транскрипції
Зовнішня регуляція активності транскрипційних факторів
Активність певного гена залежить від наявності у клітині певного набору активаторів / репресорів транскрипції. Відповідно, гени самих факторів транскрипції перебувають під контролем складних систем регуляції, що працюють під час розвитку та диференціації клітин. У результаті в клітині певного типу відбувається синтез специфічного
173
Сиволоб А.В. Молекулярна біологія
набору ТФ, що призводить до активації специфічного набору генів.
Утой же час, експресія певного гена може оперативно контролюватися у відповідь на зовнішні сигнали шляхом зміни активності вже синтезованих транскрипційних факторів. Два найважливіші механізми такої регуляції – взаємодія ТФ певного типу зі стероїдними гормонами та каскади посттрансляційних модифікацій у відповідь на дію хімічних сигналів (сигнальна трансдукція).
Гормонові рецептори – транскрипційні фактори, активність яких залежить від стероїдних гормонів. Гормоновий рецептор (зазвичай гомодимер) складається з трьох структурних доменів: 1) ДНК-зв'язуваль- ний домен, що має специфічну спорідненість до певних елементів послідовності ДНК (див. рис. 3.14, б); 2) активаційний домен; 3) гормонзв'язувальний домен. У відсутності гормону білок міститься в цитоплазмі, де гормон-зв'язувальний домен взаємодіє з білком теплового шоку hsp90 (розділ 8), який підтримує недоструктурований стан домену.
Урезультаті гормоновий рецептор є інактивованим (рис. 6.13).
гормон |
Цитоплазма |
|
AD |
hsp90 |
Ядро |
|
HBD |
|
|
DBD |
|
Рис. 6.13. Активація гормонового рецептора стероїдним гормоном. AD – активаційний, DBD – ДНК-зв'язувальний,
HBD – гормон-зв'язувальний домени.
Коли гормон проникає в цитоплазму, він взаємодіє з гормонзв'язувальним доменом, витісняючи hsp90, відбувається остаточне структурування гормонового рецептора, і той стає активним – прямує до ядра, де зв'язується зі специфічним елементом послідовності. Сайт
174
Розділ 6. Транскрипція: Еукаріоти
зв'язування гормонового рецептора є досить маленьким, а чим коротшою є довжина сайта зв'язування, тим імовірнішою є його доступність. Тому взаємодія гормонового рецептора з ДНК часто запускає каскад збирання енхансосоми: рецептор рекрутує інші транскрипційні фактори за рахунок свого активаційного домену.
Сигнальна трансдукція. Приклад сигнальної трансдукції наведено на рис. 6.14. Білковий гормон не проникає у клітину, а зв'язується рецептором на зовнішньому боці мембрани. Рецептор є гомодимером, і у відсутності гормону дві субодиниці вільно дифундують у площині мембрани. Зв'язування гормону викликає димеризацію, унаслідок чого в цитоплазматичної частини рецептора виникає кіназна активність. Кіназа фосфорилює неактивні субодиниці транскрипційного фактора. Після фосфорилювання субодиниці об'єднуються в димер, що й активує цей фактор: він проникає в ядро, де знаходить специфічну послідовність ДНК. Наведена схема є найпростішим варіантом сигнальної трансдукції: часто примембранна кіназа запускає каскад фосфорилювання – фосфорилює білок, який набуває внаслідок цього кіназної активності, ця нова кіназа фосфорилює інший білок (або кілька різних білків, завдяки чому здійснюється підсилення сигналу та / або його розгалуження по кількох шляхах, спрямованих до кількох кінцевих мішеней), перетворюючи його на кіназу, і так далі – до фосфорилювання та, відповідно, активації транскрипційного фактора.
білковий |
Цитоплазма |
|
|
|
|
||
гормон |
|
Ядро |
|
|
|
||
Р |
Р |
Р |
|
Р |
|||
|
|||
|
|
 кіназа рецептор
кіназа рецептор
Неактивний
мономер
Рис. 6.14. Активація транскрипційного фактора у відповідь на дію білкового гормону
175

Сиволоб А.В. Молекулярна біологія
Ацетилювання гістонів
Нуклеосоми та хроматинова фібрила в цілому виступають як загальний репресор генної активності. Тим самим вони допомагають забезпечити загальну інактивацію більшості генів в еукаріотичній клітині, за винятком тих, чия активація здійснюється за участю ТФ. Ключовим моментом механізмів активації є підвищення доступності регуляторних сайтів у складі промоторів, що забезпечується, зокрема, специфічними модифікаціями гістонових хвостів (див. розділ 4). Специфічна картина (патерн) модифікацій відіграє також і зворотну роль
– у здійсненні гарантованої репресії гетерохроматинових ділянок. Серед інших модифікацій ацетилювання залишків Lys (у певних
консервативних позиціях, див. рис. 4.13) майже завжди корелює з активацією транскрипції – ацетильовані гістон-ацетилтрансфера- зами гістони акумулюються в активних промоторах, і навпаки – дія гістон-деацетилаз призводить до інактивації. Гістон-ацетилтранс- ферази (НАТ) входять до складу мультибілкових комплексів, які часто є компонентами енхансосом. НАТ-комплекси можуть рекрутуватися до промоторів транскрипційними факторами чи кофакторами (наприклад, активаційним доменом гормонового рецептора). Зв'язування НАТ може індукуватися іншими гістоновими модифікаціями, скажімо, через впізнання фосфорильованого Ser10 гістону Н3. Крім того, часто до складу НАТ входять бромодомени – структурні модулі, які мають специфічну спорідненість до ацетильованих лізинів. Тобто НАТ упізнають Lys, уже ацетильовані іншими НАТ, і здійснюють ацетилювання сусідніх нуклеосом, підтримуючи таким чином ацетильований статус певної ділянки хроматину.
Механізми головних впливів ацетилювання гістонів на структуру хроматину та активацію транскрипції полягають у наступному:
•Ацетилювання сприяє деконденсації хроматинової фібрили за рахунок зниження позитивного заряду головних факторів конденсації, якими є гістонові хвости. У результаті знижуєть-
ся спорідненість ацетильованих нуклеосом до гістону Н1, що далі сприяє деконденсації фібрили. Розгортання фібрили й тимчасова дисоціація Н1 створює “вікно можливості” для зв’язування регуляторних факторів на виході ДНК з нуклеосоми та з міжнуклеосомною лінкерною ДНК.
•Хоча ацетилювання гістонів не змінює структуру нуклеосоми, зниження позитивного заряду гістонових хвостів при-
176
Розділ 6. Транскрипція: Еукаріоти
зводить до дестабілізації нуклеосоми на виході з неї нуклеосомної ДНК за рахунок підвищення електростатичного розштовхування між сусідніми витками нуклеосомної суперспіралі (див. розділ 4). У результаті полегшується тимчасове руйнування нуклеосом іншими факторами: перенесення гістонів на проміжні акцептори та робота комплексів ремоделювання хроматину (див. нижче).
•Ацетильовані лізинові залишки гістонів можуть безпосередньо впізнаватися факторами й кофакторами транскрипції.
Так, наявність бромодомену у складі TAFII250 (див. вище) сприяє підвищенню локальної концентрації TFIID у ацетильованих ділянках хроматину.
Доступність промоторів
Залежне від послідовності ДНК переважне позиціювання нуклеосом (розділ 4) призводить до диференційного експонування ділянок ДНК до дії регуляторних факторів. З одного боку, будь-яка послідовність пар основ диктує певний “передустановлений” розподіл нуклеосом. З іншого боку, активація промоторів призводить до їхнього збіднення на нуклеосоми або за рахунок репозиціювання, або внаслідок тимчасового видалення гістонів.
Рисунок 6.15 ілюструє детально досліджений приклад: присутність нуклеосом у промоторі дріжджового гена PHO5, вивчену Корнбергом зі співавторами (Roger D. Kornberg).
0,32 |
0,18 |
0,60 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Регуляторні ТАТА-бокс елементи
Рис. 6.15. Позиції нуклеосом (овали) у промоторі гена РНО5 дріжджів Saccharomyces cerevisiae та рівень їхньої присутності після активації
(числа – частка часу, коли нуклеосома присутня)
У неактивному стані промотор містить 3 нуклеосоми у специфічних позиціях, у межах однієї знаходиться ТАТА-бокс, іншої – специфічна регуляторна послідовність. При активації промотора (цьому передує
177

Сиволоб А.В. Молекулярна біологія
гіперацетилювання гістонів) спостерігається втрата нуклеосом в усіх трьох сайтах, але ця втрата не є повною в жодному з них. У середньому втрачається 1,9 нуклеосоми з трьох; кожна з нуклеосом від 0,18 до 0,6 (специфічно для певної нуклеосоми) частини часу зберігається в активному промоторі. Це означає, що при активації здійснюється певна рівновага між видаленням та реформуванням нуклеосом.
Тимчасове видалення нуклеосом з активних промоторів є загальним правилом. Тотальний аналіз розподілу нуклеосом по ділянках усього геному дріжджів указує, що він є нерівномірним: 1) у міжгенних зонах щільність нуклеосом зменшена порівняно з відкритими рамками зчитування; 2) регуляторні області, зокрема промотори, містять менше нуклеосом, ніж інші міжгенні зони; 3) існує зворотна кореляція між щільністю нуклеосом у промоторах і рівнем транскрипційної активності відповідних генів.
Комплекси ремоделювання хроматину
Підвищення доступності промоторів за їхньої активації потребує спеціальних механізмів. Адже за фізіологічної іонної сили електростатичні взаємодії ДНК і гістонів є дуже міцними, і нуклеосома зберігає високу стабільність. Ця стабільність практично виключає навіть переміщення нуклеосоми вздовж ДНК (слайдинг): таке переміщення потребує появи високоенергетичних інтермедіатів із частковим порушенням взаємодії гістонів із ДНК. Оскільки переміщення нуклеосом є необхідним для експонування регуляторних сайтів на ДНК до дії транскрипційних факторів, у клітині існує спеціальна система, що сприяє репозиціюванню нуклеосом за рахунок індукування проміжних структурних станів: АТРзалежні комплекси ремоделювання хроматину.
На сьогодні описано велику кількість таких комплексів у дріжджів, комах і ссавців. Усі комплекси ремоделювання (КР) – мультибілкові комплекси досить великої молекулярної ваги – містять у своєму складі субодиницю, що має АТРазну активність. Власне АТРазний домен є дуже подібним для усіх комплексів і має високу гомологію з ДНК-геліказами. Залежно від наявності додаткових структурних доменів різного типу
вскладі каталітичної субодиниці, КР поділяють на три основні групи:
1)Swi/Snf (Switch/Sucrose non-fermenting – назва походить від першого описаного КР цієї родини, який було відкрито як групу мутацій дріжджів з певними біохімічними проявами) – комплекси складаються з 10–15 субодиниць, каталітична субодиниця містить бромо-
178

Розділ 6. Транскрипція: Еукаріоти
домен, під час дії комплексу спостерігаються різноманітні проміжні структурні форми нуклеосом.
2)ISWI (Imitation SWItch) – 4–5 субодиниць, індукують слайдинг нуклеосом без масштабних змін їхньої структури;
3)CHD (Chromodomain Helicase DNA binding) – містять хромодомен
і гістон-деацетилазу, тісно пов’язані з перебудовами хроматину в репресованих ділянках.
Крім того, є низка комплексів, що не вкладаються в цю класифікацію. КР здатні здійснювати численні взаємодії з нуклеосомною ДНК, гістоновими хвостами, специфічними та загальними факторами транскрипції, гістон-ацетилтрансферазами тощо. При взаємодії з нуклеосомою КР і нуклеосома чітко орієнтуються відносно одне одного: КР родини Swi/Snf оточують нуклеосому, зв'язуючи її всередині глибокої порожнини.
Основний результат активності всіх комплексів ремоделювання – репозиціювання нуклеосом. Крім того, комплекси родини Swi/Snf можуть індукувати перенесення октамеру гістонів з однієї ділянки ДНК на іншу або з ДНК на проміжні акцептори гістонів (див. розділ 4).
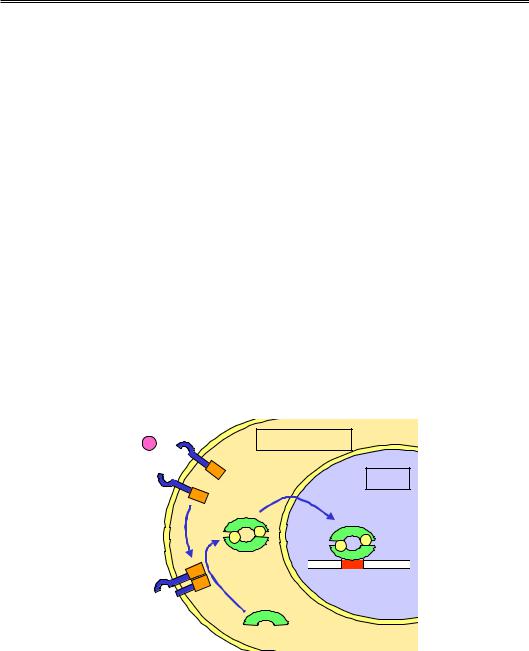
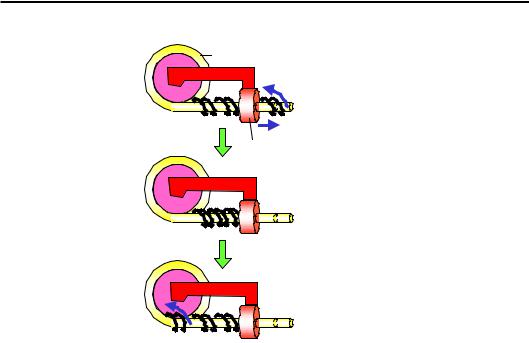
Механізм дії комплексів ремоделювання базується на гомології з ДНК-геліказами. Незважаючи на це, АТРазна субодиниця КР не здатна діяти як геліказа – розводити два ланцюги. Подібно до геліказ, комплекси ремоделювання, використовуючи енергію гідролізу АТР, пересуваються вздовж ДНК, але без її руйнування. Така транслокація має бути пов’язана з одночасним обертанням ферменту навколо подвійної спіралі або навпаки – прокручуванням спіралі через фермент. Оскільки КР при цьому зафіксований на нуклеосомі, тобто взаємне обертання комплексу й нуклеосоми є неможливим, рух комплексу в бік від нуклеосоми буде генерувати торсійну напругу (зміну твіста), штовхаючи додаткові витки подвійної спіралі всередину нуклеосомної ДНК – ДНК прокручується через КР (рис. 6.16). Такий сценарій роботи комплексів ремоделювання розглядається сьогодні як найбільш імовірний.
Напруга, яка створюється за рахунок транслокації комплексу ремоделювання, може трансформуватися в зміну твіста в межах кінцевої ділянки нуклеосомної ДНК. Локальна зміна твіста дифундує всередину нуклеосоми, результатом чого є прокручування подвійної спіралі по поверхні октамеру гістонів, тобто зміна його позиції (рис. 6.17). При такому механізмі переміщення шляхом твістингу (twisting) не повинно спостерігатися великих змін у структурі нуклеосоми під час її пересування. Саме це й характерно для комплексів ремоделювання типу ISWI.
179
Сиволоб А.В. Молекулярна біологія
Нуклеосома
Комплекс
ремоделювання
Рис. 6.16. Модель дії комплексу ремоделювання шляхом створення торсійної напруги в ДНК, яка входить у нуклеосому
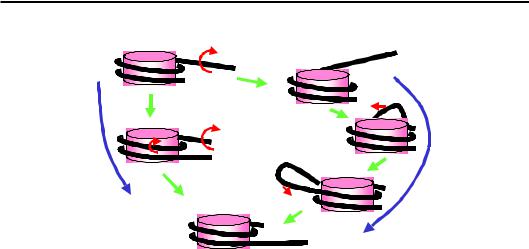
Комплекси ремоделювання родини Swi/Snf здатні генерувати проміжні стани нуклеосоми, в яких ДНК є більш доступною для нуклеаз, за рахунок формування петлі ДНК на поверхні октамеру гістонів. Отже, на відміну від попереднього механізму, для комплексів Swi/Snf напруга, що є результатом транслокації, викликає випетлювання (bulging) нуклеосомної ДНК. Така петля, імовірно, формується на кінцевій ділянці ДНК у нуклеосомі й далі пересувається по поверхні октамеру, що приводить знову до зміни позиції нуклеосоми (рис. 6.17).
Проміжні метастабільні стани нуклеосоми з випетлюванням ДНК можуть відігравати важливу функціональну роль самі по собі, оскільки вже можуть забезпечувати зростання доступності нуклеосомної ДНК: експонування петлі створює умови для її “захоплення” транскрипційними факторами. Крім того, значна дестабілізація ДНКгістонових взаємодій у проміжному стані з випетлюванням значно підвищує імовірність руйнування нуклеосоми: у присутності Swi / Snf продемонстровано перенесення гістонів на іншу ділянку ДНК або на проміжні переносники гістонів.
180
Розділ 6. Транскрипція: Еукаріоти
Твістинг
Випетлювання
Рис. 6.17. Два механізми зміни трансляційної позиції нуклеосоми в результаті активності комплексів ремоделювання
Обидва описані механізми дії комплексів ремоделювання розпочинаються з ділянки ДНК на вході до нуклеосоми. Відповідно, ця ділянка має бути вільною від гістону Н1: Н1 і КР конкурують між собою за зону входу / виходу нуклеосомної ДНК.
Шляхи рекрутування комплексів ремоделювання до промоторів.
Насправді функціональні наслідки ремоделювання хроматину певним комплексом можуть бути різноманітними. Серед відомих нині компле-
ксів ремоделювання лише один – NuRD (Nucleosome Remodeling and Deacetylation), представник родини CHD – працює виключно як корепресор. Дія інших комплексів ремоделювання призводить або до репресії, або до активації – залежно від контексту інших функціонально важливих впливів, у кооперації з якими працює даний комплекс.
У разі активації система АТР-залежного ремоделювання хроматину завжди працює кооперативно із системою ацетилювання гістонів. Реалізуються різноманітні стратегії рекрутування КР до промоторів:
•За рахунок взаємодії КР з транскрипційними факторами.
Активація ініціюється ТФ, який упізнає невеликий сайт зв'язування на ДНК (навіть на поверхні нуклеосоми) і безпосередньо рекрутує комплекс ремоделювання, або КР рекрутується пізніше на стадії збирання енхансосоми іншими ТФ. Після цього, як правило, до енхансосоми рекрутується гіс- тон-ацетилтрансферазний комплекс.
181
Сиволоб А.В. Молекулярна біологія
•За рахунок упізнання ацетильованих Lys бромодоменом,
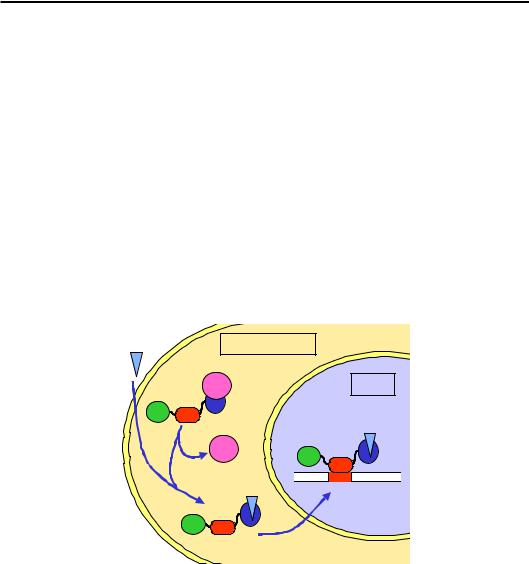
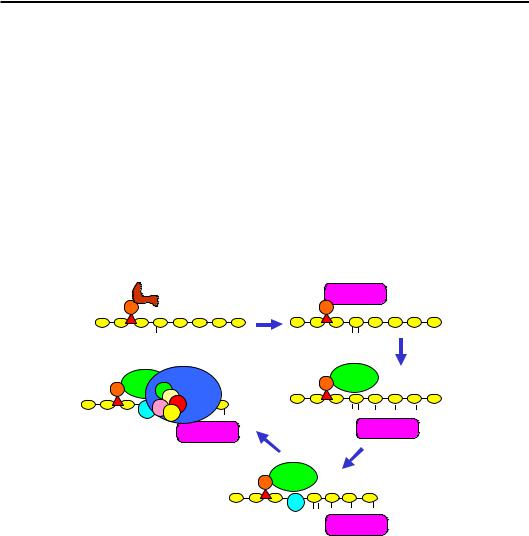
що входить до складу КР. Один із прикладів, який поєднує цей і попередній шляхи рекрутування КР, зображено на рис. 6.18: невеликий транскрипційний фактор зв'язується у промоторі й рекрутує гістон-кіназу; кіназа здійснює фосфорилювання Ser-10 гістону Н3 та дисоціює; фосфорильований Ser-10 і транскрипційний фактор упізнаються гіс- тон-ацетилтрансферазою, відбувається ацетилювання лізинів; ацетильовані Lys та ТФ рекрутують SWI/SNF (комплекс, що належить до родини Swi/Snf), який, здійснюючи репозиціювання нуклеосоми, звільняє ТАТА-бокс; відбувається зв'язування TFIID і збирання преініціаторного комплексу. Інший приклад див. на рис. 6.19.
кіназа |
|
HAT |
|
|
|
ТФ |
нуклеосоми |
|
|
||
|
|
|
|||
P |
|
|
PAc |
|
|
|
|
|
SWI/SNF |
|
|
|
PIC |
|
|
|
|
|
PAc Ac Ac |
Ac |
PAc |
Ac Ac |
Ac |
|
HAT |
|
|||
|
|
|
|
||
TFIID |
PAc Ac Ac |
Ac |
|
|
Рис. 6.18. Послідовність подій при активації дріжджового промотора INO1
•За рахунок взаємодії з білками ядерного матриксу (див. розділ 4),
які можуть рекрутувати комплекс ремоделювання до основи хроматинової петлі – до ділянок, асоційованих з матриксом (MAR). Така ділянка часто використовується як своєрідні “вхідні ворота” для факторів, що забезпечують регуляцію активності в межах петлі, де міститься один або кілька генів.
182
