
- •1. Скорость химической реакции
- •1.1. Кинетическая классификация реакций
- •1.2. Понятие о скорости химической реакции
- •1.3. Факторы, влияющие на скорость реакции
- •1.3.1. Зависимость скорости реакции от природы реагирующих веществ
- •1.3.2. Зависимость скорости реакции
- •1.3.3. Влияние температуры на скорость реакции
- •1.3.4. Уравнение Аррениуса
- •1.3.5. Влияние среды на скорость реакции
- •1.3.6. Другие факторы, влияющие на скорость химической реакции
- •1.4. Катализ
- •1.4.1. Особенности катализаторов
- •1.4.2. Механизм действия катализаторов согласно теории активации. Гомогенный и гетерогенный катализ
- •1.4.3. Ферментативный катализ
- •1.5. Цепные реакции
- •1.6. Фотохимические реакции
- •1.7. Последовательность расчета кинетических данных
- •1.8. Примеры решения задач
- •2. Химическое равновесие
- •2.1. Обратимые и необратимые реакции
- •2.2. Состояние химического равновесия
- •2.3. Способы выражения константы равновесия
- •2.4. Смещение химического равновесия
- •2.4.1. Влияние изменения концентрации на состояние равновесия
- •2.4.2. Влияние изменения температуры на состояние равновесия
- •2.4.3. Влияние изменения давления на состояние равновесия
- •2.5. Влияние температуры на константу равновесия
- •2.6. Состояние равновесия и катализаторы
- •2.7. Использование кинетических знаний в управлении химическим процессом
- •2.8. Примеры решения задач
- •3. Контрольные вопросы
- •4. Экспериментальная часть
- •Задачи и упраждения для самостоятельной работы
- •2. Влияние температуры и природы веществ на скорость реакции
- •4. Вычисление молярности растворов и равновесных концентраций
2.4.3. Влияние изменения давления на состояние равновесия
Из экспериментальных данных (рис. 19) следует, что процентное содержание аммиака в системе с повышением давления (Р) возрастает при любой температуре.
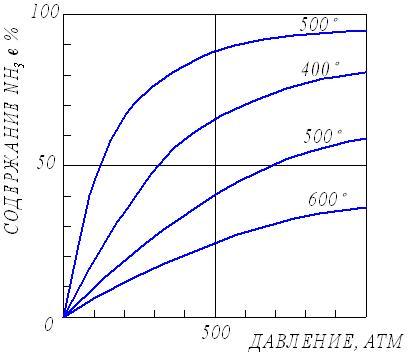
Рис.19. Влияние температуры и давления на состояние
химического равновесия при синтезе аммиака.
Сопоставим эти данные с изменением числа молекул в газовой смеси:
повышение внешнего давления
уменьшение общего числа молекул
N2(г) + 3H2(г) 2NH3(г)
понижение внешнего давления
увеличение общего числа молекул
В левой части уравнения всего 4 моль газов, а в правой 2. Четыре моль газа при данной температуре и давлении, согласно закону Авогадро, займут объем в два раза больший, чем два моль. Следовательно, процесс синтеза аммиака сопровождается уменьшением общего числа молекул, что приводит к уменьшению объема системы. Этот процесс, как видно из экспериментальных данных, усиливается при повышении давления.
Уменьшение давления действует, соответственно, в обратном направлении: усиливая процесс разложения аммиака, оно способствует увеличению общего числа молекул в системе согласно уравнению
2NH3 3H2 + N2,
откуда видно, что из двух молекул образуется четыре молекулы: одна – азота и три – водорода.
Обобщая, можно сформулировать следующее:
а) если реакция идет с изменением числа молекул газов, то давление влияет на ее скорость и, следовательно, вызывает нарушение равновесия,
б) повышение давления увеличивает скорость реакции, протекающей с понижением давления, и, соответственно, наоборот.
Значения равновесных концентраций веществ в системе
H2(г) + Cl2(г) 2HCl(г)
при изменении давления остаются постоянными (по два моль газов в обеих частях уравнения).
2.5. Влияние температуры на константу равновесия
При рассмотрении вопроса о смещении равновесия показано качественное влияние температуры на константу равновесия. Количественно эта зависимость определяется уравнением Вант-Гоффа. Покажем вывод этого уравнения.
Так как константа скорости химической реакции зависит только от температуры, то, очевидно, и константа равновесия зависит только от температуры. Подставив в выражение константы равновесия значения констант скоростей прямой и обратной реакций из уравнения Аррениуса и выполнив несложные преобразования, можно получить
Кр = k1/k2 = (А1/А2)е(Е2Е1)/RT = А еЕ/RT, (2.13)
где А1 и А2, Е1 и Е2соответственно предэкспоненциальные множители и энергии активации прямой и обратной реакций, а Е разность энергий активации обратной и прямой реакций. Эта разница соответствует тепловому эффекту реакции. Тогда зависимость константы равновесия от температуры выразится уравнением:
Кр = А еQ/RT (2.14)
Если Q 0, т.е. реакция идет с поглощением тепла (эндотермическая), то значение константы равновесия с повышением температуры возрастает (рис.20). Если Q 0, т.е. тепло в результате реакции выделяется (экзотермическая), то с увеличением температуры значение константы уменьшается.
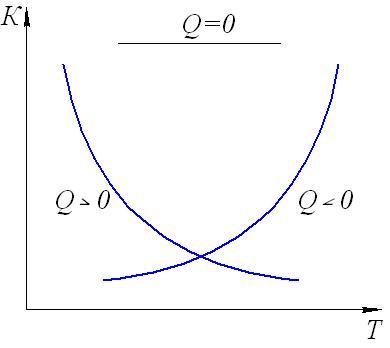
Рис.20. Зависимость константы равновесия от температуры
Выводы, сделанные на основании уравнения Вант-Гоффа, находятся в полном соответствии с принципом Ле-Шателье.
Покажем возможности использования уравнения Вант-Гоффа для определения константы равновесия при разных температурах и вычисления теплового эффекта реакции.
Прологарифмируем уравнение (2.14):
lgКр = Q/(2,303 RT) + lgA или lgКр = (Q/(2,303 R))(1/Т) + lgA (2.15)
Последнее выражение представляет собой уравнение прямой линии в координатах lgКр – 1/Т:
Если построить график зависимости lgКр от 1/Т (рис.21), то полученная экспериментальная прямая отсечет на оси ординат отрезок, равный lgA и имеющий наклон, равный Q/(2,303RT), откуда можно определить Q.
Если принять, что тепловой эффект реакции не зависит от температуры, что допустимо в небольших температурных интервалах, то зная константу равновесия при одной температуре (Т1), можно определить константу равновесия при любой другой температуре (Т2).
Запишем выражения константы равновесия для температур Т1 иТ2:
lgКр1 = Q/(2,303RT1) + lgA, lgКр2 = Q/(2,303RТ2) + lgA.
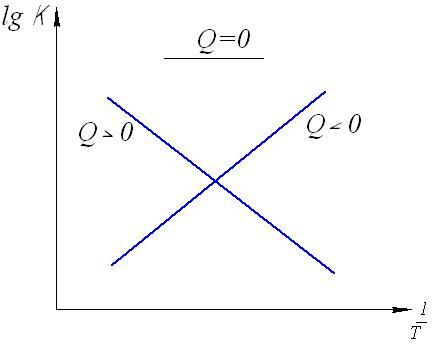
Рис.21. Зависимость логарифма константы равновесия от температуры.
Вычитая второе уравнение из первого, получим:
lg(Кр1/Кр2) = (Q/(2,303R)) (1/Т11/Т2) (2.16).
Этим уравнением можно воспользоваться для вычисления теплового эффекта реакции, если известны константы равновесия при двух температурах.
Немаловажно отметить, что константа равновесия (а значит и состояние равновесия) не зависит от энергии активации. Это следует из уравнения (2.13) и подтверждается экспериментально.
Очевидно, что изменение, например, увеличение константы равновесия с изменением температуры еще не означает достижения высокого выхода продуктов реакции и, соответственно, целесообразности осуществления процесса в препаративных целях, так как абсолютное значение Кр может оставаться невысоким. Например, уже при достаточно высокой температуре 1000 К константа равновесия эндотермической реакции
N2 + O2 2NO
очень мала всего 5,5.10-9. Повышение температуры до 2000 К увеличивает значение константы до 3,3.10-4, но даже при 5000 К ее величина составляет всего 0,24. Только при температуре 15000 К значение константы равновесия образования оксида азота достигает 4,5 величины, которую в какой-то степени можно считать приемлемой. Но эта температура в два с половиной раза выше, чем на поверхности Солнца.
