
Миронова. Экология.2010
.pdf15.Общая жесткость воды. Классификация жесткости.
16.Временная и постоянная жесткость воды. Примеры.
17.Единицы измерения жесткости воды. Перевод одних единиц измерения в другие.
18.Вычислить, сколько граммов хлороводородной кислоты содержится
в500 мл раствора, если на титрование 25,00 мл его израсходовано 23,50 мл 0,15 н раствора гидроксида натрия.
19.Определить процентное содержание гидроксида натрия в каустической соде, если навеска 4,062 6 г ее растворена в воде в мерной колбе емкостью 1 000 мл. На титрование 25,00 мл этого раствора затрачивается 26,75 мл 0,093 н раствора серной кислоты.
20.К 20 мл 0,217 5 н раствора хлороводородной кислоты прибавлено 22,50 мл 0,195 2 н раствора гидроксида натрия. Каковы реакция и нормальность полученного раствора?
21.Какова нормальность раствора серной кислоты, если на титрование 20 мл этого раствора потребовалось 15 мл раствора гидроксида натрия, имеющего титр 0,004 000 г/мл?
22.К 550 мл 0,192 5 н раствора хлороводородной кислоты прибавлено 50 мл раствора хлороводородной кислоты с титром 0,023 700 г/мл. Каковы нормальность и титр полученного раствора?
23.Определить постоянную жесткость воды, если известно, что после действия на 100 мл воды 10,00 мл 0,11 н раствора карбоната натрия и вы-
паривания на обратное титрование избытка карбоната Na2CO3 израсходовано 6,20 мл 0,1 н. раствора.
24.Определить жесткость воды, если сухой остаток из 0,4 л воды содержал 0,129 5 г гидрокарбоната кальция Са(НСO3)2.
25.Общая жесткость воды равна 15°. Вычислить жесткость воды
вмг-экв/л.
26.Общая жесткость воды равна 4,8 мг-экв/л. Вычислить жесткость воды в градусах.
27.Какова жесткость воды (в мг-экв/л), если в 1 л ее содержится 111 мг хлорида кальция СаСl2 и 60 мг сульфата магния MgSO4?
28.Какова жесткость воды, содержащей в 1 л 0, 6 г хлорида кальция?
29.Вода, жесткость которой равна 2 мг-экв/л, содержит гидрокарбонат кальция. Определить количество этой соли, содержащейся в 100 л воды.
30.Рассчитать жесткость воды, содержащей в 1л 0,01 моль гидрокарбоната магния.
31.Рассчитать, сколько карбоната натрия Na2CO3 нужно прибавить к 1 м3 воды, чтобы устранить ее жесткость, равную 3 мг-экв/л.
32.Определить, чему равна жесткость воды, в 1 л которой содержится
240 мг сульфата магния MgSO4. Сколько граммов карбоната натрия нужно прибавить к 100 л этой воды для устранения жесткости?
31
33.Чему равна карбонатная жесткость воды, если на титрование 100 мл
ееидет 5,00 мл 0,09 н. раствора хлороводородной кислоты?
Методы окисления-восстановления
Воснове окислительно-восстановительных методов объемного анализа лежит применение окислительно-восстановительных реакций, т. е. таких реакций, которые идут со сдвигом или полным переходом электронов от одних частиц к другим – от восстановителя к окислителю. В отличие от обменных, эти реакции сопровождаются изменением степени окисления элементов.
Вкачестве рабочих растворов используют титрованные растворы
окислителей (КМnO4, I2, К2Сr2О7, KBrO3, Ce(SO4)2 и др.) и восстановителей (FeSO4, SnCl2, TiCl3 и др.).
Восстановители титруют растворами окислителей, а окислители – растворами восстановителей.
Реакции должны протекать до конца, поэтому разность потенциалов двух участвующих окислительно-восстановительных пар должна быть достаточно большой.
Для определения веществ, проявляющих в достаточной степени окислительные или восстановительные свойства, разработаны специальные методы анализа, которые классифицируют следующим образам (в зависимости от окислителя и восстановителя, применяемых в методе): перманганатометрия, иодометрия, хроматометрия и др. Используя косвенные методы анализа, определяют содержание веществ, не проявляющих окислительновосстановительных свойств. Реакции окисления-восстановления лежат в основе потенциометрического титрования и электровесового метода анализа.
Для фиксирования точки эквивалентности в большинстве случаев используют окислительно-восстановительные индикаторы.
Восстановители определяют методом прямого титрования, окислители – методом обратного титрования. Последний метод широко используется при анализе воды на окисляемость.
Контрольные вопросы и задания
1.Основные окислительно-восстановительные методы. Используемые рабочие растворы.
2.Зависимость течения реакции окисления перманганатом от концентрации водородных ионов в растворе. Определить эквивалент перманганата калия в кислой, нейтральной и щелочной среде.
3.Почему раствор перманганата калия необходимо отделять от осадка оксида марганца (IV) и защищать от действия света?
4.Вещества, используемые для установки титра перманганата калия.
5.Какие определения проводят методом перманганатометрии? Примеры.
32
6. Как определяют восстановители и окислители методом перманганатометрии? Примеры.
ОПТИЧЕСКИЕ МЕТОДЫ
Оптические методы основаны на взаимодействии лучистой энергии с анализируемым веществом. По характеру взаимодействия лучистой энергии и способу ее измерения различают абсорбционный анализ, турбидиметрию, нефелометрию, люминесцентный анализ.
Наибольшее распространение получили абсорбционные методы анализа, или, как иначе их называют, фотометрические методы. Абсорбционный (фотометрический) анализ основан на избирательном поглощении света анализируемым веществом в видимой, ультрафиолетовой и инфракрасной областях спектра.
В зависимости от применяемой аппаратуры в фотометрическом анализе различают спектрофотометрический и фотоколориметрический методы. Они основаны на общем принципе – существовании пропорциональной зависимости между светопоглощением какого-либо вещества, его концентрацией и толщиной слоя раствора. В спектрофотометрическом методе используют монохроматический поток лучистой анергии (излучение с определенной длиной волны) различных участков спектра, в фотоколориметрическом методе – полихроматический поток лучистой энергии. Колориметрия – это метод, основанный на визуальном измерении светопоглощения в видимой части спектра, т. е. в области 400–750 нм (1 нм = 10–7 см).
Фотоколориметрический метод применяется при определении концентрации веществ в растворе. Применяя спектрофотометрический метод, можно определять не только концентрации веществ, но и их состав, прочность, оптические характеристики.
Фотометрические методы характеризуются высокой чувствительностью.
Методы колориметрии
Колориметрия (от латинского color – цвет и ... метрия) – в аналитической химии – группа фотометрических методов количественного анализа, основанных на определении концентрации вещества в окрашенном растворе путем измерения количества света, поглощенного этим раствором.
Различают субъективные (визуальные) и объективные (фотоколориметрические) методы колориметрии. В первом случае оптическую плотность определяют, сравнивая окраску исследуемого раствора с окраской серии стандартных (эталонных) растворов, а также при помощи визуальных колориметров.
33

Фотометрический метод основанный на избирательном поглощении электромагнитных излучений различных участков спектра однородной системой, называют методом абсорбционной спектроскопии или спектрофотометрии. Основной характеристикой электромагнитного излучения является длина волны λ или частота ν. Электромагнитные излучения различных длин волн (частот) составляют электромагнитный спектр, в абсорбционной спектроскопии используются ультрафиолетовый (УФ), видимый и инфракрасный (ИК) участки электромагнитного спектра. Ниже приведены длины волн этих участков спектра:
λ, нм |
УФ |
Видимый |
ИК |
10–10 |
200–400 |
400–700 |
Более 700 |
Поглощение излучений низких энергий (ИК) приводит к изменению вращательной или колебательной энергии молекул. Поэтому ИК область спектра используют для изучения химического строения различных соединений. Поглощение излучений УФ и видимого участков спектра вызывает изменение также энергии электронов, в результате чего происходит переход электронов внешних энергетических уровней в возбужденное состояние.
Каждая однородная система обладает способностью избирательно поглощать излучение определенных длин волн. Наиболее это заметно на системах, избирательно поглощающих в области видимого спектра. Цвет любого окрашенного раствора является дополнительным к цвету поглощенного излучения.
Колориметрические и фотоколориметрические методы основаны на измерении интенсивности светового потока, прошедшего через окрашенный раствор. При применении этих методов используются химические реакции, при которых определенное вещество переходит в окрашенное соединение, вызывающее изменение окраски анализируемого раствора. При колориметрическом методе анализа сравнивают интенсивность полученной окраски испытуемого раствора с окраской раствора известных концентраций. Этот метод является визуальным или субъективным. При фотоколориметрическом анализе (объективный метод) светопоглощение окрашенного раствора измеряют с помощью Фотоэлементов в специальных приборах. В отличии от колориметрического анализа фотоколориметрический метод предполагает использование поглощения монохроматических излучений. Одним из упрощенных способов монохроматизации спектра является применение светофильтров. Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества.
Эта зависимость выражается законом светопоглощения Бугера–Лам- берта–Бера: растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и толщине слоя раствора всегда поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое:
34
I = I0 10−ECL, |
(1) |
где I – интенсивность светового потока, прошедшего через раствор; I0 – интенсивность падающего на раствор светового потока; Е – коэффициент поглощения светового потоки – постоянная величина, характерная для каждого окрашенного вещества и зависящая от его природы; С – концентрация окрашенного вещества в растворе; L – толщина слоя светопоглощения раствора, см.
Закон светопоглощения составляет теоретическую основу большинства фотометрических методов, в том числе и фотоколориметрического.
Прологарифмируем уравнение (1):
Lg(I0/I) = ECL. |
(2) |
Величина Lg(I0/I) называется оптической плотностью раствора – D:
Dλ = Lg(I0/I) = EλCL, |
(3) |
где λ – выбранная длина светопоглощения.
Из уравнения (3) следует, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Отношение интенсивности монохроматического потока излучения, прошедшего через исследуемый раствор к интенсивности первоначального потока излучения называют прозрачностью или пропусканием раствора – Т:
T = I0/I = 10–ECL. |
(4) |
Оптическая плотность (D) и пропускание (Т) связаны между собой следующим образом:
D = –LgT. |
(5) |
Если Т выразить в процентах, то энергия превращается в электриче-
скую. Возникающий при этом ток: |
|
|
|
D = Lgl/T 100; |
(6) |
||
D = |
2 − LgT. |
||
|
|||
Анализ уравнения (3) показывает, что основными параметрами фотоколориметрического определения являются: длина волны, при которой производится измерение оптической плотности, величина оптической плотности, толщина кюветы и концентрация окрашенного раствора. Сюда же следует отнести и различные химические факторы, связанные с полнотой и условиями протекания фотометрической реакции, концентрацией окрашенных растворов и других реактивов, их устойчивостью и т. д. В зависимости от свойств анализируемой системы и характеристик прибора выбирают оптимальные условия анализа.
35
Точность фотометрических определений зависит от прочности окрашенных комплексов. Интенсивность окраски комплексных соединений зависит от количества добавляемого реактива и от других факторов. Чтобы устранить их влияние, испытуемый раствор и раствор сравнения готовят и анализируют в одинаковых условиях.
Молярный коэффициент поглощения (светопоглощения) и оптическая плотность окрашенного вещества различны для различных длин волн света. Зависимость светопоглощения вещества от длины волны выражается кривой (спектром) поглощения. Для получения спектра поглощения проводят серию измерений оптической плотности раствора или молярного коэффициента погашения при различных длинах волн, затем строят график, на котором по оси абсцисс откладывают длины волн, а по оси ординат значения молярных коэффициентов погашения, или оптической плотности, или их логарифмов.
Основными преимуществами фотоколориметрических методов измерения являются быстрота и легкость определений при высокой их точности.
Спектр поглощения является индивидуальной характеристикой вещества. Максимум поглощения энергии данным веществом приходится на область спектра с определенной длиной волны λmax. Спектр поглощения характеризуется также размытостью максимума поглощения, или полушириной полосы, т. е. интервалом длин волн, соответствующих половинным значениям максимального моляльного коэффициента погашения или максимальной оптической плотности. При выборе участка спектра для работы измерение оптической плотности желательно проводить на длине волны, при которой поглощение максимально.
При измерении оптической плотности в области максимального светопоглощения повышается чувствительность определения.
Принцип работы фотоэлектроколориметра (ФЭК)
Вфотометрическом анализе количество вещества определяют по интенсивности окраски или светопоглощения окрашенных соединений. Определяемый ион переводят в окрашенное соединение, а затем измеряют его светопоглощение. Измерения оптических плотностей стандартных и исследуемых растворов производят в одинаковых условиях. В отличие от визуальных методов в фотоколориметрии степень поглощения света окрашенным раствором оценивается не глазом, а с помощью фотоэлементов
вспециальных приборах – фотоэлектрических колориметрах и фотометрах. В визуальной колориметрии для сравнения светопоглощения растворов применяют колориметрические пробирки, цилиндры, колориметры сливания, колориметры погружения, компараторы.
Вколориметрии всегда сравниваются интенсивности окрасок испытуемого и стандартного растворов.
36
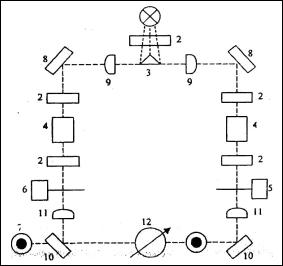
Схема устройства фотоэлектроколориметра ФЭК отображена на рис. 2. Световой поток от источника света через светофильтр 2 попадает на призму 3, делящую пучок на правый и левый. Источник света помещен в фокусе линз, и световые пучки, отражаясь от зеркала 8, выходят параллельными. Далее световые потоки проходят через кювету 4 и попадают на линзы 11. В фокусе линз помещены матовые стенки, за которыми расположены фотоэлементы. Раздвижная диафрагма при вращении связанного с ней барабана 5 и 6 меняет свою площадь, вследствие чего меняется интенсивность светового потока, падающего на элемент. Левый пучок является компенсационным, правый измерительным. Фотоколориметрические методы определения основаны на одном общем принципе. Световой поток проходит через кювету, наполненную испытуемым раствором. Прошедший через раствор поток воспринимается фотоэлементом, в котором световая энергия измеряется при помощи чувствительного гальванометра. Сила электрического тока, возникающего при действии, световой энергии на фотоэлемент прямо пропорциональна интенсивности освещения.
Рис. 2. Схема устройства фотоэлектроколориметра ФЭК:
1 – источник света; 2 – светофильтр;
3 – призма; 4 – кювета; 5 – измерительная диаграмма; 6 – компенсационная диафрагма; 7 – фотоэлементы; 8, 10 – зеркала;
9, 11 – линзы; 12 – регистрирующий прибор
Выбор кювет и светофильтра
В спектрофотометрическом анализе монохроматический свет выделяют при помощи монохроматоров, в фотоколориметрическом – область максимального излучения выделяют при помощи светофильтров. Светофильтр выбирают таким образом, чтобы спектральная область максимального светопоглощения окрашенным раствором и область максимального пропускания лучей светофильтром была одной и той же.
37

Точность определения зависит от правильно выбранных светофильтров и кюветы. Если используется интенсивно окрашенный раствор, следует пользоваться кюветой с малой рабочей длиной (12–13 мм), при работе со слабоокрашенными растворами необходимо применять кюветы с большой рабочей длиной (30–50 мм). Если величина оптической плотности больше 0,7, берут кювету меньшей рабочей длины, а если она меньше 0,1, то следует брать кювету с большой рабочей длиной, раствор при этом должен быть средней концентрации. Светофильтр подбирают по табл. 2 или согласно указанию в методике определения.
|
|
|
Таблица 2 |
|
Выбор светофильтра в зависимости от окраски раствора |
||
|
|
|
|
№ п/п |
Окраска раствора |
Окраска светофильтра |
Длина волны, нм |
1 |
фиолетовая |
желто-зеленая |
400–450 |
2 |
синяя |
желтая |
450–480 |
3 |
зелено-синяя |
оранжевая |
480–490 |
4 |
сине-зеленая |
красная |
490–500 |
5 |
зеленая |
пурпурная |
500–560 |
6 |
желто-зеленая |
фиолетовая |
560–575 |
7 |
желтая |
синяя |
575–590 |
8 |
красная |
сине-зеленая |
590–625 |
9 |
пурпурная |
зеленая |
625–750 |
Способы расчета
Способ калибровочного графика. Для построения калибровочного графика D = f(c) нужно приготовить серию эталонных растворов, содержащих разные количества определяемого вещества. Сначала приготавливают стандартный раствор, содержащий строго определенное количество исследуемого вещества. С помощью пипеток отбирают в мерные колбы различные, точно измеренные объемы этого стандартного раствора и соответствующих реактивов, вызывающих окраску анализируемого раствора. Затем содержимое каждой мерной колбы разбавляют дистиллированной водой, доводя объем раствора до метки.
С помощью фотоколориметра измеряют оптические плотности приготовленных эталонных растворов. Результаты измерений записываются в виде таблицы:
Эталонный раствор |
1 |
2 |
3 |
4 |
5 |
Содержание определяемого вещества, С |
|
|
|
|
|
Оптическая плотность, D |
|
|
|
|
|
38
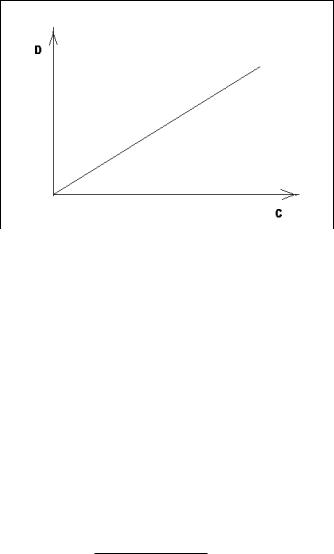
На основании полученных результатов строят график зависимости D = f(C). Это и есть калибровочный график – график зависимости оптической плотности от концентрации раствора (калибровочная кривая).
Определив значение оптической плотности испытуемого раствора Dx аналогичных условиях, можно найти Сх определяемого вещества по калибровочному графику (рис. 3).
Рис. 3. Калибровочный график
По прямо пропорциональной зависимости:
Dx/Dэтал = Сx/Сэтал.
Оценка точности измерений. Возможны две группы ошибок.
1.Ошибки, связанные с получением химического соединения, поглощающего излучения определенной длины волн. Эти ошибки зависят от правильности выбора оптимальных условий и четкости проведения фотометрической реакции.
2.Ошибки, связанные с процессом измерения оптической плотности раствора.
Расчет погрешности исследований:
η = | Cтеорет − Cпракт | 100 %.
Cтеорет
Контрольные вопросы и задания
1.Сущность колориметрии. Область ее применения.
2.Практические задачи, решаемые методами колориметрии и спектрофотометрии. Охарактеризовать возможности каждого метода.
3.Преимущества колориметрического анализа перед весовым и объемным; его недостатки.
4.Закон Бугера–Ламберта–Бера; условия его применимости.
39
5.Определение и расчет оптической плотности раствора.
6.Реакции каких типов используют в колориметрии для получения окрашенных растворов? Привести примеры.
7.Какое условие необходимо соблюдать при использовании колориметрического метода анализа веществ в зависимости от различных факторов?
8.Какие условия необходимо соблюдать, сравнивая окраски по методу визуальной колориметрии?
40
