
Миронова. Экология.2010
.pdf–использование в водоподготовке технически и морально устаревших технологий, сооружений;
–отсутствие систем водоочистки и обеззараживания на питьевых водопроводах сельских территорий края;
–изношенность водозаборных сооружений, разводящих сетей;
–отсутствие лицензированных организаций по ремонту и эксплуатации водопроводных сетей в сельской местности;
–неудовлетворительно организованный производственный лабораторный контроль качества питьевой воды;
–частая реорганизация предприятий, при которой объекты водоснабжения остаются «бесхозными».
|
|
|
|
Таблица 1 |
Характеристика показателей общей жесткости в питьевой воде |
||||
на административных территориях в 2007 г. |
|
|||
|
|
|
|
|
Территория |
Доля проб питье- |
Население, потре- |
|
Население, потре- |
|
вой воды с жест- |
бляющее питьевую |
|
бляющее питьевую |
|
костью ≥ 10 |
воду с жесткостью |
|
воду с жесткостью |
|
мг/экв/л, % |
≥10 мг/экв/л, чел. |
|
≥10 мг/экв/л, % |
Красноярский край |
2,8 |
46 853 |
|
1,6 |
Балахтинский район |
77,8 |
531 |
|
2,2 |
Богучанский район |
100,0 |
11 596 |
|
23,9 |
Идринский район |
15,4 |
130 |
|
0,9 |
Каратузский район |
11,5 |
1 150 |
|
6,7 |
Краснотуранский район |
25,8 |
1 524 |
|
9,4 |
Курагинский район |
0,4 |
2 120 |
|
4,1 |
Минусинский район |
10,0 |
250 |
|
1,0 |
Новоселовский район |
100,0 |
6 699 |
|
43,2 |
Рыбинский район |
4,7 |
5 421 |
|
23,0 |
Ужурский район |
1,9 |
1 457 |
|
4,3 |
Уярский район |
6,3 |
15 899 |
|
70,3 |
Шушенский район |
1,3 |
76 |
|
0,2 |
Нецентрализованным водоснабжением обеспечено 15,6 % населения Красноярского края, проживающего, в основном, в сельской местности. К основным факторам, определяющим низкое качество воды нецентрализованных источников питьевого водоснабжения, следует отнести:
–неудовлетворительное санитарно-техническое состояние из-за несвоевременного проведения ремонта;
–слабую защищенность водоносных горизонтов от загрязнения с поверхности территорий;
–отсутствие своевременной чистки и обеззараживания колодцев.
11
Практически повсеместно общественные колодцы на селе не состоят на балансе сельских администраций, не финансируется их ремонт, дезинфекция и производственный контроль.
Качество воды открытых водоемов в пунктах культурно-бытового водопользования на территории Красноярского края, на протяжении последних пяти лет, характеризуется более низкими показателями химического
имикробного загрязнения. Таким образом, из выше изложенного следует:
1.Качество воды поверхностных источников в пунктах хозяйственнопитьевого водопользования населения на территории Красноярского края имеет тенденцию к улучшению по санитарно-химическим и микробиологическим показателям. Отмечается улучшение показателей качества воды подземных водоисточников по бактериологическим и санитарно-химичес- ким показателям.
2.Вода поверхностных источников в пунктах культурно-бытового водопользования населения Красноярского края имеет тенденцию к улучшению по санитарно-химическим показателям; санитарно-химическим и бактериологическим показателям качественно превышает средние показатели по Российской Федерации.
3.Питьевые водопроводы крупных городов Красноярского края, использующие поверхностные и подрусловые водоисточники, имеют системы водоподготовки и способны обеспечить население питьевой водой гарантированного качества. Менее надежными остаются питьевые водопроводы сельских территорий края, не обеспеченные системами водоочистки
иобеззараживания.
4.Около 27,2 % трубчатых и шахтных колодцев, используемых населением для питьевых целей, находятся в неудовлетворительном санитарнотехническом состоянии. Местные органы исполнительной власти не имеют средств на ремонт и содержание этих нецентрализованных водоисточников, что приводит к снабжению населения водой, не соответствующей гигиеническим нормативам по бактериологическим показателям в 30,1 % случаев, по санитарно-химическим показателям – в 44,9 % случаев.
5.Питьевая вода систем централизованного водоснабжения, потребляемая населением городов Ачинск, Дивногорск, Канск, Красноярск, Минусинск, Назарово, Норильск, в 55,5 % проб обладала мутагенной активностью, обуславливая опасность неблагоприятного воздействия на здоровье человека.
МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ПРИ АНАЛИЗЕ СТОЧНЫХ ВОД
Титриметрический (объемный) метод анализа
Титриметрическим (объемным) методом анализа называют метод количественного анализа, основанный на точном измерении количества реагента, требующегося для завершения реакции с данным количеством определяемого вещества.
12
В титириметрическом анализе реакцию проводят между двумя растворами и как можно точнее определяют момент завершения реакции между обоими веществами. Зная концентрацию одного, можно установить и точную концентрацию другого.
Методы титриметрического анализа классифицируются чаще всего по характеру химических реакций, лежащих в основе определения веществ. Это реакции соединения ионов и реакции окисления-восстановления ионов. В соответствии с этим титриметрические определения делятся на следующие методы: нейтрализации, или кислотно-основного титрования; осаждения, комплексообразования; окисления-восстановления, или оксидиметрии.
Сущность объемного анализа заключается в следующем:
−вычисление навески вещества с целью получения раствора определенной нормальности;
−вычисление нормальности раствора по данному количеству растворенного вещества, содержащемуся в известном объеме;
−вычисление нормальности анализируемого раствора по результатам титрования;
−вычисление нормальности раствора по его титру и титра раствора по его нормальности;
−написание уравнений реакций взаимодействия исходного вещества
ирабочего раствора.
Процесс постепенного контролируемого приливания раствора В с точно известной концентрацией к определенному объему другого раствора А называют титрованием.
Раствор реагента В точно известной концентрации, применяемый для титрования в методах титриметрического анализа, называют стандартным или титрированным раствором, титрантом.
Титруемый раствор – А-раствор, к которому приливают титрант. Титруемый раствор обычно помещают в колбу для титрования, а титрант в бюретку (рис. 1).
13
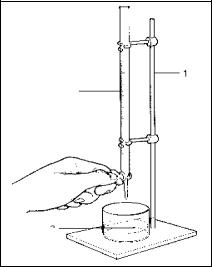
1
2
3
Рис. 1. Установка для титрования:
1 – штатив; 2 – бюретка с титрантом;
3 – стакан с титруемым раствором
Реакции, используемые в титриметрическом анализе:
–реакции кислотно-основного взаимодействия;
–окислительно-восстановительные реакции (например, перманганатометрия);
–реакции комплексообразования (например, комплексонометрия);
–реакции осаждения.
Требования для реакций следующие.
–высокая скорость реакции;
–необратимость реакции;
–возможность установить момент завершения реакции;
–концентрация одного из используемых веществ должна быть известна с достаточной точностью, и в течение определенного времени она не должна изменяться;
–желательно, чтобы реакция протекала при обычных условиях.
Понятие об эквиваленте, молярная масса эквивалентов. Закон эк-
вивалентности. Во многих химических реакциях принимает участие не целая частица вещества Х, а лишь ее часть, которую называют эквивалентом.
В титриметрическом анализе расчет результатов основан на принципе эквивалентности.
Эквивалент – некая реальная или условная частица вещества Х, которая в кислотно-основной реакции эквивалентна одному иону водорода или в кислотно-основной реакции – одному электрону.
Закон эквивалентов: в химической реакции с n эквивалентами одного вещества всегда вступает во взаимодействие n эквивалентов второго и образуется по n эквивалентов каждого продукта.
Точную концентрацию стандартного раствора реагента В (титранта) называют титром и выражают, числом граммов растворенного вещества, содержащегося в 1 см3 (мл) раствора.
14

Титр раствора – это отношение массы растворенного вещества к объему раствора:
T (X ) = mV(X ) .
Титр раствора по определяемому компоненту – это масса определяемого компонента Y, эквивалентная одному миллилитру раствора вещества Х:
T (X /Y ) = m(Y ) ; V (X )
T (NaOH / HCl) = Vm(NaOH)(HCl) .
Титр по определяемому компоненту показывает число граммов определяемого вещества, реагирующее с 1 мл рабочего раствора или соответствующее 1 мл рабочего раствора.
Стандартные растворы – это растворы с точной концентрацией. Одна из существенных особенностей титриметрического анализа за-
ключается в том, что при титровании употребляют не избыток реагента, а количество его, точно отвечающее уравнению реакции и химически эквивалентное количеству определяемого вещества. Именно на эквивалентности основано вычисление результатов анализа.
В точке эквивалентности произведения объемов (в мл) реагирующих веществ на их нормальности равны:
Va ∙ Na = Vb ∙ Nb или Va / Vb = Na / Nb.
Эту формулу используют для расчета содержания определяемого вещества А.
При титровании необходимо точно установить момент наступления эквивалентности – точку эквивалентности. Точка эквивалентности (т. э.) – момент титрования, когда число эквивалентов титранта равно числу эквивалентов определяемого вещества. Точку эквивалентности устанавливают различными, способами, например, по изменению окраски индикатора, прибавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования.
Рабочие титрованные растворы могут быть приготовлены по точным навескам веществ. Эти вещества называются исходными и должны удовлетворять определенным требованиям: быть химически чистыми, устойчивыми при хранении в твердом виде и в растворе; состав вещества должен строго соответствовать химической формуле. Массу навески исходного вещества рассчитывают по формуле
g = VNЭ (объем берется в литрах),
15
где g – навеска вещества, г; V – объем раствора; N – нормальность раствора; Э – эквивалентная масса.
Пример 1. Сколько нужно взять хлорида натрия для приготовления 500 мл 0,1 н. раствора?
Решение:
1-й вариант. g = 0,5 ∙ 0,1 ∙ 58,44 = 2,9220 (г).
Растворы веществ, не удовлетворяющие требованиям, предъявляемым к исходным веществам, готовят приблизительной концентрации. Например, минеральные кислоты (НСl, H2SO4) выделить в чистом виде трудно вследствие непостоянного состава. Едкие щелочи (NaOH, КОН) изменяют состав, поглощая оксид углерода (IV) и влагу из воздуха и т. д.
Растворы, титр которых находят не по точной навеске, а устанавливают по тому или иному исходному веществу, называют растворами с установленным титром.
Таким образом, установку титра растворов производят либо по точным навескам основного вещества, либо по исходным титрованным растворам. Основной характеристикой растворов является их концентрация. Способы выражения концентрации подробно рассматриваются в курсе неорганической химии. В объемном анализе используют в основном растворы нормальной концентрации, которую выражают числом грамм-эк- вива-лентов в одном литре раствора или числом миллиграмм-эквивалентов в одном миллилитре.
Например, 0,5 н. растворы содержат 0,5 г-экв в 1 л или 0,5 мг-экв в 1 мл, сантинормальные (0,01 н.) – 0, 01 г-экв в 1 л или 0,01 мг-экв в 1 мл раствора.
Следует помнить, что эквивалент вещества не является постоянным числом, а зависит от той реакции, в которой это вещество участвует.
Концентрацию растворов можно выражать также количеством граммов растворенного вещества, содержащегося в 1 мл раствора, иначе говоря титром (Т).
Например: Т (Na2C2O4) равный 0,006 700 г/мл, выражает титр рабочего раствора оксалата натрия, т. е. показывает, что в 1 мл этого раствора содержится 0,006 700 г оксалата натрия.
Зная титр, можно определить нормальность раствора. Для этого нужно узнать, сколько граммов вещества содержится в литре раствора: 0,006 700 ∙ 1 000 = 6,700 0 г (Na2C2O4). Полученное число разделить на эквивалент данного вещества; M(Na2C2O4) равна 134,00; грамм-эквива- лент оксалата натрия составляет:
134,00 = 67,000 0 (г).
2
Отсюда нормальность (N) раствора равна:
16

6,700 0 = 0,1 (г-экв/л).
67,000 0
Следовательно, чтобы перейти к нормальности, нужно титр раствора умножить на 1 000 и разделить на грамм-эквивалент (Э) растворенного вещества:
N = T 1 000.
Э
Наоборот, зная нормальность раствора, можно определить его титр. Например, требуется определить титр 0,1 н. раствора оксалата натрия.
Так как NNa2C2O4 = 0,l, то в 1 000 мл раствора содержится 0,1 ∙ 67,000 =
= 6,700 0 г оксалата натрия, а в одном миллилитре содержится оксалата натрия в тысячу раз меньше:
TNa C O |
= |
6,700 0 |
= 0,006 7 |
(г/мл). |
|
2 |
2 |
4 |
1 000 |
|
|
|
|
|
|||
Общая формула:
T = 1N000Э (г) = NЭ (мг). Титр вещества рассчитывают по формуле
T = gv (г/мл).
Пример 2. Навеска 0,584 4 г хлорида натрия, взятая на аналитических весах, растворена в мерной колбе емкостью 200 мл, и объем раствора доведен водой до метки. Найти титр раствора.
Решение:
TNaCl = 0,594200 4 = 0,002 922 (г/мл).
Титр рабочего раствора можно выражать в граммах или миллиграммах по другому веществу. Он обозначает количество граммов (миллиграммов) определяемого вещества, которое эквивалентно 1 мл данного раствора. Титр раствора по определяемому веществу показывает, какой массе определяемого вещества соответствует один миллилитр рабочего раствора. Вычисляют титр по формуле:
T = 1Э000опред ,
где Эопред – эквивалентная масса определяемого вещества.
17
Пример 3. Вычислить титр 0,1 н. раствора серной кислоты по гидрокарбонату натрия.
Решение:
|
|
T |
|
|
= |
NH SO |
ЭNaHCO |
3 |
; |
|
|
|
|
2 4 |
|
||||
|
|
|
|
|
|
|
|||
|
|
H SO / NaHCO |
|
1 000 |
|
|
|||
|
|
2 |
4 |
3 |
|
|
|
||
|
|
|
|
|
|
|
|||
T |
|
|
= 0,1 94,007 1 = |
0,008 401 (г/мл). |
|||||
H SO / NaHCO |
|
1 000 |
|
|
|
|
|||
2 |
4 |
3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
Во многих случаях не стремятся получить раствор точно требуемой нормальности (навеску вещества не берут точно теоретически рассчитанной, так как на это требуется много времени), а вводят понятие коэффициента нормальности (К). Коэффициент нормальности иначе называют поправочным коэффициентом, фактором нормальности или поправкой к нормальности раствора.
Вычисление результатов объемных определений. На основании данных титрования производят вычисления результатов анализа. Различают метод пипетирования и метод отдельных навесок.
Метод пипетирования заключается в том, что навеску анализируемого вещества, взятую на аналитических весах, растворяют в мерной колбе, доводя объем до метки. Из этого раствора с помощью пипетки берут определенные аликвотные порции раствора.
Пример 4. Определить процентное содержание щавелевой кислоты в техническом препарате, если навеска 1,308 0 г щавелевой кислоты перенесена в мерную колбу емкостью 200 мл, растворена и объем раствора доведен водой до метки. Из этого раствора отобрана пипеткой аликвотная часть, равная 10 мл, и оттитрована 9,85 мл 0,1026 н. раствора гидроксида натрия.
Решение:
N1Vl = N2V2.
Отсюда |
|
|
|
|
|
|
N1= |
N2V2 |
; N |
H2C2O4 |
2H2O |
= 0,102 6 9,85 |
= 0,1011н; |
|
||||||
|
V1 |
10 |
|
|||
|
|
|
|
|||
MH2C2O4 2H2O =126,067;
ЭH2C2O4 2H2O = 63,033.
По практическим данным находим весовое содержание щавелевой кислоты в 200 мл раствора:
g = NЭV;
18
g = 0,1011 ∙ 63,033 ∙ 0,2 = 1,2745 (г).
Метод отдельных навесок заключается в том, что каждую навеску анализируемого вещества растворяют в произвольном объеме воды и титруют весь полученный раствор. Вычисления производят, исходя из того, что при титровании вещества взаимодействуют в эквивалентных количествах.
Пример 5. Взята навеска 0,150 0 г щавелевой кислоты. На титрование ее израсходовано 25,60 мл 0,090 02 н раствора гидроксида натрия. Определить процентное содержание кислоты в технической щавелевой кислоте.
Решение: находим, сколько грамм-эквивалентов участвовало в реакции или содержалось в 25,60 мл раствора.
1 000 мл раствора NaOH содержит 0,090 02 г-экв NaOH 25,60 мл → x г-экв
x = 25,60 0,002 305 =0,002 305(г-экв NaOH). 1 000
При титровании 1 г-экв вещества взаимодействует с 1 г-экв другого. Следовательно, в реакции участвовало также 0,002 305 г-экв щавелевой кислоты H2C2O4 ∙ 2H2O. Находим количество щавелевой кислоты:
ЭH2C2O4 2H2O = 63,033 (г). Анализируемый раствор содержит:
0,002 305 ∙ 63,033 = 0,145 3 (г Н2С2O4 ∙ 2Н2O). В процентах это составляет:
0,150 0 → 100 %
0,145 3→ x %
x = 0,145 3 100 =96,86 (%). 1,150 0
Различают следующие методы титрования: прямое; титрование заместителя; обратное (по остатку).
При прямом титровании исследуемый раствор титруют рабочим раствором. Предположим, что на титрование исследуемого раствора до точки эквивалентности израсходовано V мл рабочего раствора нормальности N, тогда число миллиграмм-эквивалентов определяемого вещества, очевидно, равно числу миллиграмм-эквивалентов рабочего раствора.
Содержание определяемого вещества в титруемой порции раствора рассчитывают по уравнению g = ЭNV.
19

Титрование по методу замещения применяют в случаях, когда определяемый ион: реагирует не в стехиометрических отношениях; непосредственно не реагирует с рабочим раствором.
В этом методе определяемый ион переводят сначала в какое-нибудь другое химическое соединение, которое затем титруется непосредственно рабочим раствором.
Если число миллиграмм-эквивалентов заместителя точно равно числу миллиграмм-эквивалентов определяемого вещества, то расчет будет тем же, что и при методе прямого титрования.
Метод обратного титрования применяют в том случае, когда исследуемое вещество реагирует с рабочим раствором медленно или не реагирует совсем. В этом случае к раствору прибавляют определенный объем третьего компонента, реагирующего с исследуемым веществом в заведомом избытке, а избыток оттитровывают рабочим раствором. Концентрацию раствора, взятого в избытке, устанавливают путем отдельного титрования рабочим раствором.
Расчет по результатам обратного титрования производится по уравнению
g = Э(VN – V1Nl),
где V – объем рабочего раствора, взятого в избытке; N – нормальность; V1 – объем другого рабочего раствора, израсходованного на обратное титрование избытка первого рабочего раствора; N1 – нормальность второго раствора.
Тогда VN – число миллиграмм-эквивалентов первого рабочего раствора, взятого в избытке; N1V1 – число миллиграмм-эквивалентов второго рабочего раствора, израсходованного на обратное титрование. Разность VN – N1V1 очевидно, будет равна количеству миллиграмм-эквивалентов реактива первого рабочего раствора, израсходованного на реакцию с определяемым веществом. Умножив эту разность на величину эквивалентной массы определяемого вещества, найдем количество этого вещества в титруемой порции раствора в миллиграммах.
Для определения процентного содержания определяемого компонента необходимо знать ту часть аналитической навески, которая заключалась во взятом для титрования растворе. Процентное содержание определяемого компонента в анализируемом веществе вычисляется по формуле
gV 100 , aV1 1 000
где g – искомое количество определяемого вещества в титруемой порции раствора, мг; а – навеска анализируемого вещества, г; V – объем раствора, в котором растворена навеска (объем мерной колбы), мл; V1 – объем раствора, взятого для титрования (объем пипетки), мл.
Находим количество анализируемого вещества:
20
