
6 курс / Клинические и лабораторные анализы / Лабораторная_диагностика_нарушений_гемостаза_В_В_Долгов,_П_В_Свирин
.pdf
Плазменные белки гемостаза
ся под действием тромбостенина(тромбоцитарного актомиозина) вследствие присущих им контрактильных свойств (см. главу «Тромбоциты»). Происходит ретракция сгустка крови. Сгусток уплотняется, из него выдавливается часть сыворотки.
Формирование окончательного тромба наступает на 10-15-й минуте после полимеризации фибрина.
Если тромбоциты отсутствуют или имеют дефект GPIIb-IIIa, то ретракции кровяного сгустка не происходит и он быстро лизируется в процессе фибринолиза. При отсутствии ретракции тромба в сосудистом русле возможен отрыв тромботических масс и эмболия удаленных сосудов (тромбоэмболия).
Роль кофакторов и микроокружения в процессе свертывания крови
Плазменные ферменты и ингибиторы системы гемостаза эффективно функционируют только в определенном микроокружении. Эффективность функционирования факторов IX, X, протеина С, антитромбина III в присутствии своих кофакторов (факторы VIII, V, протеин S, гепарансульфат соответственно) возрастает в десятки тысяч раз. Большинство реакций протеолитической активации предшественников ферментов эффективно протекают только на «твердой фазе», роль которой играют отрицательно заряженные фосфолипиды. Для всех реакций, протекающих на поверхностях, необходимы ионы кальция. На рис. 47 показана степень активации тромбина фактором Ха в различных условиях микроокружения. Комплекс
фактора Ха, фактора Va, фосфолипидов и Са2+ |
Рис. 47. |
Влияние |
условий микроокружения на образо- |
(протромбиназный комплекс) значительно эффек- |
вание |
тромбина |
фактором . ХаКомплекс фактора Ха, |
|
|
2+ |
|
тивнее активирует тромбин, нежели один фактор Ха, |
фактора Va, фосфолипидов и Са (протромбиназный ком- |
||
причем в комплексе с кофакторами фактор Ха за- |
плекс) значительно эффективнее активирует тромбин, нежели |
||
фактор Ха один или в комбинации только с фосфо-липидами |
|||
щищен от деградации антитромбином. |
и/или Са2+ |
|
|
Роль кальция в гемостатических реакциях
Роль кальция в гемостазе огромна. Большинство белков гемостаза имеют сайты связывания кальция. При удалении кальция из плазмы(например, при смешивании крови с цитратом натрия) активировать гемостатические реакции практически невозможно. Наиболее важные из известных функций кальция в гемостазе:
• Участие в образовании связей витамин-К-за- висимых факторов (II, VII, IX, X, протеин С, протеин S) с фосфолипидной поверхностью.
• Участие в активации фактора XIII.
• Участие в образовании связи ф.VII и ткане
вого фактора. •
• Ускорение процесса роста фибринового сгу стка, участие в стабилизации фибринового сгустка, ограничение протеолиза фибрина и фибриногена плазмином, защита фибриноге-
на и фибрина от температурной и щелочной денатурации.
•Стабилизация структуры многих белков ге мостаза и опосредование взаимодействия между ними.
•Участие в процессах активации тромбоцитов и других клеток.
•Кальций необходим для формирования цитос-

Плазменные белки гемостаза
Ингибиторы системы свертывания плазмы крови
Ингибиторы системы свертывания крови представлены в табл. 7.
Таблица 7
Ингибиторы системы свертывания плазмы крови
Ингибиторы системы свертывания крови условно можно разделить на три группы - ингибиторы ферментов, ингибиторы коферментов и ингибиторы активных комплексов.
Ингибиторы ферментов системы гемостаза
Среди ингибиторов ферментов системы гемостаза, в свою очередь, можно условно выделить 2 группы - ингибиторы сериновых протеаз и неспецифические ингибиторы протеаз, к которым относится α2-макроглобулин.
Ингибиторы сериновых протеаз, или серпи-
ны. Большинство ферментов каскада свертывания крови составляют сериновые протеазы. Сериновыми протеазами также являются ферменты фибринолитической системы, некоторые ферменты системы комплемента, эластаза, трипсин, химотрипсин и многие другие. Все они имеют гомологичную структуру. Существует группа ингибиторов, специфичных для сериновых протеаз, - серпины. Механизм их ингибирующего действия изучен довольно хорошо. Серпины имеют строение, похожее на строение субстрата сериновых протеаз. Однако, охотно соединяясь с ферментами, серпины не подвергаются немедленному расщеплению. Это соеди-
нение блокирует ферментативную активность сериновой протеазы (рис. 48). Различные серпины несколько отличаются по строению, могут быть более или менее специфично ингибировать разные ферменты. Кроме того, на актив-
Рис. 48. Ингибирование активных сериновых протеаз серпинами за счет образования стабильного неактивного фермент-субстратного комплекса
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
Плазменные белки гемостаза
ность и специфичность серпинов может влиять |
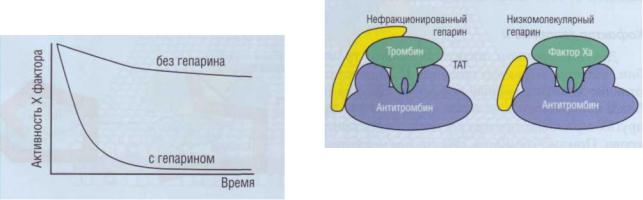
ющее действие на AT оказывает гепарин (рис. 49), |
|
микроокружение. |
вырабатываемый тучными клетками. Антикоагу- |
|
|
лянтное действие гепарина связано с его способ- |
|
Антитромбин и гепарин |
ностью вызывать конформационные изменения |
|
AT. Функция гепарина каталитическая. После об- |
||
Антитромбин (синоним - антитромбин III, |
||
разования эквимолярного 1:1 комплекса тромбин- |
||
AT) - гликопротеин, состоит из 432 аминокислот и |
антитромбин (ТАТ) гепарин может освобождать- |
|
имеет 4 участка гликолизации с разным количе- |
ся для организации других комплексов. |
|
ством сиаловых кислот. Этот ингибитор формиру- |
Нефракционированный гепарин представляет |
|
ет стабильный 1:1 комплекс с сериновыми протеа- |
собой смесь гепаринов различной молекулярной |
|
зами плазменного гемостаза. Кроме того, AT свя- |
массы. До последнего времени он широко применял- |
|
зывается со специфическими сульфатными группа- |
ся в клинической практике как антикоагулянт. В на- |
|
ми на пентасахаридных структурах гепарина. |
стоящее время большее распространение получили |
|
AT синтезируется в печени и является наиболее |
препараты низкомолекулярного гепарина (НМГ, |
|
значимым ингибитором системы свертывания кро- |
английская аббревиатура - LMWH), который полу- |
|
ви. Активности находящегося в крови здорового |
чается из гепарина химической или энзиматической |
|
человека антитромбина достаточно, чтобы ингиби- |
обработкой. Гепарин не только значительно усили- |
|
ровать в три раза больше тромбина, чем может об- |
вает активность AT, но и модулирует его ингиби- |
|
разоваться из циркулирующего протромбина. Не- |
торную активность. Для стабилизации комплекса |
|
смотря на это, уже при снижении активности AT в |
ТАТ гепарин должен быть представлен структурой, |
|
плазме ниже 60% возрастает риск патологических |
имеющей, по крайней мере, 18 моносахаридных ос- |
|
тромбозов. При изолированном дефиците активно- |
нований. Нефракционированный гепарин связыва- |
|
сти AT риск тромботических проявлений возраста- |
ется одновременно как с ферментом, так и с AT, тог- |
|
ет пропорционально степени снижения активнос- |
да как НМГ связывается только с молекулой AT |
|
ти. Помимо тромбина, AT ингибирует фактор Ха, |
(рис. 50). Нефракционированный гепарин усиливает |
|
а также факторы IХа, ХIа, ХIIа и калликреин. |
активность AT в отношении всех сериновых про- |
|
Антитромбин по структуре гомологиченα1 -ан- |
теаз каскада свертывания крови, тогда как низкомо- |
|
титрипсину. В его активном центре присутствует |
лекулярный - в основном в отношении ф.Ха. |
|
специфическая связь Arg-Ser, которая и взаимодей- |
Наиболее эффективно AT «работает» в токе |
|
ствует с сериновыми протеазами. |
||
крови. В составе протромбиназного комплекса |
||
Активность AT в десятки тысяч раз усилива- |
||
(рис. 41), содержащем также фосфолипиды, Са и |
||
ется в присутствии отрицательно заряженных гли- |
ф.Vа, фактор Ха лучше защищен от ингибирова- |
|
козаминогликанов, таких, как гепарансульфат, вхо- |
ния комплексом АТ-гепарин. |
|
дящих в структуру гликокаликса на поверхности |
|
|
эндотелиальных клеток. Аналогичное потенциру- |
|
|
Рис. 50. Эффект нефракционированного гепарина |
|
(молекулярная масса до 30 кДа) по стабилизации комп- |
|
лекса тромбин-антитромбин и низкомолекулярного гепа- |
Рис. 49. Влияние гепарина на активность фактора Ха в |
рина (молекулярная масса 3 кДа), предпочтительно влия- |
ющего в качестве кофактора на образование комплекса |
|
плазме. Гепарин существенно усиливает ингибирующий |
фактор Ха - антитромбин, ТАТ - тромбин-антитромбино- |
эффект антитромбина на фактор Ха |
вый комплекс |

Плазменные белки гемостаза
Гепарин и НМГ широко используются для про- |
дел «Внутренний путь образования протромби- |
||
филактики и лечения тромбозов. |
|
назы. Факторы контактной активации»). С1-ин- |
|
Антикоагулянтное действие |
гепарина можно |
гибитор-высокогликозилированный серпин, ин- |
|
быстро и обратимо снять внутривенным введени- |
гибирующий факторы ХПа, ХIа, калликреин, |
||
ем протаминсульфата - основного белка, содер- |
плазмин и субкомпоненты Clr и Cls первого ком- |
||
жащегося в сперме рыб и ковалентно связываю- |
понента системы комплемента. |
||
щегося с гепарином. Гепарин, помимо активации |
Вклад С1-ингибитора в систему гемостаза, ве- |
||
AT, обладает дополнительными антикоагулянтны- |
роятно, не очень велик, так как его дефицит не |
||
ми эффектами. Очень важной функцией является |
проявляется ни кровоточивостью, ни тромбозами. |
||
нейтрализация гепарином тромбоцитарного фак- |
Основное проявление дефицита С1-ингибитора - |
||
тора 4, который освобождается из а-гранул, а так- |
рецидивирующие ангионевротические отеки. |
||
же стимуляция гепарином освобождения из сосу- |
|
||
дистой стенки ингибитора внешнего пути (TFPI) |
α2-макроглобулин |
||
и кофактора гепарина П. |
|
α2-макроглобулин - гликопротеид, неспецифи- |
|
Серьезным осложнением |
гепаринотерапии |
||
ческий ингибитор протеаз. Это крупный белок с |
|||
может быть развитие гепариновой тромбоцито- |
молекулярной массой 725 000 Да. Механизм его |
||
пении и рикошетных тромбозов (см. раздел |
|||
действия отличается от такового у серпинов. Он |
|||
«Тромбоцитопения, вызванная гепарином»). |
|||
действует по принципу мышеловки, у которой |
|||
|
|
||
Комплекс тромбин-антитромбин |
|
дверца захлопывается после попадания объекта |
|
|
внутрь (рис. 51). Образуя связи с внутренними пеп- |
||
Продукт взаимодействия тромбина и AT |
|||
тидами α2-макроглобулина, протеазы не могут |
|||
(ТАТ) - неактивный комплекс, в нем тромбин и |
расщепить такой высокомолекулярный субстрат. |
||
AT быстро теряют свою активность. ТАТ удаля- |
α2-макроглобулин имеет большую емкость по свя- |
||
ется из системы циркуляции печенью в течение не- |
зыванию протеиназ, но относительно низкое срод- |
||
скольких минут. Увеличение ТАТ в системе цирку- |
ство. Он включается в физиологическую инакти- |
||
ляции свидетельствует о развитии гиперкоагуля- |
вацию протеиназ после истощения других инги- |
||
ции с увеличением образования тромбина. В част- |
биторов, обладающих высоким сродством, но от- |
||
ности, ТАТ повышен у пациентов сгипергомоцис- |
носительно низкой емкостью. Он инактивирует |
||
теинемией, которая вызывает, по-видимому, вос- |
большинство протеаз, включая ферменты системы |
||
палительную реакцию на уровне эндотелиальных |
свертывания крови и фибринолиза. Потребление |
||
клеток. У таких больных увеличен риск тромбо- |
α2-макроглобулина обычно обнаруживают в со- |
||
эмболической болезни и окклюзии артериальных |
стояниях повышенной протеолитической активно- |
||
сосудов. После лечения фолиевой кислотой и ви- |
сти, в частности при панкреатитах. У новорож- |
||
тамином В6 ТАТ значительно снижается. |
денных содержание α2-макроглобулина пример- |
||
|
|
но в 2 раза выше, чем у взрослых. |
|
Кофактор гепарина II
Другим серпином, инактивирующим тромбин, является кофактор гепарина П. Однако, в отличие от антитромбина, кофактор гепарина II более избирателен и не ингибирует активность других сериновых протеаз системы свертывания крови. Помимо тромбина, субстратом инактивации для кофактора гепарина II являются химотрипсин и катепсин Н.
С1-ингибитор
С1-ингибитор (Cl-Ing) - наиболее важный ингибитор факторов контактной активации (см. раз-
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/

Плазменные белки гемостаза
Ингибиторы коферментов
Наиболее значимым ингибитором в этой |
го, он ингибирует PAI, что приводит к усилению |
группе является система протеина С. |
фибринолиза. |
|
Активация ПС происходит на поверхности |
Система протеина С |
эндотелиальных клеток. ПС связывается с РПСЭК |
на эндотелиальной мембране и контактирует с |
|
Система протеина С включает непосредствен- |
комплексом тромбин-тромбомодулин. Проис- |
но сам протеин С (ПС) и его кофактор протеин S |
ходит ограниченный протеолиз неактивного |
(ITS). Другими компонентами системы являются |
ПС с образованием активной сериновой про- |
мембранный белок тромбомодулин(ТМ), рецеп- |
теазы. |
тор протеина С на эндотелиальных клетках |
АПС способен инактивировать факторы Va |
(РПСЭК) и С4-связывающий протеин. Система |
и Villa, расположенные на мембране активиро- |
протеина С вместе с антитромбином и ингибито- |
ванных тромбоцитов или других клеток, в при- |
ром внешнего пути - наиболее важные и эффек- |
2+ |
сутствии ионов Са . Протеин S является кофак- |
|
тивные компоненты, очищающие плазму от акти- |
тором этой реакции (рис. 52). Механизм инакти- |
вированных кофакторов плазменного гемостаза и |
вации факторов Va и VIII протеином С заклю- |
ограничивающие процесс свертывания крови. |
чается в их лизисе. Время полувыведения АПС из |
|
плазмы примерно 15 мин. |
Протеин С |
Фактор Виллебранда (vWF) защищает ф.VШ |
от протеолитического воздействия протеина .С |
|
Протеин С (ПС) - витамин-К-зависимый бе- |
При типе 2N болезни Виллебранда мутация зат- |
лок плазмы, синтезируется в печени. Активиро- |
рагивает сайт vWF, связывающий ф.VIII. Пос- |
ванный протеин С (АПС) является специфичес- |
ледний лишается защиты и подвергается уско- |
кой сериновой протеазой, сходной по структуре |
ренному разрушению АПС, что приводит к сни- |
с другими витамин-К-зависимыми сериновыми |
жению его активности в крови. ф.VIII в комплек- |
протеазами. Основная функция его в гемостазе- |
се с ф.IХ и ф.V в комплексе с ф.Х также относи- |
инактивация факторов Va и VIIIa. Помимо это- |
тельно защищены от инактивации. Основным ин- |
Рис. 52. Деградация активных факторов Va и Villa активированным протеином С (АПС), Транспортный С4-связыва-
ющий протеин (С4-СП) доставляет протеин S (F1S), участвующий как кофактор в формировании комплексов на фосфолипидной мембране

Плазменные белки гемостаза
гибитором АПС является PAI-3, который иног- |
Дефицит nS, так же как и дефицит ПС, при- |
|
да обозначают как протеин С ингибитор (ПСИ, |
водит к развитию тромбозов. Тяжесть течения |
|
в английской аббревиатуре PCI), другим ингиби- |
тромбофилии при дефиците nS также пропорци- |
|
тором АПС является α2-макроглобулин. |
ональна степени снижения его активности, а го- |
|
Значение протеина С в системе гемостаза |
мозиготные формы дефицита nS неизвестны. |
|
чрезвычайно велико. Пациенты с дефицитом про- |
На рис. 53 схематично представлена последо- |
|
теина С страдают венозными и артериальными |
вательность взаимодействий компонентов систе- |
|
тромбозами. Выраженность тромбофилии корре- |
мы протеин С - протеин S при инактивации фак- |
|
лирует с тяжестью дефицита этого белка. Паци- |
тора Va. |
|
енты с гомозиготным дефицитом протеина С не |
|
|
описаны, видимо, это состояние не совместимо с |
С4-связывающий протеин |
|
жизнью. |
||
С4-связывающий протеин (С4-СП) - острофаз- |
||
|
||
Протеин S |
ный белок, синтезируется в печени. В плазме при- |
|
сутствует в виде молекулы, содержащей 7 идентич- |
||
Протеин S (ПS) - витамин-К-зависимый бе- |
ных ос-цепей и одну β-цепь(рис. 54). Сниженный |
|
лок, синтезируемый в печени. Протеин S присут- |
уровень С4-СП имеет место у новорожденных и |
|
ствует в плазме частично в свободном состоянии, |
лиц, принимающих непрямые антикоагулянты. |
|
частично в комплексе с С4-связывающим проте- |
Повышение С4-СП наблюдается при воспалении, |
|
ином (С4-СП), который доставляет протеин S на |
активации аутоиммунных реакций, при беремен- |
|
фосфолипидную мембрану. Это важно учиты- |
ности, у женщин, принимающих стероидные |
|
вать, так как комплекс протеин S - С4-СП не об- |
контрацептивы; при этом происходит избыточное |
|
ладает кофакторной активностью по отношению |
связывание протеина S. Дефицит свободной фор- |
|
к протеину С. Только свободный протеин S явля- |
мы протеина S рассматривается как фактор рис- |
|
ется кофактором АПС. Активность АПС в коо- |
ка тромбофилии. С4-СП способен также регули- |
|
перации со свободным протеиномS значительно |
ровать активность системы комплемента, обра- |
|
выше, чем без него. |
зовывать Са-зависимые комплексы с амилоидным |
Рис. 53. Система протеина С. Активированный протеин С (АПС), сопрягаясь с теназным комплексом на фосфолипидной поверхности (активированный тромбоцит), вызывает деградацию фактора V. ТМ - тромбомодулин, С4-СП - связывающий протеин, F1S - протеин S, ПС - протеин С, На, Va - активированные плазменные факторы, Vi - деградированный фактор V
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/

Плазменные белки гемостаза
Рис. 55. Нарушения в системе протеина С, способству-
ющие развитию тромбофилий: 1 -дефицит протеина С, 2 - дефицит тромбомодулина, 3 - дефицит протеина S, 4 - резистентность к активированному протеину С
Система протеина С активно реагирует на развитие воспаления в организме. Известно, что развитие воспаления, особенно в условияхграмнегативного сепсиса значительно воздействует на гемо-
Рис. 54. Схематическое изображение α- и β-цепей статический баланс, вызывая гиперкоагуляцию. Это
С4-cвязывающего протеина и участок связываниясвязано с несколькими эффектами в системе проте- |
||
протеина S |
|
ина С. Во-первых, медиаторы воспаления подавля- |
|
|
|
Р-белком сыворотки. Определение С4-СП возмож- |
ют синтез тромбомодулина, что ведет к уменьше- |
|
нию активации протеина С. Во-вторых, в крови |
||
но методом иммунотурбидиметрии илиELISA. |
повышается активность комплемента, следствием |
|
Концентрация С4-СП в сыворотке составляет в |
этого является относительное увеличение количе- |
|
норме около 200 мкг/мл. |
|
ства связанного и уменьшение активного несвязан- |
Тромбомодулин был описан ранее в разделе, |
ного протеина S. В-третьих, фагоцитарные фер- |
|
посвященном функции эндотелия. |
менты могут отщеплять тромбомодулин от эндо- |
|
Нарушения в системе протеина С(рис. 55), |
телиальной поверхности. Он появляется в свобод- |
|
среди которых выделяют дефицит протеина С, |
ной циркуляции, но его активность в этих условиях |
|
дефицит тромбомодулина, дефицит протеина S |
значительно ниже, чем у фиксированного на мемб- |
|
и особенно резистентность к активированному |
ране. В-четвертых, стимуляция синтеза и экспрес- |
|
протеину С (РАПС), - наиболее изученная па- |
сии тканевого фактора на мембране клеток в зоне |
|
тоология, значительно |
увеличивающая риск воспаления ведет к усилению синтеза факторовIХа |
|
па-тоологического |
тромбообразования - |
и Ха и нарастанию дисбаланса. |
тромбо-филии. |
|
|
|
Ингибиторы активных комплексов |
|
Ингибитор пути тканевого фактора, или ин- |
ИВП ограничивает синтез тромбина комп- |
|
гибитор внешнего пути |
|
лексом ТФ-ф.VII-ф.Ха, блокируя его вскоре пос- |
Открытие в последнее десятилетие ингиби- |
ле образования. Один из ингибирующих доменов |
|
тора пути тканевого фактора (ИПТФ, ИВП, |
ИВП связывается с ф.Ха, после чего другой до- |
|
TFPI) стало важным шагом в пересмотре клас- |
мен реагирует с активным центром ф.VII, когда |
|
сического каскада свертывания крови и созда- |
последний связан с тканевым фактором. Аффин- |
|
ния современной каскадно-матричной теории |
ность ИВП к ф.VIIа значительно повышается в |
|
гемостаза. |
|
присутствии гепарина (рис. 56). Образуется пол- |

Плазменные белки гемостаза
Рис. 56. Механизм действия ингибитора внешнего пути (ИВП) за счет образования комплекса с фактором Ха и формирования четырехкомпонентного комплекса - фактор Vila + тканевой фактор + ИВП + фактор Ха
ностью неактивный тетрамолекулярный комп- |
рицательная связь для снижения образования |
лекс ТФ-ф.VII-ИВП ф.Х. Помимо ингибирова- |
тромбина. |
ния, ИВП способствует поглощению и деграда- |
Определение ИВП в плазме проводят мето- |
ции этого комплекса. Таким образом, во внеш- |
дом ELISA или методом с образованием факто- |
нем каскаде плазменного гемостаза формирует- |
ра Ха, который определяется в тесте с хромоген- |
ся отрицательная обратная связь. |
ным субстратом. Определение ИВП в плазме вы- |
ИВП, по-видимому, ответственен при лече- |
являет не более 5-10% общего количества ИВП в |
нии гепарином за удлинение ряда тестов коагу- |
сосудистой системе, так как основное его коли- |
лограммы, в частности АЧТВ. ИВП в плазме ча- |
чество депонируется в сосудистой стенке. Повы- |
стично связан с липопротеидами низкой и очень |
шение ИВП в плазме обнаружено после лечения |
низкой плотности (ЛПНП и ЛПОНП). В таком |
нефракционированным или низкомолекулярным |
комплексе ИВП более устойчив к инактивации. |
гепарином, при диабете и у больных с инфарк- |
Появились сообщения, что тромбин способен |
том миокарда. Есть сообщения о снижении ИВП |
стимулировать освобождение ИВП из эндотелия |
при тромботической тромбопенической пурпуре |
и ЛПНП, тем самым формируется обратная от- |
и ишемическом инсульте. |
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/

Система фибринолиза
СИСТЕМА ФИБРИНОЛИЗА
В процессе формирования гемостатической |
рого направлены все реакции системы фибрино- |
пробки активизируются механизмы, направлен- |
лиза. В рамках настоящего изложения будет рас- |
ные на ограничение роста сгустка, постепенное |
сматриваться роль компонентов системы фибри- |
растворение тромба и создание условий для нор- |
нолиза в гемостазе. |
мального кровообращения. Осуществляется эта |
Фибринолиз локализует образование фибри- |
функция благодаря системе фибринолиза. |
на в месте повреждения, сдерживает избыточное |
Система фибринолиза - протеолитическая |
фибринообразование, препятствуя окклюзии про- |
система плазмы крови, ответственная за лизис |
света сосуда. Баланс между фибринообразовани- |
фибринового сгустка, а также вовлеченная в дег- |
ем и фибринолизом (рис. 31) способствует сохра- |
радацию коллагена, ангиогенез, апоптоз и связан- |
нению окончательного тромба на весь период вос- |
ная с другими протеолитическими системами. |
становления целостности сосудистой стенки, |
Центральным ферментом системы фибринолиза после чего равновесие сдвигается в сторону фиб-
является плазмин, на регуляцию активации кото- |
ринолиза и, став ненужным, тромб растворяется. |
||||
|
Компоненты фибринолиза |
||||
Система фибринолиза, так же как и система |
активаторы, ингибиторы и конечный фермент |
||||
свертывания крови, - многокомпонентная про- |
(табл. 8). теолитическая система, в состав которой |
||||
входят |
|
|
|
|
|
|
|
|
|
Таблица 8 |
|
Основные компоненты системы фибринолиза |
|||||
|
|
|
|
|
|
Фактор |
Концентрация |
|
Период |
Функция |
|
|
(мг/л) |
полувыведения |
|
|
|
|
|
|
|
|
|
1 |
2 |
|
3 |
4 |
|
Плазминоген |
200 |
|
2,2 дня |
Профермент (предшественник плазмина) |
|
Активатор плазминогена тканевого |
0,005 |
|
4 мин |
Протеаза, активирует плазминоген |
|
типа (t-PA) |
|
|
|
|
|
Урокиназный активатор плазми- |
0,002 |
|
7 мин |
Протеаза, активирует плазминоген |
|
ногена (и-РА) |
|
|
|
|
|
Ингибитор активатора плазмино- |
0,01 |
|
8 мин |
Ингибитор t-PA и и-РА |
|
гена 1-го типа (PAI-1) |
|
|
|
|
|
Фактор XII |
30 |
|
2-3 дня |
Профермент. Участвует в реакции актива- |
|
|
|
|
|
ции плазминогена |
|
Прекалликреин |
40 |
|
— |
Профермент. Участвует в реакции актива- |
|
|
|
|
|
ции плазминогена |
|
Высокомолекулярный кининоген |
70 |
|
5 дней |
Кофактор. Участвует в реакции активации |
|
|
|
|
|
плазминогена |
|
Витронектин |
350 |
|
- |
Кофактор PAI-1 |
|
|
|
|
|
|
|

Система фибринолиза
|
|
|
|
|
Окончание табл. 8 |
|
|
|
|
|
|
|
|
1 |
|
2 |
3 |
|
4 |
|
С1-ингибитор |
|
180 |
70 ч |
|
Ингибитор ф.ХПа. калликреина, плазмина |
|
а2-антиплазмин |
|
70 |
3 дня |
|
Ингибитор плазмина |
|
а2-макроглобулин |
|
2500 |
— |
|
Ингибитор плазмина. калликреина, |
|
|
|
|
|
|
урокиназы, t-PA и др. |
|
Богатый гистидином гликопротеин |
|
100 |
3 дня |
|
Ингибитор плазмина |
|
Аполипопротеин(а) |
|
<70 |
- |
|
Снижает фибринолиз |
|
Активируемый тромбином инги- |
|
5 |
10 мин |
|
Предшественник ингибитора (зимоген) |
|
битор фибринолиза |
|
|
|
|
|
|
Рецептор урокиназного активатора |
|
— |
— |
|
Рецептор u-PAR, модулирующий |
|
плазминогена (u-PAR) |
|
|
|
|
его активность |
|
Аннексии II |
|
— |
— |
|
Рецептор t-PA, активирующий |
|
|
|
|
|
|
его функцию |
|
Рецептор LRP/o^-макроглобулина |
|
— |
— |
|
Рецептор t-PA, способствующий |
|
|
|
|
|
|
его элиминации |
|
Рецептор маннозы |
|
— |
— |
|
Рецептор t-PA, способствующий |
|
|
|
|
|
|
его элиминации |
|
|
|
|
Плазминоген |
|||
Плазминоген - одноцепочечный гликопроте- |
|
Активация плазминогена осуществляется, в |
||||
ин. Концентрация его составляет примерно2 мик- |
основном, 2 специфическими протеазами - акти- |
|||||
ромоля в литре плазмы. У женщин в последнем |
ватором плазминогена тканевого типа и уроки- |
|||||
триместре беременности активность плазминоге- |
назой. Кроме того, плазминоген может связывать- |
|||||
на повышается. Основное место синтеза плазми- |
ся с фибрином и активироваться в комплексе с |
|||||
ногена - печень, однако он обнаруживается и в |
ним. Связанный с фибрином плазмин относитель- |
|||||
эозинофилах, клетках почек, роговице. Возмож- |
но защищен от инактивации. В токе же крови |
|||||
но, в этих тканях он также синтезируется. В сис- |
плазмин очень быстро (примерно за 0,1 с) инак- |
|||||
теме циркуляции плазминоген связан с богатым |
тивируется ингибиторами. |
|||||
гистидином гликопротеином. |
|
|
|
|
|
|
Активатор плазминогена тканевого типа
Активатор плазминогена тканевого типа (t-PA) является сериновой протеазой. Он высокоспецифичен; его единственным доказанным субстратом является плазминоген. Видимо, t-PA - основной физиологический активатор фибринолиза в просвете сосуда. Основным местом синтеза t-PA является эндотелий. Помимо эндотелия, t-PA синтезируется во многих других клетках: моноцитах, мегакариоцитах, мезотелиальных клетках, мышечных клетках сосудов, фибробластах сердца и др. Большая часть плазменного t-PA связана с его основным ингибитором PAI-1. Как связанный, так и свободный активатор быстро удаляются из тока крови клетками печени.
Помимо активации фибринолиза, t-PA участвует в противовоспалительных реакциях, стимуляции пролиферации эндотелия. Есть данные, что t-PA может активировать ф.VII.
Функция t-PA связана с наличием ряда рецепторов. Рецепторы t-PA делятся на 2 большие группы - активирующие и удаляющие.
Активирующие t-PA-рецепторы располагаются на клеточных поверхностях и усиливают активацию плазминогена t-PA. Наиболее изученным активирующим t-PA-рецептором является аннексин II. Избыточная экспрессия аннексина II у пациентов с промиелоцитарным лейкозом ведет к гиперфибринолизу с геморрагическими проявлениями.
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
