
5 курс / Госпитальная педиатрия / 2 том Респираторная медицина
.pdf
Раздел 9
тальному исходу заболевания. Так, известно, в частности, что степень тяжести ВП ассоциируется с генетическими изменениями локуса ИЛ-10. Другое генетическое отклонение, связываемое с модификацией белка теплового шока, характеризуется возрастанием риска развития септического шока при пневмонии.
Ко второй разновидности неэффективности лечения больных ВП в стационаре относят «персистирующую» пневмонию или пневмонию, «не отвечающую» должным образом на антибиотикотерапию. В данном случае имеет место замедленное обратное развитие клинических симптомов заболевания, наблюдаемое в 15–25% случаев.
Ожидаемые сроки разрешения клинических симптомов пневмонии у больных, демонстрирующих адекватный «ответ» на антибактериальную терапию, представлены на рис. 9.11.
Лихорадка на фоне адекватного лечения регрессирует на 2–4-е сутки лечения. К числу других критических точек, определяющих эффективность терапии, относят частоту сердечных сокращений и дыхательных движений, показатели систолического артериального давления, сатурации гемоглобина кислородом и пр. (так называемые критерии клинической стабильности). При адекватном «ответе» среднее время достижения соответствующих значений вышеуказанных критериев составляет 3 сут; напротив, для пациентов с «персистирующей» пневмонией этот временной отрезок составляет 6 дней и более. Причинами неэффективности лечения в случаях «персистирующей» ВП могут служить обострение/декомпенсация сопутствующих заболеваний, присоединение нозокомиальной суперинфекции, а также многочисленные неинфекционные заболевания, нередко ошибочно принимаемые за пневмонию, а именно тромбоэмболия легочной артерии (ТЭЛА), системные васкулиты, сердечная недостаточность, лекарственные пневмопатии, легочные эозинофилии и др.
В значительной части случаев (>40%) неэффективность терапии как при «прогрессирующей»,
так и «персистирующей» пневмонии обусловливается инфекционными причинами; при этом может иметь место как первичная инфекция, вызванная, в частности, лекарственно-устойчивыми штаммами возбудителей, так нозокомиальная суперинфекция. В ряду наиболее частых микробиологических находок фигурируют S. pneumoniae,
L.pneumophila, S. aureus и P. aeruginosa.
Ксожалению, в реальной клинической практике конкретную причину неэффективности антибактериальной терапии ВП не удается установить едва ли не в половине случаев.
Выделение представленных разновидностей неэффективности лечения ВП имеет важное практическое значение, так как определяет дальнейшую тактику ведения пациента. Очевидно, что модификация антибактериальной терапии оправдана только при «прогрессирующей» пневмонии, в случаях получения данных микробиологических исследований, указывающих на выделение культуры микроорганизма с природной или приобретенной устойчивостью к назначавшимся АМП или при открывшихся эпидемиологических данных, позволяющих предполагать альтернативную этиологию заболевания.
В определенных клинических ситуациях, когда на фоне улучшения клинической картины к исходу 4-й недели (30 дней) от начала заболевания не удается достичь полного рентгенологического выздоровления, следует говорить о неразрешающейся (медленно разрешающейся) или затяжной ВП. Данный вариант течения заболевания рассматривается отдельно от пневмонии, «не отвечающей» на лечение, и требуют иных подходов к ведению больного.
Если анализу причин неэффективности лечения ВП было посвящено довольно много исследований, то предикторы (факторы риска) неэффективности стали изучаться относительно недавно. Так, в частности, были установлены следующие прогностические факторы неэффективности эмпирической антибактериальной терапии: прожи-
Все симптомы  21 (21–28)
21 (21–28)
Слабость,  14 (6–21) утомляемость
14 (6–21) утомляемость
Кашель  14 (7–21)
14 (7–21)
Тахипноэ  6 (5–14)
6 (5–14)
Миалгия  5 (4–6)
5 (4–6)
Лихорадка  3 (2–4)
3 (2–4)
0 |
5 |
10 |
15 |
20 |
25 |
|
|
|
Дни |
|
|
Рис. 9.11. Среднее время разрешения клинических симптомов у больных внебольничной пневмонией [78]
60

Респираторные инфекции
вание в доме престарелых, сопутствующие заболевания печени и желудочно-кишечного тракта. Достоверно ассоциировались с увеличением риска неэффективности лечения больного ВП лейкопения и гипонатриемия, мультилобарное поражение легочной ткани. Осложнения пневмонии (абсцедирование, плевральный выпот) увеличивали риск развития отрицательного «ответа» на терапию в 2–4 раза; неэффективность антибиотикотерапии чаще отмечалась у пациентов с тяжелым течением заболевания (35 и 13,5% пациентов, отнесенных к IV и V классам риска по шкале «Исследование исходов пневмонии» соответственно).
Интересным представлялся факт того, что у пациентов с сопутствующей ХОБЛ частота терапевтических неудач оказалась ниже, что могло быть связано с терапией ингаляционными глюкокортикоидами (ИГК), которые обладают мощным противовоспалительным действием. Впрочем, подтверждение данного предположения требует дополнительных исследований.
Предшествующая вакцинация антипневмококковой вакциной также характеризовалась снижением риска общей неэффективности лечения.
Была выявлена отчетливая связь между частотой терапевтических неудач и этиологией ВП: отмечено, в частности, что пневмония, вызываемая Legionella spp. и грамотрицательными микроорганизмами, ассоциируется с риском ранней неэффективности антибактериальной терапии. Другим важным фактором риска неэффектив-
ности лечения оказалось применение АМП, не соответствующих современным клиническим рекомендациям.
Анализируя установленные факторы риска неэффективности лечения ВП (табл. 9.22), с практической точки зрения важно выделить ряд факторов, поддающихся модификации (пересмотр тактики антибактериальной терапии), а также те клинические ситуации (например, пневмония, вызванная грамотрицательными микроорганизмами, «болезнь легионеров» и пр.), развитие которых возможно предугадать при анализе клинико-эпи- демиологических данных или установить с помощью современных методов экспресс-диагностики.
Анализируя представленные данные, важно подчеркнуть, что одним из важнейших независимых факторов риска ранней неэффективности лечения является проводимая антибактериальная терапия, не соответствующая клиническим рекомендациям. Данное положение наиболее актуально для амбулаторного лечения ВП. Например, в РФ среди наиболее частых ошибок антибактериальной терапии ВП в амбулаторной практике фигурирует назначение цефазолина (низкая антипневмококковая активность, отсутствие клинически значимой активности в отношении H. influenzae), ципрофлоксацина (низкая активность в отношении S. pneumoniae и M. pneumoniae), ко-тримоксазола [сульфаметоксазола + триметоприма] (высокая распространенность в РФ резистентных к антибиотику штаммов S. pneumoniae
Таблица 9.22. Факторы риска неэффективности антибактериальной терапии внебольничной пневмонии [79]
Факторы риска |
Неэффективность лечения |
Ранняя неэффективность |
||||
|
|
в целом |
|
лечения |
||
|
|
|
|
|
|
|
|
снижение |
|
повышение |
снижение |
|
повышение |
|
риска |
|
риска |
риска |
|
риска |
Возраст >65 лет |
– |
|
– |
0,35 |
|
– |
|
|
|
|
|
|
|
ХОБЛ |
0,60 |
|
– |
– |
|
– |
|
|
|
|
|
|
|
Заболевания печени |
– |
|
2,0 |
– |
|
– |
|
|
|
|
|
|
|
Применение гриппозной вакцины |
0,30 |
|
– |
– |
|
– |
|
|
|
|
|
|
|
Плевральный выпот |
– |
|
2,7 |
– |
|
– |
|
|
|
|
|
|
|
Мультилобарная инфильтрация |
– |
|
2,1 |
– |
|
1,81 |
|
|
|
|
|
|
|
Абсцедирование |
– |
|
4,1 |
– |
|
– |
|
|
|
|
|
|
|
Лейкопения |
– |
|
3,7 |
– |
|
– |
|
|
|
|
|
|
|
Высокий класс риска по шкале иссле- |
– |
|
1,3 |
– |
|
2,75 |
дования «Исследование исходов |
|
|
|
|
|
|
пневмонии» (IV и V классы) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Легионеллезная пневмония |
– |
|
– |
– |
|
2,71 |
|
|
|
|
|
|
|
Пневмония, вызываемая грамотрица- |
– |
|
– |
– |
|
4,34 |
тельными микроорганизмами |
|
|
|
|
|
|
|
|
|
|
|
|
|
Терапия «респираторными» фторхи- |
0,5 |
|
– |
– |
|
– |
нолонами |
|
|
|
|
|
|
|
|
|
|
|
|
|
Терапия, соответствующая рекомен- |
– |
|
– |
0,61 |
|
– |
дациям |
|
|
|
|
|
|
|
|
|
|
|
|
|
Терапия, не соответствующая реко- |
– |
|
– |
– |
|
2,51 |
мендациям |
|
|
|
|
|
|
61

Раздел 9
и H. influenza), ампициллина для приема внутрь (низкая биодоступность препарата — 40%; для сравнения у амоксициллина — 75–93%) и доксициклина (высокая распространенность в РФ резистентных к антибиотику штаммов S. pneumoniae).
Другой важной проблемой, характерной для амбулаторной практики лечения ВП и обусловливающей значительное число случаев неэффективности терапии, является низкая комплаентность пациентов. Справедливость этого заключения многократно подтверждалась результатами клинических исследований, демонстрировавших значительное снижение эффективности антибиотикотерапии ВП при несоблюдении пациентами предписанного режима лечения. Проведенное в России исследование показало, что каждый второй пациент, получающий антибиотики, не соблюдает график приема препаратов, а 3% вовсе не соблюдают рекомендации врача.
Ведение пациентов с ВП, «не отвечающей» на лечение, предполагает следующий алгоритм действий:
1)перевод больного на более высокий уровень лечения (то есть госпитализация больного в случае первоначального амбулаторного лечения или перевод пациента из отделения общего профиля в ОРИТ);
2)пересмотр тактики антибактериальной терапии;
3)проведение целенаправленного диагностического поиска.
Очевидно, что первым врачебным действием при лечении ВП у госпитализированных больных является тщательный пересмотр анамнестических, эпидемиологических и клинических данных, позволяющих определить альтернативную этиологию пневмонии, анализ факторов риска инфицирования полирезистентными штаммами микроорганизмов, полноценное микробиологическое обследование и последующее модифицирование антибактериальной терапии с учетом выявленных причин неэффективности лечения. Безусловным подспорьем в обсуждаемой клинической ситуации могут оказаться данные микробиологической диагностики и оценки чувствительности выделенного микроорганизма к антибиотикам, которые чаще всего доступны на 2–3-е сутки от начала лечения. Впрочем, стоит заметить, что, по некоторым данным, целенаправленная модификация антибактериальной терапии с учетом результатов микробиологической диагностики демонстрирует сравнимую летальность с эмпирически назначенным лечением — 67 и 64% соответственно.
Однако даже отсутствие положительного микробиологического результата (например, отсутствие синегнойной палочки или MRSA в исследуемом материале) заставляет принять решение о дальнейшем системном диагностическом поиске (лучевая диагностика высокого разреше-
ния, инструментальные и лабораторные методы). Известно, что такой подход обследования больных
сВП, «не ответившей» на лечение, приводит к постановке специфического диагноза в 70% случаев.
При ухудшении состояния больного и прогрессировании симптомов заболевания необходимо проводить повторные посевы крови, так как в данном случае возникает риск развития вторичной бактериемии. Несмотря на предшествующую антибиотикотерапию, данное исследование имеет большую диагностическую ценность, так как в случае положительного результата посева крови на фоне адекватной антибактериальной терапии можно сделать вывод о наличии антибиотикорезистентных штаммов возбудителей либо о появлении других очагов инфекции (например, эндокардит).
Впоследние годы все большее внимание привлекает исследование сывороточного уровня С-реактивного белка и прокальцитонина. Показано, в частности, что наиболее высокая концентрация С-реактивного белка отмечается у пациентов с тяжелой пневмококковой или легионеллезной пневмонией, а также может рассматриваться как самостоятельный фактор неэффективности антибактериальной терапии. Уровень прокальцитонина также коррелирует с тяжестью состояния больных ВП и может быть предиктором развития осложнений и неблагоприятного исхода заболевания. Впрочем, окончательного мнения о целесообразности использования вышеуказанных тестов для дифференциации этиологии и определения тяжести состояния пациентов пока нет.
Безусловно, важным в ходе обследования являются выявление возможных иммунологических нарушений и последующая их коррекция (наряду
спересмотром тактики антибактериальной терапии). В настоящее время в общетерапевтической и пульмонологической практике нередкими стали случаи пневмоцистной пневмонии (возбудитель — Рneumocystis jiroveci), являющейся едва ли не основным клиническим проявлением у больных СПИДом. В связи с этим всем поступающим в стационар больным показан ИФА для обнаружения антител к ВИЧ.
Вряде случаев на фоне применения β-лак- тамных антибиотиков наблюдается лекарственная лихорадка, требующая отмены антибиотика. Кроме этого, при приеме пенициллина (реже других β-лактамных антибиотиков), сульфаниламидов возможно развитие аллергического (гиперчувствительного) васкулита, манифестирующего геморрагической сыпью и легочными инфильтратами. Диагноз подтверждают данными биопсии участков кожи, где выявляют признаки васкулита мелких сосудов. Важнейшим фактором риска развития гиперчувствительного васкулита является аллергическая реакция на ЛС в анамнезе.
И, конечно, следует помнить о том, что неэффективность лечения может быть обусловлена внелегочными очагами инфекции (инфекции
62

Респираторные инфекции
кожи, мочевых путей, брюшной полости, кате- тер-ассоциированные инфекции), в том числе нозокомиального характера, что обусловливает дальнейший диагностический поиск и микробиологическое исследование актуального материала.
В числе необходимых методов диагностики, применяемых при ведении пациентов с ВП, «не отвечающей» на лечение, следует прежде всего упомянуть КТ органов грудной клетки, фибробронхоскопию и торакоцентез, результаты которых дают возможность заподозрить, а порой и диагностировать альтернативное пневмонии заболевание. КТ органов грудной клетки, помимо исключения неинфекционных заболеваний (например, бронхиолит с организующейся пневмонией), позволяет диагностировать целый ряд других причин неэффективности лечения пневмонии — осложненный плеврит/эмпиему, абсцесс легкого и пр. Применение КТ целесообразно у пациентов с выявленными ранее при рентгенографии нетипичными для пневмонии изменениями (обтурационный ателектаз, инфаркт легкого на почве ТЭЛА и пр.), при рецидивирующей пневмонии (повторно возникающие инфильтративные изменения в одной и той же доле/сегменте), а также в случае затяжной пневмонии.
Бронхоскопия позволяет выявить ряд патологических процессов (мукоидная закупорка бронха, бронхогенная карцинома и пр.), а микробиологическое исследование жидкости БАЛ/материала щеточной биопсии обладает большей ценностью, чем рутинное культуральное исследование мокроты. Так, исследование жидкости БАЛ с использованием специальной окраски серебром или имму-
нофлюоресцентным красителем характеризуется высокой специфичностью и чувствительностью
вдиагностике P. jiroveci-инфекции. По данным одного из исследований, у 44% больных ВП, «не ответившей» на лечение, этиология заболевания была установлена именно при бронхоскопии.
При наличии плеврального выпота с толщиной слоя свободно смещаемой жидкости на латерограмме >10 мм показан торакоцентез с последующим исследованием плевральной жидкости (окрашивание мазков по Граму и на кислотоустойчивые бациллы; посев на аэробы, анаэробы, МБ; подсчет лейкоцитов с лейкоцитарной формулой; определение рH, активности ЛДГ, содержание белка и пр.). Например, лимфоцитарный плевральный выпот позволяет заподозрить наличие у пациента туберкулеза легких.
Сводный анализ причин неэффективности лечения ВП и способов их коррекции представлен
втабл. 9.23.
При получении данных микробиологической диагностики, свидетельствующих о выделении соответствующего пневмотропного микроорганизма, проводится целенаправленная терапия. Так, при обнаружении MRSA к стандартной антибактериальной терапии следует добавить ванкомицин или линезолид. При выделении культуры P. aeruginosa препаратами выбора являются цефтазидим, цефепим, цефоперазон + сульбактам, тикарциллин + клавулановая кислота, пиперациллин + тазобактам, карбапенемы (меропенем, имипенем), ципрофлоксацин, левофлоксацин. Все вышеуказанные препараты можно применять как в рамках монотерапии, так и с аминогликозидами (амикацином).
Таблица 9.23. Причины неэффективности антибактериальной терапии внебольничной пневмонии и способы их коррекции [80]
Предполагаемая причина |
Метод |
неэффективности терапии |
коррекции |
|
|
Неадекватная антибактериальная терапия |
Пересмотр лечения в соответствии с требованиями национальных/ |
|
международных клинических рекомендаций |
Предполагаемая низкая комплаентность |
Госпитализация больного, назначение парентеральной терапии |
пациента |
|
Первоначальная недооценка тяжести |
Госпитализация, перевод в ОРИТ |
состояния больного |
|
|
|
Предполагаемая антибиотикорезистент- |
Пересмотр терапии в пользу антибиотиков, преодолевающих распро- |
ность микроорганизмов |
страненные механизмы лекарственной устойчивости возбудителей |
|
(учет данных микробиологической диагностики) |
|
|
Внелегочные очаги инфекции (эндокардит, |
Посев крови, диагностический поиск, модификация антибактериальной |
менингит и пр.) |
терапии |
|
|
Осложнения пневмонии (абсцесс легкого, |
Торакоцентез, пересмотр тактики антибактериальной терапии с учетом |
эмпиема плевры) |
актуальных (предполагаемых или выделенных) возбудителей |
|
|
Альтернативный диагноз (ТЭЛА, эндокар- |
КТ, бронхоскопия и пр. |
дит трикуспидального клапана, облитери- |
|
рующий бронхиолит с организующейся |
|
пневмонией, системные васкулиты и пр.) |
|
|
|
Нозокомиальная суперинфекция |
Своевременная диагностика, адекватная антибактериальная терапия |
|
|
63

Раздел 9
При подозрении на аспирацию предпочте- |
неполным разрешением к исходу 4-й недели от |
|
ние следует отдавать антибиотикам, активным в |
начала заболевания при улучшении клинической |
|
отношении широкого круга аэробных грамотри- |
картины (в частности, достижении апирексии и |
|
цательных возбудителей и анаэробов — амокси- |
пр.) на фоне проводимой антибактериальной те- |
|
циллину + клавулановой кислоте, цефоперазону + |
рапии». |
|
сульбактаму, тикарциллину + клавулановой кис- |
Причины медленного разрешения очагово-ин- |
|
лоте, пиперациллину + тазобактаму, карбапене- |
фильтративных изменений в легких разнообразны |
|
мам (меропенему, имипенему). |
и связываются с характеристиками возбудителя, |
|
Полученные положительные данные о наличии |
особенностями клинического течения заболева- |
|
гриппозной инфекции позволяют принять своев- |
ния и факторами «хозяина». Здесь же следует упо- |
|
ременное решение о проведении антивирусной |
мянуть и многочисленный перечень заболеваний/ |
|
терапии ингибиторами нейраминидазы (осельта- |
патологических состояний, синдромосходных с |
|
мивир, занамивир). |
пневмонией (рис. 9.12). |
|
Медленно разрешающаяся/неразрешающаяся |
Причины затяжного течения ВП, связанные |
|
с пациентом, как правило, оказывают более су- |
||
внебольничная пневмония |
||
щественное влияние на клинико-рентгенологиче- |
||
Термин «медленно разрешающаяся/неразре- |
скую эволюцию заболевания, нежели известные |
|
шающаяся» ВП принят для обозначения тех слу- |
характеристики возбудителя (вирулентность, ле- |
|
чаев заболевания, когда рентгенологические изме- |
карственная устойчивость). В числе важнейших |
|
нения сохраняются достаточно длительное время, |
факторов медленного рентгенологического раз- |
|
превосходя ожидаемые сроки обратного развития |
решения пневмонии следует выделить пожилой/ |
|
очагово-инфильтративных изменений в легких. |
старческий возраст пациента и наличие у него |
|
Пожалуй, наиболее точное определение медленно |
сопутствующих инвалидизирующих заболеваний |
|
разрешающейся/неразрешающейся ВП было дано |
внутренних органов. Так, лишь у 30% больных в |
|
S.H. Kirtland и R.H. Winterbauer: «…медленный |
возрасте старше 50 лет спустя 4 нед от начала лече- |
|
регресс рентгенологических изменений у имму- |
ния наблюдается полное исчезновение пневмони- |
|
нокомпетентных больных, характеризующийся |
ческой инфильтрации, в то время как у пациентов |
|
уменьшением размеров пневмонической инфиль- |
молодого/среднего возраста рентгенологическое |
|
трации менее чем на 50% к исходу 2-й недели и |
выздоровление в эти сроки наблюдается более чем |
Причины медленно разрешающейся/ неразрешающейся ВП
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Связанные |
|
Связанные |
|
|
Связанные |
|
Альтернативный |
||||
с возбудителем: |
|
с пациентом: |
|
|
с самим |
|
диагноз: |
||||
|
|
|
|
|
|
|
заболеванием: |
|
|
|
|
• Пневмония, вызванная |
|
• Возраст старше 50 лет |
|
|
• Тяжелое течение ВП |
|
• Туберкулез |
||||
высоковирулентными |
|
• Наличие сопутствующих |
|
|
• Наличие осложнений |
|
• Новообразования (рак легкого, |
||||
микроорганизмами: |
|
заболеваний |
|
|
(парапневмонический |
|
метастатическая болезнь |
||||
– Legionella |
|
внутренних органов |
|
|
плеврит, абсцесс |
|
легких, аденома бронха, |
||||
pneumophila |
|
(ХОБЛ, застойная |
|
|
легкого, эмпиема |
|
лимфопролиферативные |
||||
– Staphylococcus |
|
сердечная |
|
|
плевры) |
|
заболевания) |
||||
aureus |
|
недостаточность, |
|
|
• Вторичная |
|
• ТЭЛА и инфаркт легкого |
||||
– Enterobacteriaceae |
|
почечная |
|
|
бактериемия |
|
• Иммунопатологические |
||||
• Возбудители ВП, |
|
недостаточность, |
|
|
|
|
|
заболевания (системные |
|||
|
злокачественные |
|
|
|
|
|
|||||
устойчивые |
|
|
|
|
|
|
васкулиты, волчаночный |
||||
|
новообразования, |
|
|
|
|
|
|||||
к антибиотикам |
|
|
|
|
|
|
пневмонит, аллергический |
||||
|
сахарный диабет и др.) |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
бронхолегочный аспергиллез, |
|||
|
|
|
• Иммунодефицитные |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
идиопатическая |
|||
|
|
|
состояния/заболевания; |
|
|
|
|
|
организующаяся пневмония, |
||
|
|
|
• Алкоголизм |
|
|
|
|
|
эозинофильная пневмония) |
||
|
|
|
• Курение |
|
|
|
|
|
• Прочие заболевания |
||
|
|
|
|
|
|
|
|
|
|
(застойная сердечная |
|
|
|
|
|
|
|
|
|
|
|
недостаточность, |
|
|
|
|
|
|
|
|
|
|
|
лекарственная пневмопатия, |
|
|
|
|
|
|
|
|
|
|
|
аспирация инородного тела, |
|
|
|
|
|
|
|
|
|
|
|
саркоидоз, альвеолярный |
|
|
|
|
|
|
|
|
|
|
|
протеиноз, липоидная |
|
|
|
|
|
|
|
|
|
|
|
пневмония, округлый ателектаз) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 9.12. Причины медленно разрешающейся/неразрешающейся внебольничной пневмонии [81]
64

Респираторные инфекции
в90% случаев. У 70–80% пациентов с сопутствующими заболеваниями (ХОБЛ, застойная сердечная недостаточность, почечная недостаточность, сахарный диабет и пр.) также наблюдается затяжное (более 4 нед) разрешение ВП. В этом перечне особое место занимает застойная сердечная недостаточность. Во-первых, при этом заболевании нередко ошибочно диагностируется пневмония, что «побуждает» к неоправданному назначению антибиотиков. Во-вторых, венозное полнокровие
вмалом круге кровообращения вследствие «застоя» сурфактанта и нарушения лимфатического дренажа обусловливает предрасположенность к бактериальной инвазии и оказывается одной из причин медленного разрешения пневмонической инфильтрации.
Медленное рентгенологическое выздоровление наблюдается у немалого числа (35–75%) больных хроническим алкоголизмом, а курение табака угнетает мукоцилиарный клиренс и является самостоятельным фактором риска инвазивной пневмококковой инфекции. Кроме этого, курение сопряжено с повышенным риском пневмококковой бактериемии и рассматривается как самостоятельный фактор риска легионеллезной инфекции.
Отдельно необходимо выделить случаи пневмонии у лиц с иммунодефицитом, практически всегда сопровождающиеся синдромом затяжного рентгенологического разрешения. У ВИЧинфицированных больных обычно диагностируется пневмония, вызываемая S. pneumoniae и H. influenzae, однако при снижении числа лимфоцитов СD4+ <0,2×109/л чаще других развивается пневмоцистная пневмония (возбудитель — Р. jiroveci), являющаяся ведущей оппортунистической инфекцией при СПИДе. При этом на рентгенограмме органов грудной клетки у большинства пациентов (>85%) визуализируются ограниченные или диффузные двусторонние затенения (при КТ наблюдается картина «матового стекла»), формируются полосные образования. Примечательно, что в 15–25% случаев, несмотря на демонстративную клиническую симптоматику (лихорадка, признаки интоксикации, одышка), рентгенограмма может оставаться малоизмененной или интактной. Пациентам из групп риска (молодые люди, предполагаемые внутривенные наркоманы) с замедленным регрессом клинико-рентгенологи- ческих симптомов пневмонии показаны ИФА для обнаружения антител к ВИЧ, микробиологическая диагностика пневмоцистоза — микроскопия окрашенных мазков мокроты, ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами с последующей модификацией антибактериальной терапии.
Пневмония у пациентов с иммунодефицитными заболеваниями/состояниями характеризуется, как правило, тяжелым/осложненным течением и медленным регрессом клинико-рентгенологиче-
ских симптомов заболевания. Нередкими микробиологическими находками у такого рода больных наряду со S. pneumoniae, H. influenzae, S. aureus оказываются Р. jiroveci, а также цитомегаловирусная и грибковая инфекции. Подозрение на вторичные иммунодефициты должно возникать всякий раз
уистощенного больного, в случаях диагностики солидных злокачественных новообразований, диффузных заболеваний соединительной ткани, гемобластозов, при приеме системных ГК, а также
уреципиентов донорских органов.
Важной причиной медленного разрешения ВП является тяжелое течение заболевания, при котором средние сроки рентгенологического выздоровления составляют около 10 нед. Мультилобарная пневмоническая инфильтрация и вторичная бактериемия также являются независимыми факторами риска затяжного течения пневмонии.
Еще одним из возможных факторов риска медленно разрешающейся ВП нередко оказывается неэффективная стартовая антибактериальная терапия, в свою очередь, обусловливаемая выбором антибиотика, неактивного в отношении возбудителя/возбудителей заболевания (приобретенная или природная устойчивость), нарушениями режима дозирования и пр.
Затяжное течение ВП закономерно часто корреспондирует с такими осложнениями заболевания, как абсцесс легкого или осложненный плеврит/эмпиема плевры, которые нередко разрешаются с образованием постпневмонического пневмоплеврофиброза.
На первый взгляд парадоксальным представляется тот факт, что пневмококк, являющийся ведущим возбудителем ВП, обусловливает и большинство случаев затяжного течения заболевания. Между тем еще в одном из первых исследований, посвященных изучению причин медленно разрешающейся пневмонии, было показано, что рентгенологическое выздоровление пневмококковой пневмонии к исходу 4-й недели отмечалось у 91% больных с однодолевым поражением легких и только в 56% случаев — при мультилобарной распространенности процесса.
В числе известных причин затяжного течения пневмококковой пневмонии фигурируют полирезистентные S. pneumoniae и вторичная бактериемия. В последнем случае сроки полного обратного развития пневмонической инфильтрации составляют 3–5 мес.
При пневмонии, вызванной L. pneumophila, практически во всех случаях наблюдается длительное сохранение инфильтративных изменений в легких. Отчасти это связано с тем, что больные «не отвечают» должным образом на эмпирическую антибактериальную терапию, что сопровождается как клиническим, так и рентгенологическим ухудшением. Смена антибиотиков с назначением макролидов или «респираторных» фторхинолонов позволяет добиться выздоровления, но при
65

Раздел 9
этом рентгенологическое разрешение запаздывает порой до 6–12 мес. Впрочем, и в случаях адекватной стартовой антибактериальной терапии для «болезни легионеров» характерным является медленное обратное развитие очагово-инфильтратив- ных изменений и высокая частота образования постпневмонического пневмофиброза. Показано,
вчастности, что у 65% больных с легионеллезной пневмонией рентгенографические изменения
влегких сохраняются и спустя 8 нед от начала заболевания. Согласно результатам целого ряда исследований рентгенологическое выздоровление наблюдается в течение первых 4 нед в среднем у 12% (от 0 до 29%) и сохраняется более 12 нед у 54% (от 42 до 70%) больных.
Для микоплазменной пневмонии характерно нетяжелое течение; однако лишь в 40% случаев к исходу 4-й недели заболевания достигается рентгенологическое выздоровление, тогда как в остальных случаях для этого требуется не менее 8 нед.
Пневмония, вызываемая C. pneumoniae, также протекают нетяжело и характеризуются быстрым разрешением клинико-рентгенологиче- ских симптомов, особенно у молодых пациентов. В большинстве случаев сроки разрешения пневмонической инфильтрации при этой форме ВП не превышают 4 нед, но у 20% больных могут достигать 8–9 нед. Более того, остаточные изменения в виде постпневмонического пневмофиброза сохраняются у 10–20% пациентов.
Вотношении других возбудителей известно, что пневмония, вызываемая H. influenzae, более чем в половине случаев сопровождается длительным (в среднем 6 нед) разрешением пневмонической инфильтрации. ВП, вызываемая аэробными грамотрицательными энтеробактериями, характеризуется, как правило, более тяжелым течением и практически всегда сопровождается длительным сроком рентгенологического выздоровления. Стафилококковая пневмония характеризуется закономерно частым формированием деструктивных изменений в легких; разрешение заболевания медленное, часто с исходом в локальный пневмофиброз.
Антибиотикорезистентность возбудителей ВП также может оказаться причиной затяжного заболевания. В этой связи важное значение приобретают знание врачом локальной эпидемиологии резистентности основных возбудителей пневмонии и учет известных факторов риска полирезистентности S. pneumoniae.
Перечень заболеваний, протекающих под маской собственно пневмонии, чрезвычайно разнообразен (см. рис. 9.12), поэтому в случаях медленно разрешающейся/неразрешающейся ВП поиск альтернативного заболевания приобретает порой решающее значение. В целом более чем у 20% больных с синдромом «затяжной» пневмонии устанавливается альтернативный диагноз.
Впервую очередь следует учесть возможные факторы риска медленного рентгенологического выздоровления:
•возраст старше 55 лет;
•алкоголизм, курение;
•наличие сопутствующих заболеваний внутренних органов (ХОБЛ, застойная сердечная недостаточность, почечная недостаточность, злокачественные новообразования, сахарный диабет и др.);
•тяжелое течение ВП;
•мультилобарная инфильтрация;
•наличие осложнений ВП (плевральный выпот, эмпиема плевры, абсцесс легкого);
•вторичная бактериемия;
•высоковирулентные возбудители (L. pneumophila, S. aureus, грамотрицательные энтеробактерии);
•лекарственно-устойчивые штаммы возбудителей.
Втех случаях, когда у пациента присутствуют факторы риска медленного разрешения пневмонии, но при этом наблюдается отчетливое клиническое улучшение, целесообразна выжидательная тактика с проведением контрольного рентгенологического исследования органов грудной клетки спустя 4 нед.
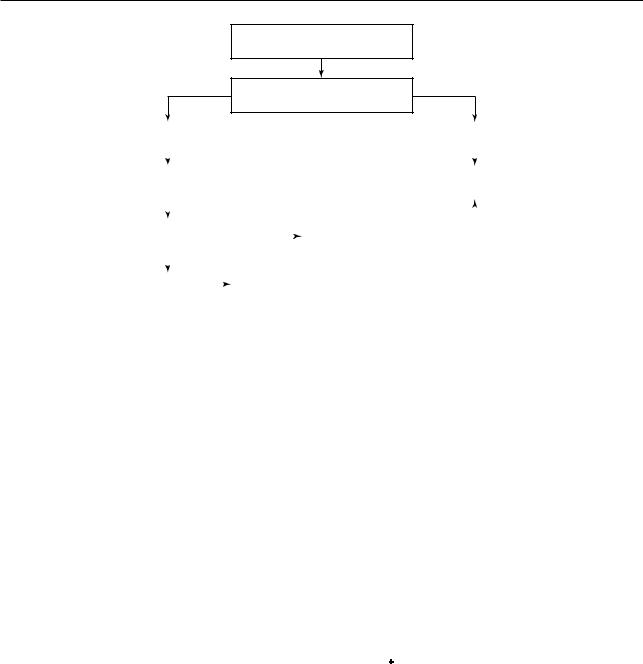
Напротив, при отсутствии известных факторов затяжного течения заболевания показано дополнительное обследование — в ряду первоочередных диагностических мероприятий следует провести КТ органов грудной клетки и фибробронхоскопию с комплексом бактериологических и цитологических исследований (рис. 9.13).
Профилактика внебольничной пневмонии
Наиболее эффективными средствами профилактики ВП в настоящее время являются пневмококковые и гриппозные вакцины.
С целью специфической профилактики инвазивных пневмококковых инфекций, в том числе пневмококковой ВП с бактериемией, у взрослых в РФ используется 23-валентная полисахаридная пневмококковая вакцина (ППВ23), содержащая очищенные капсулярные полисахаридные антигены 23 серотипов S. pneumonia и 13-валентная пневмококковая конъюгированная вакцина. Вакцинация пневмококковой вакциной рекомендуется группам лиц с высоким риском развития инвазивных пневмококковых инфекций. К ним относятся:
•пациенты в возрасте 65 лет и старше;
•лица с сопутствующими хроническими заболеваниями бронхолегочной (ХОБЛ, эмфизема, БА), сердечно-сосудистой систем, сахарным диабетом, хроническими заболеваниями печени (включая цирроз), хронической почечной недостаточностью, нефротическим синдромом, алкоголизмом, кохлеарными имплан-
66
Респираторные инфекции
Медленно разрешающаяся/ неразрешающаяся ВП
Наличие факторов риска затяжного течения заболевания
|
Да |
|
|
|
|
|
|
|
|
|
|
|
|
Нет |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Контрольное рентгенологическое |
|
|
|
|
|
Дополнительное обследование |
|||||||||||
исследование через 4 |
недели |
|
|
|
|
|
|
(КТ, фибробронхоскопия и др.) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Разрешение пневмонической |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Нет |
|
|
|
|
|
|
|
|||||||
инфильтрации |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Больной в дополнительном |
|
|
|
|
|
|||||
|
Да |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
обследовании не нуждается |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 9.13. Схема обследования пациента с медленно разрешающейся/неразрешающейся внебольничной пневмонией
тами, ликвореей, функциональной или органической аспленией (серповидно-клеточная анемия, спленэктомия);
•пациенты с иммунодефицитом (ВИЧ-инфек- ция, злокачественные новообразования, иммуносупрессивная терапия и др.);
•лица, проживающие в домах престарелых и других учреждениях закрытого типа;
•курильщики.
Иммунокомпрометированные пациенты старше 50 лет, в том числе лица с хронической почечной недостаточностью и нефротическим синдромом, анатомической или функциональной аспленией, ликворными шунтами, кохлеарными имплантатами, должны быть первоначально вакцинированы однократно конъюгированной, а затем (не ранее чем через 8 нед) полисахаридной пневмококковой вакциной. Если пациенты с указанными факторами риска ранее получали полисахаридную вакцину, им рекомендуется введение конюъгированной вакцины (не ранее чем через 12 мес с момента последней вакцинации).
Если вакцинация полисахаридной пневмококковой вакциной проводилась до 65 лет, то в возрасте 65 лет (или не менее чем через 5 лет с момента введения первой дозы вакцины) пациентам с факторами риска инвазивных пневмококковых инфекций рекомендуется ревакцинация.
Введение гриппозной вакцины с целью профилактики гриппа и его осложнений, в том числе ВП, рекомендуется при наличии высокого риска осложненного течения гриппа. К группам риска относятся:
•пациенты в возрасте 65 лет и старше;
•лица с сопутствующими хроническими заболеваниями бронхолегочной, сердечно-сосуди- стой системы, сахарным диабетом, заболеваниями почек, гемоглобинопатиями;
•лица, проживающие в домах престарелых и других учреждениях закрытого типа;
•женщины во II или III триместре беременности (в период сезонного подъема заболеваемости). Вакцинация также рекомендуется медицинским работникам, осуществляющим лечение и уход за лицами, входящими в группы высокого
риска осложнений гриппа.
Вакцинация гриппозной вакциной проводится ежегодно, оптимальное время для проведения вакцинации — октябрь–первая половина ноября. Предпочтение у взрослых следует отдавать инактивированным вакцинам.
Следует отметить, что при наличии показаний обе вакцины (пневмококковая и гриппозная) могут вводиться одновременно без увеличения частоты нежелательных лекарственных реакций или снижения иммунного ответа.
Список литературы
См. 
9.3. Вентилятор-ассоциированная пневмония
С.Н. Авдеев
Введение
Вентилятор-ассоциированная пневмония (ВАП) определяется как пневмония, возникающая через 48–72 ч после интубации трахеи, характеризующаяся появлением новых и прогрессированием легочных инфильтратов, признаками системной инфекции (лихорадка, лейкоцитоз), изменением характера мокроты (или секрета) и выделением виновного агента [1, 2].
67

Раздел 9
На долю ВАП приходится около половины всех случаев госпитальных пневмоний [1–3]. Распространенность ВАП составляет 9–27% всех случаев механической вентиляции, наибольший риск развития ВАП приходится на ранние сроки госпитализации [1, 2, 6]. ВАП является второй по частоте нозокомиальной инфекцией в ОРИТ и занимает первое место среди инфекций у пациентов, получающих механическую вентиляцию [7, 8]. Частота ВАП варьирует от 1,2 до 8,5 на 1000 дней механической вентиляции, в зависимости от критериев, используемых для диагностики ВАП [9]. Риск ВАП наиболее высок в первые пять дней респираторной поддержки (3%), и среднее время между интубацией трахеи и развитием ВАП составляет около 3,3 дня [1, 2, 10]. Данный риск уменьшается на 2% в сутки между 5-м и 10-м днями вентиляции, и затем на 1% в сутки [1, 11].
Вранних исследованиях атрибутивная летальность ВАП оценивалась как 33–50%, но данный показатель довольно вариабельный и очень сильно зависит от основного заболевания [1–3].
Вболее современных исследованиях атрибутивный риск летального исхода от ВАП оценивается как 9–13% [12, 13], что, вероятно, связано с широким внедрением стратегий профилактики ВАП. Приблизительно 50% всех антибактериальных препаратов, используемых в ОРИТ, назначаются по поводу ВАП [5, 7].
По времени возникновения ВАП можно разделить на две группы:
•ранняя ВАП — возникшая ранее первых 5 дней с момента госпитализации; чаще всего причиной ранней пневмонии являются возбудители, чувствительные к традиционно используемой антибактериальной терапии;
•поздняя ВАП — возникшая через 5 и более дней от момента госпитализации, которая харак-
теризуется более высоким риском инфекции мультирезистентными бактериями [1, 2, 7]. Таким образом, ВАП является значимой про-
блемой для интубированных пациентов в ОРИТ во всем мире, так как приводит к серьезным осложнениям и затратам на здравоохранение. Независимыми факторами риска для развития ВАП являются мужской пол, травма и тяжесть основного заболевания (отношения риска 1,58; 1,75 и 1,47–1,70 соответственно) [10].
Патогенез
Развитие ВАП определяет комплексное взаимодействие таких факторов, как интубационная трубка, наличие факторов риска, вирулентность виновного патогена и факторы защиты макроорганизма. Наиболее важным фактором риска ВАП является наличие интубационной трубки, что приводит к нарушению естественных механизмов защиты (кашлевой рефлекс со стороны глотки и гортани) против микроаспирации в ды-
хательные пути вокруг манжетки интубационной трубки [7, 14].
Виновные микроорганизмы получают прямой доступ в нижние дыхательные пути посредством следующих механизмов:
1)микроаспирация, которая происходит уже во время интубации трахеи;
2)развитие биопленок, состоящих из микроорганизмов (обычно грамотрицательных бактерий и грибков), на внутренней поверхности интубационной трубки;
3)скопление и протекание секрета вокруг манжетки интубационной трубки;
4)нарушения мукоциарного транспорта секрета в дыхательных путях [14–16].
Патогенный материал может также аккумулироваться в окружающих анатомических структурах, таких как желудок, синусы, носоглотка и ротоглотка, при этом происходит замещение нормальной микрофлоры более вирулентными штаммами [14, 15, 17]. Данный материал, обогащенный патогенными микроорганизмами, постоянно проталкивается в дыхательные пути пациента благодаря положительному давлению, создаваемому респиратором. В то время как повторная интубации трахеи повышает риск развития ВАП, использование НВЛ значительно уменьшает данный риск [7]. Факторы макроорганизма, такие как тяжесть основного заболевания, объем хирургических вмешательств и предшествующее назначение антибактериальных препаратов, также являются факторами риска развития ВАП [1, 2].
В дополнение к этому необходимо отметить, что у пациентов, находящихся в критическом состоянии (что обычно бывает в ОРИТ), достаточно часто происходит нарушение врожденного иммунитета, в частности фагоцитоза, то есть пациенты имеют функциональный иммунодефицит даже еще до развития нозокомиальной инфекции [7, 18, 19]. Данный эффект связан с повреждающим действием анафилатоксина, C5a, который нарушает фагоцитарную активность нейтрофилов [18]. Относительно недавно было показано, что сочетание дисфункции T-лимфоцитов, моноцитов и нейтрофилов позволяет предсказать развитие нозокомиальных инфекций [19]. Например, повышение числа регуляторных T-клеток (Tregs), деактивация моноцитов (оцениваемая по экспрессии HLA-DR моноцитов) и дисфункция нейтрофилов (оцениваемая по экспрессии CD88) являются факторами риска развития инфекций у больных, находящихся в критических состояниях [19].
Факторы риска вентиляторассоциированной пневмонии
Главными факторами риска ВАП являются интубация трахеи и инвазивная ИВЛ. В целом все факторы риска ВАП могут быть разделены на
68

Респираторные инфекции
модифицируемые и немодифицируемые, а также связанные или несвязанные с интубацией трахеи и ИВЛ [1–4].
Модифицируемые факторы риска ВАП включают:
•аспирацию;
•нарушение сознания;
•использование антацидов или H2-блокаторов;
•наличие назагастрального зонда.
Кнемодифицируемым факторам риска ВАП относятся:
•возраст старше 60 лет;
•ХОБЛ и другие хронические заболевания легких;
•аномалии верхних дыхательных путей;
•тяжесть заболевания, оцененную по шкале APACHE II;
•неврологические заболевания;
•травма;
•хирургия на органах грудной клетки.
Вслучае проведения ИВЛ специфическими
модифицируемыми факторами риска являются следующие:
•низкое положение головного конца больного;
•частая смена респираторных контуров;
•использование миорелаксантов;
•постоянная седация;
•повторная интубация трахеи;
•транспорт больного за пределы ОРИТ (например, для проведения диагностических иссле-
дований).
К неизбежным (немодифицируемым) факторам риска ВАП для вентилируемых больных относятся:
•респираторная поддержка более 24 ч;
•ОРДС;
•болезни сердца;
•ожоги;
•сниженный уровень сознания;
•необходимость мониторирования интракраниального давления;
•экстренная интубация трахеи (на этапах до ОРИТ).
Этиология вентиляторассоциированной пневмонии
Вид микроорганизма, вызывающего ВАП, обычно зависит от продолжительности механической вентиляции. В целом ранние ВАП ассоциированы с патогенами, чувствительными к антибактериальной терапии, в то время как поздние ВАП связаны с мультирезистентными бактериями. Однако это правило полезно лишь при подборе начальной антибактериальной терапии, пока не становится доступной более точная информация о характере причинной инфекции.
Обычно бактерии, вызывающие ВАП с ранним началом, включают Streptococcu spneumoniae,
Hemophilus influenzae, метициллин-чувствительные
Staphylococcus aureus, антибиотик-чувствитель- ные грамотрицательные бациллы (Escherichia coli,
Klebsiella pneumonia, Enterobacter spр., Proteus spр.
И Serratia marcescens). Патогенами, вызывающими ВАП с поздним началом, обычно являются мультирезистентные бактерии, такие как MRSA,
Acinetobacter, Pseudomonas aeruginosa, и бактерии, продуцирующие бета-лактамазы расширенного спектра [7]. Частота встречаемости мультирезистентных бактерий достаточно вариабельна и различается между различными медицинскими учреждениями и даже отделениями внутри одного учреждения [1, 2]. Пациенты с анамнезом госпитализации в стационар ≥2 раз в течение последних 90 дней, живущие в домах ухода, получающие химиопрепараты или антибиотики в течение последних 30 дней и гемодиализ, имеют риск развития инфекций, в том числе и ВАП, вызываемых мультирезистентными бактериями [1–3, 7].
Среди микроорганизмов, полученных в образцах от пациентов ВАП, могут быть обнаружены бактерии, которые являются обычными обитателями ротоглотки (Streptococcus viridans, Coryne bacterium, коагулаза-негативные staphylococcus,
Neisseria sрp.), но они редко являются причиной ВАП. В более редких случаях (обычно у имммунокомпрометированных пациентов) причинами ВАП могут быть вирусы и бактерии [1–2]. Факторы риска для определенных патогенов у больных ВАП представлены в табл. 9.24.
Патогены, являющиеся причиной ВАП, их частота (в скобках) и возможные механизмы множественной резистентности к антибиотикам перечислены ниже [1–6]:
1)Pseudomonas (24,4%) — повышенная активность эффлюксных помп, снижение экспрессии наружной мембраны пориновых каналов, приобретение плазмидных маталлобета-лак- тамаз;
2)S. aureus (20,4%, из которых >50% MRSA) — продукция пенициллин-связывающего белка со сниженной афинностью к бета-лактамным антибиотикам, кодируется геном mecA;
3)Enterobacteriaceae (14,1% — включают Klebsiella spp., E. coli, Proteus spp., Enterobacter spp., Serratia spp., Citrobacter spp.) — опосредованная плазмидами продукция бактерий, продуцирующих бета-лактамазы расширенного спектра, опосредованный плазмидами фермент AmpC;
4)Streptococcus spр. (12,1%);
5)Hemophilus spр. (9,8%);
6)Acinetobacter spр. (7,9%) — продукция металлоферментов или карбопенемаз;
7)Neisseria species (2,6%);
8)Stenotrophomonas maltophilia (1,7%);
9)коагулазонегативные стафилококки (1,4%); 10) другие (4,7% — включают Corynebacterium,
Moraxella, Enterococcus, грибы).
69
