
- •От автора…
- •ПРЕДИСЛОВИЕ
- •Оглавление
- •1.1. Физические основы люминесценции
- •Глава 2. Собственная люминесценция клеток
- •3.2. Определение соотношения различных веществ в клетке
- •ДВУХВОЛНОВЫЕ МЕТОДЫ
- •ТРЕХВОЛНОВЫЕ МЕТОДЫ
- •3.3. Анализ спектральных характеристик
- •ПРИЛОЖЕНИЕ
- •Приложение 1
- •Приложение 3
- •Приложение 4
- •Приложение 5
- •Приложение 6
- •Обобщенная Схема Окислительного Метаболизма Клетки
- •Список первоисточников

(механического) его ярко люминесцирующих кристаллов (рис.65) с поверхности среза.
Спектр люминесценции окрашенного таким образом препарата (рис.66) содержит полосы люминесценции растворенного в липидах бензпирена (430, 454, 480 нм) и этидиум бромида, связанного с нуклеиновыми кислотами (620 нм). Соотношение интенсивностей люминесценции в областях 430 и 620 нм может, по-видимому, быть использовано для определения соотношения в изучаемом участке клетки липидов и нуклеиновых кислот.
ТРЕХВОЛНОВЫЕ МЕТОДЫ
По своей сути эти методы аналогичны описанным выше двухволновым методам и отличаются от них только несколько большей сложностью выбора комплекса красителей-меток и интерпретации результатов. В то же время они несут больше информации, и развитие этих методов представляется весьма заманчивым.
Определение соотношения липидов, белков и нуклеиновых кислот. Рассмотрение трехволновых методов имеет смысл начать именно с этого метода из соображений удобства изложения, так как он состоит в комбинации только что описанных выше двухволновых методов определения соотношений липиды : белки и липиды: нуклеиновые кислоты. При этом используются те же люминесцентные красители-метки - 3,4-бензпирен, ДХТАФ и этидиум бромид.
Данные о соотношении спектров поглощения и люминесценции этих меток и о количественном связывании их с липидами, белками и нуклеиновыми кислотами также приведены выше и нет необходимости повторять их еще раз.
Срезы головного мозга крысы обрабатывают вначале (6 мин) водным раствором 3,4- бензпирена (или 70%-ным спиртовым раствором 3,4-бензпирена) и в течение 1 мин докрашивают затем этидиум бромидом (10-5 М). В результате такой обработки срез приобретает люминесценцию, спектр которой представлен на рис.66, 3. Линии люминесценции растворенного в липидах 3,4- бензпирена в голубой области (430, 450, 480 нм) и широкая полоса люминесценции связанного о нуклеиновыми кислотами этидиум бромида (620 нм) составляют характерную особенность этого спектра (рис. 67, 1).
Последующая обработка того же препарата водным раствором ДХТАФ (10-4 М, время окраски 2 мин, промывка 2 мин) приводит к появлению в зеленой области описанного выше спектра дополнительной полосы люминесценции (530 нм) ковалентно связанного с белками ДХТАФ (рис. 67, 2, 3). Необходимо при этом отметить, что соотношение интенсивностей люминесценции 3,4- бензпирена, ДХТАФ и этидиум бромида различно для разных по своей структуре и функциям участков головного мозга, что отражает, по-видимому, разное соотношение концентраций липидов, белков и нуклеиновых кислот в этих участках мозга.
Порядок окраски препарата может быть изменен таким образом, что после обработки 3,4- бензпиреном следует окраска белков активным красителем (ДХТАФ или ФИТЦ), а затем — обработка этидиум бромидом. Регистрируемые при этом результаты не отличаются от приведенных выше.
Рис. 67. Спектры люминесценции участка среза головного мозга крысы после окраски: 1 – 3,4-бензпирен и этидиум бромид; 2 – тот же участок после дополнительной окраски ДХТАФ; 3 – другой участок того же препарата.
Определение соотношения липидов, ДНК (двухспиралъных) и РНК (односпиральных нуклеиновых кислот). Этот метод основав на совместном применении 3,4-бензпирена и акридинового оранжевого и был предложен впервые Бревисом [272]. Не останавливаясь подробно на описании метода окраски препарата, рассмотрим получаемые таким методом результаты.
Срез мозга крысы обрабатывают водным раствором 3,4-бензпирена (окраска 6 мин, промывка 1 мин) с последующей докраской акридиновым оранжевым 1:30 000 (рН 4,6; окраска 8 мин; промывка 3 мин). В результате такой обработки срез приобретает полихроматическую люминесценцию. Липидные включения имеют голубой цвет, ядра - зеленые, цитоплазматические включения и ядрышки - красные. Соответственно этому в спектре люминесценции (рис. 68) наблюдаются характерные линии излучения растворенного в липидах 3,4-бензпирена (430, 454 нм), а
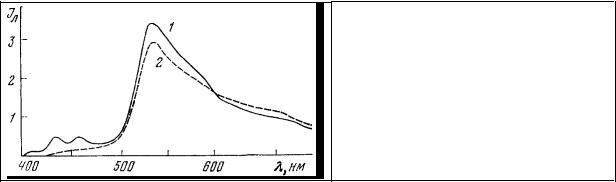
также полосы излучения мономеров (530 нм) и димеров (640 нм) акридинового оранжевого, связанных с двухспиральными (ДНК) и односпиральными (РНК) нуклеиновыми кислотами.
Рис. 68. Спектры люминесценции участка среза головного мозга крысы после окраски: 1 – акридиновый оранжевый; 2 – 3,4-бензпирен и акридиновый оранжевый.
Определение соотношения белков, ДНК (двухспиральных), РНК (односпиралъных нуклеиновых кислот). В качестве основного красителя при разработке этого метода [246, 247] был использован акридиновый оранжевый, спектральные характеристики которого подробно описаны выше. Поэтому для реализации идеи метода было необходимо в пару к акридиновому оранжевому подобрать такую люминесцентную метку на белки, которая наиболее полно удовлетворяла бы изложенным выше требованиям. Поиск метки проводился внутри класса активных красителей проционового типа, аналогичных по своей структуре описанному выше ДХТАФ. С этой целью были изучены спектральные характеристики проционовых красителей: алого GS, красного GS, яркокрасного 8ВS, ярко-красного 5ВS, желтого 4RS, ярко-желтого GGS, ярко-оранжевого GS, яркооранжевого 2RS, зеленого 2ВS, печатающего зеленого В и синего 3RS [277]. Спектры поглощения этих красителей приведены на рис. 69 и 70, а спектры люминесценции наиболее ярко люминесцирующих из них - на рис 69. Сравнение спектральных характеристик упомянутых проционовых красителей и акридинового оранжевого показывает, что наиболее подходящим, хотя, возможно, и не наилучшим, является проционовый печатающий зеленый В, максимум люминесценции в первой полосе которого лежит в области 450 нм.
При этом необходимо отметить, что полоса поглощения этого красителя в области 600—700 нм перекрывается частично с полосой люминесценции димеров акридинового оранжевого с максимумом излучения 640 нм.
При обработке срезов нервных ганглиев брюхоногого моллюска Lymnaea stagnalis (фиксация замораживанием с замещением или ФСУ (6:3:1), по В.Я. Бродскому [227]) вначале проционовым печатающим зеленым В (водный раствор, 5 10-4 г/мл, рН 5,6), а затем акридиновым оранжевым (цитрат-фосфатный буфер; рН 4,1; 10-4 М) возникает полихроматическая картина люминесценции гигантских нейронов [247]. Места локализации белков (аксон, нейропиль) характеризуются голубым свечением, в то время как область ядра, где расположены ДНК и белки, обладает голубовато-зеленой люминесценцией. Малиновая люминесценция (смесь голубого и красного излучения) специфична для областей цитоплазмы, богатых как белками, так и РНК (апикальный участок и аксонный холмик).
Соответственно этому различные по своей структуре [278] и функциям участки гигантского нейрона (рис. 71) обладают характерными спектрами люминесценции. Основной полосой в спектре люминесценции аксона является полоса излучения печатающего зеленого В (450 нм), связанного с белками. Слабая зеленая люминесценция в области 530 нм может быть обязана своим происхождением комплексам мономеров акридинового оранжевого с цитоплазматической ДНК и двухспиральными участками РНК (рис. 71, в).
Область зелено-голубого свечения ядра нейрона демонстрирует наличие двух достаточно интенсивных полос люминесценции (рис. 71), одна из которых принадлежит связанному с белком печатающему зеленому В (450 нм). Наибольшей интенсивностью в этом участке клетки обладает полоса люминесценции комплексов мономеров акридинового оранжевого (530 нм) с двухспиральными нуклеиновыми кислотами (ДНК).
Участки клетки, для которых характерна высокая скорость синтеза белков и развитая сеть шероховатого эндоплазматического ретикулума (апикальный участок, аксонный холмик), имеют ярко выраженный трехполосный спектр люминесценции (рис.71, а). Наибольшую интенсивность при этом демонстрирует печатающий зеленый В (белки) и димерная форма акридинового оранжевого (640 нм), связанная, по-видимому, с односпиральными нуклеиновыми кислотами (РНК). Слабое свечение в зеленой области спектра (530 нм) обязано своим происхождением комплексам мономеров акридинового оранжевого с двухспиральными участками рибосомальной РНК, цитоплазматической (в том числе - митохондриальной) ДНК.

Рис. 69. Спектры поглощения растворов проционовых красителей в концентрации
5 10-4 г/мл [277]. а: 1 – алый GS, 2 – ярко-
красный 8BS, 3 – зеленый 2BS; б: 1 – синий
3PS, 2 – желтый, 3 – ярко-красный 4RS 5BS.
Рис. 70. Спектры поглощения растворов проционовых красителей в концентрации
5 10-4 г/мл [277]. а: 1 – красный GS, 2 – ярко-
оранжевый GS, 3 – ярко-желтый G GS; б: 1 – ярко-оранжевый 2RS, 2 – печатающий зеленый B.
Рис. 71. Спектры люминесценции различных участков гигантского нейрона моллюска
Lymnaea stagnalis, окрашенного проционовым красителем печатающим зеленым В и акридиновым оранжевым.
а – апикальный участок; б – ядро; в – проксимальный участок.
Длина волны возбуждения 365 нм.
Рис 72. Спектры люминесценции растворов проционовых красителей [277].
а: 1 – печатающий зеленый В, 2 – яркооранжевый 2RS, 3 – ярко-оранжевый GS, 4 – красный - GS; б: 1 – ярко-красный 8ВS, 2 – желтый 4RS.
Длина волны возбуждения 365 нм.
