
- •От автора…
- •ПРЕДИСЛОВИЕ
- •Оглавление
- •1.1. Физические основы люминесценции
- •Глава 2. Собственная люминесценция клеток
- •3.2. Определение соотношения различных веществ в клетке
- •ДВУХВОЛНОВЫЕ МЕТОДЫ
- •ТРЕХВОЛНОВЫЕ МЕТОДЫ
- •3.3. Анализ спектральных характеристик
- •ПРИЛОЖЕНИЕ
- •Приложение 1
- •Приложение 3
- •Приложение 4
- •Приложение 5
- •Приложение 6
- •Обобщенная Схема Окислительного Метаболизма Клетки
- •Список первоисточников

постоянным квантовым выходом люминесценции могут приобрести способность к изменению квантового выхода за счет миграции энергии на близко расположенную молекулу - акцептор. При этом перемещение акцептора относительно донора может давать информацию о структурных изменениях макромолекулы, на которой адсорбирована такая пара взаимодействующих меток. В этих случаях естественно стремление к тому, чтобы концентрация красителя с переменным квантовым выходом оставалась постоянной величиной и в правой части уравнения (9') было не более двух переменных k и d. Однако и в этом случае методика эксперимента должна предусматривать контроль постоянства концентрации с люминесцентной метки.
Наиболее надежным методом такого контроля является, конечно, измерение концентрации по поглощению света в максимуме полосы поглощения красителя. С этой же целью может быть использована регистрация прошедшего через исследуемый участок объекта возбуждающего его люминесценцию излучения (см. рис.7), хотя длина волны этого излучения не всегда совпадает с максимумом полосы поглощения красителя.
Глава 2. Собственная люминесценция клеток
Любая клетка живого организма обладает собственной люминесценцией, которая обязана своим происхождением различным компонентам ее структуры и метаболизма [9]. Собственная люминесценция лежит в основе ряда исключительно ценных методов исследования процессов внутриклеточной регуляции [8-10, 64-66]. В то же время она может служить источником помех и ошибок при изучении функциональных механизмов клетки с помощью люминесцентных меток, так как в ряде случаев интенсивность собственной люминесценции оказывается сравнимой по величине с интенсивностью так называемой вторичной люминесценции, вызванной введением в клетку экзогенных красителей-меток. Количество люминесцирующих эндогенных соединений в клетках велико, и в рамках данной монографии нет возможности полно рассмотреть этот вопрос. Представляется, однако, необходимым привести ряд примеров, показывающих, что, по сути дела, в любой области спектра лежат полосы излучения эндогенных люминесцирующих соединений.
2.1. Спектральные характеристики собственной люминесценции клеток
Ультрафиолетовая люминесценция. Утверждение о наличии собственной люминесценции у любых клеток связано, прежде всего, с составляющими их основу белками, обладающими люминесценцией в ультрафиолетовой области спектра [10, 67]. При воздействии на клетку излучения с длиной волны в области 280 нм (полоса поглощения белков) наблюдается полоса излучения, максимум интенсивности которой лежит в области 330-350 нм (рис. 9). Как было
Рис. 9. Спектры УФ-люминесценции клеток мышцы (1), нейронов (2), клеток печени (3), эритроцитов (4) [68].

установлено [68-72], ответственными за ультрафиолетовую люминесценцию белков являются входящие в их состав ароматические аминокислоты - триптофан, тирозин и фенилаланин. Индивидуальный спектр люминесценции каждой из этих аминокислот различается по положению максимума излучения (рис. 10). Поэтому можно было бы ожидать, что спектры УФ-люминесценции различных белков также будут иметь несколько различающиеся по положению максимумов спектры люминесценции в соответствии с относительным содержанием той или иной ароматической аминокислоты. Однако то обстоятельство, что квантовый выход люминесценции триптофана намного выше квантового выхода тирозина и фенилаланина, приводит обычно к преобладанию полосы излучения триптофана в суммарном спектре ультрафиолетовой люминесценции клетки.
Рис. 10. Спектры люминесценции аминокислот в нейтральном водном растворе при комнатной температуре [72].
1 – триптофан; 2 – тирозин; 3 – фениланин.
Наиболее яркой УФ-люминесценцией в клетке характеризуются сократительный аппарат [73, 74], митохондрии [75-77], ядрышки [78] и некоторые другие структуры цитоплазмы. Интенсивность УФ-люминесценции зависит от физиологического состояния клеток и меняется при различных воздействиях, в том числе и при ионизирующем облучении животных [79-82]. Специально проведенные исследования с применением специфических ингибиторов дыхания показали, что характер ультрафиолетовой люминесценции митохондрии в значительной мере определяется соотношением восстановленной и окисленной форм дыхательных ферментов и отражает функциональное состояние митохондрии [83, 84].
Учитывая, что квантовый выход люминесценции ароматических аминокислот не остается постоянным, а довольно сильно зависит от свойств окружения [10, 15, 16], исследования Уфлюминесценции могут служить основой для разработки разнообразных методов слежения за изменениями структуры белковых молекул при их функционировании в клетке [85]. Весьма перспективным оказалось, в частности, применение поляризованной УФ-люминесценции при изучении особенностей конформационных изменений белков в структуре саркомера поперечнополосатой мышцы в покое ипри сокращении. Была установлена [86-88] существенная анизотропия в расположении триптофановых остатков сократительных белков в А- и -зонах саркомера. Оказалось, что в А-зоне триптофановые остатки белков преимущественно ориентированы вдоль оси мышечного волокна, в то время как в I-зоне они ориентированы преимущественно перпендикулярно. При сокращении мышцы уменьшается поляризационная анизотропия обеих зон. Это свидетельствует о существенном уменьшении степени ориентации триптофановых остатков белков мышечного волокна при сокращении.
Синяя и желтая область спектра. Количество веществ, люминесцирующих в этой области, достаточно велико [9], но только с некоторыми из них мы неизбежно сталкиваемся при изучении любых клеток. К числу этих веществ следует, прежде всего, отнести такие важнейшие, встречающиеся у любых представителей живой природы компоненты систем энергетического обмена, как восстановленные пиридиннуклеотиды (НАД Н, НАДФ Н) и окисленные флавопротеины (ФП). Как следует из приведенной на Схеме метаболизма [89], пиридиннуклеотиды и флавопротеины находятся в различных участках энергопроизводящих систем клетки: гликолизе, пентозофосфатном цикле, цикле Кребса, системе окисления жирных кислот и различных путях терминального окисления. Восстановленные формы НАД и НАДФ обладают характерными спектрами поглощения, состоящими из двух полос в УФ-области (260 и 340 нм), и полосой собственной люминесценции, максимум которой лежит в интервале 465÷480 нм (рис. 11). При переходе НАД и НАДФ в окисленное состояние они теряют полосу поглощения 340 нм и
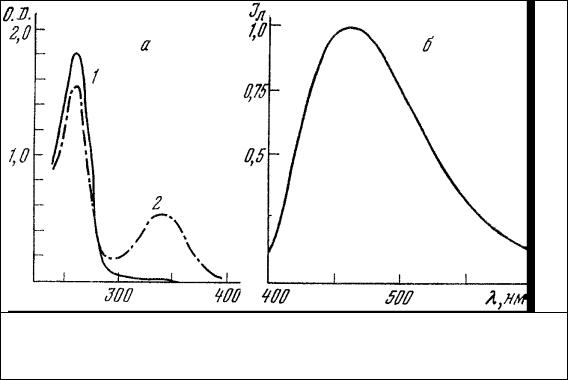
способность к люминесценции (Схема метаболизма), как это было установлено Варбургом [90]. При связывании НАД и НАДФ с их дегидрогеназами максимум полосы люминесценции сдвигается в сторону более коротких длин волн до 440 нм, и ее интенсивность возрастает [91]. Производные рибофлавина - флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) [9] - являются простетическими группами многих флавопротеиновых компонентов (Схема метаболизма). систем терминального окисления. Окисленные формы ФМН и ФАД обладают характерными спектрами поглощения (рис. 12) и собственной люминесценции [92]. При переходе этих групп в восстановленное состояние они теряют полосы поглощения 450 нм и собственной люминесценции
[93].
Присоединение ФМН и ФАД к белковой части молекулы фермента приводит к изменению спектра поглощения, различному для разных флавопротеинов. Наиболее часто, однако, в видимой области происходит сдвиг полосы поглощения от 450 до 455÷ 465 нм и появляется характерное плечо на кривой поглощения в области 480÷490 нм (рис. 13, б). При этом флавиновая группа может утратить способность к аутоокислению и потерять полностью или частично собственную люминесценцию. Примером не люминесцирующих или слабо люминесцирующих флавопротеинов могут служить глюкозооксидаза и ксантиноксидаза. Интенсивность люминесценции ФМН и ФАД уменьшается при связывании их с апоферментами таких флавопротеинов, как оксидаза D-аминокислот (Фп6), электронно-транспортные флавопротеины (Фп4 и Фп5) и цитохром b5 -редуктаза (Фп7) (Схема
метаболизма).
Рис. 11. Спектры поглощения (а) и люминесценции (б) НАД. А – спектры поглощения водного раствора НАД в окисленной (1) и восстановленной (2) формах [91]; б – нормированный спектр люминесценции НАД в восстановленной форме в этиловом спирте.
Исключением является ЛДГ - липоилдегидрогеназа (Фп1), в которой на одну молекулу апофермента приходятся две простетические группы типа ФАД. Интенсивность люминесценции этого флавопротеина примерно в три раза превышает интенсивность люминесценции эквивалентного количества свободного ФАД (рис.13, в) и отличается характерным спектром люминесценции, обладающим помимо основного максимума (530 нм) плечом (540 нм) [92].
Физико-химические характеристики флавопротеинов усиленно исследовались в последние годы [94-98] в связи с возможностью использования их, а также пиридиннуклеотидов в качестве внутриклеточных меток активности энергетического аппарата [65, 98-110]. Этот вопрос будет подробнее рассмотрен в следующем разделе данной главы.
Следует, однако, остановиться здесь на том обстоятельстве, что, как это следует из приведенных на Схеме метаболизма данных, множественность входящих в разные участки общей энергетической системы пиридиннуклеотидов и флавопротеинов создает ряд методических трудностей. При люминесцентных спектральных исследованиях клетки в поле зрения прибора оказываются различные органоиды, и поэтому в общем случае регистрируется суммарный спектр, состоящий из полос люминесценции нескольких флавопротеинов и пиридиннуклеотидов, относящихся к разным системам, одна из которых обычно вносит основной вклад. В этих условиях люминесцентный спектральный анализ перестает быть чисто физическим методом и используется

скорее как индикаторный инструмент при проведении своего рода функциональной диагностики спектра по результатам действия на исследуемую клетку различными биохимическими и физическими факторами, такими, как перевод клетки из аэробного в анаэробное состояние, действие на нее специфических субстратов и ингибиторов окислительных систем, изменение физиологического состояния и т. д. [65].
Рис. 12. Спектры поглощения (а, б) и люминесценции (в) флавинов и флавопротеинов. а: 1 – окисленная форма ФАД, 2 – восстановленная форма ФАД; б, в: 1 – окисленная форма ФАД, 2 – окисленная форма липоилдегидрогеназы (ЛДГ).
Это означает, что если даже мы полностью уверены (электронно-микроскопический контроль, морфология и т.д.), что в поле зрения микроспектрофлуориметра локализованы в основном митохондрии и зарегистрированный спектр люминесценции соответствует ожидаемому для митохондриальной системы терминального окисления (Схема метаболизма), то только после изучения изменения этого спектра при действии специфических именно для этой (митохондрии) системы ингибиторов (амитал, ротенон, цианистый калий и т.д.) и субстратов (например, сукцинат) можно идентифицировать структуру как митохондриальную. Некоторые приемы такого типа будут также рассмотрены ниже.
Среди других, люминесцирующих в синей и желто-зеленой областях спектра соединений при исследовании клеток животных можно встретить различные витамины и продукты метаболизма, в том числе пиридоксали, фолиевую кислоту и ее производные и т.д. [9]. Яркой люминесценцией, например с максимумом излучения 480 нм [111], обладает витамин А (рис.13). Характерной особенностью этого соединения является быстрое фотовыцветание - снижение интенсивности люминесценции под действием возбуждающего ее УФ-излучения, что может быть использовано для его индентификации в ткани.
Рис. 13. Спектры возбуждения (а) и люминесценции (б) раствора ацетата витамина А до (1) и после (2) УФ-облучения и изменение интенсивности люминесценции при УФ-облучении (в). Спектр возбуждения регистрировался в длине волны 480 нм, спектр люминесценции – при возбуждении излучения 340 нм.

Гранулы внутриклеточного пигмента старения - липофусцина (которые в последнее время предложено называть каротиноксисомами [65]) - обладают собственной люминесценцией, цвет которой может варьировать от желтого до оранжевого. Спектры люминесценции срезов коры головного мозга молодых крыс (рис.14, а, 1) содержат два максимума излучения. Один из них (480 нм) принадлежит восстановленным пиридиннуклеотидам, в то время как другой (520 нм) обязан своим происхождением окисленным флавопротеинам. Цвет люминесценции срезов голубоватобелесый без каких-либо включений. В отличие от этого на срезах коры головного мозга старых крыс на голубовато-белесом фоне люминесценции наблюдаются липофусциновые гранулы разного размера и формы, люминесцирующие ярко-желтым светом.
Рис. 14. Спектр собственной люминесценции: а – срезов коры головного мозга молодых (1) и старых (2-4) крыс; б – клеток корня моркови (1); нулевая линия препарата (2).
Соответственно этому в спектрах люминесценции ткани старых животных, кроме полос излучения восстановленных пиридиннуклеотидов (480 нм) и окисленных флавопротеинов (520 нм), появляется дополнительная полоса излучения с максимумом 560-565 нм (рис. 14, а, 2). В том случае, когда липофусцин занимает значительную часть поля зрения, этот максимум увеличивается (рис.14, а, 3) и становится преобладающим в спектре (рис.14, а, 4) [112-116]. Возможно, что люминесценция липофусциновых гранул обязана своим происхождением каротиноидам [115], являющимися важнейшей составной частью этих гранул [65, 114, 117]. Сходные по форме и положению максимумов излучения спектры люминесценции регистрируются и у каротиноидсодержащих гранул клеток корня моркови (рис.14, б) и нейронов моллюска большого прудовика [115]. Спектры люминесценции отдельных гранул липофусцина (рис.15) состоят из полос люминесценции нескольких соединений. Вариации относительных интенсивностей этих полос определяют форму
Рис. 15. Спектры собственной люминесценции. 1, 2 – гранулы липофусцина в нейронах головного мозга коровы (8-10 лет); 3 – каротиноидсодержащие гранулы
(каротиноксисомы) в нейронах моллюска; 4 - β-каротин в масле (аптечный препарат). Длина волны возбуждения 365 нм.
результирующего спектра люминесценции и цвет свечения самих гранул, который может изменяться от ярко-желтого (рис.15, 1) до красновато-бурого (рис.15, 2). Основной максимум при этом совпадает с максимумом спектра люминесценции раствора β-каротина в масле (рис.15, 4) [112—113]. При этом не исключена возможность, что среди входящих в состав липофусциновых гранул люминесцирующих соединений имеются и переокисленные ненасыщенные жирные кислоты [118].

При проведении исследований на фиксированных препаратах с применением флуорохромов не следует забывать, что действие фиксатора приводит к появлению в препарате люминесценции, интенсивность которой может оказаться сравнимой с интенсивностью излучения используемого флуорохрома и явиться, таким образом, источником методических ошибок. Например, при использовании фиксирующих смесей, содержащих формалин, возникает достаточно яркая люминесценция клеток в желто-зеленой области спектра. Это, с одной стороны, создает помехи для применения флуорохромов с невысоким квантовым выходом, а с другой - может служит основой для разработки специальной люминисцентно-цитохимической реакции, выявляющей биогенные моноамины, продукты взаимодействия которых с формальдегидом и являются причиной появления люминесценции в области 480-520 нм. Такую реакцию можно проводить на лиофилизированном материале в парах формальдегида (известный метод Фалька [119-120]) либо непосредственно при фиксации живых клеток водными растворами формальдегида [121].
Красная область спектра. В тканях животных люминесценция в красной области спектра чаще всего связана с присутствием порфиринов [122, 123] в живых клетках. Порфириновая структура, обладающая яркой и характерной люминесценцией (рис.16), лежит в основе простетических групп таких широко распространенных соединений, как цитохромы, пероксидаза, каталаза, гемоглобин и миоглобин. В гемопротеинах люминесценция «погашена» присутствием атома железа. Однако в клетках с высокой скоростью синтеза этих соединений могут присутствовать значительные количества порфиринов, являющихся промежуточным продуктом в синтезе гема. С другой стороны, патологические нарушения в обмене гемосодержащих соединений, например в результате некоторых отравлений [124, 125], также могут приводить к появлению характерной люминесценции порфиринов в клетках и служить, таким образом, важным диагностическим тестом.
Рис. 16. Спектр люминесценции гематопорфирина в эритроцитах, обработанных концентрированной кислотой.
Длина волны возбуждения 436 нм.
Интересные возможности слежения за физиологическим состоянием некоторых микроорганизмов открываются при изучении в них обмена порфиринов. Прямой регистрацией спектров люминесценции порфиринов в популяции дрожжей Candida quilliermondii было установлено [126], что в процессе основного цикла ферментации, когда в аппарат (ферментер) поступает необходимое количество субстрата (нормальные углеводороды, соли и микроэлементы), в дрожжах накапливаются порфирины с основным максимумом люминесценции около 625 нм (рис. 17,
а). Во второй же стадии процесса ферментации, характеризующейся прекращением поступления субстрата, в дрожжах синтезируются порфирины с основным максимумом люминесценции около 580 нм. Параллельный подсчет мертвых клеток в популяции показал, что количество их пропорционально интенсивности флуоресценции порфиринов в области 580 нм (рис.17, б). Авторы пришли к выводу, что в нормально растущих дрожжах накапливаются свободные формы копропорфирина III и протопорфирина IX (табл.1). При этом концентрация копропорфирина III в 5-10 раз превышает концентрацию протопорфирина IX (рис.17, а).
При повреждении же дрожжевых клеток в условиях голодания, инактивирующего действие нагревания, блокирования дыхательной цепи и т. д., происходит накопление хелатных комплексов копропорфирина III и протопорфирина IX с цинком, содержащимся в среде культивирования в качестве микроэлемента, что и приводит к наблюдаемому изменению спектра люминесценции клеток (рис.17, б) [127]. Обнаруженная закономерность

послужила основой способа определения жизнеспособности дрожжей - продуцентов в микробиологическом синтезе [128].
Рис. 17. Спектры люминесценции нормально растущих (а) и голодающих (б) дрожжей [127].
Спектральные характеристики некоторых порфиринов |
Таблица 1 |
||||||
|
|||||||
|
|
|
|
|
|
|
|
Соединение |
|
|
Раство |
|
Положение максимумов, нм |
|
|
|
|
|
-ритель |
|
люминесценция |
возбуждение |
поглощение |
Копропорфирин III |
|
Эфир |
625, 690 |
401, 531, 498, 573 |
392, 568, 495, 623, 528, |
||
Протопорфирин IX |
|
» |
|
635, 700 |
408, 538, 506, 580 |
403, 575, 504, 633, 535, |
|
Копропорфирин |
III |
0,1н.НС |
595, 651 |
400, 548 |
400, 547, 590 |
||
дикатион |
|
l |
|
|
|
||
Протопорфирин |
IX |
|
1,5н.НС |
606, 662 |
410, 560 |
407, 554, 600 |
|
дикатион |
|
1 |
|
|
|
|
|
Zn-Копропорфирин III |
|
|
|
578, 628 |
409, 542 |
407, 540, 576 |
|
Zn-Протопорфирин IX |
|
|
|
588, 638 |
418, 550 |
417, 548, 585 |
|
Необходимо отметить, что при обработке тканей животных некоторыми фиксаторами может происходить отрыв атома железа от простетической группы ряда внутриклеточных гемопротеинов (например, миоглобина). В результате на месте локализации этих соединений появляется характерная люминесценция порфиринов [122], что необходимо учитывать при работе с флуорохромами, люминесцирующими в этой области спектра. Реакция может быть использована также и для разработки цитохимического метода выявления некоторых гемопротеинов в клетках животных. Именно этот прием используется, например, в криминалистике для обнаружения отдельных эритроцитов по их порфириновой люминесценции после обработки объекта серной кислотой.
Особенно широко распространены люминесцирующие в красной и желто-оранжевой областях спектра соединения (хлорофиллы и фикобилины) в клетках растений и водорослей. При этом представители разных типов имеют различающийся набор хлорофиллов и фикобилинов [129-131] (рис.18). Учитывая, что каждое из этих соединений имеет характерное для него положение максимумов в спектрах поглощения и люминесценции [132-135] (табл. 2), можно ожидать, что и суммарные спектры люминесценции клеток (например, водорослей), относящихся к разным типам, будут различаться между собой.
Действительно, спектры люминесценции одиночных клеток красной водоросли Ceratium rubrum (рис.19, 2) отличаются от спектров зеленой (рис.19, 3) и бурой (рис.19, 1) водорослей прежде всего присутствием двух дополнительных полос излучения с максимумами 585 и 640-660 нм, принадлежащих характерным для этих растений фикоэритрину и фикоцианинам, отсутствующим у бурых и зеленых водорослей. В то же время положения основного максимума люминесценции хлорофиллов у них совпадают, отражая то обстоятельство, что хлорофилл а является общим основным пигментом этих растений (рис.18).

Тип |
Тип тилакоида |
Хлорофилл |
R-фикоэритрин |
|
R-фикоцианин |
|
Аллофикоцианин |
|
C-фикоэритрин |
|
C- фикоцианин |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
a |
b |
c |
c1 |
c2 |
d |
|||||||||||
Clorophyceae |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Euglenophyceae |
VI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Xanthophyceae |
IIIb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Eustigmatophyceae |
IIIa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Chrysophyceae |
IIIb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Haptophyceae |
IIIb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pheophyceae |
IIIb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bacillariophyceae |
IIIb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dinophyceae |
IIIa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cryptophyceae |
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rhodophyceae |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cyanophyceae |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 18. Пигментный состав и структурная организация тилакоидов хлоропластов у водорослей разных типов
Таблица 2
Положение полос люминесценции (в нм) пигментов растений в растворе [132—135] и в плетке
Соединение |
Раствор |
Клетка |
Примечание |
Хлорофилл а |
669, 723 |
678 |
рис. 21, 3 |
Хлорофилл b |
649, 708 |
— |
— |
Хлорофилл с |
629, 690 |
— |
— |
Хлорофилл |
696, 752 |
— |
— |
Бактериохлорофилл |
805 |
— |
— |
Хлоробиум-хлорофилл . |
653 |
— |
— |
R-фикоэритрин |
578 |
572 |
рис. 21,2; 22, 2 |
С-фикоэритрин |
575 |
— |
— |
R-фикоцианин |
565, 637 |
640 |
рис. 22, 3 |
С-фикоцианин |
647 |
643 |
рис. 23,б, 2 |
Аллофикоцианин |
660 |
660 |
рис. 22, 2 |
лорофиллы – раствор в этиловом эфире: фикобилины – водный раствор
По-видимому, пигментный состав, а следовательно, и спектральные, в том числе люминесцентные, характеристики одноклеточных водорослей являются более вариабельными, чем у клеток многоклеточных водорослей (рис.19), и в большей степени зависят от условий обитания, возраста и т. д. Однако по приведенным на рис.20 спектрам люминесценции одиночных клеток одноклеточных зеленых, синезеленых, красных и диатомовых водорослей можно, пользуясь сравнением с данными рис.18, установить положение полос люминесценции в живых клетках только некоторых пигментов. Наиболее четко при этом выделяется полоса излучения 572 нм (рис.20, 2), принадлежащая R-фикоэритрину, характерному для красных водорослей (рис.18). Что касается полос излучения хлорофиллов, лежащих в области 670÷690 нм, то кривая 3 (синезеленые) должна отражать присутствие только хлорофилла а, в то время как спектры 1 (зеленые), 2 (красные) и 4 (диатомовые) должны содержать полосы излучения смеси хлорофиллов: a+b, a+d, a+c1+c2 соответственно (рис.18). Поэтому можно полагать, что основная полоса излучения хлорофилла а в относительно «чистом» виде наблюдается в спектре синезеленых водорослей (рис.21, 3) и ее максимум лежит в области 678 нм. Для определения максимумов других хлорофиллов требуется более тонкий анализ.

Рис. 19. Спектры люминесценции клеток бурой
(1 – Cystoseira barbata), красной (2 – Ceratium rubrum) и зеленой (3 – Ulva lactuca) морских водорослей. Длина волны возбуждения 365 нм.
Рис. 20. Спектры люминесценции одиночных клеток зеленых (1 – Scenedesmus quadricauda), красных (2 – Porphyridium cruentum), синезеленых (3 – Microcystis aeruginosa) и диатомовых (4 – Biddulphia mobiliensis) одноклеточных водорослей. Длина волны возбуждения 436 нм.
Дополнительные сведения могут быть получены при изучении изменений спектральных характеристик клеток под действием тех или иных факторов. Простейшим в методическом отношении случаем, по-видимому, является изменение спектров во времени под действием интенсивного светового облучения. Приведенные на рис.21 данные позволяют по мере «выгорания» части компонентов спектра установить положение максимумов излучения, маскировавшихся ранее. Так, например, по спектру 2 можно определить максимум люминесценции аллофикоцианина (660 нм) и уточнить положение максимума R-фикоэритрина (572 нм). Дальнейшее облучение приводит к «выгоранию» аллофикоцианина, и положение максимума излучения R-фикоцианина (640 нм) становится доступным для определения (рис. 21, 3).
Рис. |
21. |
Изменение |
спектра |
люминесценции |
одиночной |
клетки |
|
красной водоросли Porphyridium cruentum
(1) через 1 (2), 2 (3) и 3 (4) мин облучения светом с длиной волны 436 нм. Длина волны возбуждения 436 нм.

Динамика спектров люминесценции синезеленой водоросли в процессе старения популяции (рис. 22) указывает на значительные изменения пигментного состава клеток и позволяет определить положение максимума люминесценции С-фикоцианина (643 нм) в спектре клеток, относящихся к 8- месячной популяции (рис. 22, б, 2), в котором исчезают близко расположенные полосы люминесценции других пигментов. Следует обратить внимание и на то обстоятельство, что по мере уменьшения интенсивности люминесценции хлорофилла а (678 нм) наблюдается увеличение интенсивности люминесценции пиридиннуклеотидов (470 нм) и флавопротеинов (520 нм), что указывает, по-видимому, на происходящую по мере старения культуры смену аутотрофного (фотосинтетического) способа энергообеспечения на гетеротрофный.
Рис. 22. Спектры люминесценции одиночных клеток синезеленой водоросли Microcystis aeryginosa в разные сроки культивирования: а – 3 (1), 15 (2) и 120 (3) суток культивирования; б – 6 (1), 8 (2) и 9 (3) месяцев культивирования. Длина волны возбуждения 365 нм.
Приведенные примеры в какой-то мере показывают перспективность применения люминесцентного спектрального анализа в исследовании физиологии растительных клеток. Следует отметить также, что благодаря чрезвычайно яркой люминесценции (высокий квантовый выход) хлорофиллы используются иногда в люминесцентной цитохимии в качестве специфического красителя - метки жиров.
Биолюминесценция. Хотя биолюминесценция (способность клеток некоторых видов животных и микроорганизмов генерировать свет) встречается не очень часто, это явление требует, тем не менее, пристального внимания по ряду причин.
1.Биолюминесценция, несомненно, связана с интимными химическими процессами, протекающими в клетке и ее органоидах, и может быть использована после соответствующего изучения для тонкого анализа физиологического состояния клеток обладающего способностью к биолюминесценции организма.
2.Между молекулярными механизмами ярко выраженной у некоторых рыб, беспозвоночных
имикроорганизмов биолюминесценции и так называемым сверхслабым свечением клеток теплокровных животных [136-139] существует, по-видимому, некоторая общность, и изучение биолюминесценции может способствовать более глубокому пониманию процессов, лежащих в основе сверхслабого свечения тканей и клеток животных.
3.Наконец, биолюминесцентные реакции характеризуются высокой специфичностью и участвующие в них вещества могут быть выделены и использованы в качестве хемилюминесцентных меток некоторых химических компонентов метаболизма. Примером тому может служить биолюминесцентная реакция экстракта из светлячков, позволяющая определять концентрацию АТФ в среде [140-142]. По-видимому, наиболее убедительные данные о динамике кальция в процессе мышечного сокращения были получены Эшли и Риджуэем [143], использовавшими фотопротеин медузы Aequorea в качестве хемилюминесцентного реагента на кальций [144-147]. Поиск подобного типа хемилюминесцентных флуорохромов-меток является одним из наиболее перспективных направлений развития люминесцентного анализа функциональных механизмов живой клетки.
Явление биолюминесценции широко распространено у организмов самого разного уровня филогенеза [148—153]. Биолюминесцентное излучение может лежать в ультрафиолетовой, синей, зеленой и красной областях спектра [151, 152]. Следует, правда, отметить, что ультрафиолетовая и красная биолюминесценции встречаются редко среди описанных видов. В частности, только у колониальных кишечнополостных Renilla [154] обнаружена ультрафиолетовая компонента в спектре излучения. В видимой области спектра биолюминесценция этих кишечнополостных характеризуется

наличием двух максимумов излучения, один из которых (509 нм) является основным. Вторая полоса излучения меньшей интенсивности расположена в области 540-570 нм и регистрируется (рис.23, а, б) в виде плеча [155, 156]. Аналогичная форма спектров биолюминесценции сохраняется и при проведении реакции in vitro с выделенным [157] из тканей фотопротеином. При этом в процессе реакции потребляется О2 и выделяется СО2 [158]. Реакция протекает по схеме, приведенной на рис.24.
Рис. 23. Биолюминесценция
Renilla reniformis. а – спектры люминесценции целого животного
(1) и люминесценции люциферазы (2), выделенной из этого животного [155]; б – зависимость Са2+- индуцируемой люминесценции люмисом, изолированных из R reniformis, от кислорода [159].
Рис. 24. Генерация света (hν) при хемолюминесцентном и биолюминесцентном окислении синтетического люциферина [158].
В клетках кишечнополостных биолюминесценция локализована в специальных внутриклеточных гранулах, названных люмисомами [159, 160]. Выделенные люмисомы генерируют свет при добавлении к ним Са2+ в присутствии кислорода (рис.24, б). Следует при этом отметить, что и другие ионы помимо кальция способны стимулировать биолюминесцентное излучение люмисом, хотя и с несколько меньшей эффективностью (см. ниже).
Добавленный ион |
Са2++ Sr2++Ва2++Со2++Cu2++ Mn2++Zn2++Fe2++La2++Pb2++Mg2++NH4+ +K+ |
Биолюминесценция, % |
100 26 1 22 24 31 20 21 6 2 <1 <1 <1 |
Приведенные на рис.23, б данные указывают на возможность использования биохемилюминесценции фотопротеинов кишечнополостных (в том числе и известного экворина [161-163] и его синтетических аналогов [161]) в качестве реагента не только на внутриклеточный кальций [143], но и на кислород.
Желто-зеленая биолюминесценция (рис.23, а) наиболее распространена, хотя у некоторых видов животных, например «железнодорожный червь» и фотофоры на теле кальмара Lycoteuthis diadema, наблюдается биолюминесцентное свечение в красной области.
Можно полагать, что биолюминесценция на уровне организма и популяции несомненно имеет определенные поведенческие функции [164]. Однако эти функции являются, вероятно,

вторичными, и способность клеток организма к генерации света определяется в первую очередь биохимическими потребностями их энергопроизводящих систем. Экскреция избыточной энергии в виде светового излучения и предупреждение таким образом нежелательных химических реакций в клетке или теплового нагрева ее в некоторых ситуациях может оказаться решающим фактором вообще в существовании клеток и организмов данного типа. Многие системы терминального окисления (Схема метаболизма) имеют своим конечным продуктом перекись водорода Н2О2, которая обычно разлагается до воды с помощью гемсодержащих пероксидаз (рис.25, 4).
Рис. 25. Связь биолюминесценции с энергопроизводящими системами окислительного метаболизма клеток
Однако дезактивация Н2О2 может происходить и с помощью негемовой пероксидазы, излучающей избыток энергии в виде биолюминесцентного кванта света (рис.25, 2). Реакция типа
люцифераза
LH2 + Н2О2 → L + 2Н2О2 + hν
обнаружена у представителя кишечнодышащих Balanoglossus himinesis [165] и у земляного червя
Diplocardia longa [166].
Системы терминального окисления этого типа (рис.25, 2, 3, 4) обладают низким КПД и, повидимому, не используются клетками в нормальном режиме, когда энергообеспечение осуществляется за счет работы основной высокоэкономичной, но обычно маломощной системы (рис.25, 1) терминального окисления. Только в условиях напряженного энергетического обмена, когда скорость выработка энергии в основной цепи терминального окисления перестает удовлетворять энергетическим запросам клетки (действие различных физических и химических раздражителей), происходит переключение путей переноса электронов в систему терминального окисления с большей мощностью, но и с меньшим КПД, и может возникнуть необходимость в

экскреции неиспользуемой части энергии в виде биолюминесцентного излучения. По-видимому, именно это обстоятельство и является причиной того, что биолюминесценция возникает у многих видов животных как реакция на то или иное раздражение или сопровождает возбуждение животного.
В настоящее время трудно определить, обязательно ли присутствие специальной негемовой пероксидазы в системе (рис.26, 2) или эту роль могут выполнять непосредственно сами флавопротеины (рис. 26, 3) и перекись водорода вообще не образуется в этом случае. Красное биолюминесцентное излучение может, по-видимому, возникать, если экскреция энергии происходит с более низкого энергетического уровня цепи переноса электронов, например с уровня цитохромов
(рис. 25, 1).
При изучении внутриклеточных механизмов биолюминесценции особый интерес в связи с изложенным выше представляет сравнение биолюминесцентных и люминесцентных характеристик клетки с целью установления взаимосвязи механизмов генерации света с окислительным обменом. Такое исследование было выполнено на примере фотогенных клеток гребневика Bolinopsis infundibulum [167] с использованием микроспектрофлуориметра [168] с улучшенными спектральными характеристиками [169]. Возбуждение люминесценции объекта производилось линией излучения 365 нм ртутной дуговой лампы ДРШ-250, выделяемой светофильтром УФС-6. Размеры фотометрируемого участка 20×100 мкм. Во время регистрации спектров биолюминесценции полностью отключался источник ультрафиолетового излучения (ДРШ-250) и на объект подавались прямоугольные импульсы электрической стимуляции c частотой 0,5-1 Гц, вызывавшие световые вспышки той же частоты (рис. 26).
Рис. 26. Установка для регистрации спектров биолюминесценции и люминесценции фотогенных клеток гребневника Bolinonsis infundibulum.
1 – микроспектрофлуориметр; 2, 5 – фотоумножители; 3 , 6 – промежуточные усилители; 4, 7 – одноканальные регистраторы.
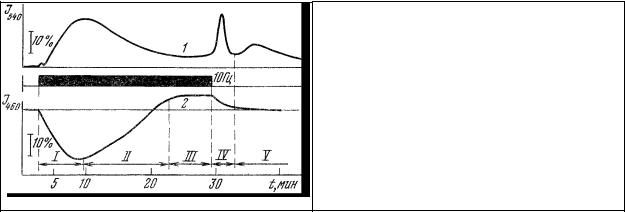
Ввиду того, что при малой частоте (0,5-1 Гц) и длительности (1-5 мс) импульсов электрической стимуляции биолюминесцентные вспышки характеризуются малой дисперсией амплитуды, при включении развертки микроспектрофлуориметра в интервале длин волн от 400 до 700 нм регистрировалась последовательность световых импульсов, огибающая которой представляет собой спектр импульсной биолюминесценции (рис.27, а, 2). В ряде экспериментов применялся параллельный контроль стабильности амплитуды световых вспышек с помощью второго фотоумножителя (рис.26).
Для исследования использовали небольшие кусочки фотогенной ткани (1-3 мм), вырезанные из меридиональных рядов гребных пластинок. Препараты приготавливали обычно накануне экспериментов и хранили в чашках Петри при t = 0° 8-12 ч. К началу опытов из этих вырезанных кусочков ткани образовывались сферические агрегации клеток, окруженные венчиком бьющихся гребных пластинок. В отличие от целого животного такие агрегации отвечают на раздражение более или менее стандартными по форме одиночными световыми импульсами.
Особенностью биолюминесценции гребневика (и хемилюминесценции выделенного из него фотопротеина) является то, что достаточно интенсивный белый свет полностью инактивирует ее и открывается возможность сравнивать спектральные характеристики фотогенных клеток в двух состояниях - способных к биолюминесценции и не способных (инактивированных белым светом).
Биолюминесценция целых гребневиков и агрегаций их фотогенных клеток возникает в ответ на электрическое, механическое или иное стрессирующее раздражение и имеет импульсный характер. При этом форма и длительность световых импульсов более или менее стандартны и не определяются характером стимуляции. При электрическом раздражении животного появление биолюминесцентного импульсного ответа запаздывает (рис.28, а) относительно начала стимуляции,

биолюминесцентные импульсы наблюдаются также и после окончания раздражения (рис.28, б). Только при использовании для электростимуляции импульсов достаточно высокой амплитуды и малой частоты их следования (0,5-1 Гц) можно получить биолюминесцентный ответ на каждый стимулирующий импульс.
Рис. 27. Спектры биолюминесценции и люминесценции фотогенных клеток гребневника. а – статическая (1) и импульсная
(2) биолюминесценция; б – сравнение спектра импульсной биолюминесценции фотогенных клеток (1) со спектрами люминесценции тех же клеток, адаптированных к темноте (2, 3) и после облучения видимым светом в течение 40 мин (4). По оси ординат – интенсивность излучения в отн. ед. по оси абсцисс – длина волны в нм. Длина волны возбуждения люминесценции 365 нм.
Рис. 28. Взаимоотношение биолюминесценции
(1) и электрической стимуляции (2) фотогенных тканей гребневника.
Оказалось, что, как и у многих кишечнополостных (см. рис.23), основной максимум спектра биолюминесценции гребневика лежит в области 505±5 нм и имеется дополнительный максимум излучения 540—570 нм (рис.27, б, огибающая 1).
Спектры люминесценции (возбуждаемой УФ-излучением) фотогенных участков агрегаций, находившихся в темноте и способных к биолюминесценции, характеризуются максимумом излучения 490 нм .(рис.27, б, 3). Освещение этих агрегаций ярким видимым светом (15000 люкс) приводит к потере ими способности высвечиваться в ответ на раздражение и сопровождается, как оказалось, изменением спектра люминесценции таким образом, что одновременно с уменьшением полосы с максимумом 490 нм наблюдается увеличение интенсивности полосы с максимумом 465 нм
ипоследний максимум становится основным в спектре (рис.27, б, 4).
Вряде случаев на свежеприготовленных препаратах адаптированных к темноте агрегаций регистрируются спектры люминесценции, отличающиеся большой интенсивностью излучения в области 505 нм (рис. 27, б, 2) и совпадающие по положению максимума со спектрами биолюминесценции. Амплитуда таких спектров быстро уменьшается, их максимум смещается в область 490 нм, и сами спектры приобретают обычно регистрируемую форму (рис.27, б, 3). Продолжающееся действие возбуждающего люминесценцию УФ-излучения приводит к дальнейшим изменениям спектра и приближению его к характерной для неспособных к биолюминесценции агрегаций форме (рис.27, б, 4). В то же время ритмические биения ресничек агрегаций не только не подавляются видимым светом в ходе опытов, но, напротив, ускоряются на свету.
При добавлении нескольких капель дистиллированной воды в камеру с объектом наблюдается серия вспышек и последующая статическая биолюминесценция, максимум спектра
которой совпадает с максимумом спектра импульсного высвечивания (рис.27, а, 1). После прекращения статической биолюминесценции объект длительное время сохраняет способность отвечать импульсами высвечивания, на электрическую стимуляцию.
Приведенные данные указывают на то, что биолюминесценция, представляющая собой излучение в пространство определенных порций энергии, развивается параллельно с усилением энергетического обмена клеток в ответ на раздражение. Об изменении энергетического обмена клеток, точнее - терминальной стадии его, свидетельствует значительное изменение их спектров люминесценции под действием света.
Веществами, ответственными за полосы люминесценции клеток с максимумами 460-470 и 520-530 нм, относительная интенсивность которых зависит от функционального состояния тканей, являются обычно восстановленные пиридиннуклеотиды (460-470 нм) и окисленные флавопротеины (520-530 нм) систем терминального окисления. Совпадение максимумов спектра биолюминесценции и, по-видимому, полосы люминесценции окисленного флавопротеина, а также резкое уменьшение интенсивности люминесценции этого флавопротеина при световой инактивации биолюминесценции указывает на возможность того, что именно окисленная форма флавопротеина является веществом, ответственным за генерацию биолюминесцентного излучения, и тогда предположительно реализуется система 3 (рис.25). Однако несколько необычное для флавопротеинов положение максимума (505-509 нм) не позволяет исключить существования некоего промежуточного соединения, функцией которого является трансформация химической энергии в световое излучение, аналогичного негемовой пероксидазе системы 2 (рис. 25).
Видимый свет подавляет биолюминесценцию клеток, не влияя при этом на их жизнеспособность (о чем свидетельствует нормальное или даже несколько ускоренное биение ресничек). Это позволяет предполагать, что биолюминесценция связана именно с вспомогательной (рис.25, 2, 3), а не с основной (рис.25, 1) системой терминального окисления.
Микроскопические наблюдения биолюминесценции и люминесценции агрегаций при увеличениях ×100 - ×1000 показывают, что при электрическом раздражении происходит импульсное высвечивание отдельных внутриклеточных гранул, обладающих участками с интенсивной желтозеленой люминесценцией. Такие овальные гранулы, достигающие 6-8 мкм в диаметре, наблюдаются в клетках, расположенных под гребными пластинками в области меридиональных гастроваскулярных каналов [170-172].
Интересно отметить, что биолюминесцентная система с импульсным высвечиванием представляет собой, по-видимому, систему, аналогичную лазеру с химической накачкой излучающих молекул на возбужденный энергетический уровень. По мере увеличения заселенности возбужденного уровня повышается вероятность перехода одной из молекул в основное состояние с излучением кванта света, который индуцирует развитие лавинообразного процесса перехода остальных молекул в основное состояние, что и приводит к появлению биолюминесцентного импульса. Освещение белым светом подавляет только способность к импульсному высвечиванию, постоянно стимулируя переход молекул с возбужденного уровня на основной. При этом излучается то же, что и ранее, общее количество энергии, но за счет равномерного распределения ее во времени интенсивность непрерывного излучения резко падает.
2.2. Функциональная активность клетки и регуляция энергетического аппарата
Среди проблем, решаемых методами микроспектрального анализа, особое место занимают вопросы регуляции энергетического аппарата клетки [23, 64, 65, 173]. Энергетическое обеспечение - важнейшая сторона жизнедеятельности живых систем. Любое функциональное проявление от сокращения мышечной клетки и транспорта ионов через мембрану против градиента концентрации до синтеза специализированных белков или нуклеиновых кислот должно быть оплачено поставками энергии из соответствующих энергопроизводящих систем.
Биологической основой применения спектральных методов к изучению взаимосвязи энергетических систем клетки с ее функциональными механизмами являются два важных обстоятельства.
1.Спектры поглощения и люминесценции многих ферментов и коферментов сильно зависят от того, в какой (окисленной или восстановленной) форме находятся эти компоненты систем окислительного метаболизма (Схема метаболизма).
2.Благодаря действию соответствующих систем регулирования, соотношение окисленных и восстановленных форм компонентов окислительного метаболизма (т.е. скорость выработки энергии) определяется функциональной активностью клетки.

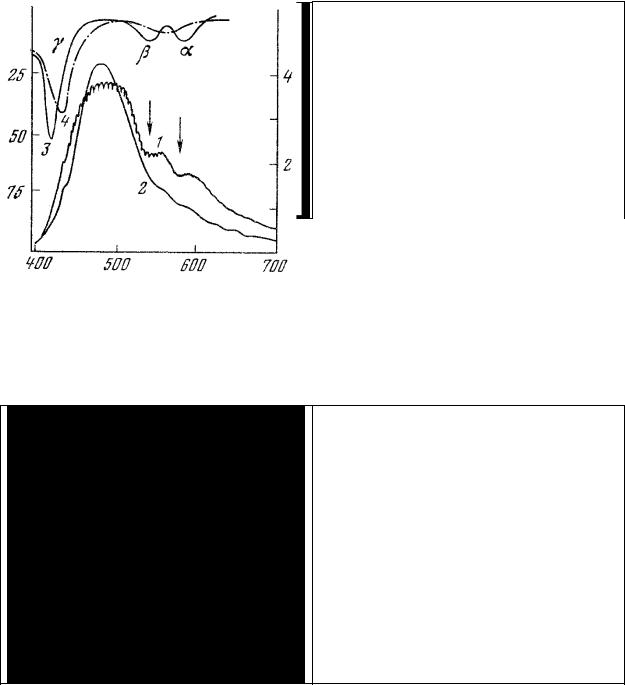
В качестве иллюстрации этого положения на рис.30 представлено соотношение окисленных и восстановленных форм компонентов наиболее хорошо изученной м:итохондриальной системы [174] окислительного фосфорилирования: цитохром с — цитохромоксидаза (Схема метаболизма) для разных функциональных состояний митохондрий. Из этого рисунка следует, в частности, что переход из состояния покоя (состояние 4) в состояние активного обмена (состояние 3) сопровождается увеличением концентрации окисленных форм пиридиннуклеотида (НАД), флавопротеинов (Фп) и цитохромов (а + а3, с1, с, в) и соответствующим уменьшением концентрации их восстановленных форм. Такая же закономерность характерна и для других систем терминального окисления.
Как уже отмечалось выше, такие компоненты окислительного метаболизма, как пиридиннуклеотиды и флавопротеины, обладают характерными спектрами люминесценции. Причем, если пиридиннуклеотиды люминесцируют только в восстановленном состоянии (460-480 им) и теряют способность люминесцировать при переходе в окисленное состояние (рис.11), то флавопротеины, наоборот, люминесцируют только в окисленном состоянии, (520-530 нм) и теряют способность к люминесценции при переходе в восстановленную форму (рис.12). Поэтому каждое из приведенных на рис.29 метаболических состояний митохондрий может быть охарактеризовано
Рис. 29. Соотношение окисленных (светлые столбики) и восстановленных (темные столбики) форм компонентов дыхательной цепи митохондрий (рис. 11, система 2) в разных функциональных состояниях.
Действие ингибиторов приводит к восстановлению компонентов цепи, расположенных левее точки действия ингибиторов, и окислению компонентов, расположенных справа от точки действия ингибитора.
спектром люминесценции с различным соотношением интенсивностей полос излучения восстановленных пиридиннуклеотидов (460-480 нм) и окисленных флавопротеинов (520-530 нм).
Для иллюстрации возможностей применения метода люминесцентного спектрального анализа при изучении взаимосвязи энергетики и функций живой клетки могут быть рассмотрены результаты исследования рецептора растяжения ракообразных [175]. Особый интерес представляет при этом наличие в препарате рецептора растяжения нервных и мышечных клеток двух типов, значительно различающихся по скорости адаптации их к нагрузке.
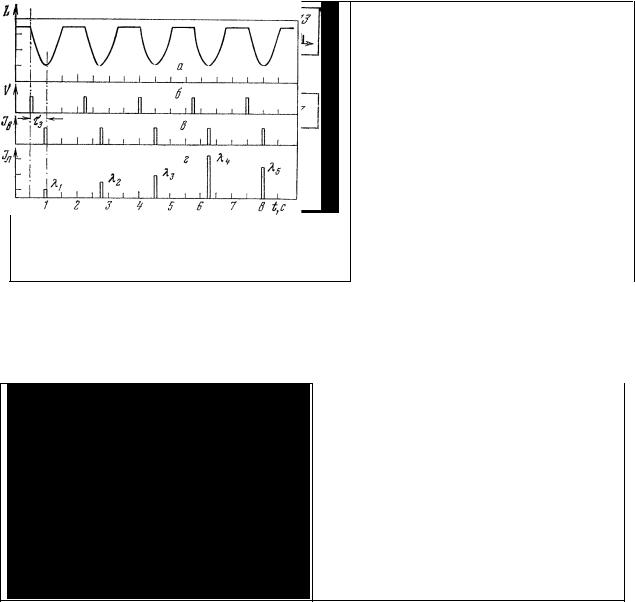
В состав препарата (рис.30, а) входят два крупных (70-100 мк) механорецепторных нейрона, медленно и быстро адаптирующихся к раздражению. Короткие дендриты этих нейронов оканчиваются на тонких пучках мышц, медленно и быстро адаптирующихся к нагрузке. Аксоны нейронов направляются в соответствующий ганглий брюшной цепочки [176-181].
При спектральных люминесцентных исследованиях такого препарата оказалось, что клетки (нервные и мышечные), различающиеся по скорости адаптации их к нагрузке, характеризуются различными по форме спектрами люминесценции (рис.30, б-г). Положение полос излучения в спектрах и изменение их амплитуды при действии на препарат ингибитора гликолиза - моноиодуксусной кислоты (рис.30, д) - и разобщителя окисления с фосфорилированием - 2,4- динитрофенола (рис.30, в, г) - позволяет полагать, что люминесценция нейронов и мышц обязана своим происхождением восстановленным пиридиннуклеотидам (470—460 нм) и окисленным

флавопротеинам (520 нм) систем окислительного метаболизма.
Соотношение интенсивностей полос люминесценции пиридиннуклеотидов и флавопротеинов в спектрах свидетельствует о разном метаболическом состоянии энергосистем исследованных клеток. Медленно адаптирующиеся нервные (рис.30, б) и мышечные (рис.30, в) клетки характеризуются спектрами с примерно одинаковыми интенсивностями полос восстановленных пиридиннуклеотидов (460-470 нм) и окисленных флавопротеинов (520 нм). Такое соотношение окисленных и восстановленных форм компонентов дыхательных систем характерно для тканей, находящихся в состоянии активного обмена (рис.29, 3). Скорость переноса электронов по дыхательной цепи при этом максимально высока, и действие разобщителя окисления с фосфорилированием 2,4- динитрофенола практически не меняет соотношения интенсивностей полос ПН — Н2 и ФП (рис.30,
в).
Наблюдаемое уменьшение амплитуды спектра связано со значительным поглощением возбуждающего люминесценцию излучения слоем раствора 2,4-динитрофенола.
Рис. 30. Схема рецептора и спектры люминесценции нейронов и мышц рецептора растяжения речного рака.
а – медленно (1) и быстро (2) адаптирующиеся нейроны, медленно (3) и быстро (4) адаптирующиеся мышцы, аксоны (5); б – медленно (1) и быстро (2) адаптирующиеся нейроны; в – медленно адаптирующаяся мышца до (1) и после (2) действия 2,4-динитрофенола в течение 4 мин; г – быстро адаптирующаяся мышца до (1) и после (2) действия 2,4-динитрофенола в течение 4 мин; д – изменение спектра люминесценции быстро адаптирующегося нейрона (1) после действия на препарат моноиодуксусной кислоты в течение 15 (2), 13 (3) и 16 (4) мин. Длина волны возбуждения 365 нм; размер фотометрируемого участка 10×40 мкм.
В отличие от этого спектры быстро адаптирующихся нервных (рис.30, б) и мышечных (рис.30, г) клеток характеризуются ярко выраженным преобладанием полос люминесценции восстановленных пиридиннуклеотидов. Такое соотношение окисленных и восстановленных форм компонентов дыхательной цепи характерно для тканей, находящихся в состоянии покоя (рис.29, 4). Введение в препарат 2,4-динитрофенола приводит, как это и должно быть при разобщении окисления с фосфорилированием, к резкому изменению формы спектра люминесценции клеток. Преобладающими при этом становятся полосы люминесценции окисленных флавопротеинов (рис.30, г), а сами спектры приобретают форму, аналогичную форме спектров медленно адаптирующихся

тканей (рис.30, б, в), т.е. скорость переноса электронов по дыхательной цепи становится максимально высокой.
Приведенные на рис.30, д спектры люминесценции показывают динамику изменения быстро адаптирующегося нейрона (рис.30, а, 2) при введении в препарат ингибитора гликолиза - моноиодуксусной кислоты. Наблюдающееся при этом увеличение концентрации окисленных флавопротеинов по отношению к концентрации восстановленных пиридиннуклеотидов свидетельствует, по-видимому, о снижении скорости восстановления флавопротеинов дегидрогеназами цикла Кребса за счет блокирования гликолиза моноиодуксусной кислотой при оставшейся неизменной скорости поступления кислорода в дыхательную цепь.
Основываясь на спектрах люминесценции (рис.31), получаемых при возбуждении излучением
Рис. 31. Определение параметра ξ.
– спектр люминесценции внутриклеточных митохондрий;
– нормированный спектр люминесценции раствора НАД Н (1.5 10-4 М) в этаноле для определения его вклада в максимуме люминесценции окисленных флавопротеинов (530 нм).
Длина волны возбуждения 365 нм; диаметр зонда 10 мкм.
с длиной волны 365 нм, удобно количественно охарактеризовать степень активности внутриклеточных митохондрий параметром [65].
ξ = Ιфп /Ιпн == В/А |
(12) |
В этом выражении А представляет собой интенсивность люминесценции восстановленных пиридиннуклеотидов (НАД Н) в длине волны 465 нм, а В - интенсивность люминесценции окисленных флавопротеинов, для определения которой необходимо из общей интенсивности люминесценции в длине волны 530 нм (рис.31, 1) вычесть вклад полосы излучения НАД Н в этой длине волны. Поскольку интенсивность люминесценции раствора НАД Н (рис.31, 2) в длине волны 530 нм составляет 0,47 от интенсивности люминесценции этого соединения в максимуме (465 нм) излучения (см. рис.11, б), для определения величины В с достаточной степенью точности можно из общей интенсивности в длине волны 530 нм (Ι530 ) вычитать ½ интенсивности люминесценции НАД Н в максимуме (Ι465). Тогда выражение (12) для определения параметра ξ приобретает вид:
ξ= B/A = (Ι530 - 0,5Ι465) /Ι465 , |
(12’), |
в котором все величины могут быть измерены по спектру люминесценции внутриклеточных митохондрий (рис.31, 1).
Полученный таким образом безразмерный параметр характеризует степень активности митохондрий и, как было показано выше (см. уравнение 11, гл.1), не зависит ни от изменения рассеивающих свойств микрообъекта, ни от изменения таких аппаратурных факторов, как чувствительность регистрирующей системы, интенсивность возбуждающего излучения и т. п.
Описываемый препарат рецептора растяжения интересен и в другом отношении. Оказалось [182], что в его механорецепторных нейронах присутствует два пула митохондрий, различающихся по своей энергетической активности. Действительно, при микроскопическом излучении нейронов в свете их собственной люминесценции наиболее высокая плотность люминесцирующих частиц наблюдается в областях, расположенных вокруг ядер механорецепторных нейронов (рис.32, 1, 2). Несколько меньшая плотность таких частиц характерна для областей цитоплазмы, прилегающих к наружноной мембране нейронов. По данным электронной микроскопии, в околоядерной области и в примембранных областях цитоплазмы располагаются скопления митохондрий [183].
При проведении микроспектрофлуориметрических исследований оказалось, что митохондрии, расположенные в различных участках приядерной области, обладают почти идентичными спектрами люминесценции (рис.33, 1-3) и значительно отличаются по форме спектра от митохондрий, локализованных в примембранных областях цитоплазмы (рис. 33, 4-6). Эти примембранные митохондрии, в свою очередь, характеризуются почти одинаковыми по форме (соотношение

максимумов излучения) спектрами люминесценции. Присутствие в одной и той же клетке скоплений митохондрий, характеризующихся в один и тот же момент времени разными по форме спектрами люминесценции, указывает на существование в этих клетках отдельных пулов митохондрий, находящихся в разных по своей функциональной активности состояниях. В частности, для медленно адаптирующегося нейрона, приведенного в качестве примера на рис.33, характерна более высокая активность приядерного пула митохондрий по сравнению с митохондриями примембранных областей (рис.33, 3, 5). Не менее часто наблюдается и противоположная ситуация, когда более активными оказываются митохондрии примембранного пула.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис.32 |
|
|
Рис.33 |
|
|
||
Рис. 32. Рецептор растяжения речного |
Рис. 33. Спектры люминесценции приядерной области (1-3) |
||||||
рака |
в |
свете |
собственной |
и периферических участков (4-6) цитоплазмы медленно |
|||
люминесценции. 1-5 – то же, что на |
адаптирующего нейрона. |
||||||
рис. 31, а; микроскоп МЛ-4, «синяя» |
Длина волны возбуждения 365 нм; диаметр зонда 7 мкм. |
||||||
пластинка. Длина волны возбуждения |
|
|
|||||
365 |
нм |
светофильтр |
УФС-6); |
|
|
||
запирающий светофильтр – (ЖС-3 + |
|
|
|||||
БС-8). |
|
|
|
|
|
|
|
Используя введенный выше безразмерный параметр, характеризующий степень активности митохондрий, можно проследить как за распределением степени активности митохондрий в одиночном механорецепторном нейроне, так и за изменением этого распределения при умеренных физиологических воздействиях на клетку. Приведенные на рис.34, а данные показывают, что в то время как митохондрии приядерного пула находятся в состоянии малой активности (ξ=0,6), митохондри примембранного пула аксона характеризуются высокой активностью (ξ = 0,9÷1,3). Умеренное растяжение мышц приводит к увеличению активности как приядерных (ξ == 0,8), так и примембранных (ξ = 1,5÷1,6) митохондрий (рис.35, а, 2). Однако исходное распределение активностей между двумя упомянутыми пулами митохондрий остается в общем неизменным: примембранные митохондрии более активны, чем митохондрии приядерной зоны.
Рис. 34. Распределение состояний митохондрий (ξ) в двух клетках (а, б) в норме (1), после растяжения (2) и введения бескальциевой среды
(3) в медленно адаптирующем нейроне рецептора растяжения речного рака.
Диаметр зонда 7 мкм. По оси ординат – безразмерный индекс ξ состояния митохондрий.
Резкое изменение соотношений активностей митохондрий разных пулов наблюдается при замене раствора Харевельда на бескальциевую среду той же тоничности (рис.34, а, 3). При этом
степень активности приядерных митохондрий (ξ == 1,7) становится выше, чем у примембранных (ξ = 1,5÷1,6). Еще более четко изменение соотношения активностей митохондрий двух пулов прослеживается в случае, приведенном на рис.34, б. Если в исходном состоянии (рис.34, б, 1) митохондрии приядерного пула (ξ = 0,4) были менее активны, чем митохондрии примембранного пула (ξ ==0,8÷0,85), то после замены среды на бескальциевую наблюдается обратное соотношение. Активность у приядерных митохондрий (ξ = 1,6) становится выше, чем у примембранных (ξ = 0,8÷1,0). По-видимому, именно такое состояние нейронов и зафиксировано на рис. 32.
Приведенные данные указывают на существование в одной клетке двух (приядерного и примембранного) пулов митохондрий, обеспечивающих энергией, по-видимому, разные функциональные механизмы, локализованные в области ядра и в примембранных областях нейрона соответственно. В настоящее время нет возможности высказать экспериментально аргументированные суждения о механизме синхронизации активности митохондрий, относящихся к какому-либо из этих пулов. Неясно, обеспечивается ли эта синхронизация только за счет повышения скорости потребления энергии соответствующим функциональным механизмом или в основе наблюдаемого явления лежит наличие связи между митохондриями одного и того же пула. Такая связь может быть как прямой, объединяющей наблюдаемые на электронно-микроскопических срезах митохондрий в единый митохондриальный сросток [184], так и опосредованной через взаимодействие отдельных митохондрий с какой-либо другой системой.
В этой связи следует отметить, что имеются данные [185] о непосредственной связи примембранных митохондрий с протяженной системой септального ретикулума, наличие которого является характерной особенностью исследованных механорецепторных нейронов речного рака [183]. Возможно также, что все перечисленные механизмы в той или иной мере вносят свой вклад в наблюдаемую синхронизацию состояния митохондрий, относящихся к одному и тому же пулу.
Как видно из приведенных выше данных, параметр активности ξ митохондрий достаточно хорошо описывает поведение системы. Поэтому представляется полезным попытаться более подробно разобраться в биологическом (биохимическом) смысле этого параметра. Согласно уравнению (9), интенсивность люминесценции окисленных флавопротеинов в длине волны 520 нм равна
ΙФ = 2,31 ΙоdоεФkФcФ , |
(13) |
в то время как интенсивность люминесценции восстановленных пиридиннуклеотидов в длине волны 465—470 нм, измеренная в то же время и в том же участке клетки, составляет
ΙПН = 2,31ΙоdоεПНkПНcПН. |
(14) |
Тогда выражение для определения ξ принимает вид:
ξ = ΙФ / ΙПН = εФkФ / εПНkПН cФ / cПН , |
(15) |
где ε - молярные коэффициенты экстинкции; k - квантовые выходы люминесценции; cФ - концентрация окисленных флавопротеинов; cПН - концентрация восстановленных пиридиннуклеотидов.
По данным Чанса и Вильямса [174], степень окисленности и восстановленности флавопротеинов и пиридиннуклеотидов меняется в зависимости от функционального состояния митохондрий (рис.30), и потому концентрация окисленных флавопротеинов в уравнении (15) для каждого состояния митохондрий может быть определена как
cФi = ηФi СФ , |
(16) |
где ηФi — степень окисленности флавопротеинов в данном (i) состоянии; СФ - полная концентрация флавопротеинов в митохондриях, составляющая 0,72 нмоль/1 мг белка [174].
Аналогичным образом определяется и концентрация восстановленных пиридиннуклеотидов для определенного функционального состояния митохондрий:
сПНi = ηПНi СПН , |
(17) |
где ηПНi - степень восстановленности пиридиннуклеотидов в данном (i) состоянии; СПН - полная концентрация пиридиннуклеотидов в митохондриях, составляющая 3,8 нмоль/1 мг белка [174].
Тогда уравнение (15) для определенного (i) состояния митохондрий принимает вид:
ξ = ΙФ / ΙПН = εФkФ / εПНkПН 0,72/3,8 ηФi /ηПнi |
(15') |
или |
|
ξi = P ηФi /ηПнi, |
(15'') |
где Р = 0,2 εФkФ / εПНkПН - в первом приближении постоянный множитель.
Из сопоставления данных Чанса и Вильямса о соотношении окисленных и восстановленных форм компонентов дыхательной цепи митохондрий и результатов определения ξ для митохондрий нейрона рецептора растяжения (рис.34), приведенных в табл.3, можно видеть, что ξ оказывается практически равным отношению степени окисленности флавинов к степени восстановленности
пиридиннуклеотидов и постоянный множитель в уравнении (15'') близок к 1: Р = 0,2εФkФ / εПНkПН ≈ 1, при возбуждении люминесценции излучением с длиной волны 365 нм.
Таблица 3
Количественные отношения окисленных флаеопротеинвв и восстановленных пиридиннуклеотидов в митохондриях
Функциональное состояние |
ηФ [174] |
ηПН [174] |
ηФ / ηПН |
ξ = ΙФ / ΙПН |
митохондрий [174] |
|
|
|
|
1 |
0,79 |
0,9 |
0,88 |
- |
Истощение (2) |
1,0 |
0 |
|
|
Активное состояние (3) |
0,8 |
0,53 |
1,51 |
1,6-1,8 |
Покой (4) |
0,4 |
0,99 |
0,6 |
0,4-0,6 |
Анаэробиоз (5) |
0 |
1,0 |
0 |
- |
Таким образом, регистрация спектров люминесценции одиночных клеток и их органоидов позволяет не только качественно, но и количественно следить за работой энергосистем клетки.
Одним из наиболее «простых» объектов для изучения регуляции энергоаппарата клетки ее физиологической активностью [186] являются, по-видимому, клетки поперечно-полосатой скелетной мускулатуры, основная функция которых в организме заключается в преобразовании энергии химических связей питательных веществ в механическую работу. Возможность одновременно с измерением интенсивности люминесценции пиридиннуклеотидов и флавопротеинов регистрировать и функциональную активность мышцы (силу натяжения) значительно облегчает трактовку результатов.
В принципе, например, ответственным за изменение интенсивности люминесценции клетки в длине волны 465—470 нм мог бы являться не только митохондриальный НАД Н, но и НАД Н из системы гликолиза, а также и НАДФ Н, как это следует из Схемы метаболизма. Однако в случае мышечной ткани, где концентрация НАДФ составляет только около 3% от общего количества пиридиннуклеотидов [188], учитывая, что квантовый выход НАДФ Н в 3-4 раза ниже такового НАД Н, вкладом НАДФ Н в изменение люминесценции в области 465-470 нм можно пренебречь [101, 102]. Вопрос же о необходимости учета влияния гликолитического НАД Н на люминесцентный сигнал [103, 104] является более сложным. Хотя определенная синхронность разнонаправленного изменения интенсивности люминесценции пиридиннуклеотидов и флавопротеинов (рис.30, г) указывает на митохондриальную природу регистрируемых таким образом пиридиннуклеотидов мышцы (НАД Н), для выяснения этого вопроса потребовались специальные опыты, результаты которых приведены на рис. 35 [189]. Сила натяжения, развиваемая мышцей лягушки при калиевой контрактуре регистрировалась с помощью тензодатчика из электропроводной бумаги [190].
Развитие натяжения (рис.35, а, 1) при калиевой контрактуре в интактной мышце сопровождается двухфазным изменением интенсивности люминесценции пиридиннуклеотидов (рис.35, а, 2). При ингибировании гликолиза моноиодуксусной кислотой изменение люминесценции пиридиннуклеотидов (рис.35, б, 2) сохраняется, в то время как ингибирование цитохромоксидазы цианистым калием полностью устраняет их люминесцентную реакцию (рис.35, в, 2) на натяжение (рис.35, в, 1) при калиевой контрактуре.
Эти экспериментальные данные позволяют полагать, что изменение люминесценции мышечных клеток в области 4650-470 нм отражает изменение концентрации именно митохондриального НАД Н.
Клетки разных тканей, по-видимому, отличаются особенностями механизмов энергетической

регуляции. Поэтому для построения общих представлений необходимы исследования широкого плана. Однако изучение мышечных клеток вызывает особый интерес в связи с тем, что их основной функцией является именно преобразование химической энергии в механическую работу, которое характеризуется при этом и наиболее широким диапазоном развиваемых мощностей.
Рис. 35. Изменение натяжения (10 и интенсивности люминесценции пиридиннуклеотидов (2) мышцы лягушки при калиевой контрактуре [189].
а – нативная мышца, 122 мМ КCl; Р – отмывка раствором Рингера;
б – мышца после предварительной инкубации (50 мин) в растворе моноиодуксусной кислоты (5 мМ); 200 мМ
KCl;
в – мышца после предварительной инкубации (40 мин) в растворе цианистого калия (5 мМ); 122 Мм KCl.
Измерение люминесценции в длине волны 465 нм, длина волны возбуждения 365 нм.
Исследование люминесцентной реакции НАД Н мышечной клетки в ответ на единичное сокращение и кратковременную стимуляцию к выполнению работы разной мощности [191] позволяет полагать, что в скелетных мышцах связь между энергетикой и функцией является достаточно мягкой благодаря наличию мощных демпфирующих систем-аккумуляторов (запасы АТФ и креатинфосфата). Запасов макроэргов в этих аккумулирующих системах достаточно для энергообеспечения одиночного сократительного цикла и короткой серии (5-10) сокращений. При этом активация системы окислительного фосфорилирования происходит в течение одной или нескольких секунд после окончания сократительного цикла и направлена на восполнение запасов макроэргов в аккумулирующих системах. Таким образом, при нагрузках малой мощности система окислительного фосфорилирования не принимает непосредственного участия в осуществлении сократительного цикла.
При более мощных нагрузках (калиевая контрактура), величины которых превышают мощность аккумулирующих систем, митохондриальная система окислительного фосфорилирования оказывается непосредственно вовлеченной в осуществление сократительной функции, обеспечивая развитие фазы расслабления. Сравнение приведенных на рис.36, а, в данных показывает, что выключение системы окислительного фосфорилирования цианидом (рис.35, в) не препятствует быстрому развитию контрактуры, хотя амплитуда натяжения при этом уменьшается, по-видимому, в связи с уменьшением запасов макроэргов в аккумулирующих системах. Фаза же расслабления оказывается сильно затянутой в связи с прекращением выработки АТФ в митохондриальной системе окислительного фосфорилирования. При этом единственным источником АТФ становится, повидимому, анаэробный гликолиз. Резкое замедление расслабления (рис.35, в) указывает на то, что мощность гликолиза (скорость выработки АТФ) в несколько раз ниже, чем у митохондриальной
системы терминального окисления (рис.35, а).
Учитывая также и малый КПД гликолитической системы по сравнению с окислительной (в 20 раз ниже), можно полагать, что гликолиз представляет собой в мышце не столько альтернативный механизм производства АТФ, сколько основную систему поставки субстратов в цикл Кребса для обеспечения работы систем окислительного фосфорилирования. Действительно, выключение гликолиза моноиодуксусной кислотой (рис.35, б) приводит к тому, что расслабление, будучи энергетически не полностью обеспеченным, происходит не до конца, после чего следует новая фаза сокращения, сопровождающаяся окислением митохондриального НАД Н в связи с прекращением поставки водорода из цикла Кребса, который, в свою очередь, не получает субстратов из системы гликолиза, причем в скелетных мышцах в норме гликолиз является, по-видимому, основным поставщиком субстратов в цикл Кребса.
Как упоминалось выше, способность мышечных клеток осуществлять функционирование в широком диапазоне мощностей представляет особый интерес, и потому служила объектом специальных исследований [169, 192]. Было установлено, что при длительной работе мышцы лягушки с большой мощностью (высокая частота стимуляции) происходит изменение путей выработки энергии, включение, по-видимому, менее экономичных систем с более высокой мощностью. Приведенные на рис.36 данные показывают, что в первой фазе процесса наблюдается обычная для дыхательной системы митохондрий [174] реакция увеличения окисленных (рис.36, 1) и уменьшения восстановленных (рис.36, 2) форм компонентов цепи терминального окисления НАД H- цитохромоксидаза. Однако максимальная мощность этой системы оказывается, по-видимому, не достаточной для обеспечения сократительного аппарата в этом режиме и потому в фазе II наблюдается переход на иной путь терминального окисления. По окончании переходного процесса (фаза II) энергообеспечение сократительного аппарата уже полностью осуществляется энергосистемой высокой мощности (фаза III), т.е. происходит своего рода адаптация энергетики клетки к наложенной на нее нагрузке. Одним из указаний на наличие такой адаптации является колебательная реакция окисленных флавопротеинов (рис.35, 1) на снятие нагрузки (фаза IV).
Описанная реакция энергетической системы мышечных клеток проявляется только при относительно высоких мощностях (частотах стимуляции) нагрузки. При малой мощности (до 1-1,5 Гц) переключения путей терминального окисления не происходит и наблюдается только описанный Чансом и Вильямсом [174] переход митохондриальной системы из состояния покоя в состояние активного обмена. Ввиду того, что данные эксперименты проводились на мышечных клетках in situ, наблюдаемые эффекты не могут быть отнесены за счет каких-либо нарушений жизнеобеспечения тканей.
Рис. 36. Изменение концентрации окисленных флавопротеинов (1) и восстановленных пиридиннуклеотидов (2) мышечной клетки при длительной стимуляции с частотой 10 Гц. Длина волны возбуждения 365 нм. I – V – фазы адаптации энергоаппарата клетки.
Полезно при этом напомнить одну из работ Хилла [193], в которой, сравнивая скорость потребления кислорода и выполняемую мышцей работу, он показал, что коэффициент полезного действия преобразования мышцей химической энергии в механическую оказывается наиболее высоким (≈25%) при частотах сокращения 1—2 Гц. При частотах выше 1 Гц КПД резко падает.
Несомненно, что исследования регуляции энергоаппарата мышечных клеток находятся в настоящее время еще в стадии феноменологического накопления сведений. Однако значение этого этапа нельзя недооценивать, так как при изучении живой клетки в целом выявляются те особенности систем, которые обычно элиминируются при деструкции клеток в соответствии с требованиями методов классической биохимии. Большой интерес, в частности, представляют сведения о регулирующей роли кислорода, в работе энергосистем клеток разного типа [187, 194]. При параллельной регистрации концентрации НАД Н и дыхания [195] мышц был обнаружен любопытный феномен задержки дыхания (рис.37, 2) и быстрого восстановления митохондриального НАД Н (рис. 37, 1) в момент включения стимуляции мышц с относительно высокой (более 1,5 Гц) частотой. Величина

эффекта растет с увеличением частоты. По-видимому, в этом случае мы сталкиваемся с проявлением действия неизвестной нам обратной связи между активностью системы окислительного фосфорилирования и скоростью потребления ею кислорода. Увеличение скорости потребления кислорода в момент выключения нагрузки делает предположения о наличии обратной связи в достаточной мере обоснованными для дальнейших экспериментальных исследований природы этой связи.
Рис. 37. Изменение люминесценции НАД Н (460 нм) (1) и скорости потребления кислорода
(2) мышцей лягушки при стимуляции с частотой 1 (а), 2 (б) и 5 (в) Гц [195].
Заканчивая главу, следует подчеркнуть особые преимущества люминесцентного спектрального анализа в изучении физико-химических процессов, протекающих непосредственно в живой, функционирующей клетке. Возможность возбуждать люминесценцию излучением, фокусируемым на объект исследования тем же микрообъективом, который используется и для сбора света люминесценции, позволяет изучать клетки, лежащие на поверхности или на глубине 200—300 мкм от нее, не выделяя их из организма животного. Таким образом, в отличие от метода абсорбционной спектрофотометрии, где толщина объекта не может быть более 100—150 мкм, метод люминесцентного спектрального анализа позволяет производить исследования клеток in situ. При этом отпадает необходимость в наиболее сложной части экспериментов по физиологии клетки, а именно в поддержании адекватных условий внешней среды для выделенной из организма клетки. Эта задача возлагается на само подопытное животное [169, 196-198].
Именно такой подход был использован, например, при изучении адаптации энергоаппарата мышечных клеток, обсуждавшейся выше (рис.36). Живую лягушку помещали в препаровальную камеру и закрепляли в ней в таком положении, чтобы ее конечности, закрепленные лигатурами к бортикам камеры в слегка растянутом состоянии, оказались в удобном для дальнейшей работы
положении. На уровне голени и бедра разрезали кожу и оголяли мышцу. Стеклянными палочками раздвигали мышцы бедра и обнажали седалищный или большой берцовый нерв, к которому подводили электроды электростимулятора. Затем препаровальную камеру с животным помещали на предметный столик микроспектрофлуориметра [105, 168] и с помощью контактного микрообъектива производили регистрацию люминесценции (спектр или кинетика в определенной длине волны) участка одиночной мышечной клетки. Применение контактной оптики [199], по-видимому, особенно необходимо при исследовании такого подвижного объекта, как скелетная [169] или гладкая [198] мускулатура.
Другим методическим приемом, который может быть рекомендован при изучении периодических процессов в объектах, отличающихся высокой степенью подвижности, является метод стробоскопического микроспектрального анализа (схема которого приведена на рис.38), отличающийся тем, что источник возбуждающего излучения поджигается только в заранее заданной фазе периодического процесса (рис.39). Если объектом исследования является скелетная или гладкая мышца, то поджиг источника (1) осуществляется стимулирующим импульсом электростимулятора (4), задержанным линией задержки (5) относительно начала сокращения на требуемый интервал времени. Если же объект обладает способностью к поддержанию автоколебательного режима (сердце), то вместо стимулятора (4) используется усилитель биопотенциалов, управляющий источником (I) через ту же линию задержки (5).
Рис. 38. Блок-схема стробоскопического микроспектрофлуориметра.
1 – ртутная дуговая лампа ДРШ-250 (НВО-50); 2 – поджигающий высоковольтный трансформатор; 3 – управляемый контакт;
4 – электростимулятор (или усилитель биопотенциала); 5 – линия задержки; 6 – мышца;
7 – источник питания;
8 – микрообъектив;
9 – интерференционная светоделительная пластинка; 10 – зеркало;
11 – монохроматор;
12 – фотоумножитель;
13 – регистрирующее устройство.
При включенной развертке монохроматора (11) на самописце или осциллографе с памятью (13) регистрируется последовательность импульсов, огибающая которой представляет собой спектр люминесценции объекта в выбранной фазе сокращения. При этом момент измерения соответствует вполне определенному геометрическому положению объекта, что устраняет погрешности, связанные
Рис. 39. Фазовые соотношения между сокращением мышцы (а), стимулирующим импульсом (б), световым импульсом возбуждающего излучения (в) и импульсом люминесценции мышечной клетки (г).
с его перемещением в плоскости фокусировки. В качестве примера регистрируемых таким образом данных на рис.40 приведен спектр люминесценции мышечной клетки в фазе максимального сокращения.
Иногда, в особенности при изучении клеток и тканей теплокровных животных, возникают опасения, что поглощение гемоглобином крови люминесцентного излучения клеток может затруднить трактовку получаемых результатов. При использовании микрофлуориметрической
техники (измерения кинетики люминесценции в одной или нескольких длинах волн) эти опасения являются в достаточной степени основательными. Применение же спектральной техники позволяет не только избавиться от помех, создаваемых гемоглобином крови, но и извлечь из них дополнительную полезную информацию.
Рис. 40. Спектр люминесценции одиночной мышечной клетки лягушки, зарегистрированный в стробоскопическом режиме.
Длина волны 365 нм.
Возможности и особенности такого подхода могут быть проиллюстрированы на примере изучения спектров люминесценции ткани коры головного мозга живых крыс [197]. Регистрируемый при этом спектр люминесценции участка нервной ткани (20×100 мкм) (рис.41, 1) отличается от спектра люминесценции среза коры головного мозга крысы [200, 201] двумя особенностями, связанными с присутствием гемоглобина крови. Пульсация капилляров мозга приводит к появлению периодических импульсов на кривой спектра люминесценции нервной ткани, составляющих 2—5% от общей интенсивности люминесценции. Такие пульсации не только не мешают анализу спектра люминесценции, но и позволяют постоянно контролировать в процессе эксперимента количество крови, циркулирующей через излучаемый участок мозга.
Рис. 41. Спектры люминесценции участка (20×100 мкм) коры головного мозга крысы до
(1) и после (2) гибели животного. По оси ординат справа – интенсивность люминесценции в отн. ед, слева – интенсивность поглощения в %; по оси абсцисс – длина волны в нм. Длина волны возбуждения 365 нм. Для сравнения приведены спектры поглощения оксигенированного (3) и деоксигенированного
(4) гемоглобина.
Второй особенностью этого спектра является наложение полос поглощения гемоглобина (показано стрелками) на спектры люминесценции ткани. Поскольку спектры поглощения гемоглобина крови как в оксигенированном, так и в деоксигенированном состояниях хорошо известны (рис.41), это наложение полос поглощения гемоглобина не только не создает непреодолимых трудностей при анализе спектров люминесценции, но и позволяет постоянно контролировать в процессе эксперимента качество (степень насыщения кислородом) крови, циркулирующей в излучаемом участке мозга.
Спектр люминесценции нервной ткани живой крысы (рис.41, 1) свидетельствует о нормальном сердцебиении животного и о том, что пульсирующая в капиллярах исследуемого участка мозга кровь содержит в основном оксигемоглобин, α- и β-полосы поглощения которого образуют два минимума в спектре люминесценции при 580 и 540 нм соответственно. Коротковолновая полоса поглощения оксигемоглобина оказывает малое влияние на спектр люминесценции ткани (рис.41, 1), а сам этот спектр имеет характерную форму с примерно одинаковой интенсивностью как в области восстановленных пиридиннуклеотидов (460-480 нм), так и в области окисленных флавопротеинов
(520-530 нм).

Остановка кровообращения при гибели животного приводит к прекращению пульсации интенсивности на кривой спектра люминесценции (рис.41, 2) и исчезновению минимумов в области 580 и 540 нм, что свидетельствует о переходе гемоглобина в изучаемом участке ткани в деоксигенированное состояние. Этот переход сопровождается заменой α- и β-полос в спектре поглощения гемоглобина на одну более широкую полосу с максимумом 560 нм (рис.41, 3, 4). О том же свидетельствует и сужение спектра люминесценции (рис.41, 2) в области 430—450 нм, так как это сужение обусловлено поглощением люминесценции пиридиннуклеотидов полосой гемоглобина, смещающейся при деоксигенации в 430 нм. Прекращение кровоснабжения и деоксигенация гемоглобина крови приводит к развитию тканевой гипоксии исследуемого участка мозга, что сопровождается увеличением интенсивности люминесценции восстановленных пиридиннуклеотидов в 470 нм и уменьшением интенсивности люминесценции окисленных флавопротеинов в 520 нм
(рис.41, 2).
Глава 3. Люминесцентные красители. 1. Изучение внутриклеточного обмена веществ
Люминесцентные красители-метки являются весьма тонким и чувствительным инструментом исследования и, как всякий инструмент такого типа, требуют тщательного определения времени, места и условий их применения. В особенности это справедливо в случае использования люминесцентных меток для изучения столь сложного многокомпонентного объекта, как клетка. В руках вдумчивого и осторожного исследователя метод, разработанный им для решения конкретной задачи применительно к определенному объекту, дает обычно ценные и надежные результаты. Однако в дальнейшем недостаточно критическое копирование этого метода для решения иных задач на других объектах приводит зачастую к противоречиям. В результате возникают сомнения относительно самого метода и достоверности полученных ранее с его помощью данных. Повидимому, было бы правильным (для люминесцентных красителей) рассматривать в основном общую идею метода, его суть. Конкретный же рецепт-пропись должен разрабатываться заново на основе общей идеи применительно к конкретной задаче и объекту исследования.
Поэтому в данной главе (а также и в следующей) на примере некоторых, достаточно произвольно выбранных задач рассматриваются общие соображения и те методические приемы, которые позволяют экспериментатору, владеющему соответствующей техникой, самому обосновать и выбрать конкретные условия применения этих общих соображений для решения стоящих перед ним задач. Имея в виду изложенное во введении относительно методов люминесцентного определения концентрации веществ в клетке, в данной главе будут рассмотрены только примеры определения соотношений концентрации по двух- и трехволновым методам, так как одноволновые методы широко применяются и подробно описаны в литературе [36, 37, 41, 44, 45].
3.1.Двухволновые методы определения соотношения концентрации нуклеиновых кислот
Рассмотрение удобно начать с хорошо известного и подробно описанного метода с использованием метахроматического люминесцентного красителя - акридинового оранжевого, так как двухволновая регистрация применялась именно для этого случая [202-206].
АКРИДИНОВЫЙ ОРАНЖЕВЫЙ Хлоргидрат 3,6-бидиметиламиноакридина Препарат отечественного производства
Представляет собой соль с хлористым цинком. C17H20N3Cl + ZnCl2 м.в. 301,83 + 136,29
Характерной особенностью акридинового оранжевого, спектр поглощения которого приведен на рис. 42, является его способность существовать в растворе как в мономерной, так и в димерной форме. Максимум люминесценции мономеров лежит в зеленой области спектра (530 нм), в то время как димерная форма характеризуется красной люминесценцией с максимумом излучения 640 нм (рис. 43). Соотношение концентраций мономеров и димеров зависит от концентрации красителя в

растворе.
Рис. 42. Спектр поглощения акридинового оранжевого в концентрации 10-4 (1) и 2 10-6 г/мл (2).
Рис. 43. Спектры поглощения люминесценции акридинового оранжевого. Концентрации раствора: 1
– 1:30000; 2,2’ – 1:10000; 3 – 1:1000. Чувствительность прибора при записи кривых 2’ и 3 уменьшена в 4 раза. Длина волны возбуждения 365 нм.
Подробные исследования акридинового оранжевого [207-209] позволили установить [210], что мономерная форма, существующая в сильно разбавленных растворах, характеризуется следующими оптическими свойствами: максимум поглощения 494 нм, максимум люминесценции 530 нм, время жизни возбужденного состояния τ = 2 10-9 с. В концентрированных растворах акридиновый оранжевый существует в димерной форме с иными оптическими характеристиками: максимум поглощения 465 нм, максимум люминесценции 640 нм, время жизни возбужденного состояния τ = 20 10-9 с.
При обработке акридиновым оранжевым гистологических препаратов возникает красная и зеленая люминесценция различных клеточных структур. Эта метахроматичность люминесценции акридинового оранжевого на гистологических препаратах была впервые обнаружена независимо Штруггером [211-213] и Букачем и Хайтингером [214]. Позднее, экспериментами in vitro в работах М.Н. Мейселя [215] и М.Н. Мейселя и В.Б. Корчагина [216] было показано, что зеленая люминесценция характерна для комплекса акридинового оранжевого с ДНК, в то время как красная - для комплекса с РНК.
Эти работы послужили основанием к широкому использованию акридинового оранжевого для определения соотношения ДНК и РНК в клетке по соотношению интенсивностей люминесценции в зеленой и красной областях спектра соответственно. Хотя для большинства случаев на практике получаемые таким образом данные в достаточной мере точно отражают суть дела, при строгом рассмотрении это утверждение оказывается некорректным.
Вдействительности зеленая люминесценция (530 нм) характерна для комплексов мономеров
сдвухспиральной нуклеиновой кислотой (ДНК, двухспиральная РНК некоторых вирусов и двухспиральные участки клеточной РНК), в то время как красная (640 нм) - обязана своим происхождением комплексам димеров с односпиральными нуклеиновыми кислотами (РНК, односпиральные ДНК некоторых вирусов и бактериофагов, деполимеризованная ДНК) [203, 217221].
Вряде случаев оказывается невозможным пренебречь вкладом односпиральных ДНК и двухспиральных РНК и правильнее рассматривать соотношение зеленой и красной компонент спектра люминесценции как параметр, определяющий соотношение двух- и односпиральных

нуклеиновых кислот соответственно.
Вопрос интерпретации решается относительно легко, если объектом исследования служит одна из нуклеиновых кислот, например ДНК in vitro [205, 207 - 220] или локализованная в хромосомах [203]. В этом случае результаты естественно интерпретируются в терминах упорядоченности вторичной структуры и определяется соотношение односпиральных и двухспиральных участков в изучаемой молекуле.
Примером такого подхода является фундаментальная работа Риглера [203], в которой степень спирализации ДНК определялась по спектрам люминесценции отдельных клеток и их частей. В качестве показателя степени упорядоченности вторичной структуры ДНК автором использовался коэффициент α, представляющий собой отношение интенсивностей красной (димерной 590 нм [не корректировано на спектральную чувствительность прибора]) и зеленой (мономерной 530 нм) люминесценции акридинового оранжевого α = I590 / I530.
Другим примером применения двухволнового метода может служить определение биспиральной ДНК в смеси с денатурированной по люминесценции комплекса с акридиновым оранжевым in vitro [205]. В этом случае идея двухволнового метода была осуществлена с помощью специального двухволнового микрофлуориметра, использующего интерференционную пластинку для разделения зеленой (530 - 550 нм) и красной (630-650 нм) люминесценции по двум каналам регистрации. Авторы отмечают более высокую чувствительность двухволнового метода [205] по сравнению с одноволновым [204].
В общем случае при исследовании одиночных клеток и их групп вопрос об интерпретации наблюдаемого соотношения зеленой и красной люминесценции становится сложным и должен решаться исследователем применительно к конкретному объекту изучения и поставленной задаче. К рассмотрению возникающих при этом трудностей имеет смысл обратиться несколько позже, предварительно обсудив некоторые вопросы методики окраски препаратов. При этом весьма важно соблюсти ряд условий обработки препарата красителем, такие, как рН, ионная сила, время окраски, концентрация флуорохрома и т.д. Вопросы технологии окрашивания подробно рассмотрены в исчерпывающих монографиях Риглера [203] и А. В. Зеленина [36, 221].
При обработке фиксированных клеток акридиновым оранжевым в определенных условиях в интервале рН = 4-5 возникает двухцветная люминесцентная окраска (рис. 44), обязанная своим происхождением, в основном, комплексам мономеров с двухспиральными (полоса излучения в зеленой области спектра с максимумом 530 нм) и димеров с односпиральными (полоса излучения в красной области спектра с максимумом 640 нм) нуклеиновыми кислотами [203]. Помимо двухспиральных нуклеиновых кислот комплексы с мономерами (максимум излучения 530 нм) могут образовывать и белки. Однако при рН окрашивающего раствора, равном 4-4,6, вклад комплексов мономеров акридинового оранжевого с белками в общую интенсивность люминесценции клетки в длине волны 530 нм пренебрежимо мал. В частности, по данным Риглера [203], при рН 4,1 98% акридинового оранжевого связывается с нуклеиновыми кислотами и только 2% - с белками.
Рис. 44. Спектры люминесценции окрашенных акридиновым оранжевым клеток крови и костного мозга здорового человека.
а – нейтрофилы: сегментоядерный (1), палочкоядерный (2), юный (3); б
–лимфоциты (1-3) и моноцит (4). Длина волны возбуждения 465 нм.
Всвою очередь, димеры акридинового оранжевого могут образовывать комплексы не только с односпиральными нуклеиновыми кислотами (максимум излучения 640 нм), но и с мукополисахаридами. Однако для клеток, не содержащих мукополисахаридов в цитоплазме, а тем более для ядер клеток вкладом комплексов димеров с мукополисахаридами в общую интенсивность полосы люминесценции с максимумом 640 нм можно пренебречь, хотя, по-видимому, целесообразно при этом убедиться в отсутствии в изучаемой клетке мукополисахаридов, например, окрашивая препарат акридиновым оранжевым при рН 2, когда комплексы димеров могут образовываться только

с мукополисахаридами в случае их присутствия в клетке [36].
Необходимо отметить, однако, что существует несколько прописей-рецептов обработки препарата акридиновым оранжевым, значительно различающихся между собой [36]. Некритическое использование методики, дававшей хорошие результаты на объекте, для которого она была разработана, может привести к серьезным ошибкам, что можно видеть на примере определения таких достаточно простых параметров реакции, как концентрация красителя и время обработки им препарата.
Действительно, по-видимому, у каждого, кто начинает применять акридиновый оранжевый для окраски фиксированных препаратов, возникает ощущение некоторой неуверенности в результатах ввиду того, что неясно, как определить наиболее подходящую концентрацию красителя и время окрашивания с тем, чтобы соотношение зеленой и красной люминесценции соответствовало соотношению двух- (ДНК) и односпиральных (РНК) нуклеиновых кислот в изучаемом препарате.
Варьируя время и концентрацию, нетрудно получить «недокрашенный» препарат почти без красной люминесценции или, наоборот, «перекрасить» препарат так, что зеленая люминесценция оказывается почти незаметной на фоне красной люминесценции препарата. Даже в том случае, когда получена метахроматическая окраска, остаются сомнения в том, что препарат не перекрашен.
Конечно, длительный опыт работы может помочь решить этот вопрос при визуальном наблюдении препарата [36], однако и в этом случае предпочтительнее иметь какой-то более объективный метод оценки. По-видимому, такой способ может быть найден при рассмотрении спектров люминесценции окрашиваемых препаратов.
Если, например, воспользоваться раствором акридинового оранжевого в разведении 1:30000 (рН 4, 6, цитрат-фосфатный буфер) для окрашивания срезов мозга крыс (фиксация по Карнуа, заливка в парафин), то в зависимости от времени окрашивания спектр люминесценции определенного участка препарата будет меняться, как это показано на рис. 45, а. Кривая интенсивности люминесценции в зеленой (530 нм) и красной (640 нм) областях спектра (рис. 45, б, 1, 2) выходит на плато после 8-7,5 мин окрашивания. Увеличение длительности окрашивания (более 8 мин) не приводит к существенным изменениям интенсивности люминесценции в обеих длинах волн. Из рассмотрения рис. 45, а, б можно сделать вывод, что для изучаемых срезов головного мозга крыс оптимальное время окрашивания составляет примерно 8—10 мин при разведении акридинового оранжевого 1: 30000.
Рис. 45. Определение оптимального времени окраски акридиновым оранжевым в разведении 1:30000 среза головного мозга крысы.
а – длительность окраски (мин): 1
– 2; 2 – 4; 3 – 6; 4 – 8; 5 – 12;
б – область спектра: 1 – зеленая
(530 нм),
2 - красная (640 нм). Длина волны возбуждения 365 нм.
Известно, что ультрафиолетовое облучение окрашенного препарата приводит к его «выгоранию» - уменьшению интенсивности люминесценции. Изменение спектров люминесценции среза головного мозга крысы, окрашенного акридиновым оранжевым в разведении 1 : 30 000, приведено на рис. 46 и дает возможность вычислить ошибку в определении коэффициента α, представляющего собой отношение интенсивности люминесценции в 640 им к таковой в 530 нм (α =
I640 / I530).
Для начального спектра (рис. 46, 1) α = 0,364 и при воздействии на препарат УФ-излучения с длиной волны 365 нм уменьшается (табл. 5). При этом трехминутное облучение приводит к

допустимому отклонению значения α на 2,5%.
Рис. 46. Изменение спектров люминесценции среза головного мозга крысы, окрашенного в течение 8 мин акридиновым оранжевым в разведении 1:30000, в зависимости от длительности облучения препарата УФ-излучением (365 нм).
Время облучения (мин): 1 – 1; 2 – 2; 3 – 3; 4 - 4; 5 - 5; 6 – 6.
Ситуация резко меняется, если при всех остальных неизменных параметрах применять для окрашивания того же препарата краситель в большей (1:10000) концентрации (рис. 43, 2 и 2'). Приведенные на рис. 47 спектры люминесценции показывают, что уже при двухминутной окраске препарат сильно перекрашен и интенсивность ни зеленой, ни красной люминесценции не выходит на плато. Более того, избыточная концентрация акридинового оранжевого уже на второй минуте окрашивания приводит к образованию димеров на местах локализации мономеров, что проявляется в уменьшении люминесценции в зеленой области при возрастании люминесценции в красной (640 нм) области спектра по мере увеличения времени окрашивания. Уже на третьей минуте почти весь связанный препаратом краситель представлен димерной формой.
Таблица 4
Выцветание препарата, окрашенного акридиновым оранжевым, под действием ультрафиолетового облучения (длина волны 365 нм) в зависимости от условий обработки
|
Время облучения, |
|
1:30 000, 8 мин окрашивания |
1:10 000, 2 мин окрашивания |
||||
|
мин. |
|
α |
∆α |
(∆α/α)100% |
α |
∆α |
(∆α/α)100% |
0 |
|
0,364 |
|
0 |
1,12 |
0 |
0 |
|
1 |
|
0,363 |
0,001 |
0,3 |
1,10 |
0,02 |
2 |
|
3 |
|
0,355 |
0,009 |
2,5 |
0,96 |
0,16 |
16 |
|
5 |
|
0,338 |
0,026 |
7 |
0,88 |
0,24 |
24 |
|
Рис. 47. Спектры люминесценции среза головного мозга крысы, окрашенного акридиновым оранжевым в разведении 1:10000 в течение 1 (1), 2 (2) и 3 (3) мин.
Присутствие в препарате избытка димерной формы красителя сказывается не только на

величине коэффициента α, но и на кинетике выцветания препарата под действием УФ-излучения. При сравнении рис. 46 и 48 нетрудно видеть, что фотодеструкции подвергаются в первую очередь димеры. Уже в первую минуту облучения α изменяется на 2%, а к третьей минуте это изменение достигает 16% (табл.4).
Приведенные данные показывают, что даже относительно небольшое (примерно в 3 раза) увеличение концентрации красителя может сделать его непригодным для решения поставленной задачи.
Рис. 48. Изменение спектра люминесценции среза головного мозга крысы, окрашенного акридиновым оранжевым в разведении 1:10000 в течение 2 мин, в зависимости от длительности облучения препарата УФ-излучением (365 нм).
Время облучения (мин): 1 – 0; 2 – 1; 3 – 2; 4 – 3; 5 – 4;
В ряде методов, использующих акридиновый оранжевый в высоких концентрациях, одним из обязательных этапов является достаточно длительная промывка перекрашенного препарата в воде или в растворе хлористого кальция [36]. Цель этой операции ясна - удалить избыточный краситель. Это действительно может происходить, как следует из рис. 49, где видно, что отмывка в течение 4 мин в дистиллированной воде препарата, окрашенного акридиновым оранжевым в разведении 1:10 000 в течение 3 мин, приводит к возвращению соотношения интенсивностей люминесценции в зеленой и красной областях спектра к такому значению, которое характерно для этого препарата при двухминутной окраске (рис. 49, 4, 5). Однако вряд ли следует рекомендовать перекрашивать препарат для того, чтобы затем с помощью длительной процедуры попытаться возвратить его к оптимуму. Правильнее, по-видимому, с самого начала подобрать время окраски и концентрацию по выходу кривых интенсивности люминесценции в красной и зеленой областях на плато, как в случае, приведенном на рис. 45. Однако визуальное наблюдение препарата [36] остается важным, хотя и в этом случае предпочтительнее воспользоваться сопоставлением спектров люминесценции отдельных участков и органоидов клетки, размеры которых могут быть доведены до 1-2 мкм в диаметре.
Те же самые соображения относительно необходимости тщательного спектроскопического контроля можно было бы повторить и для дополнительных методик, используемых при изучении нуклеиновых кислот с помощью акридинового оранжевого. Важное место среди них занимает избирательная экстракция РНК с целью проверки соответствия получаемых результатов истинному положению вещей. Хорошим примером подхода такого типа является цитофотометрический анализ различных способов избирательной экстракции РНК из срезов [222], который позволил авторам обоснованно выбрать условия экстракции, наиболее адекватные объекту исследования. Аналогичный подход [223] необходим и при использовании люминесцентных методов.
Рис. 49. Изменение спектра люминесценции среза головного мозга крысы, окрашенного акридиновым оранжевым в разведении 1:10000 в течение 3 мин
(1). Длительность промывки в дистиллированной воде (мин): 1 – 0; 2 – 1; 3 – 2; 4 – 3; 5 – 4; 6 – спектр люминесценции того же препарата, окрашенного акридиновым оранжевым в разведении 1:10000 в течение 2 мин.
Таким образом, применение спектральной техники позволяет получать достаточно надежные и воспроизводимые результаты измерения интенсивности красной и зеленой люминесценции окрашенного акридиновым оранжевым препарата. Однако даже если соблюдены необходимые предосторожности вопрос интерпретации полученных данных в терминах физиологии клетки и ткани остается достаточно трудным.
Клетка. Наиболее просто вопрос решается, по-видимому, при исследовании целых дифференцированных одиночных клеток.
Как следует из рис. 44, клетки разного типа обладают спектрами люминесценции с разным соотношением полос излучения димерной и мономерной форм красителя. По соотношению полос излучения димеров и мономеров в спектре люминесценции, т.е. по величине параметра, клетки периферической крови могут бить разделены на две группы [224].
К первой группе относятся гранулоциты, отличающиеся в норме узким диапазоном изменения α, величина которого связана со степенью зрелости клетки. Если для зрелых сегментоядерных нейтрофилов характерны низкие (0,14-0,2) значения α (рис. 44, а, 1), то у палочкоядерных нейтрофилов (рис. 44, а, 2) величина этого параметра возрастает до 0,35-0,45. Юные нейтрофилы характеризуются более высоким (0,55-0,6) значением параметра α (рис. 44, а, 3). Еще более высокие значения параметра α наблюдаются у промиелоцитов (0,75-0,8) и миелобластов (0,8- 0,9).
Таким образом, созревание лейкоцитов, характеризующееся прогрессирующим снижением их синтетической активности, сопровождается снижением величины параметра α и у зрелых сегментоядерных нейтрофилов, достигает значений, характерных для комплексов акридинового оранжевого с нативной ДНК (0,178) и ДНП (0,196) [203].
Другую группу клеток периферической крови представляют собой лимфоциты, отличающиеся чрезвычайно широким диапазоном изменения параметра α. Приведенные на рис. 44, б спектры люминесценции показывают, что в мазках крови и костного мозга одного и того же практически здорового человека присутствуют лимфоциты с высоким (рис. 44, б, 1), средним (рис. 44, б, 2) и низким (рис. 44, б, 3) значениями параметра α, изменяющегося соответственно от 1,7 до
0,3.
Имея в виду особенности методики окрашивания (рН 4,6) и отсутствие в клетках мукополисахаридов, можно полагать, что в общем случае параметр α отражает характерное для клетки отношение односпиральных (НК1) к двухспиральным (НК2) нуклеиновым кислотам:
α = I640 /I530 = A1 НК1 /НК2, |
(19) |
где A1— коэффициент пропорциональности.
В пул односпиральных нуклеиновых кислот НК1, помимо РНК, входят и односпиральные («расплетенные») участки ДНК, а к пулу двухспиральных нуклеиновых кислот НК2, помимо собственно ДНК, относятся и двухспиральные участки РНК. Поэтому в общем случае по величине параметра α невозможно определить отношение РНК/ДНК в клетке.
В простейшем случае дифференцированных клеток, отличающихся той особенностью, что только 5-10% (в зависимости от типа клетки) их ядерной ДНК может находиться в активной форме, допустимо пренебречь вкладом односпиральных участков ДНК в общую интенсивность люминесценции в красной области спектра. Тогда, с достаточной для практических целей точностью можно полагать, что величина параметра α характеризует отношение РНК/ДНК в клетке:
α = I640 /I530 = A1 НК1 /НК2 = A2 РНК/ДНК, |
(20) |
где A2 — коэффициент пропорциональности, учитывающий, в частности, и то обстоятельство, что определенная часть РНК находится в двухспиральной форме. Примером подобного типа клеток могут служить клетки периферической крови (рис. 44), нервные и глиальные клетки и т. д.
Таким образом, в случае зрелых дифференцированных клеток параметр α приобретает достаточно ясный физиологический смысл. Действительно, поскольку можно полагать содержание ДНК в неделящейся клетке постоянным, параметр α показывает содержание РНК на единицу ДНК, и его изменение отражает, таким образом, изменение функциональной и синтетической активности данной клетки, сопровождающееся изменением содержания в ней РНК [225-227].
Наиболее полно взаимосвязь между функциональной и синтетической активностью была изучена Хиденом методами количественной ультрамикрохимии на примере нервных клеток. Показано [228, 229], что синтез РНК и белков в нейронах находится в прямой зависимости от функциональной активности этих клеток.
Спектры люминесценции окрашенных акридиновым оранжевым клеток крови человека показывают, что в зрелых сегментоядерных нейтрофилах (рис. 44, а, 1) практически отсутствует РНК (α = 0,18), синтетическая активность, клеток подавлена и они, по-видимому, полностью

сформированы для выполнения функций в периферической крови в течение относительно короткого (4-6 сут) времени их жизни. В отличие от этого в юных нейтрофилах (являющихся предшественниками зрелых) обнаруживается (рис. 44, а, 3) относительно высокое содержание РНК (α = 0,6), свидетельствующее о высокой активности синтетических процессов. Мнение о снижении синтетической активности клеток миелоидного ряда по мере их созревания до сегментоядерной формы подтверждается как биохимическими данными об уменьшении количества РНК в этих клетках [230], так и результатами электронно-микроскопических исследований, показывающих прогрессирующее уменьшение числа рибосом в их цитоплазме [231].
Таким образом, изменение параметра α в случае, если в поле зрения прибора находится одиночная дифференцированная клетка, указывает на соответствующее изменение в ней интенсивности синтеза РНК. При этом, по-видимому, нет необходимости заботиться о точном выяснении величины постоянного коэффициента А2 в уравнении (20), так как интерес представляет не столько абсолютное значение отношения РНК/ДНК, сколько его относительные изменения. Необходимо отметить, что получаемые таким способом данные об изменении содержания РНК по величине параметра α при развитии какого-либо внутриклеточного процесса могут оказаться несколько неточными в связи с возможным изменением интенсивности зеленой люминесценции (530 нм) за счет изменения вклада внеядерной ДНК [232-235]. Однако величина этого вклада, повидимому, в большинстве случаев невелика по сравнению с изменениями α за счет изменения содержания РНК в клетке и может быть проконтролирована методами избирательной экстракции нуклеиновых кислот.
Интересные результаты были получены при изучении лимфоцитов в норме и при лейкемии [236]. В частности, оказалось, что если распределение α в популяции лимфоцитов здоровых животных характеризуется малой дисперсией относительно низкого (0,16) значения α (рис. 50, а), то в популяции лимфоцитов, животных в стадии лейкемии наблюдается уширение гистограммы распределения величин α за счет числа клеток с высоким (0,6-0,8) значением α (рис. 50, в). Было бы соблазнительным относить увеличение параметра α лимфоцитов при лейкозе за счет увеличения в них содержания РНК. Трудность, однако, заключается в том, что в этом случае степень дифференцированности клеток заранее не известна, а стало быть, нет возможности воспользоваться допущениями, приводящими к уравнению (20), и можно рассматривать α только как параметр, отражающий отношение односпиральных и двухспиральных нуклеиновых кислот в клетке в соответствии с уравнением (19).
Рис. 50. Гистограммы распределения α в лимфоцитах тимуса мышей [236].
а– здоровые животные;
б– в предлейкозной стадии;
в – в стадии лейкемии.
По оси ординат – число клеток; по оси абсцисс - α.
Тем не менее с точки зрения физиологии клетки параметр α и в этом общем случае представляет значительную ценность, характеризуя уровень синтетической активности клетки. Действительно, двухспиральные молекулы нуклеиновых кислот (ДНК), обладающие большей, чем односпиральные, устойчивостью к повреждающим факторам и предназначенные для хранения информации, неактивны в синтетическом отношении. Процесс реализации информации в виде синтеза тех или иных внутриклеточных соединений всегда сопряжен с появлением активных в синтетическом отношении односпиральных нуклеиновых кислот, которые могут быть представлены как «расплетенными» односпиральными участками молекул ДНК, так и молекулами РНК. Таким

образом, в полностью неактивной в синтетическом отношении клетке нуклеиновые кислоты представлены, в основном, двухспиральными нуклеиновыми кислотами (ДНК) и характеризуются низким значением параметра α, близким по величине к таковому для нативной ДНК или ДНП. Зрелые сегментоядерные нейтрофилы (рис. 44, а) представляют собой, по-видимому, пример клеток именно такого типа. Активация синтетических процессов в клетке неизбежно приводит к повышению величины параметра α либо за счет появления «расплетенных» участков ядерной ДНК при активации генома клетки, либо за счет накопления различных форм РНК, либо за счет обоих этих факторов.
Хотя, как следует из сказанного выше, параметр α и в общем случае характеризует синтетическую активность клетки, остается, однако, заманчивым прецезировать долю односпиральных участков ДНК в общей массе односпиральных нуклеиновых кислот. Это позволило бы определить стадии развивающегося процесса активации синтеза в клетке и установить, имеем ли мы дело с начальной стадией активации генома, в которой вклад односпиральных участков ДНК в общую массу НК1 велик, или со второй стадией, когда односпиральные нуклеиновые кислоты представлены, в основном, различными видами РНК и в большинстве своем - рибосомальной РНК.
В этом отношении специальный интерес, по-видимому, представляет особенность фотодеструкции акридинового оранжевого, характерная для бластных клеток, костного мозга, находящихся на той или иной стадии дифференцировки [224]. В дифференцированных клетках фотодеструкция («выгорание») связанного с ними акридинового оранжевого происходит таким образом (тип I), что одновременно уменьшается интенсивность обеих, мономерной и димерной, полос излучения, хотя и не обязательно в одинаковой степени (рис. 46, табл. 4).
Совершенно по-иному протекает процесс фотодеструкции красителя, связанного с упомянутыми выше бластными клетками в препарате костного мозга. Приведенное на рис. 51 семейство спектров люминесценции гемоцитобласта свидетельствует о том, что фотодеструкции в первую очередь подвергаются димеры акридинового оранжевого (тип II). При этом на месте димера оказывается мономер и потому одновременно с уменьшением интенсивности полосы изучения димеров (640 нм) наблюдается рост интенсивности полосы излучения мономеров (530 нм) акридинового оранжевого с четко выраженной изобестической точкой, положение которой в спектральном диапазоне (565-605 нм) зависит от исходного соотношения интенсивностей полос излучения димеров и мономеров в спектре люминесценции клетки.
Рис. 51. Действие облучения с длиной волны 436 нм на окрашенный акридиновым оранжевым гемоцитобласт.
1 – исходный спектр; 2 - 6 – спектры, регистрируемые с интервалом времени 1мин. Длина волны возбуждения 436 нм.
Степень выраженности эффекта зависит от степени дифференцированности клетки. Сравнение динамики изменения спектров люминесценции нормобластов в препарате костного мозга практически здорового человека показывает, что эффект фотодеструкции красителя с проявлением изобестической точки (тип II) в большей степени выражен у базофильных нормобластов (рис. 52, а) по сравнению с более дифференцированными оксифильными нормобластами (рис. 52, б).
Интересно отметить, что мало отличающиеся между собой по величине параметра α узко- и широкоплазменные лимфоциты из лимфоузла селезенки четко различаются по типу фотодеструкции связанного с ними акридинового оранжевого. В то время как у широкоплазменных лимфоцитов наблюдается фотодеструкция (рис 53 б) типа I (характерная для зрелых дифференцированных клеток), узкоплазменным лимфоцитам свойственна, хотя и в малой степени (рис.53, а), фотодеструкция типа II с выраженной изобестической точкой семейства последовательно регистрируемых спектров люминесценции.
При более длительном облучении клеток фотодеструкция типа II переходит в тип I, когда уменьшение интенсивности излучения димеров не сопровождается увеличением интенсивности излучения мономеров. Это указывает на существование в данных клетках двух типов комплексов димеров с односпиральными нуклеиновыми кислотами, один из которых - комплекс с РНК, другой

— комплекс с односпиральными участками ДНК, для которого, по-видимому, и является характерной фотодеструкция типа II.
Рис. 52.Действие облучения с длиной волны 436 нм на окрашенный акридиновым оранжевым базофильные (а) и оксифильные (б) нормобласты из костного мозга здорового человека.
1 – исходный спектр: 2 – 10 – спектры, регистрируемые с интервалом времени 1 мин. Длина волны возбуждения 436 нм.
Рис. 53. Изменение спектров люминесценции окрашенных акридиновым оранжевым узкоплазменных (а) и широкоплазменных (б) лимфоцитов из лимфоузла селезенки человека. 1
– исходный спектр; 2 – 6 – спектры с интервалом времени 1 мин. Длина волны облучения и возбуждения 436 нм.
На обоснованность такого предположения указывает то обстоятельство, что фотодеструкция типа II наиболее ярко выражена у бластных форм клеток крови (гемоцитобласты, проэритробласты,

нормобласты), и уменьшается параллельно увеличению степени дифференцированности клетки. Аналогичный эффект наблюдается и у делящихся клеток печени в стадии удвоения числа хромосом.
Ядро. Избежать погрешностей, связанных с влиянием внеядерной ДНК, можно, переходя к характеристике состояний синтетической активности клетки по активности ее ядерного аппарата. При этом измеряются величины α только в ядре клетки или, если это представляется интересным, в ядрышке. Тогда смысл параметра α соответственно меняется и α становится характеристикой либо активности генома (ядро) клетки, либо активности только ядрышкового аппарата. Таким образом, открывается возможность прослеживать временные взаимоотношения внутриклеточных синтетических процессов и органоидов. Геометрическое разрешение и чувствительность современных микроспектрофлуориметров вполне достаточны для этой цели. Приведенные на рис. 54 гистограммы распределения α ядер идентифицированных гигантских нейронов моллюска показывают, что зависимость от физиологического состояния выражается тем более четко, чем выше разрешающая способность метода. Изменения активности ядерного аппарата ясно выражены, и для трактовки физиологического смысла наблюдаемого увеличения α могут быть использованы все приведенные выше соображения относительно α для целой одиночной клетки.
Рис. 54. Гистограммы распределения α в ядрах идентифицированных нейронов БП2 и БП4 моллюска Lymnaea stagnalis на холоду (4 0С) и при комнатной (20 0С) температуре. По оси ординат – число ядер; по оси абсцисс - α.
Ткань. Еще более сложная ситуация возникает, если объектом исследования служит не одиночная клетка, а целая группа клеток, находящаяся в поле зрения прибора. Такие измерения представляют зачастую большой интерес, так как они могут позволить сравнить соотношение концентраций РНК и ДНК в ткани, определяемое оптическими (люминесцентными) методами и методами классической биохимии.
Однако физиологический смысл изменения параметра α в этом случае теряет ясность и однозначность.
Действительно, при измерениях такого типа входная щель микроспектрофлуориметра, оставаясь постоянной, выделяет из препарата участок, площадь которого соответствует оптическому изображению щели (например, 80 × 20 мкм, рис. 55), а объем определяется толщиной среза (5 мкм, рис. 55). В результате измеряемое отношение интенсивностей красной и зеленой люминесценции оказывается отнесенным всегда к определенному объему ткани или при соответствующих пересчетах к определенному весу ее, т. е. измеренное отношение интенсивностей люминесценции отражает отношение концентрации веществ.
Рис. 55. Оптическое вычленение определенного объема нервной ткани при микроспектрофлуориметр ическом определении соотношения концентраций веществ. Размеры в мкм.
Однако в этом случае возникают те же трудности в физиологической трактовке получаемых результатов, как и при классических биохимических исследованиях отношений концентраций ДНК и РНК в различных тканях животных [237, 238]. Суть этих трудностей заключается в том, что переменным становится не, только числитель (концентрация РНК), но и знаменатель (концентрация ДНК) в выражении для параметра α, так как количество клеток и их ядер в оптически выделенном
постоянном объеме (18000 мкм3, рис. 55) может быть различным. Более того, может изменяться и соотношение клеток разного типа. В соответствии с этим будет изменяться и концентрация ДНК, отражающая количество клеток (ядер) в изучаемом объеме [239, 240]. Поэтому без привлечения дополнительных сведений, трудно определить, что означает, например, уменьшение параметра α. Оно может означать как снижение функциональной активности клеток в данном участке, сопровождающееся снижением концентрации РНК в них при неизменном количестве клеток и, следовательно, неизменной (в первом приближении) концентрации ДНК, так и резкое повышение синтетической активности ткани, сопровождаемое делением клеток и соответствующим ростом их количества в изучаемом объеме ткани. Связанное с этим увеличение концентрации ДНК, находящейся в знаменателе, может приводить к уменьшению параметра даже в случае умеренного роста концентрации РНК в тех же клетках. В наиболее ярком виде эти закономерности могут наблюдаться, по-видимому, при изучении участков корешка растения [241], находящихся на разных расстояниях от зоны роста, в которой параметр α принимает относительно низкое значение ввиду того, что поле зрения занято большим количеством мелких, только что разделившихся клеток. Увеличение размеров клеток, а стало быть, уменьшение количества их в поле зрения прибора является основной причиной увеличения параметра α по мере удаления от зоны роста, хотя интенсивность синтеза при этом становится меньше.
Как было упомянуто выше, измерения такого типа дают возможность определить соотношение концентраций РНК и ДНК в исследуемых участках ткани. По-видимому, целесообразно рассмотреть подробнее некоторые аспекты интерпретации результатов. Отношение интенсивностей красной и зеленой люминесценции препарата, окрашенного акридиновым оранжевым, связано с концентрацией димеров и мономеров, а следовательно, в рамках сделанных допущений, с концентрацией РНК и ДНК уравнением
α = I640 /I530 = ϕ ε2k2/ ε1k1 сРНК/ сDНК = ϕ A2 сРНК/сDНК = В сРНК/ сDНК,
(20')
где I640 - интенсивность люминесценции в длине волны 640 нм (димеры); I530 -интенсивность люминесценции в длине волны 530 нм (мономеры); k1, k2 - квантовые выходы связанных с субстратом мономеров и димеров соответственно; ε1, ε2 - коэффициенты экстинкции связанных с субстратом мономеров и димеров соответственно; (ϕ - коэффициент распределения, характерный для данной ткани.
Нетрудно видеть, что уравнение (20') отличается от аналогичного выражения для случая одиночной клетки (20) наличием коэффициента распределения ϕ. Смысл этого коэффициента достаточно очевиден (рис. 55) и отражает тот факт, что в состав изучаемой ткани могут входить клетки разного типа и размера, например, в случае нервной ткани - нейроны и глиальные клетки. В результате изменения соотношения количества клеток разного типа может меняться соотношение интенсивностей зеленой и красной люминесценции.
Если полагать средний объем пирамидного нейрона V слоя коры равным 1600 мкм3, а объем глиальной клетки — около 160 мкм3 [242, 243], то замена одного нейрона на 10 глиальных клеток приведет к увеличению содержания ДНК в объеме, ранее занятом одним нейроном. Такое изменение соотношения типов клеток отразится на оптических свойствах объекта, а, следовательно, и на результатах измерения. Чтобы учесть это, оказывается необходимым ввести в уравнение (20) коэффициент распределения ϕ, отражающий соотношение всех клеток в данном объеме.
Тогда для соотношения концентраций РНК и ДНК из уравнения (20') имеем
сРНК/ сDНК = α/A2ϕ = α/В |
(21) |
Отсюда следует, что для определения отношения концентраций сРНК/ сДНК, зная отношение интенсивностей люминесценции α = I640 /I530 , необходимо определить коэффициент A2, зависящий только от физических параметров, связанных с субстратом мономеров и димеров красителя, и коэффициент ϕ , характеризующий соотношение клеток разного типа в изучаемой ткани. Это можно сделать двумя способами.
Первый из них заключается в прямом измерении физических параметров (квантовых выходов и коэффициентов экстинкции) и последующем вычислении коэффициента A2. Однако даже для такого достаточно хорошо изученного красителя, как акридиновый оранжевый, имеющиеся в литературе данные вызывают сомнения относительно возможности их прямого использования для подобных расчетов. Не меньшие трудности могут возникнуть и при попытке рассчитать коэффициент распределения ϕ , хотя и это может быть осуществлено.
Второй способ заключается в том, чтобы результаты люминесцентных измерений «прокалибровать» по результатам прямого биохимического определения отношения РНК/ДНК в
исследуемой ткани. При этом сразу определяется суммарный коэффициент В в уравнении (21). Такая «калибровка» может, быть произведена либо по результатам собственного биохимического определения, либо по литературным данным. Некоторые аспекты этого подхода можно рассмотреть на примере ткани мозга крысы, подробно изученной биохимическими методами.
Для подобного рода «калибровки» определенный интерес представляют данные о концентрации ДНК и РНК в различных отделах головного мозга крысы [237, 238]. В табл. 5 приведено сравнение биохимических данных о концентрации нуклеиновых кислот и их соотношений в некоторых отделах головного мозга крысы с результатами определения соотношения РНК/ДНК методом измерения интенсивности люминесценции в длинах волн 640 и 530 им. Срезы головного мозга крысы (возраст 120 дней, фиксация по Карнуа, заливка в парафин) окрашивались акридиновым оранжевым в разведении 1:30 000 на цитратфосфатном буфере с рН 5,6 в течение 10 мин (см. рис. 45) с последующей промывкой (2 мин) и заключением в нелюминеспирующую среду. Измерения проводили при возбуждении люминесценции в длине волны 365 нм. Размер фоюметрируемого участка 20×80 мкм, толщина - 5 мкм.
Таблица 5
Сопоставление аоотношения нуклеиновых кислот, определяемых биохимически [238] и методом окрашивания акридиновым оранжевым
Отдел мозга |
Содержание (мкг/1г |
РНК/ДНК |
Интенсивность |
α |
В |
||
|
сырого веса) |
|
люминесценции (отн. ед.) |
|
|
||
|
РНК |
ДНК |
|
640 нм |
530 нм |
|
|
Большой мозг |
|
|
|
|
|
|
|
Серое вещество |
65 |
36 |
1,72 |
10 |
62 |
0,16 |
0,09 |
Белое вещество |
45 |
40 |
1,1 |
24 |
17 |
0,14 |
0,13 |
Таламус |
48 |
32 |
1,5 |
8 |
36 |
0,22 |
0,14 |
Гипоталамус |
59 |
45 |
1,25 |
7 |
29 |
0,24 |
0,19 |
Гиппокамп |
60 |
38 |
1,64 |
1,3 |
8,4 |
0,15 |
0,09 |
Сопоставление приведенных в табл. 5 данных показывает, что, действительно, величина коэффициента В в уравнении (21), представляющего собой произведение постоянного множителя А2 и коэффициента распределения ϕ, является переменной и зависит от соотношения клеток разного типа в изучаемом участке ткани. При этом близкие по своему клеточному составу ткани, такие, как, например, кора мозга и гиппокамп, имеют равные коэффициенты В.
Необходимо отметить два обстоятельства, которые важно иметь в виду при проведении такого рода «калибровки» люминесцентного метода. Первое из них заключается в том, что биохимические методы дают весьма усредненные сведения о содержании и соотношении веществ в достаточно большом объеме ткани, необходимом для проведения химического анализа. Люминесцентный же метод позволяет проводить определения в очень малых объемах, регистрируя при этом те локальные вариации концентраций, которые обычно усредняются при биохимическом анализе ткани. Поэтому, производя сравнение результатов для определения коэффициента В, в качестве получаемого люминесцентным методом параметра α необходимо использовать результат, усредненный по большему числу измерений.
Некоторые представления о локальной вариабельности соотношений интенсивности люминесценции в 530 и 640 нм можно получить, сопоставляя спектры (рис.56) разных клеток и их участков. Часть пирамидных клеток обладает довольно интенсивной красной люминесценцией цитоплазмы. Соответственно этому полоса с максимумом в 640 нм преобладает в спектре люминесценции цитоплазмы этих клеток, показывая высокое содержание РНК в них (рис. 56, 1). В то же время в спектре ядра этой клетки (рис. 56, 2) преобладающей уже является полоса излучения 530 нм, указывая на высокое содержание ДНК. В случае, если в поле зрения попадает ядро и цитоплазма, то регистрируется спектр с промежуточным соотношением интенсивностей полос 530 и 640 нм.
Хотя красная люминесценция преобладает по интенсивности только в спектрах цитоплазмы некоторых нейронов, находившихся, по-видимому, в момент фиксации в состоянии повышенной функциональной активности, тем не менее она достаточно заметна и в цитоплазме других пирамидных нейронов. В отличие от этого в спектре люминесценции целой клетки олигодендроглии, большую часть которой занимает ядро, преобладающей является полоса люминесценции с максимумом излучения 530 нм, в то время как излучение в области 640 нм относительно невелико (рис. 56, 4). Поскольку количество глиальных клеток значительно превышает количество нейронов в поле зрения микроспектрофлуометра, при регистрации спектров люминесценции достаточно больших участков ткани (рис.55) ясно, что именно глиальные клетки будут определять форму

спектра люминесценции в этом случае. Спектральные характеристики, подобные приведенным на рис.56, могут быть использованы также и для качественного определения специфичности реакций по распределению красной и зеленой люминесценции в разных внутриклеточных структурах, как это было отмечено ранее.
Рис. 56. Спектры люминесценции отдельных участков ( 12 мкм) пирамидных клеток (1 – 3) и клетки олигодендроглии (4) срезов головного мозга крысы, окрашенных акридиновым оранжевым.
1 – цитоплазма; 2 – ядро; 3 – ядро с прилегающим участком цитоплазмы; 4 – клетка олигодендроглии целиком. Длина волны возбуждения 436 нм.
Второе обстоятельство связано с точным учетом возраста животного ввиду того, что как сами концентрации определяемых соединений, так и их отношения испытывают значительные изменения в процессе развития животного. Это можно видеть на примерах изменения содержания РНК, ДНК и белков в мозжечке и в двигательной области коры больших полушарий мозга крысы (рис.57, по данным Гейто [238]).
Рис. 57. Изменение концентрации РНК (1), ДНК (2), отношения РНК/ДНК (3) и белков (4) в мозжечке (а) и двигательной зоне коры больших полушарий (б) мозга крысы с возрастом.
Такие значительные возрастные изменения концентрации РНК, ДНК и белков связаны как с изменением внутриклеточного содержания этих соединений, так и с изменением плотности клеток в ткани. Резкое повышение количества ДНК в мозжечке в течение 0-15 сут может быть связано с тем, что мозжечок в этот период очень быстро растет, увеличивая свои размеры. Это обстоятельство в сопоставлении с тем, что количество ДНК служит показателем числа клеток в данном объеме ткани [240], позволяет предполагать быстрое увеличение числа клеток в мозжечке после рождения животного [238].
В течение 15—50 сут наблюдается уменьшение содержания как РНК, так и ДНК в мозжечке, не означающее, однако, снижения содержания этих веществ в пересчете на одну клетку. Повидимому, количество ДНК в клетке остается постоянным, а количество РНК несколько возрастает. Причины наблюдаемого снижения состоят, вероятно, в том, что величины содержания ДНК и РНК приведены в пересчете на 1 г ткани. Поэтому быстрый рост клеток, сопровождающийся увеличением количества белка в них (рис. 57, 4), приводит к тому, что относительная доля РНК и ДНК в ткани становится меньше. Кроме того, уменьшение содержания РНК и ДНК может быть связано и с
уменьшением количества клеток в фиксированном объеме ткани. Бриззи и соавт. [244] приводят данные о том, что у белых крыс в возрасте 50 сут отмечается наименьшая плотность клеток в коре мозга. На 10-е сут насчитывается примерно 100000 клеток в 1 мм3, на 50-е сут - 70000, а на 100-е сут число их снова возрастает до 90000. Возможно, что именно этим объясняется повторный рост содержания ДНК в мозжечке в возрасте от 50 до 100 сут (рис. 57, а, 2). В то же время рост содержания других, не учтенных здесь компонентов нервной ткани (например, липиды) также может вносить свой вклад в наблюдаемые (рис. 57) закономерности, особенно в период 50-100 сут (падение содержания белков), в случае представления содержания веществ в пересчете на 1 г ткани.
Учитывая изложенное выше, для «калибровки» люминесцентных методов по данным биохимического анализа необходимо использовать животных одного и того же возраста. В этой связи могут представить интерес результаты определения содержания нуклеиновых кислот и белков в различных участках нервной ткани и в почке белой крысы в возрасте 100 сут (табл. 6.)
Приведенные на рис. 57 соотношения показывают всю сложность интерпретации таких данных в терминах физиологии ткани и клетки вне зависимости от того, каким методом - прямым биохимическим или косвенным люминесцентным - они получены. При этом ясно обнаруживается необходимость иметь более полные, чем соотношение РНК/ДНК, сведения. Уже наличие данных о содержании белка в изучаемом участке ткани (рис. 57) позволяет резко повысить достоверность суждения о протекающих в данной ткани процессах. Это лишний раз подчеркивает важность разработки методов, в том числе и люминесцентных, определения соотношения в клетке и ткани других компонентов, таких, как белки и липиды. Некоторые из них будут обсуждены ниже.
Таблица 6
Содержание нуклеиновых кислот и белков в тканях крыс в возрасте 100 сут (по [238])
Ткань |
Содержание (мгк/1 г ткани |
РНК/ДНК |
Белок, мг 1 г |
|
РНК |
ДНК |
|||
|
|
|
|
ткани |
Передняя вентральная кора |
407 |
491 |
0,94 |
9,4 |
Медиальная вентральная кора |
390 |
274 |
1,47 |
9,7 |
Задняя вентральная кора |
443 |
309 |
1,60 |
12,8 |
Передняя дорзальная кора (двигательная |
390 |
274 |
1,47 |
15,0 |
область) |
|
|
|
|
Медиальная дорзальная кора (область |
422 |
345 |
1,31 |
17,1 |
соматиче-ской чувствительности) |
|
|
|
|
Задняя дорзальная кора (зрительная зона) |
495 |
504 |
1,30 |
11,8 |
Задняя дорзальная кора (слуховая зона) |
584 |
456 |
1,49 |
15,1 |
Мозжечок |
443 |
2346 |
0,19 |
17,8 |
Большие полушария |
397 |
448 |
0,92 |
17,9 |
Верхний отдел ствола |
376 |
455 |
0,87 |
17,8 |
Нижний отдел ствола |
340 |
386 |
0,94 |
13,5 |
Почка |
850 |
1176 |
0,73 |
27,3 |
Возвращаясь к рассмотрению метода определения соотношения РНК/ДНК с помощью акридинового оранжевого и имея в виду приведенные на рис. 57 сведения о соотношении содержания белков и нуклеиновых кислот, необходимо отметить способность этого красителя к неспецифическому связыванию путем электростатического взаимодействия с отрицательно заряженными группами белковой молекулы. Хотя величина люминесценции (530 нм) таких комплексов мономеров красителя с белком и невелика, тем не менее, учитывая, что содержание белка на 1-2 порядка может превышать содержание ДНК, следует считаться с возможностью получения завышенных данных о содержании ДНК в ткани за счет вклада неспецифически связанных с белком мономеров акридинового оранжевого.
Существуют различные способы учета этого обстоятельства. Контрольные эксперименты по избирательной экстракции исключительно полезны в этом случае. Определенная оценка ситуации может быть сделана и на основании сравнительного анализа спектров люминесценции отдельных участков и органоидов клетки (рис. 56).
Способ устранения люминесценции акридинового оранжевого, неспецифически связанного с белком, путем предварительного ацетилирования полярных групп белков был предложен Риглером [203]. Другой способ, аналогичный по идее предыдущему, заключается в предварительной обработке препарата каким-либо красителем, прочно связывающимся с отрицательно заряженными полярными группами белков и делающим их неспособными к взаимодействию с акридиновым оранжевым [245]. Если при этом краситель обладает люминесценцией, то, очевидно, такая реакция, кроме
