
- •От автора…
- •ПРЕДИСЛОВИЕ
- •Оглавление
- •1.1. Физические основы люминесценции
- •Глава 2. Собственная люминесценция клеток
- •3.2. Определение соотношения различных веществ в клетке
- •ДВУХВОЛНОВЫЕ МЕТОДЫ
- •ТРЕХВОЛНОВЫЕ МЕТОДЫ
- •3.3. Анализ спектральных характеристик
- •ПРИЛОЖЕНИЕ
- •Приложение 1
- •Приложение 3
- •Приложение 4
- •Приложение 5
- •Приложение 6
- •Обобщенная Схема Окислительного Метаболизма Клетки
- •Список первоисточников

блокирования нежелательных групп белковых молекул, может служить для одновременного определения соотношения РНК:ДНК:белок в клетке и ткани люминесцентным методом [246, 247].
В заключение этого раздела полезно еще раз отметить ценность метахроматических красителей, позволяющих не только получить цветовой контраст наблюдаемых в люминесцентном микроскопе картин, но и достаточно просто воспользоваться преимуществами двух и более волновых методов регистрации при возбуждении одного красителя излучением подходящей длины волны. Акридиновый оранжевый - только наиболее изученный из них. По-видимому, многие из красителей акридинового ряда обладают метахромазией. А.В.Зеленин [36] отмечает, что столь же яркие и контрастные картины, как и с акридиновым оранжевым, были получены при окраске корифосфином О и эухризином 2GNX. Причем последний имеет по сравнению с акридиновым оранжевым то преимущество, что он более стоек к выцветанию под действием УФ-облучения и может быть использован для окрашивания препаратов, фиксированных осмиевой кислотой [248].
КОРИФОСФИН О Отечественные препараты выпускаются в виде соли с хлористым цинком м.в. 287,8 + х136,29
Другие акридиновые красители, такие, как аурофосфин, акрифлавин (трипафлавин) и акриди новый желтый, дают меньшее цветовое различие одно- и двухспиральных нуклеиновых кислот. Учитывая, однако, большую чувствительность аппаратурных методов, было бы полезно изучить эти соединения, тем более, что, имея различающиеся по положению полос спектры
поглощения (рис. 58), они могут быть более удобны для комплексного окрашивания.
Рис. 58 Спектры поглощения красителей акридинового ряда.
1 – эухризин 2 GNX; 2 – аурофосфин; 3 – акридиновый оранжевый.
3.2.Определение соотношения различных веществ в клетке
Ксожалению, пока неизвестны надежные метахроматаческие люминесцентные красители, которые могли бы связываться одновременно как с белками, так и с нуклеиновыми кислотами, давая комплексы с разным цветом люминесценции. Поиск такого типа красителей является, по-видимому, одним из наиболее перспективных направлений развития люминесцентной количественной цитохимии.
Впервую очередь, вероятно, могут быть исследованы красители, метахроматичность которых уже использовалась ранее в классической гистохимии или в молекулярной биологии. Известно, например, под фирменным (Serva) названием «Stains all» соединение 4,5,4',5'-дибензо-3,3'-диэтил-9- метилтиакарбоцианинбромид, используемое для метахроматической окраски акриламидных гелевых столбиков. При этом белки окрашиваются в красный, ДНК - в синий, РНК — в розовый цвет. Кислые мукополисахариды приобретают голубую окраску [249]. В качестве селективного красителя это соединение применялось в гистохимии [250] с использованием классической микроскопии в проходящем свете. Можно было ожидать, что если этот краситель обладает способностью к люминесценции, то его люминесцентное излучение будет обладать метахромазией и положение полос излучения окажется зависящим от того, с молекулами какого (белки, ДНК, РНК) внутриклеточного вещества связан краситель.
Проведенные исследования (рис. 59) показали, что «Stains all» обладает достаточно яркой метахроматической люминесценцией, но не дает, по-видимому, четкого спектрального разделения ДНК, РНК и белков и имеет только две характерные полосы в спектре люминесценции (490 и 615 нм).

Рис. 59. Спектры люминесценции срезов головного мозга крысы, обработанных красителем “Stains all” (10 –4 М раствор в этиловом спирте).
1 – зубчатая фасция гиппокампа; 2 – мозолистое тело; 3 – кора (1-й и 2-й слои); 4 – кора (молекулярный слой).
Длина волны возбуждения 365 нм.
В качестве другого примера, еще недостаточно хорошо изученного метахроматического люминесцентного красителя, может быть назван тиазиновый красный.
ТИАЗИНОВЫЙ КРАСНЫЙ
С24Н15N3O7S3Na2
м.в. 599,59
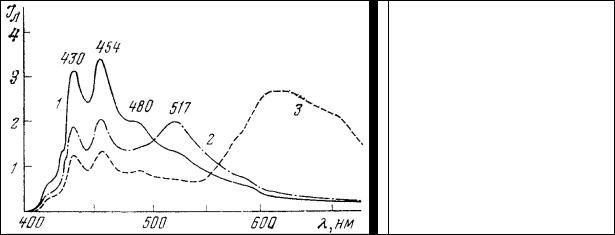
Прежде всего, следует отметить, что он совершенно по-разному взаимодействует с живыми и фиксированными клетками. При окрашивании срезов мозга, фиксированных по Карнуа, наблюдается удовлетворительная по своей яркости метахроматическая люминесценция ткани (рис. 60), характеризующаяся наличием трех полос излучения (454, 515, 580 нм), только одна из которых (454 нм) совпадает по положению с полосой люминесценции раствора (10-3 М) тиазинового красного, в то время как две другие (515 и 580 нм) появляются после взаимодействия красителя с объектом.
Рис. 60. Спектры люминесценции водного раствора (10 –3 М) тиазинового красного
(1) и окрашенных им срезов головного мозга крысы (2 – 4). Длина волны возбуждения 365 нм.
Совсем иной вид спектра характерен для тиазинового красного после его взаимодействия с живыми клетками (рис. 61). И в этом случае у препарата сохраняется имеющаяся у раствора (рис. 60, 1, 61, 1) полоса излучения 454 нм, а вместо характерных для фиксированных клеток полос 515 и 580 нм (рис. 60) появляются широкие неразрешенные полосы с максимумом в области 630-640 нм. Соотношение интенсивностей полос люминесценции 454 и 630 нм зависит от функциональных особенностей клетки (рис. 61, 3, 4). Однако, пожалуй, самым интересным свойством тиазинового красного является способность окрашенных им клеток резко менять спектр люминесценции при их гибели. Добавление к препарату нескольких капель этилового спирта вызывает гибель клетки и сопровождается исчезновением полосы люминесценции 454 нм и увеличением полосы люминесценции с максимумом 670-680 нм (рис. 61, 2, 5). Механизм этого явления пока не ясен и представляет интерес скорее для следующей, чем для данной главы.
Рис. 61. Спектры люминесценции водного раствора тиазинового красного (10 –2 М) и окрашенных им живых клеток рецептора растяжения речного рака.
1 - раствор тиазинового красного; 2 – приядерная область медленно адаптирующегося нейрона; 3 – быстро адаптирующаяся мышца; 4 – медленно адаптирующаяся мышца; 5 – приядерная область нейрона через 2 мин после добавки к препарату 0,5 мл этилового спирта.
Длина волны возбуждения 365 нм.
Отсутствие метахроматических люминесцентных красителей, которые уже сейчас можно было бы рекомендовать для определения в клетке соотношения различных компонентов ее обмена, определяет другой путь решения той же задачи - поиск пары красителей-меток, специфически связывающихся с изучаемыми компонентами клетки. При этом входящие в пару соединения должны удовлетворять нескольким условиям.
1.Максимумы их спектров люминесценции должны достаточно далеко (60-100 нм) отстоять друг от друга для раздельной регистрации интенсивности люминесценции каждого из них.
2.Соотношение квантовых выходов должно быть таково, чтобы интенсивности люминесценции обоих красителей в клетке были одного порядка.
3.Полосы поглощения обоих красителей в видимой области спектра должны совпадать или быть близкими (20-30 нм) с тем, чтобы уменьшить возможность миграции энергии возбуждения с молекулы, люминесцирующей в коротковолновой области спектра, на молекулу, люминесценция которой лежит в области более длинных волн.
4.Естественно, что оба красителя должны количественно связываться с макромолекулами - объектами изучения.
На практике обычно выбирается один из компонентов пары и к нему в соответствии с изложенными выше требованиями подбирается второй компонент. Иллюстрацией такого подхода может служить разработка ряда методов определения соотношения веществ в клетке, описываемых ниже.
ДВУХВОЛНОВЫЕ МЕТОДЫ
Белки и нуклеиновые кислоты. В качестве метки на нуклеиновые кислоты может быть использован люминесцентный краситель этидиум бромид.
ЭТИДИУМ БРОМИД 2,7-диамино-10-этил-9-фенилфенантридиум бромид
C21 H20 N3 Br м.в. 394,3
Строго говоря, этидиум бромид относится к разряду красителей с переменным квантовым выходом, величина которого зависит от субстрата связывания и окружения. Однако, будучи связан с макромолекулой, этидиум бромид имеет, по-видимому, постоянный квантовый выход. В растворах квантовый выход люминесценции этидиум бромида крайне мал и потому интенсивность люминесценции его слаба. При связывании этидиум бромида с нуклеиновыми кислотами наблюдается резкое увеличение квантового выхода [251-252], и структуры клетки, содержащие нуклеиновые кислоты, приобретают яркую малиново-красную люминесценцию с максимумом излучения 590-610 нм.
Специфичность эффекта увеличения интенсивности люминесценции этидиум бромида при взаимодействии с нуклеиновыми кислотами крайне высока, о чем свидетельствуют приведенные ниже данные [251]:
Нативная ДНК |
100 |
ДНК, гидролизованная |
|
ДНКазой |
2 |
Гепарин |
0,05 |
Плазма крови (кролик) |
0,01 |
Поли-L-глутаминовая |
|
кислота |
0 |
dАМФ, dГМФ |
0,03 |
dТМФ, dЦМФ |
0 |
Общая РНК печени |
46 |
28s-фракция РНК |
46 |
17s-фракция РНК |
46 |
4s-фракция РНК |
46 |
Дрожжевая РНК |
46 |
РНК гидролизованная |
|
РНК,азой |
0,7 |
Хондриотин сульфат |
0,07 |
Гиалуроновая кислота |
0,1 |
Если взаимодействие с ДНК приводит к возрастанию люминесценции в 100 раз, а с РНК - в 46 раз, то изменение люминесцениии этого красителя при взаимодействии его с другими соединениями незначительно или полностью отсутствует. Относительно высокий (2 и 0,7) эффект при добавлении гидролизованных ДНК и РНК связан, по-видимому, с неполным гидролизом, так как эффект при взаимодействии с основаниями либо полностью отсутствует (ТМФ, ЦМФ), либо очень мал (0,03 для АМФ и ГМФ).
Ввиду того, что интенсивность люминесценции этидиум бромида оказалась

пропорциональной концентрации нуклеиновых кислот в препарате, было предложено использовать его в качестве удобного и чувствительного реагента на нуклеиновые кислоты [251]. В дальнейшем на основе применения этидиум бромида был разработан метод автоматического определения ДНК и РНК [253]. Чувствительность люминесценции этидиум бромида к окружению послужила причиной широкого применения его в молекулярной биологии для определения изменений вторичной и третичной структуры нуклеиновых кислот [59, 251-256].
Изучая взаимодействие этидиум бромида с живыми клетками, Бурнс установил [257], что большая часть люминесценции (примерно 80%) этого красителя в клетке обязана своим происхождением комплексам этидиум бромида с РНК и исчезает после обработки клеток РНКазой. Остальная часть (20%) приходится, по-видимому, на комплексы с ДНК. Отмечается высокая специфичность взаимодействия именно с нуклеиновыми кислотами. Этидиум бромид был использован также в качестве реактива Шиффа в люминесцентном варианте реакции Фельгена на ДНК [258].
Поэтому использование этидиум бромида в качестве метки, количественно связывающейся с нуклеиновыми кислотами (условие 4), представляется достаточно обоснованным. Спектр поглощения этого красителя приведен на рис. 62, 3 и имеет максимум в области 480 нм. Максимум люминесценции его находится в красной области спектра (590-610 нм).
Таким образом, учитывая спектральные характеристики метки нуклеиновых кислот, необходимо подобрать в пару к ней метку для белка. По-видимому, наиболее удобными в этом случае будут красители с люминесценцией в синей или зеленой области спектра.
В качестве такой метки для белка может быть использован, например, активный [259] проционовый краситель ДХТАФ [260, 261].
Рис. 62. Спектры поглощения водных растворов.
1- ДХТАФ (10 –6 М); 2 – этидиум бромид (5 10 –6 М); 3 – смесь ДХТАФ (10 –6 М) и этидиум бромида (5 10 –6 М).
ДХТАФ Дихлор-симм-триазиниламинофлуоресцеин-1 Мелкокристаллический порошок светложелтого цвета. Растворим в этиловом спирте и водных растворах бикарбоната натрия, двузамещенного фосфата натрия м.в. 531,76
Предложенные В.Б. Ивановым [262] в качестве метки на белок проционовые красители были изучены разными методами [263-266] и показано, что они количественно связываются с белком (условие 4). Красители этого типа состоят из двух частей: хромофора, определяющего спектральные характеристики проциона, и реакционной группы, представляющей собой дихлортриазиновое кольцо, атомы хлора которого в высокой степени реакционно активны. Было установлено [263], что при рН 5,6 проционы реагируют с амино- и имино-группами белков, присоединяясь к ним посредством ковалентной связи. При рН 8,0 они реагируют еще и с гидроксильными группами белков и углеводов. Связанный краситель не извлекается не, только спиртом, но и другими, более сильными органическими растворителями, обесцвечивающими обычно препараты, окрашенные кислотными и основными красителями [264].
Спектр поглощения ДХТАФ в водном растворе бикарбоната натрия приведен на рис. 62, 3. Он имеет максимум поглощения 500 нм и максимум люминесценции 527 нм (рис. 63). Таким образом, расстояние между максимумами люминесценции ДХТАФ и этидиум бромида составляет
70-80 нм (условие 1).

Рис. 63. Спектры люминесценции водного раствора ДХТАФ.
1 – свежеприготовленный раствор; 2 – после 2 суток хранения при комнатной температуре.
Длина волны 365 нм.
Следует особо отметить, что водные растворы активных красителей, в том числе проционовых, малостабильны, такие соединения достаточно быстро гидролизуются и распадаются на две части - активную группу и хромофор. Поэтому водные растворы следует применять только в свежеприготовленном виде. Целесообразно также производить спектральный контроль этих растворов. Появляющийся при распаде проциона хромофор (например, флуоресцеин в случае ДХТАФ) имеет максимум люминесценции, отличающийся по положению в спектральном диапазоне от максимума люминесценции, который он имел, входя в состав активного красителя (рис. 63). Это обстоятельство может быть использовано для определения степени сохранности водного раствора активного красителя. Спиртовые растворы могут храниться достаточно долго.
Что касается условия 3, то хотя формально оно и выполнено, сопоставление спектров поглощения (рис. 62) и спектров люминесценции (рис. 64) указывает на возможность реабсорбции или некоторого гашения люминесценции ДХТАФ за счет поглощения ее длинноволновым склоном широкой полосы поглощения этидиум бромида. Однако влияние этого эффекта, а также соответствие избранной пары красителей требованиям условия 2 при экспериментальной проверке оказались допустимыми.
Методика выбора времени окраски и концентрации красителя применительно к объекту исследования и задаче, подробно описанная выше, также применялась и в этом случае. Срезы (5 мкм) головного мозга крысы (фиксация по Карнуа, заливка в парафин) окрашивали последовательно спиртовым раствором ДХТАФ (10-4 М) в течение 2 мин с последующей промывкой в дистиллированной воде (2 мин). Срезы подвергали дополнительной окраске водным раствором этидиум бромида (10-5 М) в течение 2 мин с последующей промывкой в дистиллированной воде (1 мин).
Спектры люминесценции обработанного таким образом препарата содержат два максимума излучения (рис. 64). Один из них (527-530 им), обязан своим происхождением ДХТАФ, связанному с белком, в то время как другой (600-610 нм) - этидиум бромиду, находящемуся в комплексе с нуклеиновыми кислотами. По-видимому, для анализа результатов и в этом случае удобно воспользоваться параметром β, представляющим собой отношение интенсивности люминесценции, связанной с белками (527 нм), к таковой, отражающей содержание нуклеиновых кислот (610 нм). По своему физиологическому смыслу параметр β представляет собой содержание белка в ткани или клетке на единицу нуклеиновых кислот. Его увеличение свидетельствует об усилении синтетических процессов в клетке. В случае необходимости из величины параметра β можно определить соотношение белков и нуклеиновых кислот, проведя соответствующую «калибровку» по результатам биохимических исследований.
Однако во многих случаях на практике величина параметра β может быть использована непосредственно для определения направленности изменений содержания белков в исследуемой ткани. Например, при изучении процессов репарации в головном мозге гиппокампэктомированных крыс описанным выше методом с акридиновым оранжевым в зоне разрушения было установлено увеличение параметра α, а, следовательно, отношения РНК/ДНК, что указывало на повышение интенсивности процессов синтеза белков в этой области.
К аналогичным выводам приводит и анализ приведенных на рис. 64 спектров люминесценции препаратов, подвергнутых двойной окраске на белок (ДХТАФ) и нуклеиновые кислоты (этидиум бромид). Неповрежденные участки гиппокампа характеризуются параметром β = 0,52 - 0,78 (рис. 64, 2, 3), в то время как в области разрушения, где идет интенсивный заместительный синтез, полоса люминесценции связанного с белком ДХТАФ становится преобладающей в спектре и параметр β

достигает значения 1,68.
Необходимо отметить, что общее понижение уровня кривой 1 (рис. 64) связано с присутствием в поле зрения большого количества «пустых» участков, еще незаполненных глиальными клетками. Однако применение двухволнового метода определения отношений концентрации позволяет и в этом случае получить данные, не зависящие от степени заполненности клетками поля зрения микроспектрофлуориметра.
Заканчивая этот раздел, следует подчеркнуть, что описанная пара красителей не, является, повидимому, единственной, пригодной для этих целей и, возможно даже, что это не лучший вариант. Исследователь может сам выбрать пары красителей, наиболее полно удовлетворяющих требованиям поставленной им конкретной задачи. Например, в описанной паре ДХТАФ может быть заменен флуоресцеинизотиоцианатом (ФИТЦ), имеющим спектры поглощения и люминесценции, близкие к таковым ДХТАФ. Связывание ФИТЦ с белком (условие 4) подробно изучено, так как этот краситель
— один из наиболее часто применяемых для метки антител [39].
Рис. 64. Спектры люминесценции различных участков среза головного мозга гиппокампэктомированной крысы, окрашенного ДХТАФ (белок) и этидиум бромидом (нуклеиновые кислоты).
1 – разрушенный участок гиппокампа; 2 – участок гиппокампа вблизи зоны разрушения; 3 – неразрушенный участок гиппокампа.
Длина волны 365 нм.
ФИТЦ Флуоресцеинизотиоцианат I Мелкокристаллический порошок
желтовато-оранжевого цвета, хорошо растворим в водных растворах бикарбоната натрия и двузамещенного фосфата натрия
C21H12ClNO5S м.в. 425,85
При использовании же ДХТАФ в качестве люминесцентной метки на белок следует особенно внимательно отнестись к выбору оптимального времени окраски препарата и концентрации красителя. Это связано с интересной особенностью ДХТАФ, заключающейся в том, что интенсивность люминесценции препарата достаточно быстро достигает плато насыщения и затем резко падает. В результате увеличение времени окраски приводит к резкому ослаблению люминесценции препарата. Правильно окрашенный препарат обладает высокой устойчивостью к возбуждающему люминесценцию излучению. Люминесценция препарата не уменьшается при длительной промывке в воде.
Липиды: белки. В ряде случаев возникает необходимость изучения изменения концентрации липидов по отношению к таким важнейшим компонентам структуры клетки, как белки и нуклеиновые кислоты. Естественно, что и для этой цели могут быть разработаны соответствующие двухволновые методы измерения.
В основе гистохимии липидов лежит метод окрашивания их неполярными жирорастворимыми красителями [32, 33]. Суть этого метода заключается в том, что неполярные красители растворяются в жировых веществах клетки значительно лучше, чем в воде и водноспиртовых смесях, и поэтому в процессе окраски ткани переходят из водно-спиртового раствора в жировые включения препарата. Обычно при использовании методов абсорбционной микроскопии (наблюдение в проходящем свете) применяются перенасыщенные растворы нафтоловых суданов в 50—70%-ном спирте (этанол, изопропанол и т.д.) [32, 33]. Столь высокая концентрация красителя и довольно длительная окраска срезов не являются необходимыми при использовании люминесцентной микроскопии, чувствительность которой примерно на 3 порядка выше чувствительности абсорбционной микроскопии. При этом появляется возможность применения

весьма малых концентраций люминесцентного красителя-метки на жиры в окрашивающей жидкости, что, в свою очередь, позволяет исключить в случае необходимости спирты из состава окрашивающего раствора.
Наиболее хорошо изученным красителем-меткой на липиды является обладающий сильной голубой люминесценцией 3,4-бензпирен, введенный в гистохимию Бергом [267].
3,4-БЕНЗПИРЕН (бенз[а]пирен)
Слегка желтоватые игольчатые кристаллы; не растворим в воде; слабо растворим в
этиловом спирте; растворимость в насыщенном водном растворе кофеина 0,00075%
Полное отсутствие полярных групп у этого ароматического канцерогенного соединения делает его высоко специфическим красителем на липиды. Было изучено действие 3,4-бензпирена на клетки при их прижизненном окрашивании [268-271] и показана низкая (по сравнению с красителями акридинового ряда) токсичность его. Применение 3,4-бензпирена вместе с акридиновым оранжевым позволило Бревису [272] разработать метод одновременного люминесцентно-микроскопического выявления липидов, ДНК и РНК в одной и той же клетке прижизненно и в срезах фиксированной ткани. Метод нашел применение в ряде исследований [273-276].
Для приготовления водного раствора 3,4-бензпирена берут насыщенный раствор кофеина в воде (75 мг/10 мл) и добавляют в него 3,4-бензпирен из расчета 2 мг на 100 мл. Полученную смесь выдерживают в термостате 20—24 ч при температуре 50° С и затем тщательно фильтруют, получая таким образом готовый к употреблению водный раствор красителя.
При изучении срезов фиксированных препаратов может быть использован также и водноспиртовый раствор 3,4-бензпирена. Насыщенный раствор в абсолютном этаноле (или изопропилене) разбавляется дистиллированной водой в нужной пропорции (от 50 до 70%) и после энергичного перемешивания фильтруется перед употреблением. Срезы, окрашенные в водно-спиртовом растворе, требуют тщательной промывки, так как возможно выпадение мелких сильно люминесцирующих кристаллов 3,4-бензпирена из остатков водно-спиртовой смеси при переносе препарата в воду для промывки (рис. 65, 3). Сопоставление спектров поглощения и люминесценции 3,4-бензпирена со спектрами поглощения ДХТАФ, ФИТЦ и этидиум бромида указывает на возможность совместного применения этих красителей при разработке двухволновых методов регистрации соотношения концентраций липиды: белки и липиды: нуклеиновые кислоты. Действительно, узкие линии излучения 3,4-бензпирена (рис. 65) не перекрываются полностью ни с полосами поглощения ДХТАФ и этидиум бромида, ни с полосами их излучения.
Рис. 65. Спектры люминесценции 3,4- бензпирена.
1 – бензольный раствор; 2 – кристаллы; 3 – кристаллы в бензольном растворе.
Длина волны возбуждения 365 нм. Экспедиционный микроспектрофлуориметр с интерференционным светофильтром.
Пример реализации двухволнового метода определения соотношения концентраций липидов и белков в клетке приведен на рис. 66. Срезы мозга крысы (фиксация Карнуа, заливка в парафин) обрабатывали водным раствором 3,4-бензпирена в течение 5 мин (выход окраски на насыщение) и промывали в течение 2 мин в дистиллированной воде. В результате этого липиды, оставшиеся в препарате после фиксации Карнуа, заливки в парафин и проводки по спиртам, приобретают яркую голубую люминесценцию. Наиболее интенсивно люминесцируют стенки кровеносных сосудов и область мозолистого тела, спектр которого приведен на рис. 66, 1.
Необходимо отметить, что 3,4-бензпирен можно полностью отмыть в 96%-ном этаноле, что приводит к исчезновению голубой люминесценции срезов. Последующая окраска этого препарата
водным раствором 3,4-бензнирена позволяет вновь получить голубую люминесценцию его той же интенсивности. Это указывает на строгую специфичность связывания (а вернее, растворения) 3,4- бензпирена с липидами.
Рис. 66. Спектры люминесценции одного и того же участка среза головного мозга крысы после окраски: 1 – 3,4- бензпирен; 2 – 3,4-бензпирен и ДХТАФ; 3 – 3,4-бензпирен и этидиум бромид.
Длина волны возбуждения 365 нм.
Дополнительная обработка окрашенного таким образом препарата водным раствором ДХТАФ в концентрации 10-4 М в течение 2 мин с последующей промывкой в дистиллированной воде приводит к появлению в спектре его люминесценции дополнительной полосы излучения ДХТАФ, ковалентно связанного с белком (рис. 66, 2). Некоторое перекрытие люминесценции 3,4-бензпирена с полосой поглощения ДХТАФ, а также, возможно, явление экранирования возбуждающего излучения выражается в снижении интенсивности люминесценции 3,4-бензпирена примерно в 2 раза. Особенно сильно этот эффект сказывается на линии излучения 3,4-бензпирена в 480 нм, совпадающей с максимумом поглощения ДХТАФ, которая совершенно исчезает в спектре люминесценции препарата с двойной окраской (рис. 66, 2). В наименьшей степени перекрытие спектра люминесценции 3,4- бензпирена со спектром поглощения ДХТАФ сказывается, по-видимому, на линии излучения 3,4- бензпирена в 430 нм.
С учетом эффекта взаимного экранирования возбуждающего люминесценцию УФ-излучения 365 нм можно, по-видимому, по соотношению интенсивностей люминесценции в 430 и 517 нм препарата, окрашенного двумя красителями: 3,4-бензпиреном и ДХТАФ, судить о соотношении в нем концентрации липидов (430 нм) и белков (520 нм).
Разработка других модификаций такого двухволнового метода с использованием вместо названных красителей (3,4-бензпирена и ДХТАФ) других пар с иными соотношениями полос поглощения и люминесценции и применение их для изучения того же препарата является, вероятно, наиболее прямым методом учета возможных погрешностей, связанных с перекрытием спектров поглощения и люминесценции красителей, входящих в состав пары. Другим методом определения взаимного влияния красителей может служить регистрация спектра люминесценции того же участка клетки при измененной длине волны возбуждающего излучения. При этом по изменению соотношения интенсивностей полос в спектре люминесценции может быть определена степень взаимодействия красителей.
Если количество известных люминесцентных меток на белки с самыми разнообразными спектрами поглощения и люминесценции достаточно велико, то относительно опробованных и изученных люминесцентных меток на липиды этого сказать нельзя, хотя число потенциальных меток такого типа из разряда ароматических соединений может быть исключительно большим. Поиск и исследование люминесцентных меток липидов является, по-видимому, одной из перспективных задач цитохимии.
Использованный в описанных методах неполярный ароматический углеводород 3,4-бензпирен как люминесцентная метка на липиды обладает только одним, но очень существенным недостатком
— высокой канцерогенностью. По этой причине применение его в практике лабораторных исследований не желательно. В качестве метки липидов может быть использован также хлорофилл, обладающий интенсивной люминесценцией в красной области спектра.
Липиды: нуклеиновые кислоты. Не останавливаясь подробно на этом методе, аналогичном по идее предыдущему, напомним, что соотношение полос поглощения и люминесценции 3,4-бензпирена и этидиум бромида таково, что позволяет использовать их для комплексной окраски препарата с целью получения сведений о соотношении концентраций липидов и нуклеиновых кислот в исследуемом участке клетки или ткани. В качестве примера реализации такого подхода на рис.66 приведен спектр люминесценции среза головного мозга крысы, обработанного вначале насыщенным раствором 3,4-бензпирена в 70%-ном этаноле (окраска - 3 мин, промывка 20 мин) и докрашенного затем водным раствором этидиум бромида (10-5 М, окраска 1 мин, промывка 1 мин). Длительная промывка после обработки спиртовым раствором 3,4-бензпирена необходима для удаления
