
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (44)
.pdf
5, 2007 |
Лекции и обзоры |
|
|
УДК 616.36-006.04-085.84
Новое в диагностике и лечении гепатоцеллюлярной карциномы1
Х.Е. Блюм
(Медицинская клиника Фрайбургского университета, Германия)
Факторами риска возникновения широко распространенной злокачественной опухоли
– гепатоцеллюлярной карциномы (ГЦК) – служат хронические вирусные гепатиты В, С и D, заболевания печени, наследственные факторы, прием алкоголя и канцерогены химической природы. В качестве методов скрининга в группах повышенного риска ГЦК возможны определение уровней альфа-фетопротеина и ультразвуковое исследование с интервалом в 6 мес. Для установления диагноза ГЦК проводят спиральную компьютерную томографию или маг- нитно-резонансную томографию, а также ангиографию.
В зависимости от числа, размеров и локализации очагов опухоли, ее клинических особенностей (стадии течения) в настоящее время применяются различные методы лечения: оперативные вмешательства (резекция опухоли, трансплантация печени), нехирургические методы местного воздействия (чрескожная инъекция этанола, радиочастотная термоабляция, транс артериальная химиотерапевтическая эмболизация), а также методы лучевой терапии. Среди лекарственных препаратов обсуждается возможность использования различных химиотерапевтических средств, гормонов и антигормонов, ингибиторов ангиогенеза.
Ключевые слова: гепатоцеллюлярная карцинома, факторы риска, радиочастотная термоабляция, трансартериальная химиотерапевтическая эмболизация.
Эпидемиология и патогенез |
Риск возникновения ГЦК коррелирует с этио- |
|
|
|
логией, а также с продолжительностью заболева- |
епатоцеллюлярная карцинома является |
ния печени и его активностью. Пациенты старше- |
|
одной из наиболее распространенных во |
го возраста, с наличием антител к вирусу гепа- |
|
Гвсем мире злокачественных опухолей. Ее |
тита С (анти-HCV), повышенным показателем |
|
частота в западных странах неуклонно возрастает. |
протромбинового времени и сниженным числом |
|
Наряду с хроническими вирусными гепатитами В, |
тромбоцитов образуют подгруппу больных с цир- |
|
С и D, наследственными заболеваниями печени |
розом печени, имеющих особенно высокий риск |
|
(в частности, гемохроматозом) и канцерогенами |
развития ГЦК [21]. ГЦК относится к опухолям, |
|
химической природы существенными факторами |
характеризующимся клинически высокой злока- |
|
риска ГЦК служат поражения печени, вызванные |
чественностью и плохим прогнозом при отсут- |
|
токсическими веществами (алкоголь, никотин, |
ствии лечения. Если в период с 1977 по 1996 г., |
|
афлатоксин), аутоиммунный гепатит, инсулино- |
несмотря на внедрение различных стратегий, |
|
резистентность, наблюдающаяся при сахарном |
направленных на раннее распознавание и лечение |
|
диабете, неалкогольном стеатогепатите, избыточ- |
ГЦК, не было достигнуто достоверного повыше- |
|
ной массе тела у мужчин [1, 3, 11]. У мужчин |
ния выживаемости пациентов, то в период с 1997 |
|
ГЦК встречается в 4–10 раз чаще, чем у женщин. |
по 2001 г. отмечен положительный эффект дина- |
|
Важным в клиническом отношении является тот |
мического наблюдения больных циррозом печени |
|
факт, что любой пациент с хроническим забо- |
с целью раннего выявления опухоли [14]. |
|
леванием печени (в частности, циррозом) имеет |
Патогенез ГЦК на молекулярном уровне до |
|
повышенный риск развития ГЦК. |
сих пор окончательно не изучен. Злокачественная |
|
|
|
трансформация гепатоцитов происходит на фоне |
|
|
усиленного в течение длительного времени кле- |
|
|
|
1Доложено на 12-й Российской конференции «Гепатология |
точного обновления, обусловленного хроническим |
|
сегодня» в марте 2007 г. |
(частично иммунноопосредованным) воспалением |
|
11

Лекции и обзоры |
5, 2007 |
иповреждением клеток в условиях окислительного стресса. Эти процессы ассоциированы, кроме того, с генетическими нарушениями, ведущими к активации онкогенов или инактивации туморсупрессорных генов (возможно в сочетании с геномной нестабильностью, вызванной дефектами репарации ДНК, и нарушением сегрегации хромосом), а также с повышенной экспрессией факторов роста и ангиогенеза, активацией теломеразы и др. [18]. Помимо хромосомных нарушений
иэпигенетических изменений на риск возникновения ГЦК может, по-видимому, влиять индивидуальный генотип ферментов, метаболизирующих ксенобиотики (генетическая восприимчивость).
Современные методы (например, субтрактивная гибридизация, анализ последовательности олигонуклеотидов, протеомный анализ) позволяют точнее определить профиль экспрессии генов ГЦК, имеющих патогенетическое, диагностическое, терапевтическое, а также прогностическое значение [2]. Таким образом, можно ожидать, что в будущем для диагностики ГЦК в нашем распоряжении окажутся такие же клинически значимые молекулярные маркеры, какие уже применяются для диагностики других опухолей (например, определенных видов лимфом, рака толстой кишки и молочной железы).
Диагноз, скрининг и стадии ГЦК
Диагноз (в том числе на ранней стадии) и скрининг ГЦК основываются на результатах применения лабораторных анализов, методов лучевой диагностики и гистологических методов [19]. Всем больным, относящимся к группе повышенного риска развития ГЦК, показано определение уровня альфа-фетопротеина (АФП) и прове-
дение ультрасонографии печени каждые 6 мес. Хотя сведения об эффективности такой стратегии и ее целесообразности с позиций соотношения «эффективность–стоимость», отвечающие принципам доказательной медицины, к настоящему времени отсутствуют, отдельные центры смогли обнаружить у наблюдавшихся в соответствии с этой стратегией пациентов из группы высокого риска (с лабораторными признаками активности заболевания печени, со скрыто протекавшей
инфекцией вируса гепатита В – HBV, с цир-
розом печени) развитие опухоли. У 40% больных с ГЦК, выявленной по результатам скрининга, оказалось возможным проведение эффективной терапии [8].
Наряду с определением уровня АФП важное место в распознавании ГЦК занимают методы лучевой диагностики. Особое внимание при этом уделяется общедоступному, сравнительно дешевому и необременительному для больного ультразвуковому методу исследования. Обычная ультрасонография может быть дополнена, напри-
мер, применением «гармоничного изображения тканей» («tissue harmonic imaging»), проведением цветной допплер-сонографии, а также цветной допплер-сонографии с контрастным усилением, что позволяет получить данные о васкуляризации опухоли, тромбозе или опухолевой инфильтрации портальных сосудов. Если результаты неинвазивных методов лучевой диагностики и/или определения уровня АФП дают основание подозревать наличие ГЦК, то в соответствии с существующей терапевтической стратегией показано применение других методов лучевого исследования: динами-
ческой спиральной компьютерной томографии (КТ) или магнитно-резонансной томографии
(МРТ), а также ангиографии. Как КТ, так и МРТ, если они проводятся опытными специалистами, позволяют диагностировать ГЦК небольших размеров.
Итак, для диагностики ГЦК используются: I. Гистологические критерии.
II. Неинвазивные критерии (только у пациентов с циррозом печени).
А. Методы лучевой диагностики (сочетание, по крайней мере, двух методов: ультрасонографии, спиральной КТ, МРТ или ангиографии).
Б. Комбинация критериев:
– один из методов лучевой диагностики, выявляющий очаговое поражение диаметром более 2 см с артериальной гиперваскуляризацией;
– уровень альфа-фетопротеина выше 400 нг/мл. Для оценки стадий ГЦК предложены различные классификации. Общепринятой международной классификации пока не существует. Классификация Okuda учитывает наряду с протяженностью опухолевого поражения и состояние функции печени. В качестве альтернативных классификаций используются итальянская шкала CLIP [4], испанская классификация BCLK [7],
японская шкала JIS [6].
Лечение
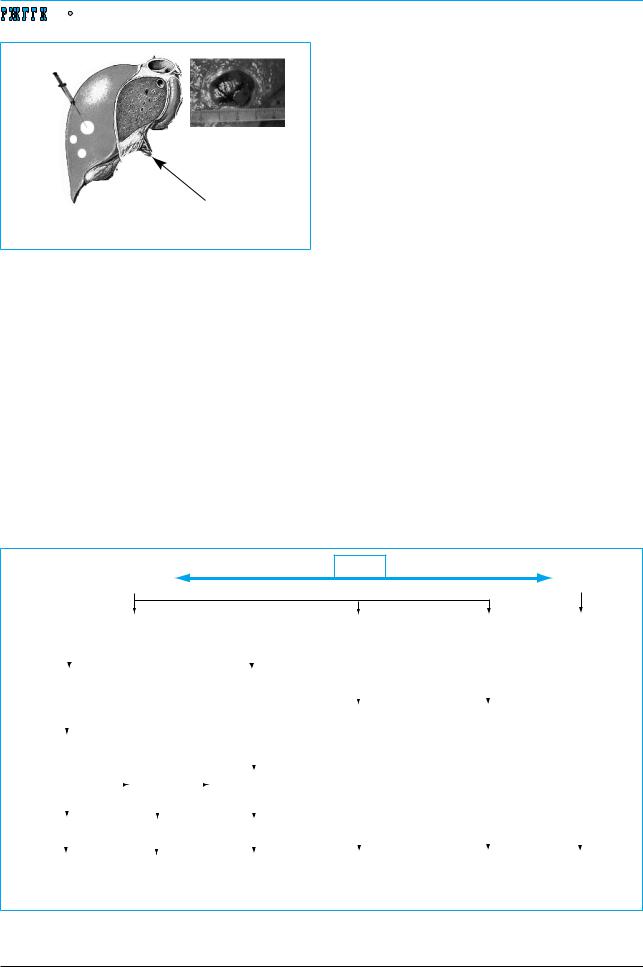
В лечении больных с ГЦК применяются как хирургические, так и нехирургические методы (рис. 1). Потенциально радикальными являются резекция, а в выборочных случаях – трансплантация печени [17]. К нехирургическим методам относятся местное чрескожное вмешательство, трансартериальный метод и новые методы лучевой терапии. Системно действующие лекарственные препараты, а также методы генной и иммунной терапии находятся на стадии доклинических и клинических исследований. Существующие методы дают возможность проводить лечение в соответствии со стадией заболевания (рис. 2) и позволяют во многих случаях добиться увеличения общей продолжительности жизни больных и длительности безрецидивного периода, а у отдельных пациентов даже полного выздоровления.
12
5, 2007 |
Лекции и обзоры |
|
|
ЧИЭ
РЧТА
ТИВЧ
ТИЛ
ФУВВИ
Резекция (менее 10%) Трансплантация печени (менее 3%)
ТХП
ТАЭ
Лучевая терапия ТАХЭ Лекарственные препараты
Рис. 1. Современные возможности лечения ГЦК
Чрескожная инъекция этанола (ЧИЭ) явля-
ется простым методом локальной абляции ГЦК [13]. У пациентов специально отобранной группы, имеющих максимально 3 очага опухоли с максимальным диаметром до 3 см, этот метод оказывается надежным и эффективным. Результаты его применения можно улучшить при комбинации с трансартериальной химиотерапевтической эмболизацией (ТАХЭ).
Методы чрескожной термоабляции.
Альтернативой ЧИЭ служит применение мето-
дов радиочастотной термоабляции (РЧТА), термоабляции, индуцированной высокой частотой (ТИВЧ), и термоабляции, индуцированной лазером (ТИЛ) [13]. Эти чрескожные методы также технически легко выполнимы, эффектив-
ны, редко сопровождаются осложнениями. Как правило, для достижения полной абляции достаточным бывает их однократного применения. Другим многообещающим методом чрескожного воздействия является абляция, вызванная
фокусированными ультразвуковыми волнами высокой интенсивности (ФУВВИ), которая в отдельных случаях может комбинироваться с трансартериальными методами воздействия.
Трансартериальная химиотерапевтическая эмболизация (ТАХЭ) и другие методы. ТАХЭ,
трансартериальная эмболизация (ТАЭ), а при наличии тромбоза воротной вены (частично-
го) трансартериальная химиотерапевтическая перфузия (ТХП) служат другими методами местного воздействия при лечении обследуемой категории больных. При преимущественно артериальном типе кровоснабжения ГЦК после суперселективного зондирования сосуда, кровоснабжающего опухоль, вводится липиодол, маслянистый контрастный препарат, накапливающийся преимущественно в клетках опухоли, смешанный с химиотерапевтическим лекарственным средством (например, митомицином или эпирубицином), с последующей окклюзией сосуда. Отдельные наблюдения позволяют говорить о хорошем терапевтическом эффекте уже после однократного проведения ТАХЭ. Однако результаты метаанализа свидетельствуют лишь о незначительном положительном влиянии данного метода лечения на течение опухоли. И все же для строго отобранной группы больных с сохраненной функцией
Okuda 1–2
PST 0–2
HCC
Okuda 3
PST 3–4
|
|
|
|
|
Стадия А |
|
|
|
|
|
|
Стадия В |
|
|
Стадия С |
|
|
Стадия D |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Один |
|
|
|
|
|
|
|
|
Максимально |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
3 очага опухоли, |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
очаг опухоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
диаметром до 3 см |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
Опухоли больших |
Инвазия сосудов |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
размеров |
или отдаленные |
|
|
|
|
|||||
Давление в вовротной |
|
|
|
и множественные |
|
метастазы |
|
|
|
|
||||||||||||||||
|
|
|
|
очаги опухоли |
|
|
|
|
|
|
|
|
||||||||||||||
вене и содержание |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
билирубина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Повышено |
|
Сопутствующие |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
заболевания |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нормальное |
|
|
|
Нет |
|
Есть |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Резекция |
Трансплантация |
|
ЧИЭ/РЧТА |
|
ТХП/ТАХЭ |
Лекарственные |
Паллиативное |
||||||||||||||||||
|
|
|
|
препараты |
|
лечение |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Радикальные методы |
|
|
|
|
|
|
|
Паллиативные методы |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2. Лечение ГЦК в зависимости от стадии заболевания
13

Лекции и обзоры |
5, 2007 |
печени (цирроз класса А по Чайльд–Пью) ТАХЭ следует рассматривать как действенный метод терапии, причем его основной эффект может быть связан с эмболизацией [9]. Другим способом оптимизации метода ТАХЭ нужно считать применение химиотерапевтических препаратов со сниженной системной токсичностью [20].
Лучевая терапия. Подающим надежды является применение внутриартериальной 131I-липиодол- терапии как варианта селективной внутренней лучевой терапии. К другим возможным методам относятся внутриартериальное введение микросфер с 90Y, облучение высокими дозами протонов, а также модифицированные методы обычной лучевой терапии (например, «с модулированием интенсивности», стереотаксическое облучение). В настоящее время они проходят клиническую проверку.
Лекарственные препараты. Обсуждается возможность использования при лечении ГЦК различных лекарственных средств: цитостатиков (5-фторурацил, капецитабин, гемцитабин, доксорубицин, этопозид, цисплатин, митоксантрон), гормонов и антигормонов (мегестролацетат, тамоксифен, октреотид), ингибиторов ангиогенеза (талидомид и его производные, моноклональные антитела – бевацизумаб, цетуксимаб, ингибиторы тирозинкиназы – гефитиниб, эрлотиниб, сорафениб), иммуномодуляторов (интерфе- рон-α, тимофизин, α1-тимозин), других препаратов (правастатин, ингибиторы циклооксигеназы-2). Многообещающим выглядит применение препаратов, влияющих на неоангиогенез: моноклональных антител к фактору роста эндотелия сосудов (бевацизумаб), антител к рецептору фактора роста эндотелия (цетуксимаб), назначение низкомолекулярных ингибиторов тирозинкиназы (гефитиниб, эрлотиниб, сорафениб). Однако эти препараты еще не используются в клинической практике, поскольку результаты исследований оказались неоднозначными. Большое число различных экспериментальных методов лечения, в частности применение онколитических вирусов [12], находятся на стадии доклинических испытаний [16].
Профилактика ГЦК
Наряду с созданием новых методов лечения важное значение придается профилактике
ГЦК с помощью превентивных или лечебных мер, направленных на снижение заболеваемости острыми гепатитами, частоты их хронизации и развития цирроза печени. У больных хроническим гепатитом В и С оценивалась эффективность применения в этих целях интерферона-α [5, 10]. У пациентов с хроническим гепатитом С без цирроза печени или с циррозом печени класса А по Чайльд–Пью интерферон-α снижает частоту возникновения ГЦК примерно на 50%, в том числе у больных, у которых не удается достичь биохимического или вирусологического ответа. Прекрасный профилактический эффект продемонстрировал в экспериментальных исследованиях ингибитор тирозинкиназы рецептора эпидермального фактора роста гефитиниб [15].
Заключение
ГЦК относится к заболеваниям, часто встречающимся в клинической практике. В зависимости от числа, размеров и локализации очагов опухоли, а также ее клинических особенностей (стадии течения) в настоящее время применяются различные методы лечения: оперативные вмешательства (резекция опухоли, трансплантация печени), нехирургические методы местного воздействия (ЧИЭ, РЧТА, ТАХЭ), а также методы лучевой терапии. Применение системно действующих медикаментов (химиотерапевтических средств, препаратов генной и иммунной терапии) находится в настоящее время на стадии доклинических или клинических испытаний. Несмотря на прогресс в лечении ГЦК, наибольшую роль в клинической практике играют меры, направленные на профилактику ее развития: устранение воздействия гепатотоксичных веществ (в частности, алкоголя), вакцинация против гепатита В, предупреждение инфицирования вирусом гепатита С, раннее распознавание и лечение наследственных заболеваний печени (например, гемохроматоза), своевременная и эффективная терапия хронической патологии, в первую очередь хронического гепатита В и С, препятствующая их прогрессированию и трансформации в цирроз печени и ГЦК.
Список литературы
1. |
Caldwell |
S.H., Crespo |
D.M., Kang H.S., Al-Osa |
|
|
imi A.M. |
Obesity and |
hepatocellular carcinoma // |
|
|
Gastroenterology. – 2004. – Vol. 127. – P. 97–103. |
|||
2. |
Chignard N., |
Beretta L. Proteomics for hepatocellu- |
||
|
lar carcinoma |
marker discovery // Gastroenterology. |
||
– 2004. – Vol. 127. – P. 120–125.
3.El-Serag H.B., Tran T., Everhart J.E. Diabetes increases the risk of chronic liver disease and hepatocellular
carcinoma // Gastroenterology. – 2004. – Vol. 126.
– P. 460–468.
4.Farinati F., Rinaldi M., Gianni S., Naccarato R. How should patients with hepatocellular carcinoma be staged?
Validation of a new prognostic system // Cancer.
–2000. – Vol. 89. – P. 2266–2273.
5.Heathcote E.J. Prevention of hepatitis C virus-related hepatocellular carcinoma // Gastroenterology. – 2004.
–Vol. 127. – P. 294–302.
14

5, 2007 |
Лекции и обзоры |
|
|
6.Kudo M., Chung H., Haji S. et al. Validation of a new prognostic staging system for hepatocellular carcinoma: the JIS score compared with the CLIP score // Hepatology. – 2004. – Vol. 40. – P. 1396–1405.
7.Llovet J.M., Bru C., Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification // Semin. Liver Dis. – 1999. – Vol. 19. – P. 329–338.
8.Llovet J.M., Fuster J., Bruix J. The Barcelona approach: diagnosis, staging, and treatment of hepatocellular carcinoma // Liver Transplant. – 2004. – Vol. 10. – P. 115–120.
9.Llovet J.M., Real M.I., Montana X. et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular
carcinoma: a randomised controlled trial // Lancet.
–2002. – Vol. 359. – P. 1734–1739.
10.Lok A.S. Prevention of hepatitis B virus-related hepatocellular carcinoma // Gastroenterology. – 2004. – Vol. 127. – P. 303–309.
11.Marrero J.A., Fontana R.J., Fu S. et al. Alcohol, tobacco and obesity are synergistic risk factors for hepatocellular carcinoma // J. Hepatol. – 2005. – Vol. 42.
–P. 218–224.
12.Mohr L., Yeung A., Aloman C. et al. Antibodydirected therapy for human hepatocellular carcinoma // Gastroenterology. – 2004. – Vol. 127. – P. 225–231.
13.Omata M., Tateishi R., Yoshida H., Shiina S.
Treatment of hepatocellular carcinoma by percutaneous tumor ablation methods: ethanol injection therapy and radiofrequency ablation // Gastroenterology. – 2004.
–Vol. 127. – P. 159–166.
14.Sangiovanni A., del Ninno E., Fasani P. et al. Increased survival of cirrhotic patients with a hepatocellular carcinoma detected during surveillance // Gastroenterology.
–2004. – Vol. 126. – P. 1005–1014.
15.Schiffer E., Housset C., Cacheux W. et al. Gefitinib, an EGFR inhibitor, prevents hepatocellular carcinoma development in the rat liver with cirrhosis // Hepatology.
–2005. – Vol. 41. – P. 307–314.
16.Shinozaki K., Ebert O., Woo S.L. Eradication of advanced hepatocellular carcinoma in rats via repeated hepatic arterial infusions of recombinant VSV // Hepatology. – 2005. – Vol. 41. – P. 196–203.
17.Song T.J., Ip E.W., Fong Y. Hepatocellular carcinoma: current surgical management // Gastroenterology.
–2004. – Vol. 127. – P. 248–260.
18.Suriawinata A., Xu R. An update on the molecular genetics of hepatocellular carcinoma // Semin. Liver Dis. – 2004. – Vol. 24. – P. 77–88.
19.Talwalkar J.A., Gores G.J. Diagnosis and staging of hepatocellular carcinoma // Gastroenterology. – 2004.
–Vol. 127. – P. 126–132.
20.VarelaM.,RealM.I.,BurrelM.etal.Chemoembolization of hepatocellular carcinoma with drug eluting beads: efficacy and doxorubicin pharmacokinetics // J. Hepatol.
–2007. – Vol. 46. – P. 474–481.
21.Velazquez R.F., Rodriguez M., Navascues C.A. et al. Prospective analysis of risk factors for hepatocellular carcinoma in patients with liver cirrhosis // Hepatology.
–2003. – Vol. 37. – P. 520–527.
Update of hepatocellular carcinoma diagnostics and treatment
H.E. Blum
Risk factors for widespread hepatocellular carcinoma (HCC) include chronic viral hepatites B, C and D, liver diseases, hereditary factors, intake of alcohol and chemical cancerogenes. Assessment of alpha-fetoprotein level and ultrasound investigation at 6-months intervals may be useful as screening diagnostics in highrisk groups of HCC. HCC diagnosis may verified by helical computer tomography or magnetic-resonance tomography and angiography.
According to number, size and localization of the foci of tumor, its clinical presentation (stage) various methods of treatment are applied nowadays: surgical interventions (resection of tumor, liver transplantation), local nonsurgical methods (percutaneous injection of ethanol, radio-frequency thermoablation, transarterial chemoembolization), and methods of radiation therapy. Option of various chemotherapeutic drugs application — hormones and antihormones, inhibitors of angiogenesis — is discussed.
Key words: hepatocellular carcinoma, risk factors, radio-frequency thermoablation, transarterial chemoembolization.
15

Лекции и обзоры |
5, 2007 |
УДК 616.36-004.4+616.36-04-02:578.891
Как оценить и уменьшить риск фиброза, цирроза и гепатоцеллюлярной карциномы у пациентов с хронической инфекцией вирусами гепатитов В и С
Ч.С. Павлов, В.Т. Ивашкин
(Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Московской медицинской академии им. И.М. Сеченова)
Гепатоцеллюлярная карцинома (ГЦК) занимает пятое место среди наиболее распространенных опухолей и третье место среди причин смерти от опухолевых заболеваний. На ее долю приходится 85–90% всех опухолей печени. В России средний уровень заболеваемости и показатель смертности при этой патологии составляют соответственно 3,73 и 5,77 случая на 100 тыс. населения. Вирусы гепатитов В (первое место среди этиологических факторов) и С (HBV
иHCV) обладают тропностью к печеночной ткани, а хроническая инфекция этими вирусами приводит к прогрессирующему воспалению печени, развитию фиброза, цирроза и в конечном счете к ГЦК.
Факторы риска ГЦК у носителей HBV: мужской пол, возраст к моменту инфицирования, длительность течения инфекции, принадлежность к азиатской или африканской расе, наличие цирроза, семейный анамнез по ГЦК, контакт с афлотоксином, злоупотребление алкоголем, курение, коинфекция вирусами гепатитов С и D, наличие HBeAg, высокая вирусная нагрузка HBV-DNA (>100 000 копий/мл), генотипы вируса HBV/С2/Се. Факторы, влияющие на сроки развития цирроза печени и ГЦК у носителей HCV: возраст пациента на момент инфицирования
идлительность заражения, мужской пол, злоупотребление алкоголем (>50 мл/день), коинфекция вирусами HBV и HCV, инфицирование зараженными компонентами крови, сопутствующий сахарный диабет и ожирение.
Небольшой процент вирусологического ответа на лечение у больных HBV-индуцирован- ным циррозом (что может снизить риск ГЦК) ставит под сомнение эффективность назначения интерферона. Энтекавир обладает более высокой (по сравнению с ламивудином) эффективностью в отношении подавления репликации вируса HBV и достижения неопределяемого уровня вирусной нагрузки. Назначение интерферонотерапии больным HCV-индуцированным циррозом уменьшает частоту ГЦК.
Ключевые слова: гепатоцеллюлярная карцинома, фиброз и цирроз печени, вирусы гепатитов В и С, хроническая инфекция вирусами HBV и HCV.
ирроз печени (ЦП) и ГЦК, по данным про- |
На ГЦК приходится 85–90% всех опухолей |
екта 2000 Всемирной организации здра- |
печени. Чаще болеют мужчины (в среднем |
Цвоохранения, включены в перечень 130 |
2:1), а в Европе это соотношение достигает 6:1. |
основных причин заболеваемости и смертности |
Россия относится к странам со средним уров- |
населения, требующих разработки и проведе- |
нем заболеваемости ГЦК, который составляет |
ния крупномасштабных программ профилакти- |
(по данным за 2003 г.) 3,73 случая, а показа- |
ки и лечения [3, 14]. ГЦК занимает пятое место |
тель смертности – 5,77 на 100 тыс. населения |
среди наиболее распространенных опухолей и |
[3]. Согласно последним эпидемиологическим |
третье место среди причин смерти от опухоле- |
исследованиям, отмечается тенденция к сни- |
вых новообразований. В год заболевает около |
жению заболеваемости в регионах, где она |
560 тыс. человек, из которых 550 тыс. умирают. |
традиционно считается высокой, и увеличению |
До 80% новых случаев заболевания регистри- |
там, где она не рассматривается как серьезная |
руется у жителей Восточной Азии и Африки. |
проблема здравоохранения. |
16

5, 2007 |
Лекции и обзоры |
|
|
HBV- и HCV-факторы риска развития рака
Вирусы гепатитов В и С обладают тропностью к печеночной ткани, а хроническая инфекция этими вирусами приводит к прогрессирующему воспалению печени, развитию фиброза, цирроза и в конечном счете ГЦК [1, 3, 5]. Сегодня доказано, что такой путь течения болезни характерен при поражении вирусом HCV (рис. 1), тогда как развитие ГЦК у больных с HBV возможно даже на стадии хронического гепатита, до формирова-
ния ЦП [6, 7].
В разных странах пик заболеваемости ГЦК
регистрируется в различных возрастных группах, что зависит от типа и распространенности хронической инфекции гепатотропными вирусами, а также от путей передачи инфекции и наличия дополнительных факторов риска, таких как злоупотребление алкоголем, ожирение и т. д. В Японии, где широко распространен вирус гепатита С и заражение пациентов происходит в зрелом возрасте, пик заболеваемости наблюдается
Рис. 1. ГЦК трабекулярного типа у больного с вирусным (вирус гепатита С) циррозом печени. Окраска гематоксилином и эозином. Увеличение ×400
на 7–8-м десятке жизни. В Китае, где доминирует вирус гепатита В, а основной путь передачи инфекции от матери к ребенку, он приходится на возраст 40–50 лет [25, 26, 36].
Результаты исследований последних лет показали, что коинфекция двумя вирусами повышает риск и ускоряет развитие опухоли. Недавно обнаружено, что вирусы гепатитов В и С могут также взаимодействовать с лимфоцитами и по всей видимости играют определенную роль в развитии неходжкинских лимфом. Высокая частота выявления инфекции HCV у больных миеломной болезнью и раком щитовидной железы послужила основанием для обсуждения возможного участия вируса в патогенезе опухолей указанной локализации [13].
HBV. Первое место среди этиологических факторов, вызывающих ГЦК, во всем мире,
занимает вирус |
гепатита В. Общее количест- |
во пациентов с |
хронической инфекцией HBV |
составляет около 300 млн человек. Проведенные исследования «случай–контроль» показали, что у данной группы вероятность развития ГЦК в 5–15 раз выше, чем в популяции в целом. Результаты проспективных исследований, в которые вошли HBV-инфицированные лица, также подтвердили высокий риск возникновения ГЦК. Так, в ходе
классического контролированного |
проспектив- |
|
ного исследования, проведенного |
на |
Тайване, |
в котором были обследованы 20 000 |
мужчин |
|
(из них 15% носители HBsAg) установлено, что средние сроки развития ГЦК у носителей HBV составляют 8–9 лет. Риск формирования ГЦК у этих пациентов был примерно в 100 раз выше, чем у остальных участников [12].
Исследования последних лет, проведенные на Аляске, в Японии, Европе и Канаде, доказали повсеместную угрозу развития ГЦК у HBVинфицированных жителей. Анализ показал, что у жителей Азии опухоли печени чаще диагностировались в цирротически неизмененном органе, тогда как у лиц европейской расы – обычно на фоне ЦП. Среди HBV-инфицированных азиатов частота вновь выявленной ГЦК достигала 0,4–0,6% в год. На Аляске данный показатель составил 0,26% и чуть меньше он был у европейцев – носителей HBV [29]. Особое внимание заслуживают регионы мира, эндемичные по HBV, где основной путь передачи вируса – от матери к ребенку (вертикальный). При таком пути у 90% больных процесс принимает хроническое течение. Таким образом, более ранние сроки инфицирования и высокая распространенность хронического гепатита В обеспечивают в этих регионах высокую частоту развития ГЦК.
В 70–90% случаев у больных, инфицированных HBV, ГЦК формируется на стадии цирроза печени (рис. 2). На этой стадии HBV-DNA выявляется как в гепатоцитах, так и в клетках опухоли. Попытки расшифровать начальные стадии и механизмы онкогенеза, в результате которых внедренная ДНК вируса способствует прогрессированию опухоли, пока остаются безуспешными. Известно, что интеграция вирусной ДНК в геном гепатоцита приводит к продукции HBV-Х антигена, который играет роль транс-активатора, запускающего злокачественную трансформацию. HBV-Х антиген связывается и нарушает активность р53 тумор-супрессор гена.
HBV индуцирует развитие ГЦК также путем поддержания хронической некровоспалительной реакции в печени [3, 5, 9]. В данном случае опухолевая трансформация возникает в результате многократного повтора циклов некроза и регенерации гепатоцитов. Избыточная стимуляция деления
17

Лекции и обзоры |
5, 2007 |
Рис. 2. Вирусный мелкоузловой цирроз печени (вирус гепатита В). Регенераторный узел окружен фиброзными прослойками (септами) с густой лимфогистиоцитарной инфильтрацией. Окраска гематоксилином и эозином. Увеличение ×200
клеток печени ведет к накоплению спонтанных мутаций (играет роль тумор-промотора) и в то же время повышает восприимчивость ДНК клеток к факторам внешней среды. Активная репликация вирусной ДНК напрямую стимулирует злокачественную трансформацию, увеличивая вероятность включения вирусных генов в локусы, где расположены клеточные проонкогены и гены туморсупрессоров или их регуляторные механизмы, нарушая тем самым стабильность генома гепатоцита. Для развития опухоли в результате хронического воспаления, вызванного HBV, необходим временной интервал в 20–30 лет [5, 36].
Темпы прогрессирования хронической инфекции HBV до стадии распространенного фиброза, цирроза и ГЦК зависят от множества факторов: спектра вирусных маркеров, состояния иммунной системы, возраста, пола, генетической предрасположенности больного и т. д. [1, 4, 7]. Факторы, влияющие на риск развития ГЦК у носителей HBV: мужской пол, возраст пациента к моменту инфицирования, длительность течения инфекции, принадлежность к азиатской или африканской расе, наличие цирроза, семейный анамнез по ГЦК, контакт с афлотоксином, злоупотребление алкоголем, курение, коинфекция вирусами гепатитов С и D, наличие HBeAg, высокая вирусная нагрузка HBV-DNA (>100 000 копий/мл), гено-
типы вируса HBV/С2/Се [15, 36].
Риск развития ГЦК выше у больных с высоким уровнем репликации HBV, показателем которого служит HBeAg. В ранее выполненных исследованиях установлено, что количество HBeAg уменьшается по мере прогрессирования заболевания печени – от стадии хронического гепатита через цирроз к ГЦК. Результаты исследований «слу- чай–контроль», проведенных недавно, показали высокую частоту обнаружения HBeAg и HBsAg
у больных с ГЦК. Тайванские ученые изучали влияние уровня репликации HBV на риск возникновения ГЦК. В исследование было включено 11 893 мужчин, за которыми велось наблюдение
втечение 5–8 лет. Частота ГЦК на 10 000 человек в год составила: 1169 – среди пациентов, положительных по HBsAg и HBeAg, 324 – для положительных только по HBsAg и 39 – для отрицательных по HBsAg. Риск развития ГЦК для мужчин, положительных по HBsAg, оценен
в9,6% (95% СI 6,0–15,2%), а для мужчин, положительных по HBsAg и HBeAg, – в 60% (95% СI 23,5–102,1%) [38].
Появление у больных с HBV антител (Ат) к HBsAg и HBeAg (сероконверсия) на фоне лечения или без него считается одним из хороших клинических признаков, говорящих о высокой вероятности разрешения инфекции. Результаты мета-анализа 12 исследований, в которые включены 1187 пациентов, получавших лечение интерфероном, и 665 составивших группу контроля, за которыми велось наблюдение в течение 5 лет, показали более низкую (0,9%) частоту развития ГЦК в группе лечившихся (95% СI 0,8–0,3%). Соответствующий показатель в группе контроля составил 3,2% (95% CI 1,8–4,5%). Разница стати-
стически недостоверна [28, 29, 34].
ГЦК редко развивается у реконвалесцентов после перенесенной HBV-инфекции. По данным R.P. Beasly и соавт. [11], частота возникнове-
ния ГЦК в год существенно ниже у больных,
укоторых был получен клиренс HВsAg-5 на 100 000 случаев, тогда как у HBsAg положительных больных этот показатель составил 495 на 100 000 пациентов. Даже при отсутствии HBsAg
убольных в течение нескольких лет в сыворотке крови определялась HBV-DNA, а при повторных биопсиях печени установлено наличие гистологической активности гепатита. Если пациенты отвечают на лечение интерфероном-α клиренсом HBeAg, то они имеют более благоприятный пятилетний прогноз, чем те, у кого этот антиген сохраняется. В данной группе темпы прогрессирования фиброза и цирроза минимальные, но сохраняется риск развития ГЦК [1, 5, 12].
Возможности современных методик полиме-
разной цепной реакции (ПЦР) – ампликор и реального времени – позволили диагностировать персистенцию вируса HBV («оккультная HBVинфекция») у больных, у которых была достигнута HBsAg сероконверсия. Положительный результат ПЦР определялся у пациентов с наличием Ат к HBcor Ag и/или Ат к HBsAg, а также
убольных в отсутствие этих антител. Повторные биопсии печени выявили гистологическую активность гепатита и фиброз печени у 5–11% обследуемых данной группы. Из указанной выше работы сделан вывод, что развитие ГЦК возможно у пациентов с сочетанной HCV/HBV-инфекцией,
18

5, 2007 |
Лекции и обзоры |
|
|
Рис. 3. Хронический вирусный гепатит С. Порто-пор- тальная фиброзная септа со значительной лимфогистиоцитарной инфильтрацией. Выраженный фиброз с нарушением долькового строения печени (3-я стадия фиброза). Окраска гематоксилином и эозином. Увеличение ×200
при наличии маркеров активности HCV и отсутствии признаков репликации HBV. В то же время по результатам ПЦР в ткани печени (в опухолевых клетках и гепатоцитах) выявлена репликация HBV. У 52% коинфицированных больных обнаружена HBV-DNA при отсутствии HBsAg и наличии репликации HCV [17].
В эндемичных по HBV регионах тотальная вакцинация новорожденных от гепатита В привела к резкому снижению числа случаев возникновения ГЦК. Например, с введением обязательной вакцинации от гепатита В на Тайване частота выявления HBsAg у детей уменьшилась с 10 до 1%, а развития ГЦК снизилась на 37% [12].
HCV. Хроническая инфекция вирусом гепатита С – один из основных этиологических факторов ГЦК. В Европе у большинства пациентов с ГКЦ обнаруживаются различные маркеры HCV с такой частотой: в Италии – 44–66%, во Франции
– 25–58%, в Испании – 60–75%. У большей части пациентов методом ПЦР в ткани печени выявляется вирусная РНК несмотря на отсутствие Ат к HCV в сыворотке крови. Результаты мета-анализа 21 исследования «случай–кон- троль», в которых с целью обнаружения Ат использован иммуноферментный анализ II поко ления, показали, что риск ГЦК в 17 раз выше
усеропозитивных больных, чем в группе, где антитела к HCV не были найдены (95% CI 14– 22%) [18]. Определение частоты развития ГЦК
уHCV-инфицированных пациентов затрудняется отсутствием исследований с длительным периодом наблюдения. Большинство авторов считают, что этот показатель составляет 1–3% в год при длительности инфицирования в 30 лет, что на порядок выше частоты заболеваемости в популяции.
HCV участвует в патогенезе ГЦК, стимулируя
развитие фиброза и цирроза печени (рис. 3). У этой группы больных опухоль развивается через несколько десятилетий анамнеза HCV-инфекции, а риск ее появления возрастает многократно у пациентов с выраженным фиброзом и циррозом. Длительный латентный период отражает время, необходимое для формирования распространенного фиброза и цирроза [5, 6]. Выявляется HCV как в сыворотке крови, так и в ткани и опухолевых клетках печени. Это РНК-содержащий вирус, и он не интегрируется в геном гепатоцита хозяина, т. е. не обладает прямым мутагенным действием. По обобщенным данным 21 контролированного исследования, опубликованным в
период с 1980 по 2001 г., |
сроки развития ЦП |
у HCV-инфицированных |
пациентов составили |
13–23 года, а формирования ГЦК – 17–31 год
[5, 6, 14, 17].
Путь инфицирования HCV представляется независимым фактором, определяющим частоту развития ЦП и ГЦК. Для пациентов, инфицированных компонентами крови, она составила соответственно 14 и 1 случай на 1000 больных в год. Через 25 лет после заражения частота ЦП достигает 3–35%, а ГЦК – 0–13% [23]. На сроки развития цирроза и ГЦК в большей степени влияют факторы хозяина и окружающей среды, а не характеристики самого вируса (генотип, количество и т. д.). В числе таких факторов: возраст пациента на момент инфицирования и длительность заражения, мужской пол, злоупотребление алкоголем (>50 мл/день), коинфекция вирусами HBV и HCV, инфицирование зараженными компонентами крови, сопутствующий сахарный диабет и ожирение [19].
Коинфекция вирусами В и С. Результаты мета-анализа 32 исследований «случай–контроль» показали значительное возрастание риска развития ГЦК у коинфицированных больных. У HCVинфицированных он оценен в 17%, у HBV-носи-
телей – в 23%, а в группе HBV/HCV – 165% (95% CI 81–374%) [19].
Современные возможности вторичной профилактики вирус-индуцированной ГЦК
Лекарственная профилактика опухолей сводится к использованию препаратов естественного или синтетического происхождения с целью предупреждения, остановки и обратного развития опухолевой прогрессии на стадии предрака. Выделяют три основных направления профилактики:
–первичная – предотвращение возможности воздействия этиологических факторов ГЦК у здоровых лиц группы риска;
–вторичная – проводится пациентам с предопухолевыми заболеваниями (в данном случае с выраженным фиброзом и циррозом печени);
19

Лекции и обзоры |
5, 2007 |
– третичная – назначается больным, леченным по поводу ранних стадий опухоли с целью предупреждения рецидива.
Ниже будут освещены современные принципы и препараты для вторичной профилактики ГЦК.
Интерферонотерапия больных HCV-индуцированным циррозом печени
В клинической практике доказано, что длительная супрессия репликации вируса уменьшает активность регенерации гепатоцитов и, таким образом, снижает риск развития дисплазии и рака печени [5, 10]. В 1995 г. были опубликованы первые результаты рандомизированного, контролированного исследования, продемонстрировавшие уменьшение частоты ГЦК у больных, леченных по поводу HCV-индуцированного цирроза печени [19]. В последующий период проведено большое количество исследований с участием ретроспективно подобранных пациентов. Работы выполнены на небольшом, гетерогенном по своему составу контингенте больных. По результатам этих работ сформулировано несколько принципиальных вопросов, требующих дальнейшего изучения.
1.Как степень тяжести цирроза влияет на профилактическую эффективность интерферонотерапии?
2.Обязательно ли достижение вирусологического ответа на лечение для уменьшения риска ГЦК?
3.Каковы механизмы противоопухолевого действия интерферона на стадии выраженного фиброза и цирроза печени?
Для ответа на эти вопросы проведены три рандомизированных, контролированных исследования и 17 контролированных исследований без рандомизации, в которые вошли 4659 пациентов. Назначение интерферонотерапии привело к уменьшению частоты ГЦК по результатам всех 20 исследований (в 13 из них снижение частоты ГЦК было статистически значимым). Популяционный анализ подтвердил эффективность назначения интерферона с целью профилактики развития ГЦК: разница шансов (RD) – 12,2% (95% CI – 8,4–16,1%; р<0,00001) [14].
Основной недостаток проведенных исследований – неоднозначность критериев оценки влияния интерферонотерапии на риск возникновения ГЦК. Очень вариабельны данные о частоте развития ГЦК без лечения – от 6,8 до 73%. По сведениям T. Suou и соавт. (обследовано 162 пациента
сHCV-индуцированным циррозом) интерферонотерапия не повлияла на риск развития ГЦК [35], тогда как, по наблюдениям S. Nishiguchi (обследовано 90 больных), применение интерферона уменьшило этот риск с 73% в группе контроля
до 26% у леченных больных [32]. RD по результатам двух исследований составила от –33,3 до +3,9%, что не смогло обеспечить проведение популяционного анализа. Перечисленные недостатки и невозможность статистической обработки данных традиционными методами потребовали применения методики регрессионного анализа, что позволило выявить достоверную разницу шансов в двух сравниваемых группах (леченных/не леченных больных): RD – 19,1% (95% CI 13,1–25,2%; p<0,00001) [14].
Интерферонотерапия больных HBV-индуцированным циррозом печени
В80-е годы прошлого века начато использование интерферона как противовирусного препарата у больных с хронической HBV-инфекцией.
Влитературе опубликованы материалы большого количества рандомизированных, контролированных и когортных исследований, оценивающих эффективность интерферона у таких больных. Основная часть исследований выполнена у пациентов с хроническим гепатитом В без выраженного фиброза и цирроза печени. Короткие сроки наблюдения за больными в этих работах не позволяют оценить влияние интерферонотерапии на долгосрочный прогноз и исходы заболевания (формирование цирроза, ГЦК, показатели смертности) [25, 26]. Изучение данной проблемы осложняется и отсутствием новых проспективных исследований с участием пациентов, ранее не получавших интерферон, что связано с длительным и широким применением препарата уже более 30 лет.
Анализируя методы и дизайн проведенных исследований, можно систематизировать их в две группы: 1) контролированные исследования; 2) когортные исследования.
Контролированные исследования. Частота ГЦК у больных HBV-индуцированным циррозом печени изучалась в 11 протоколах, в которые вошли 2560 пациентов. Во всех исследованиях было отмечено снижение частоты развития ГЦК у леченных больных (в 3 из них получены статистически значимые отличия). Результаты популяционного анализа убедительно продемонстрировали профилактическую эффективность интерфе-
рона: RD – 4,1% (95% CI – 0,8–7%, p<0,013).
Недостатком работ была значительная неоднородность групп исследования (χ2 39,12; кумулятивное распределение – DF 10; p=0,0001). После дополнительной рандомизации больных (по расовому признаку) выявлено отсутствие влияния интерферонотерапии на частоту развития ГЦК у лиц европейской расы [14].
В2007 г. опубликованы результаты исследования S.M. Lin и соавт. В протокол включе-
20
