
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (35)
.pdf
Российский
журнал
гастроэнтерологии,
гепатологии,
колопроктологии
№ 2 • Том 16 • 2006
Учредитель:
Российская
гастроэнтерологическая
ассоциация
Издатель:
ООО «Издательский дом «М-Вести»
E-mail: rm-vesti@mtu-net.ru
Периодичность издания:
1 раз в 2 месяца
Тираж: 3000 экз.
Подписной индекс: 73538
Журнал зарегистрирован Комитетом РФ по печати 15.12.1994 г.
(Регистрационный № 013128)
Информация о журнале
находится в Интернете на сайте www.m-vesti.ru
Адрес:
119992, Москва, ул. Погодинская, д. 1, стр. 1
Кафедра пропедевтики внутренних болезней Московской медицинской академии, «Российский журнал гастроэнтерологии, гепатологии, колопроктологии»
Телефон: (495)248-38-23 (E-mail:good.day@ru.net)
Журнал входит в Перечень ведущих научных журналов и изданий ВАК Минобразования России, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученой степени доктора наук
Перепечатка материалов только с разрешения главного редактора и издателя
Ответственность за достоверность рекламных публикаций несут рекламодатели
© Российский журнал гастроэнтерологии, гепатологии, колопроктологии
Состав редакционной коллегии и редакционного совета журнала
Главный редактор: |
|
Editor-in-chief: |
|
В.Т.Ивашкин |
|
V.T.Ivashkin |
|
Исполнительный директор проекта: |
Production Manager: |
|
|
Г.Г.Пискунов |
|
G.G.Piskunov |
|
Ответственный секретарь: |
Editorial Manager: |
|
|
Т.Л.Лапина |
|
T.L.Lapina |
|
(E-mail: good.day@ru.net) |
(E-mail: good.day@ru.net) |
||
Редакционная коллегия: |
Editorial board: |
|
|
Е.К.Баранская |
|
Ye.K.Baranskaya |
|
А.О. Буеверов |
|
A.O. Bueverov |
|
С.А.Булгаков |
|
S.A.Bulgakov |
|
П.С.Ветшев |
|
P.S.Vetshev |
|
Г.И.Воробьев |
|
G.I.Vorobiev |
|
А.В.Калинин |
|
A.V.Kalinin |
|
(зам. главного редактора) |
(deputy editor-in-chief) |
|
|
З.А.Лемешко |
|
Z.A.Lemeshko |
|
А.Ф.Логинов |
|
A.F.Loginov |
|
И.В.Маев |
|
I.V.Mayev |
|
М.В.Маевская |
|
M.V.Mayevskaya |
|
Ю.М.Панцырев |
|
Yu.M.Pantsyrev |
|
Л.М.Портной |
|
L.M.Portnoy |
|
С.И.Рапопорт |
|
S.I.Rapoport |
|
В.В.Серов |
|
V.V.Serov |
|
Ю.В.Тельных |
|
Yu.V.Tel’nykh |
|
А.С.Трухманов |
|
A.S.Troukhmanov |
|
А.И.Хазанов |
|
A.I.Khazanov |
|
С.А.Чернякевич |
|
S.A.Chernyakevich |
|
А.А.Шептулин |
|
A.A.Sheptulin |
|
(зам. главного редактора) |
(deputy editor-in-chief) |
|
|
Редакционный совет: |
|
Editorial council: |
|
С.А.Алексеенко |
Хабаровск |
S.А.Alexeyenko |
Khabarovsk |
В.М.Арутюнян |
Ереван |
V.M.Arutyunyan |
Yerevan |
О.Я.Бабак |
Харьков |
O.Ya.Babak |
Kharkov |
Э.И.Белобородова |
Томск |
E.I.Byeloborodova |
Tomsk |
Э.Г.Григорян |
Ереван |
E.G.Grigoryan |
Yerevan |
А.К.Ерамишанцев |
Москва |
A.K.Yeramishantsev |
Moscow |
Е.И.Зайцева |
Смоленск |
Ye.I.Zaytseva |
Smolensk |
А.Р.Златкина |
Москва |
A.R.Zlatkina |
Moscow |
Г.Ф.Коротько |
Краснодар |
G.F.Korot’ko |
Krasnodar |
С.А.Курилович |
Новосибирск |
S.A.Kurilovich |
Novosibirsk |
В.А.Максимов |
Москва |
V.A.Maximov |
Moscow |
С.Н.Маммаев |
Махачкала |
S.N.Mammaev |
Machachkala |
Ю.Х.Мараховский |
Минск |
Yu.Kh.Marakhovsky |
Minsk |
Г.А.Минасян |
Ереван |
G.A.Minasyan |
Yerevan |
О.Н.Минушкин |
Москва |
O.N.Minushkin |
Moscow |
И.А.Морозов |
Москва |
I.A.Morozov |
Moscow |
Ю.Г.Мухина |
Москва |
Yu.G.Mukhina |
Moscow |
А.И.Пальцев |
Новосибирск |
A.I.Pal'tsev |
Novosibirsk |
Л.К.Пархоменко |
Харьков |
L.K.Parkhomenko |
Kharkov |
В.Д.Пасечников |
Ставрополь |
V.D.Pasyechnikov |
Stavropol |
С.Д.Подымова |
Москва |
S.D.Podymova |
Moscow |
Г.В.Римарчук |
Москва |
G.V.Rimarchuk |
Moscow |
В.И.Симоненко |
Санкт-Петербург |
V.I.Simonenko |
Saint-Petersburg |
А.В.Ткачев |
Ростов-на-Дону |
A.V.Tkachev |
Rostov-on-Don |
Е.Д.Федоров |
Москва |
Ye.D.Fedorov |
Moscow |
И.Л.Халиф |
Москва |
I.L.Khalif |
Moscow |
Г.В.Цодиков |
Москва |
G.V.Tsodikov |
Moscow |
А.В.Шапошников |
Ростов-на-Дону |
A.V.Shaposhnikov |
Rostov-on-Don |

С о д е р ж а н и е
Лекции и обзоры
Буеверов А.О., Грязин А.Е.
Клинические аспекты изучения апоптоза при хронических вирусных гепатитах . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .4
Оригинальные исследования
Хазанов А.И.
Итоги длительного изучения (1946–2005) этиологии циррозов печени у стационарных больных . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .11
Бобров А.Н., Павлов А.И., Плюснин С.В., Плюснина И.Ю., Хазанов А.И.
Этиологический профиль циррозов печени с летальным исходом у стационарных больных . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .19
Маевская М.В.
Клинические особенности тяжелых форм алкогольной болезни печени.
Роль вирусов гепатитов В и С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .25
Карпов С.Ю., Крель П.Е., Некрасова Т.Н.
Клиническая характеристика и особенности течения хронического гепатита С низкой степени активности . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .39
Павлов А.И., Хазанов А.И., Плюснин С.В., Васильев А.П., Скворцов С.В., Бобров А.Н.
Гепатоцеллюлярная карцинома и этиология фоновых заболеваний печени . . . . . . . . . .45
Хорошилов С.Е., Гранкин В.И.. Скворцов С.В., Пономарев С.В., Кудряшов С.К., Хазанов А.И.
Лечение острой печеночной и печеночно-почечной недостаточности
с применением альбуминового диализа на аппарате MARS . . . . . . . . . . . . . . . . . . . .49
Новости колопроктологии |
|
Богуш Т.А., Гришанина А.Н., Богуш Е.А., Калганов И.Д., |
|
Жученко А.П., Барышников А.Ю. |
|
Влияние АВС-транспортеров на противоопухолевую |
|
терапию рака толстой кишки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
55 |
Обмен опытом |
|
Портной Л.М., Казанцева И.А., Мазурин В.С., Вятчанин О.В., Степанова Е.А., Назарова Е.Н., Гаганов Л.Е.
О роли традиционной рентгенологии в дифференциальной диагностике рака пищевода . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .63
Ивашкин В.Т., Степанов Е.В., Баранская Е.К, Лапшин А.В. |
|
Лазерный 13С-уреазный дыхательный тест в оценке результатов |
|
терапии H. pylori-ассоциированных заболеваний . . . . . . . . . . . . . . . . . . . . . . . . . . |
79 |
Климушева Т.А., Шифрин О.С., Галимова С.Ф. |
|
Психические нарушения у больных хроническими панкреатитами . . . . . . . . . . . . . . . |
84 |
Информация
Шептулин А.А., Киприанис В.А.
Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт-3»
(По материалам Всемирного конгресса гастроэнтерологов в Монреале и Европейской недели гастроэнтерологов в Копенгагене) . . . . . . . . . . . . . . . . . . . . . . . .88
2

С о n t e n t s
The lectures and reviews
Buyeverov A.O., Gryazin A.Ye.
Clinical aspects of apoptosis at chronic viral hepatites . . . . . . . . . . . . . . . . . . . . . . . . .4
Original investigations
Khazanov A.I.
Results of long-term (1946–2005) studying of liver cirrhoses
etiology at inpatients . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .11
Bobrov А.N., Pavlov A.I., Plyusnin S.V., Plyusnina I.Yu., Khazanov A.I.
Etiological profile of liver cirrhoses with lethal
outcome at inpatients . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .19
Mayevskaya M.V.
Clinical features of severe forms of alcoholic liver disease.
Role of hepatitis viruses B and C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .25
Karpov S.Yu., Krel P.Ye., Nekrasova T.N.
The clinical presentation and features of course of chronic viral hepatitis C
with low degree of activity . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .39
Pavlov A.I., Khazanov A.I., Plyusnin S.V., Vasiliev A.P., Skvortsov S.V., Bobrov A.N.
Hepatocellular carcinoma and etiology of background liver diseases . . . . . . . . . . . . . . . . .45
Khoroshilov S.Ye., Grankin V.I., Skvortsov S.V., Ponomarev S.V., Kudryashov S.K., Khazanov A.I.
Treatment of acute hepatic and hepatorenal failure by albumin
dialysis with MARS device . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .49
News of coloproctology |
|
Bogush T.A., Grishanina A.N., Bogush Ye.A., Kalganov I.D., |
|
Zhuchenko A.P., Baryshnikov A.Yu. |
|
Effect of АВС-conveyors on antineoplastic therapy of colorectal cancer . . . . . . . . . . . . . . |
55 |
Exchange of experience |
|
Portnoy L.M., Kazantseva I.A., Mazurin V.S., Vyatchanin O.V., Stepanova Ye.A., Nazarova Ye.N., Gaganov L.Ye.
The role of traditional roentgenology in differential diagnostics
of esophageal cancer . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .63
Ivashkin V.T., Stepanov E.V., Baranskaya E.K., Lapshin A.V.
Laser 13С-urease breath test in assessment of H.pylori-associated
diseases therapy results . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .79
Klimusheva T.A., Shifrin O.S., Galimova S.F. |
|
Psychological disorders in patients with chronic pancreatitis . . . . . . . . . . . . . . . . . . . . |
.84 |
Information
Sheptulin A.A., Kiprianis V.A.
Diagnostics and treatment of Helicobacter pylori infection: original positions of the «Maastricht-3» consensus meeting
(On proceedings of the World congress of gastroenterology in Montreal
and the European gastroenterology week in Copenhagen) . . . . . . . . . . . . . . . . . . . . . . . . . .88
3

Лекции и обзоры
УДК [616.36 002.12:578.891] 092
Клинические аспекты изучения апоптоза при хронических вирусных гепатитах
А.О. Буеверов, А.Е. Грязин
(Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Московской медицинской академии им. И.М. Сеченова)
В статье приводятся данные литературы и результаты собственных исследований по апоптозу гепатоцитов, лимфоцитов воспалительного инфильтрата и мононуклеаров периферической крови (МПК) при хронических гепатитах В и С. Продемонстрировано значение изучения апоптоза раз" личных клеточных популяций для понимания тонких механизмов взаимодействия инфицирован" ных гепатоцитов и воспалительных клеток. Показана возможность применения метода проточной цитофлуориметрии с целью оценки динамики апоптоза МПК как прогностического фактора отве" та на противовирусную терапию хронического гепатита С.
Ключевые слова: хронические вирусные гепатиты, мононуклеары периферической кро" ви, гепатоциты, апоптоз.
На клеточном уровне постоянно протекающие деление и рост должны сопровождаться альтернативным процессом удаления
рудиментарных клеток в эмбриональном периоде, а на протяжении всей жизни – старых, поврежденных, мутировавших клеток, а также клеток с измененными антигенными свойствами. Высокорегулируемую форму программированного уничтожения клетки с характерными морфологическими и биохимическими признаками определяют как апоптоз (греческое слово, соответствующее листопаду: apo – отделение, ptosis – падение).
Апоптозу принадлежит важнейшая роль в регуляции как физиологических, так и патологических процессов [1, 2, 14, 17, 20, 22]. И подавление,
инеадекватное усиление апоптоза ведет к патологическим изменениям органов и тканей. В то время как избыточная активация апоптоза, наблюдаемая, в частности, при инфицировании клеток печени гепатотропными вирусами, обусловливает разрушение печеночной ткани, ослабление апоптотической гибели клеток (вызванное, к примеру, мутацией гена, кодирующего проапоптогенный белок р53) служит одним из ведущих факторов канцерогенеза.
При гепатите наиболее важным диагностическим
ипрогностическим признаком считается некроз паренхимы печени, который, однако, значительно отличается от типичных признаков омертвения, наблюдаемых морфологом в других органах. Прежде всего в ткани печени отсутствуют некротизиро-
ванные гепатоциты, а видны лишь участки печеночной дольки, замещенные мононуклеарными инфильтратами. Вторая особенность – отсутствие по- лиморфно-ядерных лейкоцитов (за исключением острого алкогольного гепатита) – стереотипной реакции на некроз во всех тканях. Следовательно, в большинстве случаев хронического поражения печени, в том числе при инфекции гепатотропными вирусами, основным механизмом гибели клеток является апоптоз. За много лет до открытия апоптоза был описан характерный гистологический признак вирусного гепатита – округлые гомогенные эозинофильные образования, часто содержащие пикнотичное ядро. Эти образования, названные тельцами Каунсильмена, представляют собой ни что иное, как гепатоциты в состоянии апоптоза [2]. Кардинальные отличия апоптоза от некроза приведены в таблице.
Роль апоптоза в патогенезе хронического гепатита С
Недостаточная изученность многих аспектов патогенеза хронических вирусных гепатитов, особенно хронического гепатита С (ХГС) во многом сказывается на решении таких важнейших медицинских задач, как создание вакцины, определение прогноза естественного течения болезни, раннее прогнозирование успеха противовирусной терапии и, наконец, разработка новых препаратов этиотропного и патогенетического действия. Установле-
4

|
|
|
|
|
|
|
|
Лекции и обзоры |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные характеристики апоптоза и некроза |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Апоптоз |
|
Некроз |
|
|
|
|
Физиологический или патологический |
Только патологический |
|
|
|
||||||
Регулируемый процесс |
Нерегулируемый или слабо регулируемый процесс |
|
||||||||
Плазматическая мембрана интактна до поздней стадии |
Плазматическая мембрана разрушается |
|
|
|||||||
|
|
|
|
|
|
в начальной стадии |
|
|
|
|
Инфильтрация полиморфно-ядерными лейкоцитами |
Лейкоцитарная инфильтрация присутствует |
|
||||||||
отсутствует или минимальна |
в большинстве случаев |
|
|
|
||||||
Kариопикноз, кариорексис, фрагментация ДНК |
Набухание (онкоз) цитоплазмы и митохондрий |
|
||||||||
Образование апоптозных телец с последующим их |
Разрушение и дезинтеграция клетки |
|
|
|||||||
фагоцитозом или вторичным некрозом |
|
|
|
|
|
|||||
но, что вирус гепатита С (HCV) обусловливает |
зы 8, которая содержит N-конец Fas-ассоцииро- |
|||||||||
преимущественно иммуноопосредованное повреж- |
ванного белка с доменом смерти (FADD) и осуще- |
|||||||||
дение клеток печени, формирование воспалитель- |
ствляет связь рецепторов с эффекторными каспа- |
|||||||||
ного инфильтрата и фибротические изменения |
зами [1]. Второй путь апоптоза запускается вы- |
|||||||||
печени, ведущие у 20% пациентов к развитию цир- |
свобождением |
цитохрома |
C из |
митохондрий. |
||||||
роза. По современным представлениям, среди ме- |
В цитоплазме цитохром С связывается с белком |
|||||||||
ханизмов повреждения гепатоцитов при ХГС суще- |
Apaf-1, формируя комплекс, который связывается |
|||||||||
ственная роль отводится апоптозу [2, 7, 18]. |
с каспазой 9 и инициирует ее активацию. В даль- |
|||||||||
Апоптоз представляет собой основной путь |
нейшем второй путь повторяет первый, так как ка- |
|||||||||
уничтожения инфицированных вирусом клеток |
спаза 9 активирует эффекторные каспазы, как бы- |
|||||||||
цитотоксическими Т-лимфоцитами (ЦТЛ). В ЦТЛ- |
ло описано ранее [23]. |
|
|
|
||||||
опосредованном апоптозе можно выделить 5 клю- |
Апоптозу принадлежит ключевая роль в регу- |
|||||||||
чевых этапов: 1) распознавание антигена на по- |
ляции лимфоцитарного пула на стадиях созрева- |
|||||||||
верхности клетки-мишени ЦТЛ и его конъюгация |
ния и активации. Выраженность экспрессии генов |
|||||||||
с клеткой-мишенью; 2) активация ЦТЛ; 3) запуск |
B-клеточной лимфомы/лейкемии-2 (Bcl-2) или |
|||||||||
апоптоза при помощи комплекса Fas/FasL либо |
Bcl-xL находится в обратной корреляционной за- |
|||||||||
гранзим-перфоринового пути; 4) отсоединение |
висимости с чувствительностью клеток к апопто- |
|||||||||
ЦТЛ; 5) гибель клетки-мишени путем осмотическо- |
зу. Усиленная экпрессия Bcl-2 или Bcl-xL приво- |
|||||||||
го лизиса и апоптоза. |
дит к увеличению продолжительности жизни |
|||||||||
Передача апоптотического сигнала осуществ- |
созревающих лимфоцитов и усилению иммунного |
|||||||||
ляется посредством каскадной активации каспаз |
ответа. Напротив, снижение экспрессии этих ге- |
|||||||||
(относятся к семейству протеаз), подобно каскаду |
нов ведет к сокращению жизни как созревающих, |
|||||||||
реакций коагуляции, и приводит к расщеплению |
так и зрелых лимфоцитов. В отличие от Bcl-2 |
|||||||||
клеточных структур. ЦТЛ-опосредованный апо- |
и Bcl-xL усиление экспрессии белка Bax активи- |
|||||||||
птоз инициируется активацией «рецепторов смер- |
рует апоптоз. |
|
|
|
|
|||||
ти», которые запускают механизм клеточной ги- |
Результаты |
иммуногистохимических исследо- |
||||||||
бели посредством каспазного каскада. Вначале |
ваний показали, что на поверхности Т-лимфоци- |
|||||||||
активируются каспазы 8 и 10, на следующих эта- |
тов, формирующих воспалительный инфильтрат |
|||||||||
пах – каспазы 3, 6 и 9, обозначающиеся как эф- |
в печени при ХГС, увеличена экспрессия Fas-ли- |
|||||||||
фекторные ввиду их непосредственного участия |
ганда (FasL). Секретируемый FasL, высвобожда- |
|||||||||
в уничтожении клетки. Установлено наличие |
емый из активированных Т-лимфоцитов, может |
|||||||||
двух путей активации эффекторных каспаз – |
служить апоптотическим сигналом для гепатоци- |
|||||||||
внешнего и внутреннего. Первый, к которому от- |
тов, несущих на своей поверхности Fas-рецептор. |
|||||||||
носится ЦТЛ-опосредованный апоптоз, обуслов- |
У больных ХГС выявлено усиление Fas-опосредо- |
|||||||||
лен активацией «рецепторов смерти», второй – |
ванного апоптоза гепатоцитов, при этом экспрес- |
|||||||||
дисфункцией митохондрий [10, 23]. |
сия FasL нарастает параллельно прогрессирова- |
|||||||||
Выявлены восемь рецепторов, вовлеченных во |
нию заболевания [13]. Лимфоциты, инфильтри- |
|||||||||
внешний путь, из которых наиболее изучен рецеп- |
рующие печень, распознают присутствие вирус- |
|||||||||
тор фактора некроза опухоли-α 1-го типа (TNF-R1) |
ных антигенов |
на гепатоцитах, |
активируются |
|||||||
и рецептор Fas (CD95/APO-1). Fas, он же APO-1 |
и экспрессируют FasL на |
своей |
поверхности. |
|||||||
или CD95, относится к мембранным белкам I типа |
С другой стороны, инфицированные гепатоциты |
|||||||||
(молекулярная масса от 42 до 50 кДа, 325 амино- |
усиливают экспрессию рецепторов Fas и повыша- |
|||||||||
кислот). Взаимодействие TNF-α и Fas с соответст- |
ют чувствительность к Fas-опосредованному |
|||||||||
вующими рецепторами ведет к активации каспа- |
апоптозу [9, 25]. |
|
|
|
||||||
5
Лекции и обзоры |
|
|
|
Высвобождение гранзима В |
ЦТЛ |
|
|
и перфорина |
|
|
|
|
|
|
|
|
ТCR |
FasL |
|
HCV антиген |
MHC |
|
|
|
|
||
|
|
|
|
|
|
Fas"рецептор |
Cyt C |
|
|
«Комплекс смерти» |
|
Проникновение гранзима В |
Активация каспазы 8 |
|
|
Расщепление прокаспаз |
|
|
|
|
|
Активация Bid |
|
|
|
|
Bcl"2 |
|
Каскад каспаз (3, 6, 7) |
Bcl"XL |
|
|
|
||
|
|
|
Apaf"1 |
|
|
|
Активация каспазы 9 |
Гепатоцит |
|
АПОПТОЗ |
|
|
|
|
|
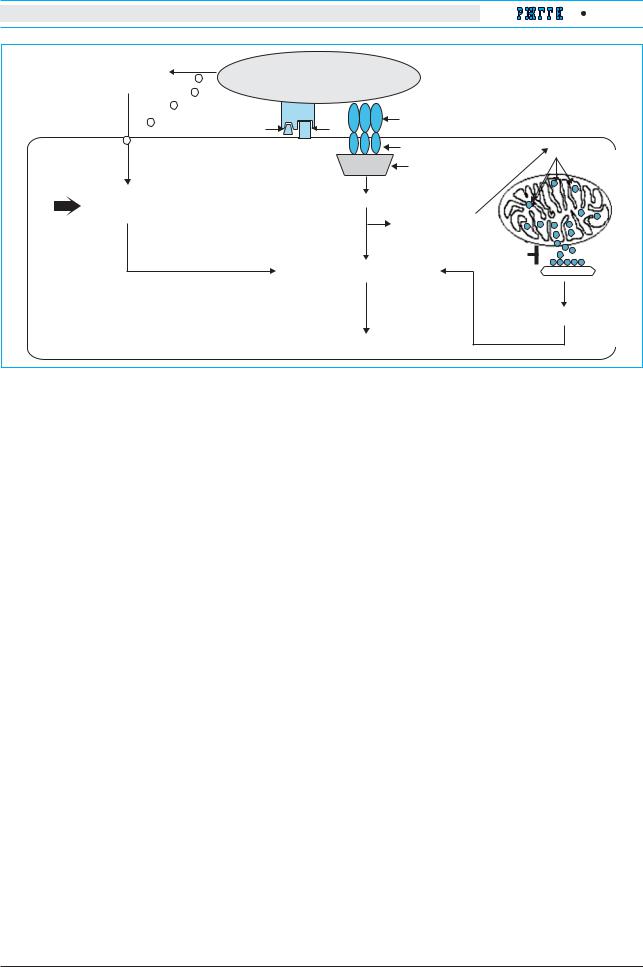
Апоптоз инфицированного вирусом гепатита С гепатоцита, опосредованный цитотоксическим Т лимфоцитом. |
|||
Активированный ЦТЛ распознает белки вируса при помощи Т клеточного рецептора (TCR) главного комплек |
|||
са гистосовместимости (MHC). Связывание Fas лиганда с Fas рецептором на поверхности инфицированного |
|||
гепатоцита приводит к формированию комплекса, активирующего каспазу 8 и запускающего каскад каспаз, |
|||
приводящий к апоптозу. Кроме того, каспаза 8 может активировать белок Bid, что приводит к высвобожде |
|||
нию цитохрома С (Cyt C) из митохондрий. Высвобождение цитохрома С может быть блокировано белками |
|||
семейства Bcl или усилено белками семейства Bax. Цитохром С затем может связываться с белком Apaf 1 |
|||
иактивировать его, что приводит к активации каспазы 9, которая также запускает каскад каспаз. После рас познания ТCR вирусного белка ЦТЛ может продуцировать цитотоксические гранулы, содержащие гранзим В
иперфорин. Поглощение гранзима В гепатоцитом осуществляется с помощью созданных перфорином пор
в мембране. Гранзим В расщепляет прокаспазы, что также приводит к развитию апоптоза
Активация иммуноопосредованного апоптоза при ХГС подтверждается, кроме того, данными
о |
повышении |
уровня перфорина/гранзима В |
у |
пациентов с |
циррозом печени в исходе ХГС |
в отличие от цирроза, вызванного невоспалительными заболеваниями, а также в отсутствие поражения печени [18]. В периферической крови спонтанный апоптоз Т-лимфоцитов у пациентов, инфицированных HCV, также значительно повышен относительно здоровых лиц [8, 26].
Core-протеин HCV, хотя и является структурным компонентом вируса, может выполнять регуляторную функцию, усиливая или ингибируя апоптоз. В ряде исследований установлено, что этот белок выполняет как проапоптогенную, так и антиапоптогенную роль в зависимости от экспериментальных условий и типа используемых клеток, в то время как белки NS3 и NS5А проявляют только антиапоптотический эффект [7, 9]. Модуляция апоптоза может включать в себя внутриклеточное связывание core-протеина с рецепторами TNF, Fas или лимфотоксина β или замещение собой сигнальных молекул, таких как TNF-рецеп- тор-ассоциированный фактор-2 (TRAF-2) или TNF-рецептор-ассоциированный домен смерти (TRADD). Было доказано, что core-протеин
может ингибировать или активировать транскрипционный фактор NFkB, а также модулировать чувствительность гепатоцита к действию цитокинов. При этом одни авторы отметили усиление такой чувствительности, а другие – ее снижение или отсутствие существенных изменений [7]. Кроме того, последние исследования показали, что coreпротеин взаимодействует in vitro и ингибирует РНК-зависимую протеинкиназу (PKR), которая также вовлечена в процесс апоптоза. Таким образом, белок HCV может модулировать апоптоз гепатоцитов при помощи прямых и непрямых механизмов (см. рисунок).
Принятая в настоящее время концепция механизмов иммунного ответа также показывает, что секреция таких цитокинов, как интерферон-γ (IFN-γ), TNF-α и интерлейкин-12 (IL-12) ведет к активации Т-хелперов 1-го типа, которые осуществляют противовирусное действие (Th1-ответ). С другой стороны, секреция IL-10 обеспечивает стимуляцию гуморального звена иммунитета (Th2-ответ), что, возможно, играет определенную роль в регуляции апоптотических процессов [12].
Какую информацию может дать клиницисту изучение апоптоза при хронических вирусных гепатитах? Во-первых, исследование процессов, веду-
6

Лекции и обзоры
щих к апоптозу клеток печени, дает возможность понять причины хронизации и прогрессирования воспаления печени и, что не менее важно, механизмы злокачественной трансформации и противоопухолевой защиты. Во-вторых, изучение апоптоза позволяет разрабатывать новые методы терапии, в частности, уменьшающие избыточную гибель гепатоцитов. Одним из направлений в этой области может служить разработка ингибиторов так называемых проксимальных каспаз (2, 8, 10). В-третьих, применение методов экспресс-оценки апоптоза быстро обновляющихся популяций клеток помогает прогнозировать ответ на противовирусное лечение. Ниже приводятся результаты выполненных нами исследований, иллюстрирующие возможности практической разработки указанных направлений.
Система Fas–FasL при хронических гепатитах В и С
Как отмечалось ранее, внешний путь апоптоза начинается с лиганд-рецепторного взаимодействия. Представление о функционировании рецепторов клеточной гибели служит теоретической базой для разработки оптимальной стратегии патогенетического лечения различных заболеваний, в том числе вирусных гепатитов.
Данные литературы свидетельствуют, что при вирусном гепатите апоптоз может быть как результатом прямого воздействия вируса, так и опосредован иммунной реакцией. Запуск процессов апоптоза при проникновении в гепатоцит вируса следует рассматривать как своего рода защитный механизм, поскольку в мертвой клетке репликация вируса становится невозможной. Поэтому «в интересах» вируса – подавить апоптоз и сохранить клетки жизнеспособными. И действительно, некоторые кодируемые вирусами белки обладают антиапоптозной активностью, которая осуществляется подавлением функции проапоптогенного (и противоопухолевого!) белка р53, инактивацией каспаз, а также усиленной экспрессией мощного ингибитора апоптоза Bcl-2 [14, 24, 25]. Интересно, что в норме Bcl-2 обнаружен в печени только в эпителии желчных протоков, постоянно контактирующих с желчью, но не в гепатоцитах [2]. О связи экспрессии Fas и последующего апоптоза с действием вируса гепатита С свидетельствует и то, что после успешного лечения α-интерфероном количество Fas-положительных клеток резко уменьшается и коррелирует как со снижением активности трансаминаз, так и с уменьшением выраженности портальной и лобулярной лимфоидной инфильтрации ткани печени [26].
Результаты собственных исследований указывают на значительные различия в реализации механизмов уничтожения инфицированных вирусом гепатоцитов при хронических гепатитах В и С. При ХГС степень экспрессии Fas и FasL лимфо-
цитами воспалительного инфильтрата достоверно превышала таковую при ХГВ: 2,3±0,2 по сравнению с 0,9±0,2 для Fas и 2,5±0,2 по сравнению с 1,1±0,3 для FasL соответственно. Средний индекс TUNEL-положительных гепатоцитов, т. е. гепатоцитов в состоянии апоптоза, в биоптатах печени составил 32±7,1%, что достоверно превышает количество таковых при ХГВ (7,6±4,3%, р=0,01) и коррелирует с уровнем экспрессии FasL клетками лимфоидного инфильтрата [5, 6].
Полученные данные подтверждают ведущую роль клеточного Fas-опосредованного иммунного ответа организма на антигены вирусов гепатитов В и С в повреждении гепатоцитов. Обнаружено, что при ХГВ даже обширный воспалительный инфильтрат содержит мало лимфоцитов, экспрессирующих FasL, поэтому ЦТЛ практически «безоружны» в окружении инфицированных вирусом клеток. При ХГС активированные Т-лимфоциты обладают мощным цитотоксическим потенциалом в виде высокого уровня экспрессии FasL для уничтожения инфицированных гепатоцитов, экспрессирующих белок Fas. Принципиальных различий в степени экспрессии Fas гепатоцитами
убольных обеих групп выявлено не было. Важно подчеркнуть, что при хронических ви-
русных гепатитах сами лимфоциты становятся объектом цитотоксического действия собственного FasL или FasL гепатоцитов. Это подтверждается как экспрессией FasL на гепатоцитах, так и экспрессией Fas на ЦТЛ, достоверно более высокой при ХГС по сравнению с ХГВ [5].
Апоптоз мононуклеаров периферической крови при хронических гепатитах В и С
Являясь универсальным биологическим механизмом, апоптоз при вирусных гепатитах может приводить к избыточной гибели не только гепатоцитов, но и других клеточных популяций, отражая либо системный иммуновоспалительный ответ на инфекцию, либо внепеченочную персистенцию вируса. В связи с этим определенный интерес представляют наши исследования апоптоза периферических лейкоцитов при хроническом гепатите [4]. У больных хроническими гепатитами В и С и у здоровых доноров определялось количество лимфоцитов и гранулоцитов периферической крови в состоянии апоптоза непосредственно после выделения и после 24-часовой инкубации в культуральной среде методом проточной цитофлуориметрии, а также повреждение ДНК по скорости щелочной денатурации [11].
Было показано, что апоптоз как лимфоцитов, так и гранулоцитов достоверно выше у больных хроническим вирусным гепатитом по сравнению с контролем как непосредственно после выделения, так и после суточной инкубации. Более ин-
7

Лекции и обзоры
тенсивный переход клеток в апоптоз наблюдался в подгруппе больных гепатитом С, хотя здесь следует учитывать роль разного количества пациентов в подгруппах (12 – с гепатитом В, 22 – с гепатитом С). Выявлена также корреляция между степенью повреждения ДНК лимфоцитов и гранулоцитов и накоплением клеток в состоянии апоптоза после инкубации [4]. Помимо этого, после суточной инкубации количество лейкоцитов обеих популяций в апоптозе достоверно коррелировало с сывороточной концентрацией TNF-α, что подтверждается литературными данными [13].
Полученные результаты свидетельствуют об усилении программированной гибели клеток периферической крови у больных хроническим вирусным гепатитом, что может отражать как повреждающее действие гепатотропных вирусов на лейкоциты (или их костномозговые предшественники), так и влияние системного действия провоcпалительных цитокинов. Косвенным подтверждением последнего механизма служит корреляция интенсивности апоптоза с сывороточным уровнем TNF-α – цитокина с наиболее выраженным проапоптогенным эффектом.
Апоптоз мононуклеаров периферической крови и ответ на противовирусное лечение при хроническом гепатите С
Нельзя игнорировать значительные успехи в борьбе с HCV-инфекцией, которыми ознаменовалось минувшее десятилетие. Введение в схемы противовирусного лечения рибавирина позволило увеличить долю больных с устойчивым вирусологическим ответом до 40–60% по сравнению с 15–20% при монотерапии интерфероном-α. Комбинированная терапия пегилированными интерферонами и рибавирином приводит к устойчивому ответу в среднем у 62% пациентов, а среди инфицированных «благоприятными» генотипами 2 и 3 – у 76–91%. Между тем значительное количество больных, резистентных к противовирусным препаратам, и высокая стоимость лечения побуждают к поиску новых критериев промежуточного контроля за эффективностью проводимой терапии. В настоящее время таким критерием служит весьма дорогостоящее количественное определение HCV РНК в сыворотке крови («вирусной нагрузки») на 4-й и 12-й неделе.
Для проведенного нами исследования [3] были отобраны следующие группы пациентов: больные ХГС – 29 человек, больные вирусно-алкогольным гепатитом – ХВАГ (ХГС и алкоголь) – 25 человек и контрольная группа (здоровые доноры) – 20 человек. У всех пациентов в сыворотке выявлялись повышенные уровни активности аланиновой и аспарагиновой трансаминаз (АлАТ, АсАТ) анти-HCV иммуноферментным методом и HCV
РНК методом полимеразной цепной реакции (ПЦР). В группу ХВАГ вошли пациенты с наличием всех вышеперечисленных критериев включения и употреблявших алкоголь в дозе более 80 г этанола в день на протяжении не менее 5 лет. Гистологическая характеристика биоптатов печени предусматривала определение индекса гистологической активности и индекса фиброза по Knodell.
Все пациенты получали комбинированную противовирусную терапию (интерферон α2a + рибавирин) в стандартных рекомендованных дозах: 3 MU 3 раза в неделю + 1000–1200 мг/сут соответственно. Определение апоптоза МПК и сывороточной концентрации цитокинов (TNF-α, IFN-γ, IL-10, IL-12) проводили до лечения и через 2 и 24 нед после его начала. Количественное определение сывороточной концентрации HCV РНК
методом ПЦР |
выполнялось исходно и |
спустя |
|
2 нед с момента начала лечения. |
|
|
|
До начала |
терапии уровень |
апоптоза |
МПК |
был достоверно выше у больных ХГС по сравнению с таковым в контрольной группе: 4,7±1,5 против 0,81±0,5%, р<0,05. Аналогичный результат получен в группе ХВАГ: уровень апоптоза МПК составил 2,9±1,9%. Достоверных различий между группами ХГС и ХВАГ не выявлено, однако имела место тенденция к несколько меньшему уровню апоптоза в группе вирусно-алкогольного гепатита. При определении концентрации цитокинов в сыворотке крови достоверное отличие от группы контроля (p<0,05) получено для IFN-γ и TNF-α в обеих группах больных. Различие между группами ХГС и ХВАГ было недостоверным.
У 29 пациентов (53,7%) 24-недельная комбинированная противовирусная терапия привела к элиминации HCV РНК. В этой группе наблюдалось усиление апоптоза МПК, более выраженное в группе ХГС по сравнению с больными ХВАГ (8,9 против 3,6%, p<0,05). В группе пациентов с ХГС, ответивших на лечение, отмечена корреляция снижения уровня вирусной нагрузки с усилением апоптоза через 2 нед комбинированной терапии. В группе ХВАГ подобной корреляции не выявлено. У пациентов, не ответивших на комбинированную терапию, достоверного усиления апоптоза в ответ на лечение зафиксировать не удалось.
С практической точки зрения исследование апоптоза МПК предпочтительнее, чем гепатоцитов, по крайней мере, по двум причинам: 1) методика значительно более простая и дешевая; 2) позволяет многократно оценивать изменения количества клеток в состоянии апоптоза в динамике, в том числе на фоне противовирусной терапии.
Достоверно более высокие показатели апоптоза МПК при ХГС по сравнению со здоровыми донорами относятся к разряду ожидаемых и соответствующих полученным в ранее проведенных исследованиях. На роль одного из основных про-
8

Лекции и обзоры
апоптогенных факторов – TNF-α – в гибели МПК указывает сильная прямая корреляция его сывороточной концентрации с числом клеток в состоянии апоптоза, что подтверждает результаты предыдущего исследования. Можно предположить, что апоптоз МПК при ХГС осуществляется преимущественно по внешнему пути, через связывание TNF-α с TNF-рецептором и последующей активацией каспазы 8.
Отсутствие значимых различий в уровнях апоптоза МПК при ХГС и ХВАГ не уменьшает роль алкоголя в качестве фактора прогрессирования ХГС и в определенной степени объясняется достаточно длительной абстиненцией большинства пациентов с ХВАГ на момент забора крови. Тенденция к меньшему уровню апоптоза МПК в группе ХВАГ может быть связана с иммуносупрессивным действием алкоголя, хотя известно, что апоптоз гепатоцитов занимает значимое место в патогенезе алкогольного поражения печени [17, 19, 21]. Более высокие сывороточные уровни TNF-α и IFN-γ у больных как ХГС, так и ХВАГ определяют ведущую роль этих цитокинов в патогенезе системного воспалительного ответа при хроническом гепатите [12, 26]. Оба цитокина характеризуются множественностью источников продукции и клеток-мишеней биологических эффектов. Четко определено, что TNF-α играет роль в апоптозе различных клеток, в том числе инфицированных HCV гепатоцитов, тогда как IFN-γ способствует противовирусной защите организма посредством активации клеточных иммунных реакций.
С позиции клинической практики наиболее важным из полученных результатов представляется усиление апоптоза МПК у больных ХГС с первичным вирусологическим ответом на комбинированную противовирусную терапию интерфероном-α и рибавирином. Относительно низкий уровень первичного ответа (53,7%) обусловлен превалированием пациентов, инфицированных 1-м генотипом HCV, и 24-недельной продолжительностью лечения к моменту оценки результатов вне зависи-
Список литературы
1.Аббасова С.Г., Липкин В.М., Трапезников Н.Н., Кушлинский Н.Е. Система FAS–FASL в норме и патологии // Вопр. биол., мед., фарм. химии. – 1999. – № 3. – С. 3–17.
2.Аруин Л.И. Апоптоз и патология печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 1998.
– Т. 8, № 2. – С. 6–10.
3.Буеверов А.О., Грязин А.Е., Ивашкин В.Т., Шептулин А.А. Апоптоз мононуклеаров периферической крови и оценка эффективности противовирусной терапии хронического гепатита С // Клин. мед. – 2006. – № 9.
4.Буеверов А.О., Тихонина Е.В., Москалева Е.Ю. и
др. Апоптоз периферических лейкоцитов при хронических вирусных гепатитах // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2000. – Т. 10, № 6. – С. 30–33.
мости от генотипа. Более того, корреляция снижения вирусной нагрузки с нарастанием уровня апоптоза через 2 нед терапии наблюдалась только в группе больных ХГС, ответивших на лечение.
Как было сказано выше, в настоящее время общепринятым прогностическим критерием устойчивого ответа на противовирусную терапию служит определение вирусной нагрузки на 4-й и 12-й неделе от ее начала. Необходимо заметить, что по сравнению с последней стоимость оценки апоптоза МПК методом проточной цитофлуориметрии приблизительно в 10 раз дешевле. Безусловно, полученные нами данные не диктуют необходимость кардинального изменения подходов к прогнозированию успеха терапии HCV-инфек- ции. Вместе с тем определение апоптоза МПК на 2-й неделе может рассматриваться как полезный и недорогой дополнительный метод ранней оценки эффективности противовирусного лечения.
Следует подчеркнуть важность тщательного сбора алкогольного анамнеза у больных ХГС. Сочетание хронической HCV-инфекции и алкогольной болезни печени не только взаимно отягощает течение гепатита, но и характеризуется отсутствием корреляции между уменьшением концентрации сывороточной HCV РНК и нарастанием уровня апоптоза МПК. Соответственно у данной категории пациентов оценка апоптоза МПК не может служить критерием ответа на противовирусную терапию.
Приведенные результаты научных исследований представляют собой лишь небольшую часть накопленных на сегодняшний день фактов, позиционирующих как роль апоптоза в патогенезе хронических вирусных гепатитов, так и возможности изучения его динамики для оценки эффективности этиотропного лечения. Можно констатировать, что апоптоз – это не только «модное» направление теоретической биохимии. Изучение этого важнейшего биологического процесса имеет вполне определенное прикладное значение, в том числе для гепатологии.
5.Дмитриева Е.В., Москалева Е.Ю., Буеверов А.О. и
др. Апоптоз клеток лимфоцитарного инфильтрата и клеток печени при хронических вирусных гепатитах // Успехи клинической иммунологии и аллергологии. – Т. 3 / Под ред. А.В. Караулова. – М., 2002. – С. 14–33.
6.Дмитриева Е.В., Москалева Е.Ю., Буеверов А.О. и
др. Роль системы Fas/Fas-лиганд в индукции апоптоза гепатоцитов при хронических вирусных гепатитах // Арх. патол. – 2003. – Т. 65, № 6. – С. 13–16.
7.Bantel H., Lugering A., Poremba C. et al. Caspase activation correlates with the degree of inflammatory liver injury in chronic hepatitis C virus infection // Hepatology. – 2001. – Vol. 34. – P. 758–767.
8.Botarelli P., Brunetto M.R., Minutello M.A. et al. T-cell response to hepatitis C virus in different clinical courses of infection // Gastroenterology. – 1993. – Vol. 194. – P. 580–587.
9

Лекции и обзоры
9.Calabrese F., Pontiso P., Perrenazzo E. et al. Liver cell apoptosis in chronic hepatitis C correlates with histological but not biochemical activity or serum HCV-RNA levels // Hepatology. – 2000. – Vol. 31. – P. 1153–1159.
10.Cohen G.M. Caspases: the executioners of apoptosis // Biochem. J. – 1997. – Vol. 326. – P. 1–16.
11.Darzynkiewicz Z., Bedner E. Analysis of apoptotic cells by flow and laser scanning cytometry // Methods Enzymol. – 2000. – Vol. 322. – P. 18–39.
12.Fan X.G., Liu W.E., Li C.Z. et al. Circulating Th1 and Th2 cytokines in patients with hepatitis C virus infection // Mediators Inflamm. – 1998. – Vol. 7. – P. 295–297.
13.Faubion W.A., Gores G.J. Death receptors in liver biology and pathobiology // Hepatology. – 1999. – Vol. 29. – P. 1–4.
14.Hayashi N., Mita E. Fas system and apoptosis in viral hepatitis // J. Gastroenterol. Hepatol. – 1997. – Vol. 12. – P. 223–226.
15.Jarmay K., Karacsony G., Ozsvar Z. et al. Assessment of histological features in chronic hepatitis C //
Hepatogastroenterology. – 2002. – Vol. 49. –
P. 239–243.
16.Kato N., Yoshida H., Ono-Nita S.K. et al. Activation of intracellular signaling by hepatitis B and C viruses: C- viral core is the most potent signal inducer // Hepatology. – 2000. – Vol. 32. – P. 405–412.
17.Kawahara H., Matsuda Y., Takase S. Is apoptosis involved in alcoholic hepatitis? // Alcohol. Alcohol. – 1994. – Vol. 29 (suppl. 1). – Р. 113–118.
18.Kountouras J., Chatzopoulos D., Zavos C. Apoptosis in
hepatitis C // J. Viral Hepatitis. – 2003. – Vol. 10. –
P.335–342.
19.Kurose I., Higushi H., Miura S. et al. Oxidative stressmediated apoptosis of hepatocytes exposed to acute ethanol intoxication // Hepatology. – 1997. – Vol. 25. – Р. 368–378.
20.Lau J.Y.N., Xie X., Lai M.M.C. et al. Apoptosis and viral hepatitis // Semin. Liver Dis. – 1998. – Vol. 18. –
P.169–176.
21.Natozi S., Rust C., Stadheim L.M. et al. Hepatocyte apoptosis is a pathologic feature of human alcoholic hepatitis // J. Hepatol. –2001. – Vol. 34. – P. 248–253.
22.Patel T., Gores G.J., Steer C.J. Apoptosis and the liver: a mechanism of disease, growth regulation, and carcino-
genesis // Hepatology. – 1999. – Vol. 30. –
P.811–815.
23.Rust C., Gores G.J. Apoptosis and liver disease // Am.
J.Med. – 2000. – Vol. 108. – P. 567–574.
24.Sprinzl M.F., Rosset S., Male F.-F. et al. Chronic viral infections causes an apoptosis resistant hepatocellular phenotype by induction of regeneration factors of the liver // Hepatology. – 2005. – Vol. 42, N 4 (suppl. 1). – 503 p.
25.Su F., Schneider R.J. Hepatitis B virus HBx protein sensitizes cells to apoptotic killing by tumor necrosis factor alpha // Proc. Natl. Acad. Sci. USA. – 1997. – Vol. 94. – P. 8744–8749.
26.Toubi E., Kessel A., Goldstein L. et al. Enhanced peripheral T-cell apoptosis in chronic hepatitis C virus
infection: association with liver disease severity // J. Hepatol. – 2001. – Vol. 35. – P. 774–780.
Clinical aspects of apoptosis at chronic viral hepatites
A.O. Buyeverov, A.Ye. Gryazin
The article presents the literature data and original results on apoptosis of hepa" tocytes, lymphocytes of inflammatory infiltrate and peripheral blood mononuclear cells at chronic hepatites B and C.
Value of studying of various cell populations apoptosis for understanding of fine mechanisms of infected hepatocytes and inflammatory cells interaction is shown. The option of flowing cytofluorimetry application for evaluation of apoptosis of peripheral mononuclear cells dynamics as a prognostic factor of the response to antiviral therapy of chronic hepatitis C is demonstrated.
Key words: chronic viral hepatites, mononuclear cells of peripheral blood, hepatocytes, apoptosis.
10
