
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (7)
.pdf
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нения, но в меньшей степени, выражены |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Таблица 4. Распределение форм толстой кишки |
|
|
||||||||||||||||
|
|
|
у М-формы органа. |
|
|
|
|
||||||||||||
|
в зависимости от возраста больных, % |
|
|
Результаты |
наших |
исследований сви- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
детельствуют о том, что М-форма тол- |
|||||||
|
Возрастной период |
|
|
Форма толстой кишки |
|
|
|
стой кишки встречается практически у |
|||||||||||
|
|
|
Л |
П |
|
М |
|
|
|
всех людей старческого возраста и у дол- |
|||||||||
|
II зрелый возраст, n=24 |
|
33,3 |
33,3 |
|
33,3 |
|
|
|
гожителей независимо от пола. Она по- |
|||||||||
|
Пожилой возраст, n=21 |
|
– |
40,0 |
|
60,0 |
|
|
|
степенно завершает |
переход от других |
||||||||
|
Старики, n=13 |
|
– |
– |
|
100,0 |
|
|
|
форм с увеличением возраста. Увеличи- |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
вается ширина кишки в слепом и восхо- |
|||||||
органа. В основном веществе определяется повы- |
|
|
|
|
|
дящем отделах (слепая кишка достигает |
|||||||||||||
|
9,2±0,5 см, восходящяя – 6,0±0,7 см, поперечная |
||||||||||||||||||
шенное содержание ГАГ (4–5 баллов) и низкое – |
|
ободочная – 4,8±0,6 см). Одновременно снижа- |
|||||||||||||||||
ГП (2–3 балла). |
|
|
|
|
|
ется толщина стенки и оболочек органа. Сниже- |
|||||||||||||
|
Начиная с пожилого возраста и продолжая у |
|
ние толщины стенки достигает максимальных |
||||||||||||||||
долгожителей выявлена тенденция к изменению |
|
значений у стариков и долгожителей. |
|||||||||||||||||
относительных размеров толстой кишки в сторо- |
|
У людей старческого возраста (табл. 5) в се- |
|||||||||||||||||
ну М-формы. К этому периоду (табл. 4) исчеза- |
|
розной |
оболочке пучки соединительнотканных |
||||||||||||||||
ют П- и Л-формы толстой кишки. |
|
|
|
волокон неравномерно окрашиваются пикрофук- |
|||||||||||||||
|
М-форма толстой кишки становится доминиру- |
|
сином, утолщены, дезориентированы и лежат |
||||||||||||||||
ющей и определяется у лиц с грушевидной фор- |
|
рыхло. Часть коллагеновых пучков распадается |
|||||||||||||||||
мой живота с основанием, расширенным вниз. |
|
на отдельные фрагменты и разволокняется. Ин- |
|||||||||||||||||
Наши данные согласуются с работами других ав- |
|
тервал между ними увеличивается. Однако тол- |
|||||||||||||||||
торов [2, 3, 7]. |
|
|
|
|
|
щина пучков остается прежней – 38,3±5,4 мкм. |
|||||||||||||
|
Так, у людей с П-формой органа в пожилом |
|
В этот период количество фибробластов сни- |
||||||||||||||||
возрасте уменьшаются в 1,3–1,5 раза размеры и |
|
жается до 2,1±1,6%, объем волокнистых структур |
|||||||||||||||||
на 10–15% снижается объем гладкомышечных |
|
значительно увеличивается. В мышечном слое |
|||||||||||||||||
клеток. Одновременно на 15–20% повышается |
|
снижается объем гладкомышечных клеток до |
|||||||||||||||||
объем и в 2 раза возрастает диаметр коллагено- |
|
40,9±2,2%, уменьшается их диаметр до 2,5 мкм. |
|||||||||||||||||
вых и ретикулярных волокон, что свидетельству- |
|
Параллельно с этим возрастает интервал между |
|||||||||||||||||
ет о глубоких дистрофических изменениях их |
|
ними, а промежутки заполняются жировой |
|||||||||||||||||
структуры и их «старении». Аналогичные изме- |
|
тканью. |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|||||||||||||||||
|
Таблица 5. Соотношение элементов СТО и гладкомышечных клеток в отделах толстой кишки |
|
|
||||||||||||||||
|
у людей старческого возраста, n = 13 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Kоличественные |
|
|
|
|
|
|
|
|
|
Kишка |
|
|
|
|
|
|
||
|
показатели |
|
|
слепая |
|
поперечная ободочная |
|
сигмовидная ободочная |
|
|
|
||||||||
|
Серозная оболочка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kоллагеновые волокна |
|
|
62,1±2,2 |
|
|
|
|
|
|
61,5±1,9 |
|
|
64,3±2,1 |
|
|
|
||
|
Эластические волокна |
|
|
20,8±1,4 |
|
|
|
|
|
|
16,4±1,5 |
|
|
22,0±1,9 |
|
|
|
||
|
Фибробласты |
|
|
3,6±1,1 |
|
|
|
|
|
|
2,4±0,7 |
|
|
3,1±1,1 |
|
|
|
||
|
Основное вещество |
|
|
12,3±2,0 |
|
|
|
|
|
|
20,6±2,5 |
|
|
14,3±1,2 |
|
|
|
||
|
Продольный мышечный слой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ретикулярные волокна |
|
|
30,1±1,4 |
|
|
|
|
|
|
24,1±1,8 |
|
|
31,1±1,7 |
|
|
|
||
|
Эластические волокна |
|
|
10,9±1,4 |
|
|
|
|
|
|
6,6±1,7 |
|
|
10,4±1,3 |
|
|
|
||
|
Гладкомышечные клетки |
|
|
43,2±2,1 |
|
|
|
|
|
|
42,9±1,5 |
|
|
46,2±2,2 |
|
|
|
||
|
Основное вещество |
|
|
16,6±2,4 |
|
|
|
|
|
|
25,9±2,3 |
|
|
12,6±2,4 |
|
|
|
||
|
Циркулярный мышечный слой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Ретикулярные волокна |
|
|
32,6±1,7 |
|
|
|
|
|
|
23,9±1,8 |
|
|
33,9±1,9 |
|
|
|
||
|
Эластические волокна |
|
|
10,9±1,4 |
|
|
|
|
|
|
7,5±1,2 |
|
|
9,4±1,3 |
|
|
|
||
|
Гладкомышечные клетки |
|
|
44,8±1,9 |
|
|
|
|
|
|
40,8±2,1 |
|
|
46,4±2,0 |
|
|
|
||
|
Основное вещество |
|
|
12,1±1,1 |
|
|
|
|
|
|
26,1±1,6 |
|
|
9,1±1,3 |
|
|
|
||
|
Подслизистая оболочка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kоллагеновые волокна |
|
|
61,2±2,1 |
|
|
|
|
|
|
59,8±1,9 |
|
|
62,4±2,1 |
|
|
|
||
|
Эластические волокна |
|
|
21,7±1,7 |
|
|
|
|
|
|
14,4±1,5 |
|
|
20,9±2,2 |
|
|
|
||
|
Фибробласты |
|
|
3,7±2,2 |
|
|
|
|
|
|
2,8±0,9 |
|
|
3,1±1,9 |
|
|
|
||
|
Основное вещество |
|
|
13,8±2,3 |
|
|
|
|
|
|
23,2±2,1 |
|
|
12,9±2,4 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
|
|
3/2001 |
51 |

В основном веществе определяются повышенная концентрация ГАГ (4–5 баллов) и пониженное содержание ГП (2–3 балла). В СТО и гладкой мускулатуре долгожителей более выраженно нарастают дегенераторные процессы.
Таким образом, на основе проведенных исследований можно сделать выводы, что с увеличением возраста, независимо от пола людей, в толстой кишке происходят инволюционные морфологические изменения. Они характеризуются количественным возрастанием удельного веса числа лиц с М-формой органа.
При М-форме толстой кишки отмечаются ее максимальная длина и значительное расширение всех отделов, истончение стенки, изменение соотношения гладкомышечных и соединительнотканных элементов (с возрастанием числа послед-
них), нарастание дистрофических изменений как в гладкомышечных клетках (снижение диаметра до 2,5 мкм), так и волокнистых структур, коллагеновых и эластических волокон (увеличение диаметра, дезориентация, дезорганизация, увеличение количества «старых» форм коллагена с увеличением количества ГАГ в основном веществе) и накопление жировых капель в межклеточном веществе.
Результаты статистической обработки данных у лиц II зрелого, пожилого и старческого возрастов подтверждают достоверность указанных изменений. Это свидетельствует об имеющейся морфологической основе развития колостаза у лиц пожилого возраста. Вероятно, что пропульсивная функция толстой кишки во многом определяется именно такими изменениями.
Список литературы
1.Воробьев Г.И., Саламов К.Н., Минц Я.В. Хирургическое лечение аномалий развития интрамуральных нервных сплетений толстой кишки // Хирургия. – 1991. – № 4. – С. 22–25.
2.Горбунов Н.С. Морфофункциональные закономерности взаимоотношения передней брюшной стенки и внутренних органов: Автореф. дис. ...
д-ра мед. наук. – Новосибирск,1999. – 41 с.
3.Жуков В.М. Формы живота у взрослых людей разного возраста // Вопросы клинической анатомии: Материалы науч. конф. – Краснодар, 1971. – С. 68–70.
4.Крякунов К.Н., Карпов О.И. Лечение хронических запоров // С.-Петербург. врач. ведомости.
– 1993. – № 4. – С. 48–56.
5.Куприянов П.А. О положении поперечно-ободоч- ной кишки // Сб. науч. тр. в честь 50-летия проф. А.Ф. Нечаева. – Пг, 1922. – С. 395–398.
6.Наврузов С.И. Классификация хронических колостазов и их лечение // Хирургия. – 1987. – № 3. – С. 55–57.
7.Романова П.А. Клиническая анатомия вариантов и аномалий толстой кишки. – М.: Медицина, 1987. – 187 с.
8.Фролькис А.В. Запор и его лечение // Клин. мед. – 1979. – Т. 57, № 3. – С. 112–117.
9.Herari D., Gureitz J.H., Minoket K.L. Constipation in the elderly // J. Amer. Geriat. Soc. – 1993. – Vol. 41, № 10. – P. 1130–1140.
10.Meier-Ruge W. Epidemiology of congenital innervation defects of the distal colon // Virch. Arch. Abt. A. Path. Anat. Histopath. – 1992. – Vol. 420, № 2. – P. 171–177.
11.M ller-Lissner S.A. Cisapride in chronic idiopathic constipation: can the colon be reducated. Bavarian constipation study group // Eur. J. Gastroenterol. Hepatol. – 1995. – № 7. – P. 69–73.
12.Stabile G., Kamm M.A., Hawley P.R., LennardJones J.E. Colectomy for idiopathic megarectum and megacolon // Gut. – 1991. – Vol. 32, № 12.
– P. 1538–1540.
FEATURES OF CONNECTIVE TISSUE STROMA AND SMOOTH MUSCLE CONSTITUTION OF LARGE INTESTINE
IN ELDERLY PEOPLE
Sukhorukov A.M., Kirghizov I.V., Gorbunov N.S.
The structure and interrelation of connective tissue and smooth muscle units of the human large intestine wall were investigated at 58 tissue specimens by morphological methods. The specimens were taken at forensic medicine expertise of the persons, died of acute trauma or diseases, not related to large intestine pathology. Age of dead persons was 36 to 90 years. Interrelation between the shape of large intestine and quantitative parameters of the connective tissue stroma and smooth muscle constitution is studied. That is, in elderly and senile age М-shape of large intestine predominates, in which the stromal type of the organ constitution is specific. The detected changes can be used as prognostic criteria for the patients with chronic colic stasis.
Key words: chronic constipation, connective tissue stroma of the large intestine, age peculiarities of the large intestine.
Российский журнал
|
|
гастроэнтерологии, гепатологии, колопроктологии |
52 |
3/2001 |

ПАТОГЕНЕТИЧЕСКАЯ КОРРЕКЦИЯ ПОСТКОЛЭКТОМИЧЕСКИХ РАССТРОЙСТВ СПОСОБОМ РЕЗЕРВУАРНОГО ИЛЕОРЕКТАЛЬНОГО АНАСТОМОЗА
Г.К. Жерлов, А.И. Рыжов, С.Р. Баширов
(Курс хирургических болезней на базе Городской больницы № 2 факультета усовершенствования врачей, кафедра гистологии и эмбриологии Сибирского государственного медицинского университета, г. Томск)
В ходе исследования установлено, что рефлюкс-энтерит является основным этиопатогенетическим фактором, значительно ухудшающим результаты применения тонкокишечных резервуаров после колэктомии и способствующим развитию диареи. Поэтому за основу способа резервуарного илеоректального анастомоза авторы предложили формировать сдерживающий арефлюксный механизм, позволяющий устранить данные осложнения. Результаты экспериментально-клинических исследований свидетельствуют, что резервуарный илеоректальный анастомоз регулирует мотор- но-эвакуаторную функцию кишечного тракта, поддерживает постоянство физических и химических свойств и бактериального состава содержимого резервуара и прямой кишки, необходимых для профилактики постколэктомической диареи.
Ключевые слова: колэктомия, резервуарный илеоректальный анастомоз, колонизация.
Замедление скорости кишечного пассажа после колэктомии остается основополагающим условием компенсации утраченной функции ободочной кишки – калообра-
зования. С этой целью используемые в повседневной практике различные по форме и величине тонкокишечные резервуары в должной мере способствуют этому [1, 5, 7], однако не обеспечивают желаемых функциональных результатов.
По нашему мнению, свободное сообщение тонкокишечного резервуара и прямой кишки является провоцирующим фактором смешивания кала и химуса, различных по химическим, физическим и бактериальным свойствам.
Склонность резервуара к гипотонии и неизбежное ретроградное попадание в него содержимого прямой кишки вызывают бродильные и гнилостные процессы в просвете неприспособленной для этого тонкокишечной конструкции. Поэтому исчезновение в стенке резервуара основной части ворсинок и увеличение числа бокаловидных клеток и крипт, до недавнего времени расцениваемое как приспособительная трансформация слизистой оболочки тонкокишечного резервуара в структуры толстой кишки [2, 4, 7, 8], по нашим данным, есть ничто иное, как следствие изменения кислотно-основного состояния и бактериального состава тонкокишечного содержимого.
Суммарное превосходство секретирующих элементов резервуара (крипты, бокаловидные клетки) над всасывающими (ворсинки) не только не
способствует, а скорее препятствует процессу калообразования, патогенетически обосновывая происхождение постколэктомической диареи. Поэтому вызывает интерес и тот факт, что при формировании илеоректальных анастомозов возникают морфофункциональные изменения терминальной петли подвздошной кишки и (или) резервуара в виде так называемой «колонизации», природа которой пока остается сомнительной.
Между тем рентгенологический феномен «колонизации» тонкой кишки, описываемый некоторыми авторами как адаптивный процесс в виде ее диффузной дилатации с сегментарными спазмами, по неясной причине чаще свойственен «илеоректостомированному» контингенту больных [2, 7]. Тогда как отсутствие субстрата – прямой кишки или ее слизистой оболочки (илеостома, илеоаностомия, илеоректальный анастомоз с демукозированной прямой кишкой), – свободно контактирующего с просветом подвздошной кишки, определяет отсутствие подобных изменений тонкокишечного рельефа [2, 6].
Чем же тогда обусловлено снижение активности адаптации в случае с илеостомой или илеоаностомией?
Подобный приоритет илеоректальному анастомозу в изменениях рельефа терминального отдела подвздошной кишки скорее подтверждает тот факт, что основой процесса адаптации является не компенсаторно-приспособительная реакция, направленная на создание подобия дигестивного
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
|
|
3/2001 |
53 |

резервуара, а патологический процесс – реф- люкс-энтерит.
Таким образом, термин «колонизация» несет в себе несколько иное смысловое значение, в большей мере напоминающее «насильственное заселение суверенной территории». Поэтому данная концепция послужила поводом для пересмотра требований к формированию илеоректальных конструкций и созданию нового типа резервуарного анастомоза.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Вэксперименте на 31 беспородной собаке разработан и применяется в клинике способ резервуарного илеоректального анастомоза со сдерживающим и арефлюксным механизмами [3].
Результаты экспериментального и клинического применения разработанного способа оценивали с помощью лабораторных (клинические, биохимические, копрологические, гистологические)
иинструментальных (рентгенологические, эндоскопические) методов исследования. Морфологическому исследованию подвергнуты 31 макро- и 412 микропрепаратов, приготовленных на основе материала, взятого у оперированных собак через 3, 7, 15, 21, 30, 90, 180, 270 и 365 сут после колэктомии.
Взависимости от целей исследования использовали обычные методы: морфологические (гематоксилин и эозин, по Ван-Гизону) и некоторые нейрогистологические (импрегнация азотнокислым серебром по Бильшовскому–Грос в модификации А.И. Рыжова, окраска толуидиновым синим по методу Ниссля).
Вконтрольную группу вошли 5 собак, у которых методика резервуарного анастомоза отличалась отсутствием сдерживающего и арефлюксного механизмов.
Способ резервуарного илеоректального анастомоза со сдерживающим и арефлюксным механизмами осуществляется следующим образом.
После наложения танталового шва по краям резекции мобилизованной кишки выполняется колэктомия. Культя прямой кишки анастомозируется в конец терминальной петли подвздошной с использованием методики непрерывного подслизистого шва на внутреннем ряде швов анастомоза и узловых на наружном. Серозно-мышечная оболочка подвздошной и прямой кишки циркулярно рассекается по линии резекции до подслизистого слоя. Мышечная оболочка кишки сокращается, оголяя 1 см подслизистого слоя.
На задней полуокружности подвздошной и культи прямой кишки накладываются 5–6 узловых серозно-мышечных швов. Используя обнаженную подслизистую оболочку, восстанавливается непрерывность внутренних слоев обеих кишок подслизистым швом с помощью двух встречных кетгутовых нитей.
Кетгутом 2/0 прошивается подслизистый слой прямой кишки и подвздошной в области одного из углов анастомоза. Нить протягивается наполовину и завязывается. Точно также сшивается противоположный угол анастомоза.
Одной из нитей правого угла анастомоза сшиваются подслизистые слои задней стенки соустья до его середины. Одной из нитей левого угла сшивается другая половина задней губы соустья (в шов берется 2 мм подслизистого слоя с шириной шага 2 мм). Нити слегка стягиваются и завязываются. Выше этого шва на 1–2 мм отсекаются стенки подвздошной и прямой кишки с ранее наложенным герметизирующим танталовым швом. Оставшимися кетгутовыми нитями сшиваются подслизистые слои правой, а затем и левой половины передней полуокружности анастомоза, которая затем перитонизируется 5–6 узловыми серозно-мышечными швами.
Проксимальнее илеоректального анастомоза на 4–5 см формируется инвагинационный клапанжом следующим образом. Пристеночно лигируются 3–4 брыжеечных сосуда. На середине мобилизованного участка кишки циркулярно рассекается серозно-мышечная оболочка. Выше и ниже этого разреза на 15–20 мм производятся еще два разреза серозно-мышечной оболочки кишки. При этом разрез, начинаясь от брыжеечного края и расширяясь, продолжается к противобрыжеечному, описывая фигуру типа эллипса. Накладываются узловые швы на верхний и нижний края се- розно-мышечной оболочки.
Поочередным завязыванием швов и дополнительным погружением стенки кишки диссектором формируется клапан. Затем создается резервуар путем дупликатуры двух антиперистальтических петель подвздошной кишки, сшитых на протяжении 10–12 см. В ходе формирования межкишечного анастомоза используется та же прецизионная техника наложения соустья, что и при создании илеоректального анастомоза.
Для увеличения резервуарных свойств конструкции проводится серозомиотомия приводящей петли тонкокишечной конструкции. На 20– 25-сантиметровом участке приводящей петли резервуара выполняются 5 косых рассечений сероз- но-мышечного слоя кишки с длиной насечек 12–15 мм и расстоянием между последними в 4–5 см, чередующихся в шахматном порядке.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Кардинальный вопрос при изучении последствий колэктомии – воспроизведение калообразующей функции. Благодаря правильно выбранному объему резекции толстой кишки у собак мы получили экспериментальную модель постколэктомической диареи.
Следует отметить, что последствия поноса сведены на нет постепенным улучшением качества
Российский журнал
|
|
гастроэнтерологии, гепатологии, колопроктологии |
54 |
3/2001 |

калообразования при формировании резервуарного илеоректального анастомоза. Так, в ранние сроки постколэктомическая диарея с частотой до 6–9 раз в сутки сменялась кашицеобразными фекалиями в ближайший период, а через 1 год, когда процессы всасывания и скорость транзита уравновесились, испражнения по консистенции напоминали фекалии неоперированных животных.
Основной фон микроскопической картины испражнений собак в ранний, ближайший и отдаленный периоды составлял обильно выделяемый детрит, свидетельствующий об активности пищеварения. Ранняя креаторея с выявлением мышечных волокон цилиндрической формы и слегка сглаженными краями с продольной и слабоизмененной поперечной исчерченностью наблюдалась в течение первого месяца. В последующем процесс протеолиза нормализовался ко 2–3-му месяцу наблюдений.
При микроскопии клетчатки, крахмала и изучении амилолитической микрофлоры процесс пищеварения углеводов отражал не только химическую динамику свойств кала, но и характеризовал скорость транзита по кишечнику. Поэтому, например, содержание крахмала в отдаленный период было меньшим, чем в ближайший и тем более в ранний, когда клинически наблюдалась диарея.
О продолжительности пребывания пищевых веществ в кишечной трубке можно судить по выявлению в копрограмме жира и продуктов его расщепления. Однако по мере нормализации сроков пассажа по кишечнику (4–5 мес) проявления стеатореи были минимальными или вообще отсутствовали.
Наиболее информативными методами, демонстрирующими постоянство тонкокишечной среды резервуара и среды прямой кишки, как следствие разграничительной функции клапана-жома, стали копрологический и микробиологический методы исследования. При этом обнаруживалась константность значения ионной реакции химуса (рН = 8,0), типичная для тонкой кишки, на всем протяжении подвздошной кишки до инвагинационного клапана.
В то же время культя прямой и 2–3 см отводящей кишки до клапана характеризовались чаще слабощелочной (рН = 7,0), а иногда и нейтральной (рН = 6,8) реакциями кишечного содержимого.
Основной фон микроскопической картины копрограмм, выполненных на основе содержимого резервуара, составлял детрит, отображая наиболее полно процесс пищеварения в нем, а характерные химусу приводящей кишки креато-, стеато- и амилорея теряли свое значение после пищеварения в тонкокишечном резервуаре.
Способность резервуарного анастомоза активно препятствовать ускоренному пассажу наглядно отразилась на его калообразующей функции: внешний вид и консистенция кала резервуара
Российский журнал
значительно отличались от последних содержимого приводящей петли, чаще напоминая консистенцию выделенных испражнений.
При микробиологическом исследовании в отдаленный период выявлено преобладание микрофлоры прямой кишки (56,0 106–20,9 106) над микрофлорой тонкокишечного резервуара (12,4 106–6,0 106). Учитывая количественное приближение микроорганизмов терминального отдела подвздошной кишки к составу микрофлоры начального отдела ободочной, можно считать полученную разницу соотношения числа микробных тел следствием надежности арефлюксного клапана.
В то же время в модели илеоректального анастомоза без арефлюксного механизма (контроль) выявлена «колонизация» тонкокишечного резервуара аллохтонной микрофлорой прямой кишки, где количество микроорганизмов достигало 57,3 106, что в 3,2 раза превосходило количество микробов прямой кишки.
Рентгенологическое наблюдение за объемом резервуара позволило с достоверностью оценить изменение резервуарных свойств илеоректальной конструкции, которые имели основополагающее значение в замедлении скорости пассажа в различные сроки после колэктомии.
Так, геометрическое подобие цилиндра и резервуара позволило нам воспользоваться формулой V=π r2 h и установить его гипотонию в ранний послеоперационный период (141,2 см3), появление тонуса в ближайшие сроки (131,5 см3) и одновременно оценить его окончательный объем (307,2 см3) в отдаленный период.
Рентгеноскопически выявлена весомая доля резервуарного илеоректального анастомоза в замедлении транзита бария. Причем в ранние сроки временные параметры составляли 1/2, в ближайшие периоды – 2/3 и в отдаленный период – 5/6 от общей продолжительности пассажа бария.
Контакт контрастного вещества со слизистой оболочкой резервуара пролонгировался за счет сдерживающей функции инвагинационного кла- пана-жома. Периодический спазм клапана в течение 2–3 мин сменялся серией его сокращений с четкой периодичностью и порционной эвакуацией контрастного вещества.
Раскрываясь до 1,5 см в диаметре, просвет клапана беспрепятственно заполнялся барием. При этом формируемая контрастная порция, достигая необходимого объема 1,24–3,40 см3, эвакуировалась только в изоперистальтическом направлении.
Выявленная закономерность моторных свойств 3–4 см отводящей кишки клапана, постоянно провоцирующая к ретроградному перемещению контрастного вещества, совершенно «бесследна» по отношению к вышележащему тонкокишечному резервуару ввиду надежности арефлюксного механизма.
Состояние арефлюксной функции клапана
гастроэнтерологии, гепатологии, колопроктологии |
|
|
3/2001 |
55 |

оценивали с помощью ирригоскопии. При тугом заполнении контрастом культи прямой кишки под давлением 45–50 мм рт. ст. бариевая взвесь распространялась в пределах арефлюксного клапана.
Наиболее полное представление о состоянии моторной функции тонкокишечной конструкции сложилось после применения эндовидеоскопического метода. Результаты оценены по впервые разработанным критериям функциональной состоятельности резервуарного илеоректального анастомоза.
Наиболее важным и информативным критерием стало состояние слизистой оболочки, которое указывало на отсутствие воспалительных изменений в ближайший и отдаленный периоды.
Изучен характер заживления илеоректального и межкишечного анастомозов. Инвагинационный клапан-жом предстал в виде функционально активной зоны, регулирующей процесс опорожнения резервуара. Проведена комплексная оценка перистальтической активности сдерживающего механизма с помощью хронометрии. Выявлена способность клапана к самостоятельному раскрытию просвета и порционной эвакуации кишечного содержимого из проксимальных отделов.
Арефлюксный механизм изучали при повышении давления инсуффляцией воздуха в просвете прямой кишки, провоцировавшего рефлюкс. В ответ на инсуффляцию клапан смыкался вне зависимости от сроков эксперимента. Согласованность перемещения химуса, визуально определимая в виде гармоничной смены волн сокращений приводящей петли перистальтикой резервуара, а последней – соответственно серией сокращений клапана, давала общее представление о моторноэвакуаторной функции илеоректальной конструкции.
Общие черты с гистологическими признаками «колонизации» [7] обнаружены при детальном изучении отводящей петли клапана, анастомозированной в прямую кишку. Неоспоримо, что этот единственный элемент резервуарного анастомоза не защищен арефлюксным клапаном и в то же время подвержен влиянию содержимого культи.
Если патологическая трансформация 3 см участка отводящей петли тонкокишечной конструкции в большей мере не отразится на калообразовании, то значение данного фактора в модели без арефлюксного механизма (контроль) приобретает серьезный и прогрессирующий характер нарушений.
Так, в контрольной серии опытов на фоне значительного укорочения ворсинок резервуара, а иногда их полного отсутствия появляются крипты, по своему строению мало чем отличающиеся от таковых прямой кишки, разве что повышенным содержанием бокаловидных клеток (рис. 1).
Выявленные поверхностно-дистрофические изменения слизистой оболочки (к тому же реакции местного иммунитета и регуляторного звена, ре-
Рис. 1. «Колонизация» слизистой оболочки тонкокишечного резервуара: отдаленные сроки эксперимента. Окраска гематоксилином и эозином, ×400
Рис. 2. Ворсинки слизистой оболочки резервуарного илеоректального анастомоза (отдаленные сроки эксперимента). Окраска гематоксилином и эозином, × 600
активного тканеобразования) не вызывают сомнений о патогенности прямокишечного рефлюкса на структуры «незащищенной» тонкокишечной конструкции. Тем более если слизистая оболочка резервуарного илеоректального анастомоза со сдерживающим арефлюксным механизмом характеризовалась близкими по форме к контролю ворсинками (рис. 2).
Колэктомия и формирование резервуарного илеоректального анастомоза со сдерживающим арефлюксным механизмом выполнены 5 больным. Показанием к выполнению одномоментной реконструктивно-восстановительной операции
Российский журнал
|
|
гастроэнтерологии, гепатологии, колопроктологии |
56 |
3/2001 |
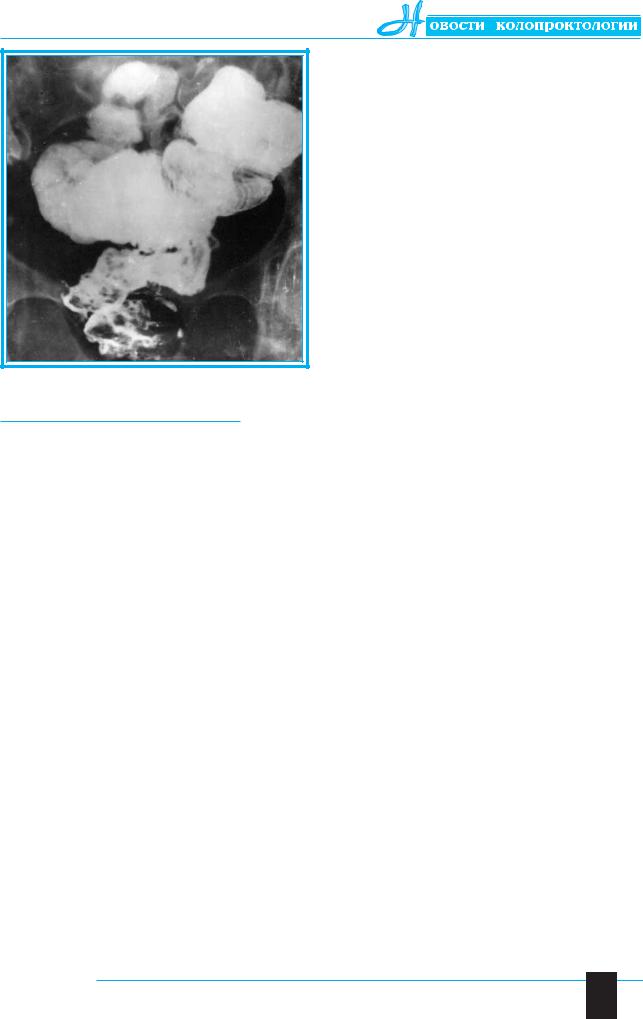
Рис. 3. Резервуарный илеоректальный анастомоз:
2 года после колэктомии. Пассаж бария у больной С. в течение 16 ч 30 мин
стал первично-множественный рак ободочной кишки, в том числе синхронный и метахронный у 3 больных, тотальный дивертикулез (1) и рак ободочной кишки в сочетании с неспецифическим язвенным колитом (1).
Средняя продолжительность жизни в группе «колэктомированных» больных составила 22±6 мес.
Причиной смерти 3 пациентов явилось прогрессирование ракового процесса.
Изучение результатов хирургического лечения показало эффективность резервуарного илеоректального анастомоза в профилактике постколэктомических нарушений. Так, восполнение резервуарной функции желудочно-кишечного тракта и, как следствие этого, 18–20 ч суммарного времени пассажа обусловливались ключевым участием илеоректальной конструкции.
Не менее важным оказалось отсутствие признаков грубой сегментации, дилатации и гипотонии тонкокишечной конструкции (рис. 3). Напротив, резервуар характеризовался своей исключительной моторной функцией, а инвагина-
ционный клапан-жом – способностью к порционной эвакуации.
Даже в случае рецидивирования язвенного колита, охватившего умеренной степенью воспалительного процесса все элементы илеоректальной конструкции больной С., функциональная активность резервуарного анастомоза не пострадала. Инвагинационный клапан-жом на фоне надежной арефлюксной функции не утратил своего сдерживающего эффекта и способности к порционной эвакуации.
Тонкокишечный резервуар отличается активной моторно-эвакуаторной функцией. Вопреки распространенному мнению клиницистов об отрицательной роли илеоректальных анастомозов в оперативном лечении язвенного колита, в нашем наблюдении прослеживается явная тенденция к улучшению функциональных результатов: изначальный 14-кратный стул у больной С. стал реже
– 3–4 раза в сутки, а ночная дефекация вообще прекратилась.
В группе больных с невоспалительными заболеваниями толстой кишки отмечалось раннее восстановление (8–12 мес) процесса калообразования.
ВЫВОДЫ
1.Способ резервуарного илеоректального анастомоза с формированием инвагинационного кла- пана-жома позволяет восстановить калообразующую функцию, избежать трансформации слизистой оболочки резервуара по толстокишечному типу.
2.Инвагинационный клапан-жом упорядочивает моторно-эвакуаторную функцию кишечного тракта вследствие сдерживающих свойств и способности к порционной эвакуации. Способность клапана поддерживать постоянство физических и химических свойств и бактериального состава содержимого тонкокишечного резервуара и прямой кишки обусловлена его арефлюксными свойствами.
3.Морфофункциональная колонизация тонкокишечных илеоректальных конструкций является следствием взаимодействия стенки тонкой кишки
ссодержимым прямой кищки. Формирование арефлюксного механизма позволяет избежать данных осложнений, значительно ухудшающих результаты применения резервуарных конструкций.
Список литературы
1. |
Балайтис Ю.В., Жельман В.А., Топчий Т.В. |
3. Жерлов Г.К., Баширов С.Р. Способ формирова- |
|
Обширные резекции толстой кишки. – Киев: |
ния резервуарного илеоректального анастомоза: |
|
Здоровье, 1990. – 178 с. |
Патент на изобретение № 2138209 РФ, приори- |
2. |
Вольвич Н.Н. Состояние тонкой кишки при не- |
тет от 19.03.98 // Бюл. № 27, 1999. |
|
специфическом язвенном колите после различ- |
4. Никитин А.М., Давыдян Г.Г., Чубаров Ю.Ю. |
|
ных видов оперативных вмешательств // Клин. |
и др. Изменение функций тонкой кишки при |
|
хир. – 1986. – № 2. – С. 14–16. |
формировании тонкокишечного резервуара // |
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
|
|
3/2001 |
57 |

|
|
|
|
|
|
Актуальные проблемы проктологии: Тез. док. – |
ректального анастомоза как альтернатива посто- |
||
|
СПб, 1993. – С. 101–102. |
янной илеостоме // Хирургия. – 1991. – № 3. |
||
5. Никитин А.М., Михайлянц Г.С., Нычкин С.Г. |
– С. 103–108. |
|||
|
и др. Реконструктивно-восстановительные опера- |
7. Юхтин В.И., Хуторянский И.Н. Оценка раз- |
||
|
ции с созданием тазовых тонкокишечных резер- |
личных типов илеоректального анастомоза после |
||
|
вуаров у больных после колэктомии: Обзор ли- |
колэктомии // Хирургия. – 1986. – № 3. – |
||
|
тературы // Хирургия. – 1989. – № 2. – |
С. 103–108. |
||
|
C. 142–148. |
8. Salemans J.M., Nagengast F.M. Clinical and |
||
6. Никитин А.М., Чубаров Ю.Ю., Богома- |
physiological aspects of ileal pouch-anal anastomo- |
|||
|
зов А.М., Якушин А.В. Колэктомия с мукозэк- |
sis// Scand. J. Gastroenterol. – 1995. – N 212, |
||
|
томией прямой кишки и формированием илео- |
suppl. – Р. 3–12. |
||
PATHOGENETIC CORRECTION OF POST-COLECTOMY DISORDERS BY RESERVOIR ILEORECTAL ANASTOMOSIS
Zherlov G.K., Ryzhov A.I., Bashirov S.R.
Investigation, that was carried out, has revealed, that the reflux-enteritis is the main ethiopathogenic factor considerably deteriorating results of small-intestine reservoirs after colectomy and promoting diarrhea. The refore, authors have proposed constraining non-reflux mechanism as a basis for reservoir ileorectal anastomosis method, that permits to prevent complications. The results of experimental and clinical investigations testify, that the reservoir ileorectal anastomosis regulates the motor and evacuatory function of the gut, maintains physical, chemical and bacterial constancy of the reservoir and rectum contents, that is necessary for prophylaxis of postcolectomy diarrhea.
Key words: colectomy, reservoir ileorectal anastomosis, colonization.
* * *
Российский журнал
|
|
гастроэнтерологии, гепатологии, колопроктологии |
58 |
3/2001 |

УДК 616.147.17-007.64-089.87
ЗАВЕРШЕНИЕ ГЕМОРРОИДЭКТОМИИ ВВЕДЕНИЕМ В АНАЛЬНЫЙ КАНАЛ ГЕМОСТАТИЧЕСКОЙ РАССАСЫВАЮЩЕЙСЯ ГУБКИ «СПОНГОСТАН»
Л.А. Благодарный, Г.И. Воробьев, Ю.А. Шелыгин, С.В. Нехрикова, Л.В. Максимова
(Государственный научный центр колопроктологии, кафедра колопроктологии Российской медицинской академии последипломного образования, Москва)
Цель исследования – определение влияния гемостатического материала «Спонгостан» на послеоперационное течение раны анального канала, частоту развития ранних осложнений и выраженность болевого синдрома. Исследование проведено у 33 пациентов, оперированных в Государственном научном центре колопроктологии по поводу геморроя III–IV стадии. У 17 пациентов основной группы сразу после операции в анальный канал вводили гемостатическую губку «Спонгостан». У 16 пациентов, составивших контрольную группу, применяли марлевый тампон, пропитанный левосиновой мазью. Результаты исследований показали, что после применения спонгостановой губки в качестве завершающего этапа геморроидэктомии отсутствуют такие осложнения, как кровотечение, и уменьшаются ранние послеоперационные боли. Благодаря применению гемостатической губки «Спонгостан» после геморроидэктомии уменьшается выделение крови из ран анального канала, снижается интенсивность и сокращается длительность болевого синдрома. Однако использование губки не влияет на длительность заживления раны и пребывания больного в стационаре.
Ключевые слова: анальный канал, геморроидэктомия, спонгостан.
Внашей стране и за рубежом большинство колопроктологов выполняет операцию иссечения трех основных коллекторов кавернозной ткани прямой кишки, являющихся геморроидальными узлами. Эта операция, предложенная Е. Milligan et al. (1937) [15], не лишена недостатков и продолжает модифици-
роваться [7, 8, 9, 10, 17, 19].
В хирургических и колопроктологических стационарах России за год выполняют 440–480 тыс. подобных операций. Частота таких ранних осложнений, как кровотечения, дизурические расстройства, многие годы остается постоянной и составляет 2–4% [5, 6, 14, 16]. К тому же одной из основных проблем у этих пациентов является выраженный и длительный болевой синдром после геморроидэктомии [2, 3, 8, 11, 12, 13].
Большинство колоректальных хирургов завершает геморроидэктомию введением в анальный канал марлевого тампона с одной из водорастворимых мазей (левосин, левомеколь, мафенид), обладающих противовоспалительным и обезболивающим эффектом. При повышенной кровоточивости тканей обычно в анальный канал вводят
гемостатическую губку – тахикомб, берипласт, спонгостан [1, 18].
Нами проведено проспективное рандомизированное исследование, целью которого явилось определение влияния гемостатической губки
«Спонгостан» на течение раны анального канала, частоту развития послеоперационных осложнений и выраженность болевого синдрома.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Спонгостан – рассасывающаяся гемостатическая анальная губка – имеет цилиндрическую форму со сквозным отверстием в центральной ее части. Она выполнена из высушенной очищенной желатиновой пены, имеет однородную пористую структуру.
По данным компании «Джонсон и Джонсон», при попадании крови в поры губки активируются тромбоциты и начинается процесс тромбообразования, завершающийся формированием фибринового сгустка.
Сухая стерильная анальная губка «Спонгостан» вводится в анальный канал в конце операции при помощи ректального зеркала, и сразу начинает проявляться ее гемостатическое действие. Губка самопроизвольно выходит из анального канала через 1–2 дня после операции или в эти же сроки удаляется во время перевязки.
По данным C. Puricelli, Qwarti Tretano [18], желатиновая основа губки не раздражает ткани, ускоряет заживление раны и уменьшает выраженность болевого синдрома. Пациенты, у кото-
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
|
|
3/2001 |
59 |

рых применялся спонгостан после подобных операций, могут покидать стационар через 24 ч, что имеет важное значение для сокращения дорогостоящего койко-дня.
Исследование проведено у 33 пациентов, оперированных в Государственном научном центре колопроктологии по поводу геморроя III–IV стадии. Пациенты, составившие основную и контрольную группы, выбраны путем открытой рандомизации. Для этого была разработана анкетная карта, в которой указаны пол и возраст пациента, стадия геморроя, характеристика болевого синдрома, наличие послеоперационных осложнений, длительность заживления раны и пребывания больного в стационаре.
В основной группе было 10 мужчин и 7 женщин, их возраст варьировал от 19 до 64 лет (средний – 43,5±2,1 года). Контрольная группа состояла из 9 мужчин и 7 женщин, их возраст – от 21 до 65 лет (средний – 44,3±2,3 года).
У17 пациентов основной группы сразу после операции в анальный канал вводили гемостатическую губку «Спонгостан».
У16 пациентов, составивших контрольную группу, после геморроидэктомии в анальный канал вводили газоотводную трубку и марлевый тампон, пропитанный левосиновой мазью.
При сравнительном анализе результатов лечения 2 групп пациентов не выявлено существенных различий по половому и возрастному признакам.
Увсех 33 пациентов выполнена геморроидэктомия. После удаления мазевого тампона на 2-й день после операции у больных контрольной и основной групп промывали раны антисептическими растворами и осуществляли перевязки с левосиновой мазью.
Для объективной оценки эффективности гемостатической губки «Спонгостан» проведено исследование, включавшее клинический анализ течения раневого процесса в ранний послеоперационный период и оценку цитологических данных.
Анализировали клинические показатели, в частности объективные и субъективные. Эти факторы представлены в виде характеристики раннего болевого синдрома и послеоперационных осложнений, течения раневого процесса (цитологические исследования) и длительности пребывания пациентов в стационаре.
Больных наблюдали только до выписки из стационара. Со 2-го дня после операции ежедневно проводили цитологическое исследование раневых отпечатков, которые получали во время перевязки
спомощью стерильных поролоновых тампонов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У пациентов основной и контрольной групп в ранний послеоперационный период состояние оставалось удовлетворительным. Лишь у одного больного контрольной группы в течение 5 дней отмечалась субфебрильная температура тела.
Субъективную оценку выраженности болевого синдрома производили по специальной таблице, разработанной по аналогии с таблицей оценки болевого синдрома, предложенной О.Н. Древалем [4]. Она включала оценку «раневой» боли и болевого синдрома во время дефекации.
Болевой синдром оценивали по характеру (боль острая, тупая), интенсивности (слабая, средняя, сильная, очень сильная) и эффективности обезболивающих средств, включавших ненаркотические и наркотические препараты. При этом оценивали их действие (боль снимали полностью или частично не снимали).
Оценивали продолжительность боли (до 1 сут, 2–4 сут, более 4 сут). Боли во время дефекации оценивали по ее интенсивности, характеру и продолжительности.
Слабовыраженный болевой синдром в основной группе зарегистрирован у 4 (23,5%) больных а сильный – у 1 (5,9%). В контрольной группе сильная боль наблюдалась у 6 (37,5%) пациентов.
Увсех пациентов основной группы боль купировалась ненаркотическими анальгетиками, длительность применения которых составила 5,7±1,5 дня.
В контрольной группе у 3 (18,8%) пациентов в течение 2 дней сильная интенсивная боль потребовала применения наркотиков. Длительность использования ненаркотических лекарственных препаратов составила 7,2±1,6 дня.
Средняя продолжительность болевого синдрома в обеих группах составила 4,3±1,3 дня.
У70,6% пациентов основной группы при первом стуле отмечена слабая болезненность, у 11,7% эти явления носили умеренный характер.
У17,7% больных первый стул после операции был безболезненный.
В то же время в контрольной группе слабая болезненность при первом стуле отмечена у 56,3% пациентов, у 31,3% – умеренная. У 12,4% болевой синдром отличался выраженной интенсивностью и потребовал назначения наркотиков.
Отмечены достоверные отличия в уменьшении болевого синдрома при применении спонгостана. Эта зависимость имеет явную тенденцию к снижению болевых ощущений при дальнейшем наборе материала.
В ранний послеоперационный период в основной группе больных воспалительных осложнений не отмечено. У 2 (12,5%) пациентов контрольной группы наблюдались гиперемия кожи и отек вокруг анального канала на протяжении 4 дней.
При анализе клинических местных показателей течения раневого процесса оценивали наиболее важные его параметры: воспалительную раневую реакцию, фазы репарации и грануляций и появление краевой эпителизации. Завершение раневого процесса с образованием соединительнотканного рубца определяли, наблюдая за пациентами после выписки из стационара на 7, 14 и 21-й день.
Российский журнал
|
|
гастроэнтерологии, гепатологии, колопроктологии |
60 |
3/2001 |
