
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (2)
.pdf
являли жалобы на схваткообразные и ноющие боли в животе (100%), вздутие и урчание, неотложные позывы к акту дефекации, ощущение неполного опорожнения кишечника (см. таблицу). Частый стул с жидкими и/или кашицеобразными фекалиями и слизью отмечался у 11 больных, у 6 понос чередовался с запором, у 3 сохранялся оформленный кал.
Дицетел назначали по 1 таблетке 3 раза в день во время еды в течение 20 дней. Монотерапия дицетелом проведена у 14 человек. В связи с продолжающимся у 5 человек поносом в течение 10 дней лечения дицетелом последующие 10 дней они дополнительно получали смекту (2 порошка в день). Одна пациентка с запорами дополнительно с 10-го дня получала форлакс (1 порошок утром ежедневно).
В процессе лечения дицетелом наблюдалось снижение выраженности абдоминального дискомфорта у 70% больных. Абдоминальные боли полностью купированы у 65% пациентов. У остальных 35% больных интенсивность болей уменьшилась, увеличилось количество дней без эпизодов болей в животе. Метеоризм исчез в 75% случаев. Оформленный кал к концу лечения наблюдался у 75% больных, полуоформленный или в виде густой кашицы сохранялся до окончания лечения у 5 (25%). Однако частота опорожнения кишечника значительно сократилась (до 1–2 раз в день).
По данным электромиографии, до начала лечения гипермоторная дискинезия ЖКТ отмечена у 12 (60%) человек, явления дискинезии по смешанному типу – у 8 (40%). Через 20 дней терапии дицетелом у 58% пациентов выравнивался исходно нарушенный коэффициент ритмичности и мощности сокращения в кишечнике при гипермоторной дискинезии. У 5 из 14 прослеженных в динамике больных сохранились нарушенные координированные сокращения и выраженные изменения коэффициента ритмичности (КР).
Частичный положительный эффект на фоне лечения, выражавшийся в снижении интенсивности абдоминальных болей, урежении частоты стула отмечен у 4 (20%) больных. У 2 (10%) пациентов к 6–8-му дню приема препарата участился стул до 6–7 раз в день с жидкими фекалиями, усилились боли в животе, появилась тошнота. Поскольку при добавлении смекты самочувствие не улучшилось, пациентки прекратили с 8–9-го дня прием дицетела.
На основании результатов наблюдения мы сделали следующие выводы:
–дицетел эффективен при лечении пациентов
сСРК преимущественно в вариантах с преобладанием абдоминальных болей и дискомфорта;
–дицетел влияет на тонус и двигательную активность ЖКТ, выравнивает время пассажа по нему и измененную электрическую активность
(ЭА) кишечника;
–дицетел может активно использоваться как селективный миотропный спазмолитик при ги-
Российский журнал
пермоторных дискинезиях ЖКТ в качестве монотерапии;
– при сочетании абдоминальных болей с диареей и недостаточной эффективности целесообразно назначать дицетел в комбинации со смектой, при преобладании запоров возможно сочетание дицетела с форлаксом.
У 15 больных с СРК мы оценили воздействие блокатора кальциевых каналов спазмомена (отилония бромид, фирма "Berlin-Chemie", Германия) на абдоминальные боли. При однократном приеме 1 таблетки (40 мг) боли в животе через 15–45 мин купировались полностью у 10 больных и существенно уменьшились у 5 больных. Действие препарата развивалось быстро и сохранялось около 6 ч.
При курсовом лечении 10 больных спазмоменом в течение 7–14 дней по 1 таблетке 3 раза в день стойкое уменьшение болей наблюдалось у 5 больных, а их исчезновение – у 4. Это позволило сделать вывод об эффективности препарата как миотропного спазмолитика при спастических расстройствах ЖКТ как при курсовом, так и при разовом его приеме.
Вкачестве спазмолитиков используют и антихолинергические средства: платифилин, атропин, метацин, гастроцепин, бускопан.
Холиноблокаторы эффективны при эпизодическом приеме для купирования сильных приступов боли, так как их спазмолитическое действие на гладкомышечные структуры более выражено, чем у спазмолитиков миотропного ряда. Однако эти препараты вызывают ряд побочных влияний,
вчастности такие, как снижение продукции слюны, задержка мочеиспускания, глазные эффекты, тахикардия, сонливость. Активность их убывает к нижним отделам кишечного тракта, где нет м- холинорецепторов.
К препаратам, стимулирующим моторику ЖКТ, или прокинетикам, относятся метоклопрамид, домперидон, цисаприд.
Метоклопрамид и домперидон – антагонисты центральных допаминовых рецепторов. Они воздействуют преимущественно на верхние отделы ЖКТ. На уровне толстой кишки их эффекты практически не проявляются. В связи с выраженными побочными эффектами метоклопрамид применяется все реже.
Вгруппе прокинетиков выгодно выделяется цисаприд – активное вещество таких препаратов, как перистил, координакс. Цисаприд обладает непрямым холинергическим действием на нейромышечный аппарат ЖКТ, способствуя местному высвобождению ацетилхолина. На допаминовые рецепторы он не влияет, поэтому не имеет побочных эффектов со стороны ЦНС.
Цисаприд повышает тонус и усиливает пропульсивную моторику кишечника, повышает тонус сфинктера нижнего отдела пищевода, предупреждает гастроэзофагеальный и дуоденогастральный рефлюксы, восстанавливает тоничность
гастроэнтерологии, гепатологии, колопроктологии |
4/2000 |
41 |

Клиническая эффективность регуляторов моторной функции кишечника при СРК
|
|
Дебридат (n=30) |
|
|
Перистил (n=30) |
|
|
Дицетел (n=20) |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Симптом |
До лечения |
Через 2 нед |
До лечения |
Через 2 нед |
До лечения |
Через 2 нед |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Абс. |
|
% |
Абс. |
% |
Абс. |
|
% |
Абс. |
% |
Абс. |
|
% |
Абс. |
% |
|
число |
|
число |
число |
число |
число |
|
число |
|||||||
|
|
|
|
|
|
|
|
|
|||||||
Боли в животе |
24 |
|
80,0 |
9 |
30,0 |
20 |
|
66,7 |
8 |
26,7 |
20 |
|
100,0 |
7 |
35,0 |
Метеоризм |
28 |
|
93,3 |
5 |
16,7 |
23 |
|
76,7 |
16 |
53,3 |
16 |
|
80,0 |
4 |
25,0 |
Запор |
16 |
|
53,3 |
1 |
3,3 |
27 |
|
90,0 |
6 |
20,0 |
5 |
|
25,0 |
0 |
0 |
Понос |
8 |
|
26,7 |
1 |
3,3 |
– |
|
– |
– |
– |
11 |
|
55,0 |
5 |
25,0 |
Тяжесть и распира |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ние в эпигастрии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
после еды |
3 |
|
10,0 |
0 |
0 |
13 |
|
43,3 |
4 |
13,3 |
3 |
|
15,0 |
0 |
0 |
Отрыжка |
8 |
|
26,7 |
2 |
6,7 |
13 |
|
43,3 |
3 |
10,0 |
3 |
|
15,0 |
0 |
0 |
Ощущение непол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ного опорожнения |
5 |
|
16,7 |
1 |
3,3 |
7 |
|
23,3 |
– |
– |
3 |
|
15,0 |
15 |
75,0 |
кишечника |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сфинктеров. Ускоряя пассаж по толстой кишке, препарат применяется при ее гипомоторной дискинезии. Поэтому при СРК с преобладанием запоров оправданно назначение цисаприда.
Мы изучали эффективность цисаприда производства индийской фирмы "Dr. Reddy's Laboratories", выпускаемого под торговым названием “Перистил". Наблюдали 30 пациентов в возрасте от 27 до 72 лет с такими симптомами СРК, как запоры, абдоминальные боли, вздутие живота, урчание в кишечнике и отсутствие ощущения полного его опорожнения, затруднения при акте дефекации.
Суточная доза перистила у 25 больных составляла 15 мг (3 таблетки по 5 мг), у 5 – 30 мг (6 таблеток). Курс лечения – 14 дней. С 4–6-го дня приема перистила абдоминальные боли исчезли и значительно уменьшились у 40 и 23,3% больных соответственно; метеоризм отсутствовал и значительно уменьшился у 23,3 и 53,3% соответственно. К 14-му дню регулярное опорожнение кишечника с ощущением полного его опорожнения отмечено у 70% пациентов. Боли в животе значительно уменьшились еще у 20,3 % и сохранились в прежнем объеме лишь у 1 (3,3%) пациента. Время карболеновой пробы до лечения составляло 56±3,2 ч, через 2 нед – 32±2,4 ч, что свидетельствовало об ускорении пассажа по кишечнику.
При электромиографии исходно у большинства больных были значительно снижены КР и ЭА желудка и дистальных отделов толстой кишки – у 75 и 83% больных соответственно; у 18% эти показатели были значительно повышены. В тощей и подвздошной кишке у всех пациентов выявлено увеличение КР и ЭА. Через 2 нед лечения отмечена положительная динамика измененных показателей во всех отделах ЖКТ. Отсутствовала динамика только у 2 больных.
Изучение содержания короткоцепочечных жирных кислот (КЦЖК) в кале показало сни-
жение концентрации отдельных КЦЖК (уксусной, пропионовой, масляной, изомасляной, изовалериановой, валериановой, изокапроновой, капроновой) и их суммарного количества до лечения и увеличение после 2-недельной терапии. Это могло свидетельствовать об усилении метаболической активности микрофлоры толстой кишки.
Впроцессе лечения перистилом изменялся и количественный состав КЦЖК, что говорило о качественных и количественных изменениях ана- эробно-аэробных взаимоотношений в сторону нормальных значений. Мы убедились в эффективности лечения абдоминального дискомфорта и запоров перистилом при СРК. Перистил может быть использован в качестве прокинетика при функциональных нарушениях ЖКТ, особенно при снижении тонуса и двигательной активности желудка и кишечника.
Вцелях регуляции моторной функции кишечника при СРК активно применяется такой универсальный регулятор моторики, как дебридат (тримебутин). Это стимулятор всех типов опиатных рецепторов. Являясь агонистом и антагонистом опиоидных рецепторов, дебридат способен восстанавливать физиологическую двигательную активность кишечника независимо от характера моторных расстройств. Он действует на все отделы ЖКТ.
На кафедре гастроэнтерологии Учебно-научно- го центра Медицинского центра Управления делами Президента РФ мы оценили эффективность дебридата у 30 больных с СРК: у 16 – с преобладанием запоров, у 8 – с преобладанием поносов, у 6 – с неустойчивым стулом, проявлявшемся чередованием запоров и поносов, с метеоризмом и болями в животе (см. таблицу). Клинический эффект при использовании дебридата достигнут у 93,4% больных. Более быстрое исчезновение симптомов наблюдалось на фоне применения дебридата в дозе 600 мг в сутки (по 2 таблетки 3 раза в день).
Российский журнал
42 |
4/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

Если у пациентов с СРК доминирующим симптомом является диарея, короткими курсами может быть использован такой регулятор моторики, как лоперамид (имодиум), который, связываясь с опиоидными рецепторами, снижает тонус и моторику гладкой мускулатуры кишечника. Лоперамид нельзя использовать длительно из-за побочных эффектов (головокружение, сухость во рту, экзантема, развитие запоров вплоть до кишечной непроходимости).
В качестве сорбента при преобладании диареи может быть использован полифепан или смекта, обладающие мукопротективными свойствами и способностью восстанавливать абсорбцию и секрецию, нормализовать моторику кишки.
Характерный симптом СРК – вздутие живота. Причем вздутие обычно доминирует при формах, сопровождающихся запорами. В целях снятия тягостных ощущений метеоризма активно можно использовать симптоматические препараты – пеногасители, содержащие в своем составе либо активированный уголь, либо кремнезем.
Нами оценивалась эффективность таких пеногасителей, как эспумизан (фирма "BerlinChemie", Германия), дисфлатил (фирма "Solko Basel", Швейцария) и метеоспазмил (фирма "ФИК Медикаль Восток", Франция). Все указанные препараты в качестве действующего вещества содержат симетикон, полученный на основе кремния. Метеоспазмил, кроме симетикона, содержит альверина цитрат – миотропный спазмолитик. Всего наблюдали 90 пациентов (по 30 больных с СРК в каждой группе).
Оценивали эффект разового приема каждого препарата и курсового лечения длительностью до 14 дней. Критерием эффективности служила динамика симптомов повышенного газообразования: метеоризма, ощущения распирания и переполнения в эпигастрии, слабого отхождения газов, болей в животе и характера стула. Все препараты были эффективны в купировании симптомов повышенного газообразования при СРК. Отличный и хороший эффект был отмечен при использовании дисфлатила в 80% случаев, эспумизана – в 87%, метеоспазмила – в 86,7%.
Разовый прием всех трех препаратов достаточно быстро (в течение 30–45 мин) купировал метеоризм. Мы считаем, что эспумизан, метеоспазмил, дисфлатил могут активно использоваться в качестве эффективных симптоматических средств при абдоминальном дискомфорте, сопровождающем избыточное образование и накопление газа в ЖКТ. Эти препараты могут также использоваться в виде монотерапии для быстрого купирования метеоризма и обусловленных метеоризмом болей в животе.
Определенную значимость при СРК, возникшего и протекающего на фоне дисбиотических изменений, имеет санация патогенной кишечной микрофлоры и восстановление нормального бактериологического "пейзажа" в кишечнике. При
Российский журнал
дисбиотической патогенной микрофлоре должны применяться кишечные антисептики.
Среди кишечных антисептиков выгодно отличается интетрикс, обладающий противомикробным действием не только в отношении бактерий, но и грибов рода Candida. Интетрикс применяют по 4–6 капсул в сутки в течение 5–6 дней, после чего назначают препараты, способствующие восстановлению нормальной микрофлоры кишечника.
К эффективным местным кишечным антисептикам следует отнести эрсефурил – препарат нитрофурановой группы, проявляющий активность в отношении грамположительных кокков и грамотрицательных микроорганизмов.
Синтетическим антибактериальным средством является метронидазол, преимуществом которого является активность в отношении грамотрицательных анаэробов.
Вцелях восстановления естественной микрофлоры кишечника в лечебной практике многие годы применяются эубиотики – препараты группы бактеринов (отечественные – бифидумбактерин, лактобактерин, зарубежные – примадофилюс, бифиформ, линекс и др.) Применение этих препаратов при дефиците или отсутствии бифидо- и лактофлоры в кишечнике нормализует его микробиоценоз, препятствует развитию патогенной микрофлоры и ее влиянию на объем и консистенцию каловых масс. Для достижения достаточного эффекта бактерины должны применяться длительно, что снижает их лечебную значимость.
Внимание клиницистов привлекает энтерол, содержащий лиофилизированные клетки лечебных дрожжей Saccharomyces boulardii. Энтерол проявляет отчетливый антагонизм к патогенным микроорганизмам, антитоксинное действие, улучшает ферментацию и повышает противоинфекционную защиту энтероцитов.
В1998 г. на кафедре гастроэнтерологии оценивалась эффективность энтерола (фирма "SanofiChinoin", Франция) у 20 больных с СРК и диареей. Эффективность лечения энтеролом по клинической симптоматике и по результатам бактериологического исследования кала отмечена у 80% больных. Энтерол способствовал восстановлению нормального гомеостаза экосистемы толстой кишки, прежде всего облигатной микрофлоры, увеличивал время транзита по пищеварительному тракту. Препарат характеризовался хорошей переносимостью и отсутствием побочных реакций.
Влечении дисбактериоза можно избрать еще один путь – воздействие на измененную микрофлору продуктами метаболизма нормальных микроорганизмов. Речь идет о применении хилака форте (фирма "Merkle", Австрия). Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочную кислоту, лактозу, амино-
гастроэнтерологии, гепатологии, колопроктологии |
4/2000 |
43 |

кислоты, КЦЖК. Эти вещества способствуют восстановлению биологической среды в кишечнике, необходимой для существования нормальной микрофлоры, подавляют рост патогенных бактерий.
Кафедра гастроэнтерологии Учебно-научного центра Медицинского центра Управления делами Президента РФ имеет практический опыт применения хилака форте при различной патологии. Проведены контролируемые испытания хилака форте на 22 больных с СРК, осложненным дисбактериозом.
Хилак форте назначали по 40 капель 3 раза в день в течение 2 нед. При бактериологическом исследовании в динамике выявлено уменьшение степени тяжести дисбактериоза: достоверно увеличивалось количество анаэробов, уменьшалось количество условно-патогенных микробов, улучшалась функция кишечника. Увеличивалась суммарная концентрация летучих жирных кислот в кале в 1,8 раза, динамика уксусной, пропионовой и масляной кислот также была положительной, что свидетельствовало об усилении активности и увеличении содержания сахаролитических анаэробов.
По нашему убеждению, попытка восстановить
нормальную микробную среду очень важна. С восстановлением “нормальной среды" в просвете кишечника возобновляется и чувствительность рецепторного аппарата. Уже одно это возобновляет ответ на физиологические стимулы к сокращению и заметно увеличивает эффективность средств, регулирующих моторную активность кишки через различные рецепторные структуры.
Таким образом, лечение СРК чаще всего должно быть комплексным. Трудности его лечения заключаются в том, что заболевание характеризуется волнообразным течением с чередованием периодов улучшения и ухудшения, спровоцированных, как правило, влиянием психоэмоциональных факторов. В лечении СРК нужно проявить упорство. При этом заметно уменьшается тенденция к прогрессированию СРК, а прогноз становится благоприятным.
Материал статьи не охватывает, конечно, все препараты, которые можно применять для лечения СРК. Однако авторы попытались исходя из своего опыта оценить эффективность наиболее часто используемых медикаментов.
Список литературы
1. |
Златкина А.Р. // Тер. арх. – 1997. – Т. 69, |
|
роэнтерол., гепатол., колопроктол. – 1999. – |
|
№ 2. – С. 68–71. |
|
Т. 9, № 2. – С. 88–89. |
2. Ивашкин В.Т. // Рос. журн. гастроэнтерол., ге- |
7. |
Шептулин А.А. // Рос. журн. гастроэнтерол., |
|
|
патол. – 1993. – Т. 2, № 3. – С. 27–30. |
|
гепатол., колопроктол. – 1997. – Т. 7, № 5. – |
3. |
Карпов О.И, Зайцев А.А. // Terra Medica |
|
С. 88–90. |
|
[СПб]. –1997. – № 4. – С. 1–5. |
8. |
Camilleri M., Choi M. // Pharmacol. Ther. – |
4. |
Материалы 25-й ежегодной научной сессии |
|
1997. – Vol. 11. – P. 3–15. |
|
ЦНИИ гастроэнтерологии // Рос. гастроэнте- |
9. |
Thompson W.G. // Lancet. – 1993. – N 2. – |
|
рол. журн. – 1997. – № 4. – С. 121–122. |
|
P. 1569–1572. |
5. Синдром раздраженной кишки: Практическое ру- |
10. Schutze R.K., Brandstatler G., Dragosics B. et |
||
|
ководство для врачей. – М., 1999. |
|
al. // Gastroenterology. – 1997. – N 3. – P. 11. |
6. |
Цырик В.А., Калинин А.В. // Рос. журн. гаст- |
|
|
POSSIBILITIES OF THE MODERN PHARMACOLOGICAL THERAPY IN RECOVERY AND REGULATION OF BOWEL MOTILITY DISTURBANCES
Minushkin O.N.
Article presents brief characteristic of main drugs, used for treatment of irritable bowel syndrome (IBS): myotropic antispasmodics, Ca-channels blockers, prokinetics, opiod receptors antagonists, probiotics. According to the literature data and results of original investigation the therapeutical spectrum for each group in different forms of IBS was defined, according to mechanisms of action and side effects.
Key words: irritable bowel syndrome (IBS), IBS treatment, prokinetics.
* * *
Российский журнал
44 |
4/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

УДК
ПРЕЦИЗИОННЫЕ ОРГАНОВОССТАНАВЛИВАЮЩИЕ ТЕХНОЛОГИИ В ЛЕЧЕНИИ ДОБРОКАЧЕСТВЕННЫХ ОБСТРУКТИВНЫХ ПОРАЖЕНИЙ ПИЩЕВОДА
В. И. Оноприев, В. М. Дурлештер
(Республиканский центр функциональной хирургической гастроэнтерологии, Краснодар)
В работе представлен 10-летний опыт хирургического лечения доброкачественных обструктивных поражений пищевода. Прооперированы 106 больных с ахалазией
ипослеожоговыми рубцовыми стриктурами. Предложены новые хирургические решения, суть которых заключается в сохранении вагусной иннервации желудка при выделении пораженного прекардиального участка пищевода и в создании “искусственной” арефлюксной кардии. Применяемые технологии лечения позволили добиться отсутствия летальности, снизить частоту послеоперационных осложнений до 0,3%
исреднее пребывание на “больничном листе” до 35±4 дня. При доброкачественных процессах отсутствовал рецидив заболевания.
Ключевые слова: ахалазия пищевода, арефлюксная кардия, суперселективная проксимальная ваготомия.
Реконструктивно-восстановительная хирургия доброкачественных стриктур пищевода сопряжена с возможностью тяжелых ранних (несостоятельность швов пи-
щеводных анастомозов, некроз трансплантата) и поздних (стенозы анастомозов, пептические язвы искусственного пищевода) осложнений, которые обусловлены не только сложностью оперативных вмешательств и снижением активности репаративных процессов у данной категории больных на почве выраженной белково-энергетической недостаточности, но и несовершенством хирургической техники.
Несмотря на то что пластическая хирургия пищевода при его стенозирующих заболеваниях существует более 100 лет, проблема создания анатомически и функционально целостной “искусственной кардии” до настоящего времени не решена, и частыми спутниками данного рода операций являются пептические эрозии, язвы, рубцовые стриктуры пищевода и трансплантата, несостоятельности, связанные с рефлюксом кислого желудочного содержимого. Это обстоятельство, с одной стороны, сводит на нет результаты столь сложной, опасной и травматичной операции, а с другой, приводит к состояниям более тяжелым по сравнению с существовавшими до оперативного вмешательства, что снижает качество жизни пациентов и часто является причиной полной инвалидизации, требует повторных сложных операций.
Имеется множество отечественных и зарубежных публикаций, посвященных проблеме регургитации, что связано с отсутствием универсального надежного способа формирования искусственной кардии и неудовлетворенностью хирургов результатами проведенных операций.
По данным отечественной и зарубежной литературы, летальность после таких операций составляет 3,4–15,0% при рубцовых стриктурах и 16–35% при раковом поражении пищевода [2,4,8]. Наиболее грозными ранними осложнениями являются несостоятельность швов анастомозов, приводящих к медиастиниту и септикопиемии – 26,1–40,0% [1, 3, 5, 7], и некроз трансплантата – 17,6% [6].
Цель исследования заключалась в разработке новых конструкций и надежных прецизионных хирургических технологий создания функционально полноценной «искусственной кардии» в толстокишечной эзофагопластике при ожоговых стриктурах и ахалазии пищевода.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
За последние 10 лет в нашем центре прооперированы 106 больных с обструктивными поражениями пищевода. В эту группу вошли 65 больных с ахалазией пищевода и 41 – с послеожоговыми стриктурами (39 мужчин и 67 женщин в возрасте от 16 до 87 лет).
Пациентам выполнялись пластические реконструктивные операции на пищеводе либо с замещением последнего левой половиной ободочной кишки, созданием “искусственной” арефлюксной кардии, либо только прецизионное пластическое формирование арефлюксной кардии при нарушении функции нижнего пищеводного сфинктора
(НПС) и стенотическом поражении прекардиального отрезка пищевода.
В зависимости от состояния пищевода и его прекардиального участка 65 больных с ахалазией пищевода были разделены на 3 группы:
– 1-я г р у п п а – расширение пищевода до
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
4/2000 |
45 |
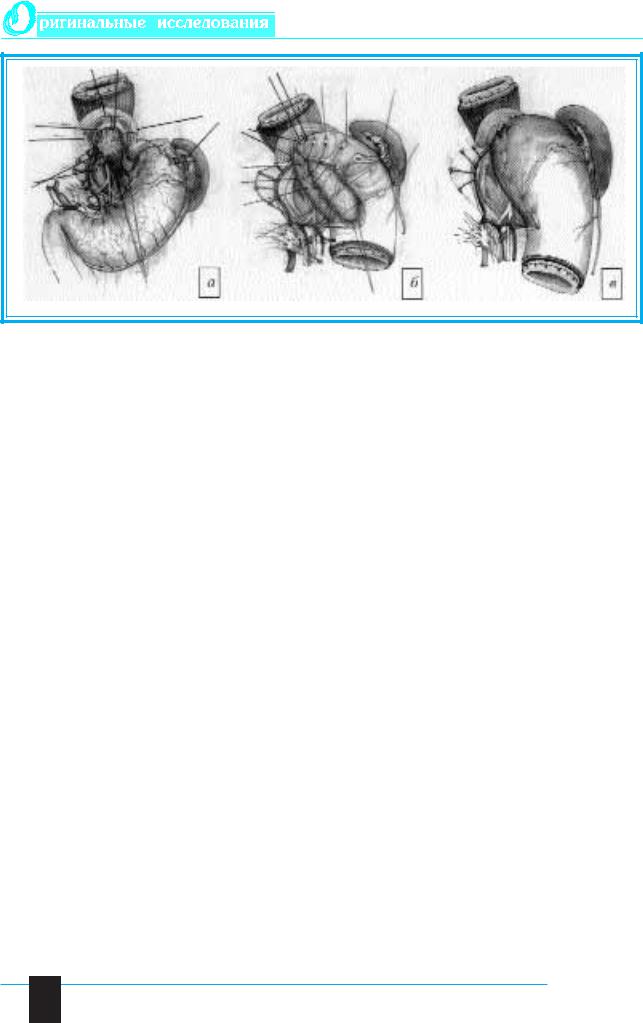
Рис. 1
4,0±1,8 см в диаметре, умеренное нарушение его моторно-эвакуаторной деятельности – повышение давления в кардии до 24,3±3,8 см вод. ст. (норма – 20–25 см вод. ст.), повышение градиента пищеводно-желудочного давления до 17,2±2,4 см вод. ст. (норма – 5–15 см вод. ст.), снижение амплитуды сократительной волны до 18,4±1,3 см вод. ст. (норма – 25–35 см вод. ст.), увеличение продолжительности сократительной волны до 16,4±2,3 с (норма – 5–8 с);
–2-я г р у п п а – значительная дилатация пищевода (более 4,0±1,8 см) с S-образным изгибом и прогрессивным нарушением моторно-эва- куаторной функции (повышение давления в кардии до 29,6±2,6 см вод. ст., увеличение градиента пищеводно-желудочного давления до 21,7±3,1 см вод. ст., снижение амплитуды сократительной волны до 11,3±1,2 см вод. ст., увеличение продолжительности сократительной волны до 26,4±3,3 с), но без рубцовых изменений в прекардиальном сегменте пищевода;
–3-я г р у п п а – рубцовый стеноз прекардиального участка пищевода, выраженное расширение органа (мегаэзофагус), практически полное отсутствие его моторно-эвакуаторной деятельности.
Использовались следующие методы диагностики болезней пищевода, пищеводно-желудочного перехода, желудка и двенадцатиперстной кишки (ДПК).
1. Эндоскопия, позволяющая установить наличие содержимого в пищеводе натощак, состояние его просвета (расширен, значительно расширен, диаметр), форму (веретенообразная, цилиндрическая, S-образная), изменена ли слизистая оболочка (гиперемирована, эрозирована, изъязвлена), исследовать функцию кардии (раскрытие воздухом, расстояние от резцов, отношение к ПОД –
пищеводному отверстию диафрагмы), линии Z (сохранена, размыта, отсутствует).
Особое внимание уделяли состоянию прекардиального участка пищевода – проходимость последнего эндоскопом, состояние слизистой оболочки или полное рубцевание с недоступностью осмотра. Осматривались желудок, привратник и ДПК для исключения возможной сопутствующей патологии.
2.Рентгенологическое исследование давало возможность обнаружить изменения пищевода и пищеводно-желудочного перехода при ахалазии. Данный метод позволяет оценить форму пищевода, его диаметр, контуры, выявить дефекты наполнения, определить протяженность поражения, диаметр сужения и скорость эвакуации бариевой взвеси из органа. Метод обеспечивает наблюдение за движением контрастного вещества, то есть за выполнением основной, пропульсивной функции пищевода.
3.Моторная функция пищевода и пищеводножелудочного перехода изучалась методами катетерной манометрии и тензометрии. Определяли максимальное давление в кардии, градиент пище- водно-желудочного давления, амплитуду и продолжительность сократительной волны.
4.Исследование секреции желудка проведено
методом внутрижелудочной рН-метрии с использованием автоматизированного рабочего места “Гастро-Ф”. Показания фиксировались с помощью рН-зонда 02 и первичного преобразователя для желудочной рН-метрии. Определяли интенсивность продукции и концентрацию соляной кислоты.
В группе обследованных больных базальная продукция кислоты (БПК) составляла 3,9± 1,2 ммоль/ч, максимальная продукция кислоты
(МПК) – 24,3±2,9 ммоль/ч. Гипосекреция (МПК – менее 18 ммоль/ч) выявлена у 7 больных, нормосекреция (МПК – 18–26 ммоль/ч) – у 31, гиперсекреция (МПК – 26–60 ммоль/ч) – у 4. Во время операции 4 больным выполнена расши-
Российский журнал
46 |
4/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2. А – рентгено- |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
грамма до операции; |
|
|
|
|
А |
|
|
Б |
|
|
|
|
Б – моторика до опе- |
|
|
|
|
|
|
|
|
|
|
рации |
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3. А – рентгено- |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
грамма после опера- |
|
|
|
А |
|
Б |
|
|
|
ции; Б – моторика |
|
|
|
|
|
|
|
|
|
после операции |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
ренная суперселективная проксимальная ваго- |
ную иннервацию. Это и является основой восста- |
|
томия (ССПВ), то есть производилось дополни- |
новления проходимости пищеводно-желудочного |
|
тельное скелетирование малой кривизны желудка |
перехода и успеха создания “искусственной” кар- |
|
до „гусиной лапки”. |
дии у всех больных с ахалазией. Последующие |
|
Больным с ахалазией пищевода в 1-й и 2-й |
этапы |
операции специфичны для каждой из |
группах выполняли продольную внеслизистую |
3 групп больных. |
|
миотомию пищеводно-желудочного перехода с |
В 1-й и 2-й группах больных затем приступали |
|
расширяющей эзофагокардиофундопластикой и |
к восстановлению разрушенного при мобилиза- |
|
сохранением вагусной иннервации желудка (па- |
ции связочного аппарата пищевода. Фиксирую- |
|
тент на изобретение № 97110337/14 от |
щие пищеводно-диафрагмальные швы-связки |
|
17.09.1997 г.). |
препятствуют смещению пищевода в средостение. |
|
Ключевым этапом операции является ССПВ, |
Для |
восстановления замыкательной функции |
которая применена во всех группах больных, так |
кардии формировали эзофагокардиогастральный |
|
как разработанная методика позволяет мобилизо- |
клапан. |
|
вать прекардиальный участок пищевода с низве- |
Внеслизистую продольную эзофагокардиомио- |
|
дением последнего из средостения и сохранить |
томию выполняли только после создания связоч- |
|
стволы и ветви блуждающего нерва, идущие к ан- |
ного аппарата пищевода, кардии и формирования |
|
тральному отделу желудка, и тем самым сохра- |
эзофагокардиогастрального клапана. Для этого |
|
нить моторно-эвакуаторную функцию желудка |
по передней поверхности пищевода острым |
|
(рис. 1). |
скальпелем и препаровочными ножницами дела- |
|
ССПВ – нейрохирургическая операция, ис- |
ли миотомный разрез длиной 5–7 см, проходя- |
|
пользуемая в брюшной полости на малых анато- |
щий через всю зону сужения с переходом на |
|
мических структурах (абдоминальный пищевод, |
1–1,5 см кардиального отдела желудка. Рассека- |
|
кардия, дно и проксимальный отдел малой кри- |
ли циркулярные мышечные волокна НПС до |
|
визны желудка), неторопливое, скрупулезное, |
подслизистого слоя и препаровочным тупфе- |
|
прецизионное выполнение которой давало воз- |
ром разводили их в стороны, освобождая его |
|
можность свободного вмешательства на прекар- |
(рис. 1а). |
|
диальном отрезке пищевода, не повреждая вагус- |
После полного рассечения и разведения в сто- |
|
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
4/2000 |
47 |

Рис. 4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
Б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5. А – рентгенограмма |
до операции; Б – моторика до операции |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б
А
Рис. 6. А – рентгенограмма после операции; Б – моторика после операции
роны краев разреза мышечной оболочки толстый желудочный зонд свободно проводили в желудок. Используя монолитную нить 4/0 и атравматическую иглу, узловыми швами к левому краю миотомного разреза подшивали переднюю стенку дна желудка, а к правому – заднюю. Такая кон-
струкция способствовала постоянному нахождению рассеченных мышечных краев в состоянии диастаза вследствие эластической тяги обеих стенок дна желудка, направленной в противоположные стороны.
Это обстоятельство препятствовало контакту,
Российский журнал
48 |
4/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

сращению и рубцеванию краев миотомного разреза (рис. 1б). Дефект в мышечном слое пищевода укрывали очень подвижной передней стенкой дна желудка, наворачивая ее на образовавшийся дефект. Убедившись в отсутствии натяжения, сверху вниз накладывали несколько узловых сероз- но-мышечных швов, захватывавших с одной стороны переднюю стенку дна желудка, а с другой
– заднюю. Затем 2–3 швами ушивали малую кривизну желудка (рис. 1в).
Операция выполнена у 57 больных с ахалазией пищевода, выделенных в 1-ю и 2-ю группы. Обследованы все больные от 1 года до 17 лет после операции. Отличные результаты получили у 55,6±6,6% пациентов, хорошие – у 33,3±6,2%, удовлетворительные – у 9,3±3,8%, неудовлетворительные – у 1,8±1,8%.
При рентгенологическом исследовании уже в ранний послеоперационный период наблюдали значительное усиление моторной деятельности пищевода, сопровождавшееся ускорением, а в ряде случаев и нормализацией темпа эвакуации контрастной массы, уменьшение диаметра эзофагуса. Причем, чем выраженнее патоморфологические изменения в пищеводе (2-я группа), тем менее интенсивно и полно шло восстановление его моторной функции. Функция антрального отдела желудка, привратника и ДПК не нарушалась (рис. 2 А, 3 А).
При эндоскопическом исследовании у всех больных кардия была сомкнута, находилась в брюшной полости, слизистая оболочка пищевода над кардией не изменена, пищевод пуст.
При эзофагоманометрическом исследовании установлено снижение максимального давления в кардии до нормальных показателей – 21,0±2,4 см вод. ст. Градиент пищеводно-желу- дочного давления составил 11,8±1,4 см вод. ст. Желудочно-пищеводный рефлюкс не отмечался. Повысилась амплитуда сократительной волны до 24,0±4,7 см вод. ст. и уменьшилась ее продолжительность до 8,5±2,8 с (рис. 2 Б, 3 Б).
Все больные прошли период консервативной терапии как медикаментозной, так и различные формы кардиодилатации. У одних этот период составил 1 год, у других – 10–15 лет. Однако безуспешность консервативной терапии привела их к оперативному лечению. Предложенная операция исключает рецидив болезни, осложнения в ближайший и отдаленный послеоперационные периоды, гарантирует отличное качество жизни, полностью возвращает больного к активному труду.
Выполнять хирургическое вмешательство необходимо в максимально ранние сроки, сократив до минимума консервативный период и тем самым сохранив подслизисто-слизистый слой прекардиального участка пищевода от рубцевания и превращение пищевода в недренирующийся ме- шок-“мегаэзофагус”. В противном случае операция требует еще более сложных конструкторских
Российский журнал
решений у больных, выделенных в 3-ю группу. В 3-й группе заболевания при полном стенозе
прекардиального участка и “мегаэзофагусе” у пожилых больных (возраст свыше 65 лет) применяли радикальную сегментарную эзофагокардиопластику (патент на изобретение, положительное решение от 30.01.1997 г. № 96122693/14). Операция выполнена у 5 больных из верхнесрединной лапаротомии.
После ССПВ (рис. 1) резецировали стенозированный и рубцово-измененный сегмент прекардиального отдела пищевода (рис. 4 а, б). До стенозированного сегмента абдоминальный пищевод дополнительно мобилизовали, максимально извлекая из средостения и значительно удлиняя его за счет расправления S-образного изгиба (рис. 4 б).
Связочный аппарат пищевода создавали в момент максимального извлечения последнего вшивными швами-связками к краям ПОД и ножкам диафрагмы (за их соединительнотканные футляры), фиксируя стенки пищевода за остатки пищеводно-диафрагмальной мембраны, параэзофагеальную клетчатку и сосудисто-нервные пучки, входящие в стенку пищевода.
Мышечные слои пищевода в швы не вовлекаются из-за опасности прорезывания. Благодаря вшивным швам-связкам пищевод хорошо фиксирован и не смещается в средостение, сохраняя достаточную (6–8 см) длину для конструирования “искусственной” кардии (рис. 4 б). Проксимальный отдел желудка подвижен, легко смещается к ПОД, месту фиксации низведенного пищевода.
Для формирования пищеводно-кардиального анастомоза широко обнажают подслизистые слои пищевода и кардии, 4 лигатурами-держалками максимально расправляют и поэтапно адаптируют компрессирующими серозно-мышечно-подсли- зистыми швами. Лучше применять рассасывающуюся мононить 5–6/0 на атравматической игле.
Итак, в анастомозе создается избыточная складчатость слизистой оболочки и тем самым восстанавливается главный арефлюксный компонент физиологической кардии – клапан Губарева.
Десерозированный (скелетированный) участок проксимальной части малой кривизны тела желудка ушивается 2–3 швами до анастомоза. Для восстановления замыкательной функции кардии создаются новые анатомические взаимоотношения между пищеводом, кардией и желудком в форме эзофагокардиогастрального клапана методом боковой инвагинации. Поэтапно абдоминальный пищевод и пишеводно-кардиальный анастомоз погружают между передней и задней стенками дна желудка серозно-мышечными швами (рис. 4 в).
Таким образом, восстанавливаются все компоненты физиологической кардии (угол Гиса, клапан Губарева) и, что особенно важно, – нижний пищеводный мышечный жом за счет широкой же-
гастроэнтерологии, гепатологии, колопроктологии |
4/2000 |
49 |

Рис. 7
Рис. 8. Рентгенограмма до операции
лудочной мышечной петли, замыкающей швами переднюю и заднюю стенки дна желудка над абдоминальной частью пищевода (рис. 4 в).
Всех больных обследовали в ближайший и отдаленный послеоперационные периоды в сроки от 3 мес до 3 лет. Из методов обследования использовали рентгенографию пищевода и желудка. Диаметр пищевода уменьшился до 3–4 см, после первого глотка начиналась порционная эвакуация из пищевода в желудок. Моторно-эвакуа- торная функция антрального отдела желудка привратника сохранена, желудочно-пищеводный рефлюкс отсутствовал.
При фиброэзофагогастродуоденоскопии – слизистая оболочка пищевода не изменена, пищевид- но-желудочный переход в виде плотно сомкнутой розетки, раскрывающейся при интенсивном нагнетании воздуха, пищевод расширен до 4 см в диаметре, привратник функционирует. Моторика пищевода и желудка – градиент пищеводно-же-
Рис. 9. Рентгенограмма после операции
лудочного давления 12,0±1,2 см вод. ст., амплитуда сократительной волны увеличилась до 15,0±3,3 см вод. ст., а продолжительность снизилась до 13,0±2,3 с.
Полученные данные убедительно свидетельствуют о наличии искусственно созданной кардии, а отсутствие таких осложнений, как пептическая язва пищевода, рефлюкс-эзофагит, язвеннонекротический эзофагит, говорит о естественной функции искусственно созданного пищеводножелудочного перехода (рис. 5, 6).
У больных молодого возраста 3-й группы с запущенной формой ахалазии экстирпировали сли- зисто-подслизистый слой пищевода и замещали его левой половиной ободочной кишки, проведенной через сохраненный мышечный футляр (патент на изобретение № 2143234 от 27.12.1999 г ).
Операцию начинали с расширенной верхнесрединнонижней лапаротомии. Выполняли ССПВ с
Российский журнал
50 |
4/2000 |
гастроэнтерологии, гепатологии, колопроктологии |
