
4 курс / Акушерство и гинекология / Морозова_К_В_Полиморфизм_генов_ферментов_детоксикации,_антиоксидантной
.pdfС целью выяснения характера проявления наследуемого признака, нами был проведен аддитивный тест Кохрана-Армитажа. По результатам было установлено, что у пациенток основной группы имеется доминантная модель наследования аллеля А, из чего следует что оба генотипа А/А и G/А являются рисковыми по развитию невынашивания беременности у данных пациенток: χ² =5,47, р=0,02. Также нами установлено, что у пациенток носителей аллеля А в 1,61 раза выше шанс потери беременности в первой половине гестации, по сравнению с носителями аллеля G. (OR=1,61, р=0,02, 95% df= 1,06-2,43).
По данным литературы (60, 98, 150) у носителей аллелей А rs 4680 гена СОМТ снижена активность фермента катехол-О-метилтрансферазы, который несет ключевую роль в процессе распада катехоламинов. Учитывая тот факт, что в нашей работе мы выявили ассоциацию полиморфизма rs 4680 с невынашиванием первой половины беременности, нам представляется интересным оценить экспрессию гена СОМТ.
По вышеописанной методике нами была определена активность фермента катехол-О-метилтрансферазы у обследованных женщин.
Установлено, что у носителей минорного аллеля А в гомозиготном состоянии наблюдалась самая низкая активность фермента 226,52 ± 79,18 мкмоль/мг; у женщин с гетерозиготным генотипом G/А активность фермента была достоверно выше и составила 335,88 ± 82,74 мкмоль /мг; а у носителей дикого генотипа G/G активность фермента была самой высокой 564,67 ± 156,77 мкмоль/мг. Полученные нами данные совпадают с популяционными значениями и соответствуют данным литературы (98, 150).
При анализе полученных результатов мы установили, что у женщин контрольной группы с аллелем А в гомозиготном состоянии уровень активности фермента достоверно выше, чем у основной группы - 256,02 ± 65,12 и 204,19 ± 82,32 мкмоль /мг соответственно (t=-2,74, p=0,008).
Полностью аналогичная ситуация выявлена и у носителей гетерозигот G/А - 318,19 ± 72,3 мкмоль/мг в основной группе и 367,34 ± 91,05 мкмоль /мг в
81

контрольной; данные показатели так же достоверно отличались (t=-3,42, p=0,0008).
мкмоль гвоякола/мг
800
700
600
500
400
300
200
100
0
 *
*
*
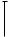 *
*
СОМТ А/А |
СОМТ A/G |
СОМТ G/G |
||||
|
|
Основная группа |
|
|
Контрольная группа |
|
|
|
|
|
|||
* Различия статистически достоверны, р< 0,05.
Рис.14. Средняя активность катехол-О-метилтрансферазы у женщин основной и контрольной групп в зависимости от генотипа rs 4680 (А1947G) гена СОМТ.
При сравнении активности фермента у пациенток с гомозиготным генотипом по аллелю G оказалось, что у женщин с невынашиванием беременности средняя активность фермента составила 474,47 ± 95,64 мкмоль /мг, что было достоверно меньше, чем у здоровых женщин 630,49 ± 160,78
мкмоль /мг (t=-4,49, p=0,00009) ( Рис.14).
Для оценки взаимосвязи активности фермента катехол-О-метилтрансферазы и невынашивания беременности, мы сравнили среднюю активность у женщин основной и контрольной групп (Рис.15).
В нашем исследовании средняя активность фермента катехол-О- метилтрансферазы у женщин, страдающих привычным невынашиванием беременности, оказалась достоверно ниже, чем у женщин контрольной группы (t=-5,68, p=0,0000).
82

|
600 |
|
|
500 |
* |
/мг |
|
|
400 |
|
|
гвоякола |
|
|
300 |
|
|
|
|
|
мкмоль |
200 |
|
|
|
|
|
100 |
|
|
0 |
|
|
Основная группа |
Контрольная группа |
* Различия статистически достоверны, р< 0,05.
Рис.15. Средняя активность фермента катехол-О-метилтрансферазы у женщин основной и контрольной групп.
На основании приведенных выше данных можно сделать вывод о взаимосвязи пониженной активности фермента катехол-о-метилтрансферазы с риском невынашивания первой половины беременности. Для обеих изученных групп показано также наличие генетически обусловленного изменения активности фермента: наименьшая активность выявлена у носителей генотипа А/А, наибольшая активность – у носителей генотипа
G/G.
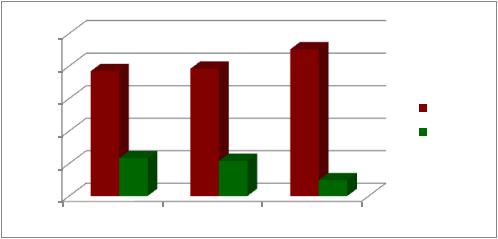
Нам было интересно также проследить частоту встречаемости эстроген зависимых гинекологических заболеваний у обследованных пациенток в зависимости от генотипа rs 4680 гена СОМТ. Выявлено, что миома матки достоверно чаще наблюдалась у группы пациенток носителей аллеля А (в гомозиготном и гетерозиготном состоянии), χ² =13,35, р=0,0003, также достоверно ассоциированного с невынашиванием в данной группе пациенток.
83
* Различия статистически достоверны, р< 0,05.
Рис.16. Распределение частоты встречаемости эстрогензависимых заболеваний в зависимости от генотипа rs 4680 гена СОМТ.
Что касается аденомиоза, то у пациенток с генотипом А/А и G/А также наблюдалось значительное превалирование данного заболевания, по сравнению со здоровыми женщинами, χ² =12,78, р=0,0004. Фибрознокистозная мастопатия выявлена в подавляющем большинстве (более 90%) у носителей гомозиготы А/А и гетерозиготы G/А, тогда как среди группы контроля практически не встречалась, χ² =28,71, р< 0,0001 (Рис.16).
Вышеперечисленные данные подтверждают наличие у пациенток основной группы склонности к гиперэстрогении, что может косвенно являться предрасполагающим фактором для развития невынашивания беременности.
В ходе нашего исследования мы также изучили ассоциацию носительства аллелей rs 4680 гена СОМТ с риском развития экстрагенитальной патологии у обследованных пациенток.
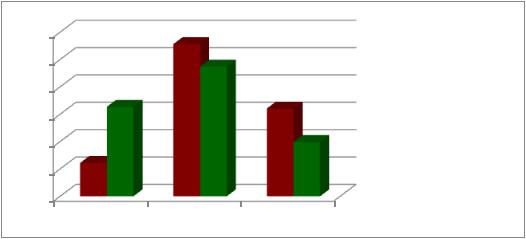
Установлено, что в группе пациенток с нормальным гемоглобином генотип G/G выявлен в 32,69 % (n=51) наблюдений, а у пациенток с анемиейвсего у 12,22 % (n=13) пациенток, χ² =5,04, р=0,03 (Рис.17).
Гетерозиготный генотип G/A примерно в равном проценте наблюдался в обеих группах, как с наличием анемии, так и при нормальном гемоглобине
– у 47,43% (n=74) и 55,66 % (n=59), разница не была достоверна (Рис.17).
84
60% |
* |
50%
40%
*
30%
20%
10%
0%
 Группа пациенток с анемией
Группа пациенток с анемией
 Группа пациенток с нормальным гемоглобином
Группа пациенток с нормальным гемоглобином
СОМТ G/G СОМТ G/A СОМТ A/A
Рис.17. Распределение генотипов rs 4680 (А1947G) гена COMT у пациенток с анемией во время беременности
Что касается минорного генотипа А/А, то среди пациенток с анемией он выявлен в 32,07% (n=34), тогда как среди пациенток с нормальным гемоглобином наблюдался в 19,87% ( n=31) наблюдений, что было достоверно различно: χ² =14,27, р=0,002 (Рис.17).
С целью выяснения характера проявления наследуемого признака, нами был проведен аддитивный тест Кохрана-Армитажа. Было установлено, что у пациенток с анемией наблюдается доминантная модель наследования аллеля А, из чего следует что оба генотипа А/А и G/А являются рисковыми по возникновению анемии во время беременности: χ² =13,65, р=0,002. При оценке рисков установлено, что у носителей аллеля А в 1,93 раза выше шанс развития анемии во время беременности, по сравнению с носителями аллеля
G. (OR=1,93, р=0,02, 95% df= 1,34-2,8).
4.2 Роль полиморфизма гена фермента эксцизионной репарации ДНК (OGG1) в течении и прогнозе беременности.
Поскольку все процессы, происходящие в клетке, связаны со структурой молекулы ДНК, поддержание ее целостности играет крайне важную роль в обеспечении гомеостаза организма (57).
85
Система репарации, то есть восстановление повреждений в молекуле ДНК, функционирует благодаря множеству механизмов от простых (фотореактивация, деалкилирование) до многоэтапных, функция которых осуществляется под контролем множества генов (57, 80). Одним из наиболее сложных путей репарации, реализующимся по аналогии с оперативным вмешательством в молекулу ДНК, является каскад реакций эксцизионной репарации (base excision repair, BER). Мишенью для системы BER являются алкилированные, неправильно спаренные и другие основания, внутриклеточные радикалы кислорода и другие генотоксические соединения. В процессе репарации первым звеном является распознавание дефектных оснований высоко специфическими ферментами гликозидазами (57).
Основным ферментом эксцизионной репарации ДНК является 8- оксогуанин-ДНК-гликозилаза (OGG1), осуществляющая элиминацию из молекулы ДНК окисленных оснований, которые, как известно, образуются под действием активных форм кислорода (8). Его функция реализуется благодаря вырезанию из молекулы ДНК мутантного окисленного основания 8-oxoG, активно участвующего в развитии многих патологических процессов, включая канцерогенез (24). Фермент OGG1 обладает двумя функциями, с одной стороны проявляя себя как гликозилаза, с другойапуриновая/апиримидиновая (регион АР) лиаза. Процесс репарации ДНК под действием OGG1 происходит в два этапа: первыйгидролиз гликозидной связи 8-oxoG , на втором этапе происходит расщепление связи в регионе АР (80). Таким образом, при участии фермента OGG1 реализуются важнейшие процессы поддержания первозданной структуры молекулы ДНК, благодаря чему организм защищается от мутагенного воздействия со стороны генотоксических веществ (7). Однако, в условиях недостаточности системы репарации в клетке накапливаются мутации, приводящие к развитию многих соматических заболеваний (141, 164).
Ген OGG1, кодирующий фермент 8-оксогуанин-ДНК-гликозилазу, располагается на 3 хромосоме (24). Изменения в структуре гена с
86
формированием полиморфного варианта могут сопровождаться экспрессией неполноценного фермента, что приводит к снижению защитной системы репарации ДНК и уязвимости организма перед возникающими мутагенами. Полиморфизм гена OGG1 ассоциирован с риском развития онкологических заболеваний различной локализации (95, 96, 164). Проблема мутагенеза особенно актуальна для организма во время беременности, так как в условиях нарушения механизмов репарации под удар ставится как материнский организм, так и формирующиеся клетки и ткани нового дочернего организма, однако взаимосвязь невынашивания беременности с носительством полиморфных вариантов гена OGG1 в литературе не описана. Объектом нашего исследования как раз являлось изучение влияния полиморфизма гена OGG1 на течение беременности I и II триместра.
Наиболее изученным является однонуклеотидный полиморфизм rs1052133 (С977G) гена OGG1, приводящий к замене цитозина на гуанин, что сопровождается изменением в строении белка с заменой аминокислоты серина на цистеин (163). По данным литературы, носительство аллеля С ассоциировано со снижением активности фермента 8-оксогуанин-ДНК- гликозилазы (90).
Нам представляется интересным изучение распределений генотипов данного полиморфизма у женщин с невынашиванием первой половины беременности в сравнении со здоровыми фертильными пациентками.
Мы провели генотипирование пациенток основной и контрольной групп; полученные результаты представлены на (Рис. 18).
87

*Различия статистически достоверны, р< 0,05.
Рис.18. Распределение генотипов rs1052133 (С977G) гена OGG1 у пациенток основной и контрольной групп.
Согласно результатам проведенного нами генотипирования, гомозиготный генотип С/С в основной группе встречался в подавляющем большинстве случаев63% (n=94), в группе контроля данный генотип также являлся самым распространенным и составил 72% (n= 87) наблюдений, что, однако, не являлось достоверно различным. В популяции европеоидов этот генотип также выявлен более чем у 60% (Рис. 18)
Гетерозиготы С/G выявлены у 30,80 % (n=46) среди женщин с невынашиванием беременности, а в контрольной группе этот показатель составил 27,2% (n=33), что также не различалось и находилось на уровне общепопуляционных 30% европеоидов (Рис. 18).
Интересные результаты получены нами при сравнении частот распределения гомозиготного генотипа G/G. Среди пациенток с потерей беременности в I и II триместрах этот генотип выявлен у 6,04 % (n= 9), при этом в группе контроля всего одна пациентка оказалась носителем генотипа G/G – 0,8 %, что оказалось статистически достоверным χ² =5,09, р=0,02. В европейской популяции, согласно данным литературы, данный генотип также встречается крайне редко. Учитывая достоверно более частое носительство генотипа G/G у пациенток основной группы с невынашиванием беременности, можно утверждать, что носительство аллеля
88

G оказывает неблагоприятное влияние на течение первой половины беременности (Рис. 18).
При проведении аддитивного теста нами было установлена доминантная модель наследования аллеля G в гетерозиготном состоянии над аллелем С (χ² =4,29, р=0,03), что может оказывать неблагоприятное влияние на течение беременности. Учитывая наличие аддитивного эффекта, мы рассчитали отношение рисков носительства аллелей исследуемого полиморфизма. По результатам проведенного сравнения носительство аллеля G полиморфизма rs1052133 гена OGG1 превалировало у женщин с невынашиванием беременности, по сравнению с аллелем С (OR=1,62, р=0,04, 95%, df= 0,38-0,99). На основании приведенных выше данных можно утверждать, что у пациенток - носителей аллеля G вероятность невынашивания беременности в 1,62 раза выше, чем у носителей аллеля С.
Для уточнения распределения генотипов относительно сроков прерывания беременности нами проведено сравнение двух подгрупп пациенток с репродуктивными потерями.
*Разница статистически достоверна, р< 0,05.
Рис. 19. Распределение аллелей rs1052133 (С977G) гена OGG1 у пациенток при потере беременности на сроке 7-10 недель.
По результатам проведенного сравнения установлено, что гомозигота С/С выявлена у пациенток с репродуктивными потерями на сроке менее 10 недель в 68% (n=53) наблюдений, что не являлось существенно отличным от общей группы контроля, где этот показатель составил 72 % (n=87) (Рис. 19).
89
Достоверной разницы также не получено при анализе частот встречаемости генотипа С/G, он выявлен у 24,3 % (n=19) женщин с потерей беременности на сроке до 10 недель и у 27,2% (n= 33) здоровых женщин
(Рис. 19).
Относительно гомозиготного генотипа G/G получены значения, совпадающие с результатами сравнения общей основной группы и группы контроля. Так, у пациенток с невынашиванием на сроках беременности менее 10 недель этот показатель составил 7,60 % (n=6) против 1 пациентки контрольной группы (χ² =6,59, р=0,01). Таким образом, генотип G/G достоверно превалировал в группе пациенток с репродуктивными потерями (Рис. 27). Результаты, полученные в группе с потерей беременности в относительно ранние сроки беременности (до 10 недель), могут объясняться большей вероятностью реализации промутагенных повреждений 8-охоG в грубые генные и хромосомные аномалии плода при генетически обусловленной сниженной активности фермента OGG1, особенно в условиях оксидативного стресса, сопутствующего протеканию беременности I триместра.
Более интересные результаты получены при изучении подгруппы пациенток с потерей беременности в сроках 10 недель и более. Среди пациенток с репродуктивными потерями на сроках 10 недель и более гомозиготный генотип С/С выявлен в 59% (n=54) случаев, тогда как в группе контроля этот показатель оказался несколько выше и составил 72 % (n=87), однако достоверной разницы выявлено не было (Рис.20).
Гетерозигота C/G в обеих группах наблюдалась примерно в равном проценте случаев, у пациенток с невынашиванием на сроках более 10 недель генотип C/G выявлен в 36,3% (n=33), что достоверно не отличалось от группы контроля, где этот показатель оказался равен 27,2% (n=33) (Рис.20).
90
