
Курс лекций по дисциплине
«Материаловедение и материалы электронных средств»
специальность 210201 «Проектирование и технология РЭС»
Автор: доцент каф. наноинженерии к.т.н. Архипов А.В.
Основы материаловедения
Вещество – совокупность взаимосвязанных атомов, ионов или молекул.
Материал – один из видов вещества, который идёт на изготовление изделия и представляет собой промежуточный продукт переработки вещества в изделие. Этот продукт, как правило, отвечает потребностям конкретного производственного процесса, имеет сложный химический состав и (или) наперёд заданную внутреннюю структуру и внешнюю форму.
Пример:
вещество – железо, медь, кремний, полиэтилен, глинозём;
материал – сталь (стальной прокат), медная фольга, полиэтиленовая плёнка, корундовая керамика.
В физике используют понятие твёрдое тело, понимая под этим вещество в твёрдом состоянии.
Содержание предмета материаловедение можно отразить общей формулой:
состав – структура – свойства
Состав
Все простые вещества в соответствии с положением в периодической таблице элементов Менделеева делятся на металлы (80 элементов), полуметаллы и неметаллы.
Лишь немногие из металлов применяются в технике в элементарном виде.
Например, для реализации хорошей электропроводности: серебро Ag, медьCu, золотоAu, платинаPt, палладийPd.
В основном, металлы используются в виде сплавов. Их количество огромно, свойства разнообразны, вследствие чего, создание новых сплавов является актуальной задачей.
Среди полуметаллов особое значение имеют элементарные полупроводники (13 элементов), такие как кремний Si, германийGe, селенSe, серое оловоSn, углерод С в структуре алмаза с примесями и т.д.
Неметаллы (12 элементов) в элементарном виде практически не используются. 9 элементов из них – газы , 1 (Br) – жидкость, 2 (S,I) – летучие легкоплавкие элементы.
Однако, значение неметаллов огромно, так как в соединениях с металлами они образуют всё многообразие простых и сложных неорганических химических соединений с новыми, неприсущими исходным веществам, свойствами, которые и являются материалами РЭС.
Существует 4 типа связи:
ионная;
ковалентная;
металлическая;
молекулярная
Ионная связь – отличается присвоением одним из элементов химического соединения валентных электронов второго.
Ковалентная связь – характеризуется равномерным распределением валентных электронов между атомарными остовами веществ, составляющих соединение.
Металлическая связь – характеризуется наиболее полным обобществлением валентных электронов. У металлов кристаллические решётки «погружены» в электронный газ.
Молекулярная связь – является наиболее слабой. Она обусловлена кулоновским взаимодействием между разно заряженными участками молекул.
В чистом виде химические связи практически не встречаются. Наблюдаются смешанные: ионно-ковалентная, ковалентно - металлическая.
Структура
Понятие структура имеет 4 аспекта:
Степень упорядоченности в расположении микрочастиц.
Особенности их взаимного расположения.
Вид и концентрация кристаллических дефектов (дефектоструктура).
Состав и строение фаз.
По степени упорядоченностиразличают тела кристаллические и аморфные.
Кристалл – твёрдое тело, имеющее трёхмерное периодически правильное пространственное расположение микрочастиц, то есть дальний порядок.
Аморфное тело – тело, не располагающее дальним порядком. Однако считать аморфные тела хаотическими, неструктурированными – не правильно. В них наблюдается ближний порядок в расположении микрочастиц.
Границей, условно разделяющей кристаллические и аморфные тела, принято считать метод исследования упорядоченности структуры.
Существует рентгеноструктурный анализ, позволяющий засечь (найти) кристаллиты (упорядоченные области) в структуре материала размером 100 нм. Поэтому, применив этот метод, и не найдя признаков упорядоченности, говорят, что данное тело рентгеноаморфно.
Монокристалл – единичный относительно крупный кристалл с совершенной структурой, заданными свойствами и полученный, как правило, искусственным путём.
Поликристалл – совокупность неориентированных относительно друг друга зёрен кристаллитов. При этом кристаллиты не являются монокристаллами, так как они не единичны, малы, их структура, как правило, искажена.
Свойства монокристалла в основном определяются природой вещества, а свойства поликристалла, помимо этого, зависят от размера кристаллитов, состава и структуры границ зёрен.
Граница зёрен – нарушение периодичности расположения микрочастиц, сопровождающееся появлением оборванных, ненасыщенных связей, которые сильно влияют на механические, химические и физические свойства материалов, в том числе и на электропроводность.
Порядки величин удельного сопротивления если принять удельное сопротивление монокристаллического проводника за единицу, то:
ρмонокристалла– 1, ρполикристалла– 10, ρаморфного тела– 100
Особенности взаимного расположения микрочастиц
Эти особенности изучает предмет кристаллография.
Минимальный повторяющийся объём кристаллический структуры называется элементарной ячейкой. Размер элементарной ячейки (период повторения) называется параметром элементарной ячейки.
Установлено 14 типов элементарных ячеек, которые различаются размерами рёбер, углами между рёбрами и т.д.
Доказано, что другие геометрические тела не могут обеспечить полного заполнения.
Все типы пространственных решёток разбиты на 7 сингоний. Наиболее распространенной в природе является кубическая сингония, в которой различают несколько видов решеток, например, на рисунке 1.
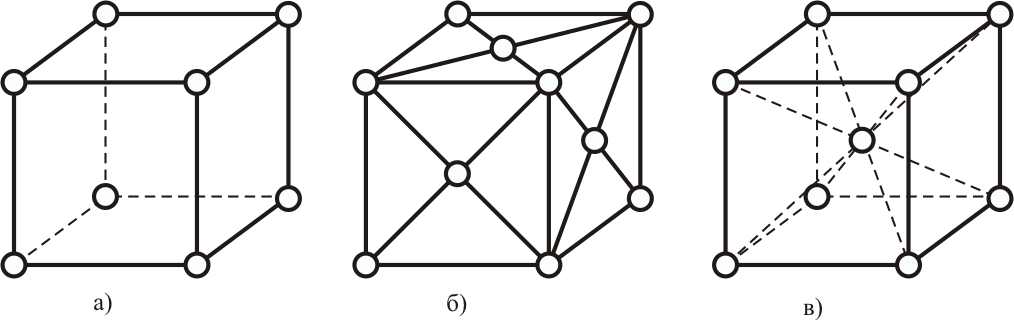
Рисунок 1 - Виды кубических решёток
а) – простая; б) - гранецентрированная (ГЦК); в) - объёмноцентрированная (ОЦК).
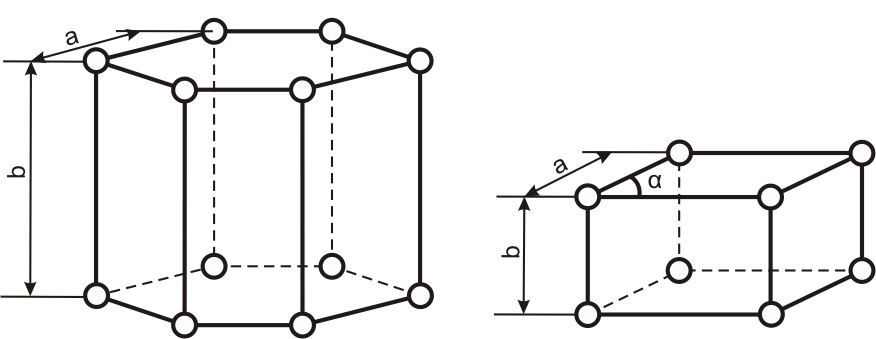
Рисунок 2. Гексагональная кристаллическая решётка
Рисунок 3. Тригональная кристаллическая решётка
Примеры:
Ag,Al,Au,Pt,Pb,Cu, некоторые сложные полупроводниковые соединения (GaAs)– ГЦК;
Sn– ОЦК;
элементарные полупроводники (Si,Ge) – алмазоподобная кубическая решётка.
Если кристалл имеет форму естественного правильного многогранника, легко установить, что свойства различных граней неодинаковы, то есть имеет место анизотропия.
В кубической кристаллической решётке простыми (сингулярными) гранями являются представленные на рисунке 4.

Рисунок 4 – Сингулярные грани кубической сингонии
Вполне очевидно, что плотность расположения атомов даже на простых сингулярных гранях различна. В порядке убывания плотности: (1,1,1); (1,0,0); (1,1,0).
Дефектоструктура
До сих пор речь шла об идеальной решётке. На практике можно утверждать: идеальных кристаллов не существует ни в природе, ни в технике.
Всё многообразие существующих дефектов структур можно разбить на два класса:
IДинамические (временные) дефекты. Оказывают существенное влияние, на них нельзя повлиять. Пример: фононы – кванты тепловой энергии – элементарное колебание атома в решётке. Отсутствие данного дефекта возможно только при 0° К.
IIСтатические (постоянные) дефекты. Их классифицируют по геометрическому признаку:
Точечные, 0-мерные. Являются самыми маленькими и распространёнными (вакансии, междоузельные атомы, примесные атомы)
Линейные, 1-мерные. К ним относят различные виды дислокаций: винтовые, сдвиговые, несовпадения и другие. Вследствие возникновения внутри кристаллической решётки протяжённого ряда атомов с оборванными связями образуется дислокационная пора, пронизывающая весь кристалл (рисунок 5).
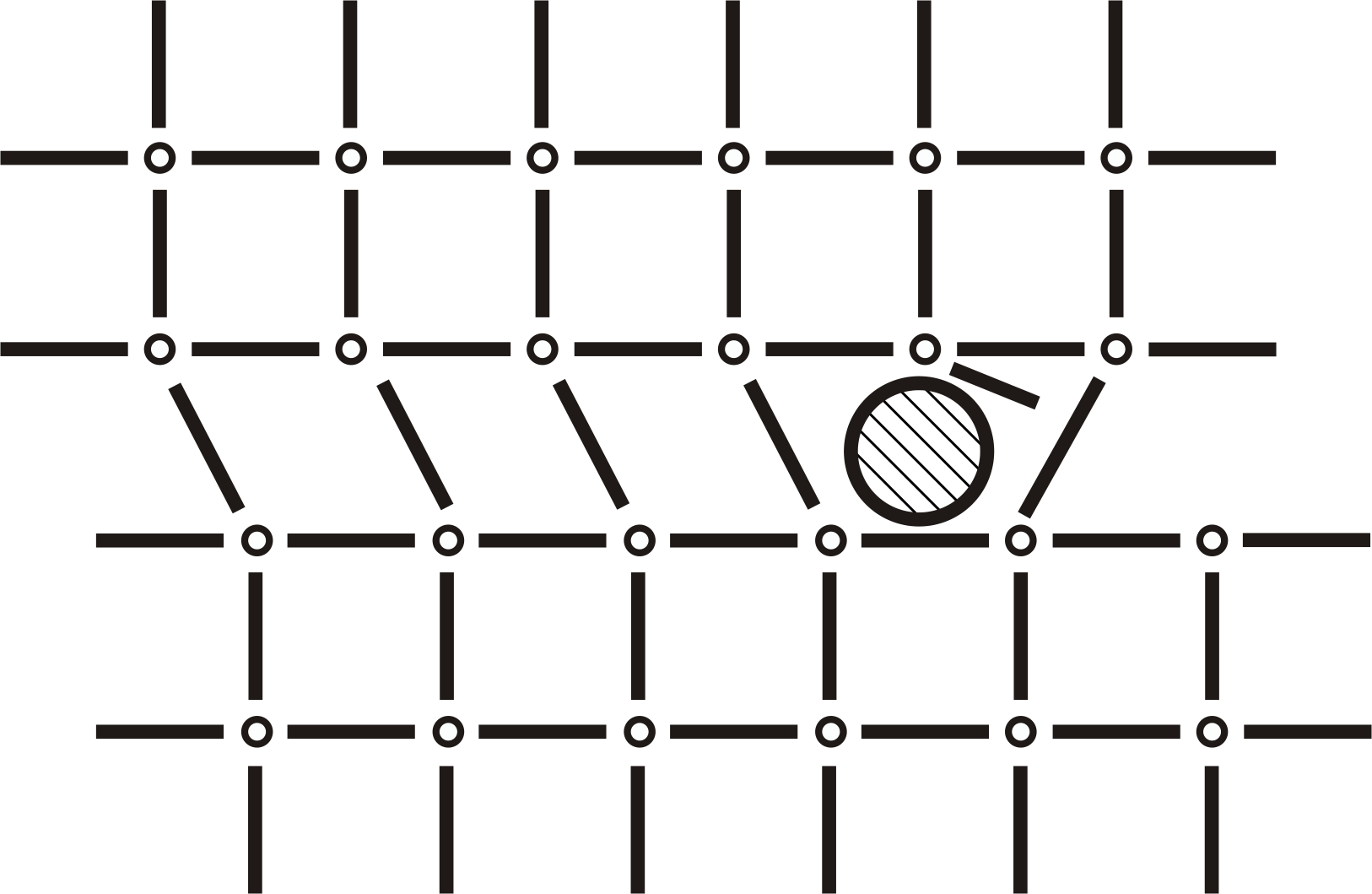
Рисунок 5. Сдвиговая дислокация
Плоскостные, 2-мерные. Наиболее большим дефектом кристалла является его поверхность. Также к плоскостным дефектам относятся границы зёрен в поликристаллической структуре вещества (рисунок 6). Возможно возникновение границы двойникования, при переходе через которую наблюдается зеркальное отображение структуры кристаллической решётки (рисунок 7).


Рисунок 6 Рисунок 7
Объёмные, 3-мерные. К ним относятся трещины, сколы, макропустоты, макровключения иной фазы.
Практически все статические дефекты сопровождаются оборванными связями, которые стремятся к завершению. Таким образом, дефекты оказывают существенное влияние на движение носителей заряда, так как фактически представляют собой своего рода микро- и наноконденсаторы, накапливающие заряд и разряжающиеся при смене полярности. Это приводит к увеличению времени быстродействия переходных процессов и, соответственно, к ограничению быстродействия.
Состав и строение фаз
Данный аспект лучше всего иллюстрируется теорией сплавов.
Элементы теории сплавов
Металлическим сплавом называется вещество, полученное сплавлением двух или более исходных веществ (компонентов) преимущественно металлических. Помимо сплавления сплавы получают спеканием, электролизом и другими методами.
При кристаллизации сплавов могут образовываться следующие твёрдые фазы: твёрдый раствор, химическое соединение, механическая смесь.
Твёрдые растворы– наиболее распространённая форма существования сплава. Характерная особенность – сохранение типа кристаллической решётки растворителя (доминирующего компонента). Различают два варианта образования твёрдых растворов:
Твёрдые растворы замещения
Твёрдые растворы внедрения
В твёрдых растворах замещения атомы растворяемого компонента встроены в кристаллическую решётку растворителя. Существуют сплавы с ограниченной и неограниченной растворимостью. В случае ограниченной растворимости количество растворяемого компонента, вводимого в объём растворителя, как правило, не велико. При превышении определённого количества происходит выделение растворяемого компонента в виде включения иной фазы. Неограниченная растворимость возможна в том случае, если решётки растворяемого компонента и растворителя изоморфны, что подразумевает схожесть кристаллического строения, близость атомарных радиусов, рассогласование не более 8-13%, близость физико-химических свойств. Причём перечисленные условия являются необходимыми, но не достаточными, так как на практике такое совпадение маловероятно. Наиболее приближенный вариант – в сплаве решётка одного компонента плавно переходит в решётку другого, замещает.
Твёрдые растворы внедрения образуются внедрением атомов в поры кристаллической решётки растворителя. Это возможно, когда внедряемые атомы имеют малые размеры (атомы водорода, углерода, азота, бора). Их атомы проникают в объем, но не встраиваются.
Химические соединения
Характерными особенностями химических соединений являются:
Постоянство свойств и состава, которое может быть выражено химической формулой.
Образуется новый тип кристаллической решетки, отличной, как правило, от решеток исходных компонентов.
Постоянство температуры кристаллизации – как у чистых компонентов.
Все химические соединения делятся на 2 группы:
Соединения типичных металлов с типичными неметаллами (оксиды, сульфиды, хлориды и т.д.)
Металлические химические соединения отличаются разнообразием типов химических связей с доминантой металлической связи. Их отличает наличие металлического блеска, электропроводности и т.д. К ним относят: сплавы металлов с углеродом (карбиды), с азотом (нитриды), с водородом (гидриды), с бором (бориды) и т.д.
Механические смеси.
Образуются при сплавлении компонентов с большим различием атомных радиусов и электрохимических свойств. Их взаимная растворимость очень мала, из чего следует, что при кристаллизации образуется чисто механическая смесь кристаллитов исходных компонентов. Например, сплавы свинца с сурьмой, цинка с оловом.
