
- •Қазахстан республикасы білім және ғылым министрлігі
- •1. Пәннің оқу бағдарламасы – syllabus
- •1.1 Оқытушылар туралы мәліметтер
- •1.2 Пән туралы мәліметтер:
- •Оқу жоспарының көшірмесі
- •Әдебиеттер тізімі
- •1.8 Білімді бақылау және бағалау
- •Студенттердің білімдерін бағалау
- •Модуль бойынша сұрақтар тізімі
- •1 Модуль
- •2 Модуль
- •2.2 Дәрістік сабақ конспектілері.
- •1 Тақырып: Кіріспе. Инженерлік жүйелер туралы жалпы мәліметтер.
- •2 Тақырып: Техникалық термодинамикадан жалпы мәліметтер.
- •3 Тақырып. Жылу алмасу негіздері.
- •4 Тақырып. Жылу энергия көздері.
- •1 Сурет
- •5 Тақырып. Жылумен жабдықтау жүйелер.
- •7 Сурет.
- •8 Сурет.
- •6 Тақырып: Жылыту жүйелері туралы жалпы түсініктер
- •7 Тақырып: Сумен жылыту жүйелері
- •8 Тақырып. Ыстық сумен қамту жүйелері
- •9 Тақырып. Желдету және ауа баптау жүйелері
- •45 Сурет.
- •10 Тақырып. Газбен қамту жүйелері
- •11 Тақырып. Сумен қамту жүйелері туралы жалпы түсініктер
- •13 Тақырып. Канализация жүйелері.
- •14 Тақырып. Ауа бассейнін қорғау жүйелері.
- •15 Тақырып Су ресурстарын қорғау жүйелері
- •2.3. Тәжірибе сабақтардың тақырыптары
- •5 Тапсырма: Сумен жылытатын жылыту жүйелерді есептеу негіздері
- •7 Тапсырма : Қоршаған ортаны қорғау жүйелер элементтерін есептеу.
- •2.4. Студенттердің оқытушы жетектелуімен өзіндік жұмысы (соөж)
- •2.5. Студенттердің өзіндік жұмысы ( сөж)
- •7 Тапсырма:
- •2.6. Өзіндік бақылау үшін тестілік тапсырмалар.
- •Дұрыс жауаптар кестесі
- •Курс бойынша емтихандық сұрақтар.
- •Глоссарий
- •050729 «Құрылыс» мамандығына арналған
- •Оқу-Әдістемелік кешен
2 Тақырып: Техникалық термодинамикадан жалпы мәліметтер.
Жылу - газбен қамту және желдету инженерлік жүйелерді жобалау және пайдалану үшін жылу техникасының теориялық негіздері жайындағы білім аса маңызды болып табылады. Жылу техникасының теориялық негіздері техникалық термодинамика және жылу алмасудың көптеген мәселелерінен тұрады.
Күй параметрлері.
Әр түрліжылу техникалық аппараттарда, құрылғыларда және жүйелерде жұмыстың дене деп аталатын заттар қолданылады. Жұмыстық дене деп көбінесе газдарды, сұйықтарды және буларды айтады. Олардың физикалық күйін күй переметрлермен сипаттайды. Термодинамикада күй параметрлерге температура қысым, меншікті көлем немесе тығыздық жатады.
Температура Т (К) немесе t ( C0) заттың қыздырылу дәрежесін сипаттайтын параметр. Оның мәні зат молекулаларының ілгерілемелі қозғалуының орташа кинетикалық энергиясымен анықталады. Температураны өлшейтін Кельвин және Цельский шкалалар былай байланысады:
Т = t +273, 15. (1)
Қысым р (Па) - ыдыстағы заттың (газдың, сұйықтың) молекулаларының ыдыс қабырғасына соққылау нәтижесімен анықталатын параметр. Жылу техникада абсолютті Ра, артық Рар. және вакуумметрлік (рвак) қысымдар ұғымдары қолданылады.
Абсолютті қысым - заттың (жұмыстық дененің) толық қысымы:
Ра= Р ар + Р б (2)
мұнда Р б - барометрлік (атмосфералық) қысым, Па.
Артық қысым абсолюттік қысыммен барометрлік қысымның айырымы болып табылады:
Рар = Р а - Р б (3)
Вакуумметрлік қысым атмосфералық қысым мен абсолютті қысымның айырымы болып анықталады:
Рвак = Р б - Р а (4)
Меншікті көлем V (м3/ кг) - заттың бірлік массасының көлемі болып анықталады:
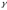 =V
/G ,
(5)
=V
/G ,
(5)
мұнда V, м3- заттың толық көлемі, G, кг- массасы.
Тығыздық
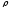 (кг/м3)
- заттың
көлем
бірлігінің
массасы:
(кг/м3)
- заттың
көлем
бірлігінің
массасы:
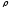 =
G / V
(6)
=
G / V
(6)
күй
параметрлер
Р,
 және
Т
арасындағы
байланыс
күй
теңдеумен
бейнеленеді.
Идеалдық
газ
және
Т
арасындағы
байланыс
күй
теңдеумен
бейнеленеді.
Идеалдық
газ
(идеал деп молекулалары өз ара әрекеттеспейтін және олар көлемсіз материалдық нүктелер түрде қараластыратын газды айтады) үшін күй теңдеу былай жазылады:
-
газдың
бірлік
массасы
үшін
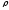
 =RT
(7)
=RT
(7)
- еркін массасы үшін PV=GRT (8)
Осы теңдеулердегі R- газ тұрақтысы., Дж /(кг.К).
Әр бөлек газ үшін R-ң сан мәні универсал газ тұрақтысы Rу = 8314 Дж /(Кмоль.К) арқылы табылуы мүмкін:
R=
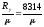 .
(9)
.
(9)
мұнда
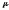 -газдың
салыстырмалы
молекулалық
массасы..
-газдың
салыстырмалы
молекулалық
массасы..
Жылу сыйымдылық
Жылу сыймдылық деп заттың бірлік мөлшерінің (1 кг, 1м3, 1 кмольдің) температурасын бір градусқа жоғарлатуға қажетті жылу шамасын айтады.
Заттың
алынған
бірлік
мөлшеріне
қарай
массалық
с,
кДж/(кг.К),
көлемдік
с1,
кДж(м3.К)
және
мольдік
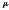 cкДж/(кг.К)
жылу
сыйымдылықтарды
айырады.
Бұлар
былай
байланысады:
cкДж/(кг.К)
жылу
сыйымдылықтарды
айырады.
Бұлар
былай
байланысады:
с=
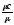 , c1=
, c1=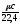 , c1=c
, c1=c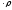 (10)
(10)
Жылу техникада сонымен қатар орташа және шын жылу сыйымдылық ұғымдары қолданылады. Егер 1 кг зат t1 температурадан t2 температураға дейін қыздырылу үшін q, кДж/кг жылу шығындалатын болса, онда
с
=
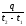 (11)
(11)
ден дейін температура аралығындағы орташа жылу сыйымдылық болып табылады. Температура айырымы t2-t1, неғұрлым аз болса, заттың жылу сыйымдылығы сол ғұрлым өзінің шын мәніне жақын болады. Олай болса, шын жылу сыйымдылықты былай табуға болады:
с=
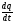 (12)
(12)
(11) өрнек негізінде заттың 1 кг берілген жылу шамасы.q
q = c ( t2-t1) , кДж/кг (13)
ал заттың G, кг берілген жылу шамасы
Q = G c (t2-t1) , кДЖ (14)
Газ тәрізді заттың жылу сыйымдылығы газға жылу берілу (алыну) жағдайларына тәуелді болады екен.
Арнайы тәжірибелер көрсету бойынша, егер газ көлемі тұрақты ( V=const) жағдайда қыздырылған болса, изохоралық деп аталатын сv жылу сыйымдылық табылады. Егер газға қысымы тұрақты ( Р= const ) жағдайда жылу берілетін болса сондағы анықталған ср изобаралық жылу сыйымдылық сv жылу сыйымдылықтан артық болып шығады. Араларындағы байланыс Майер теңдеуімен бейнеленеді:
ср- сv = R (15)
Газ қоспаларының жылу сыйымдылығы төмендегі өрнектермен анықталады:
сқос
=
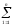 giсi
, сқос
=
giсi
, сқос
=
 riсi
, (16)
riсi
, (16)
мұндағы сі және сі і- ші газдың массалық және көлемдік жылу сыйымдылықтары, gi және ri- і- ші газдың массалық және көлемдік үлестері.
Термодинамиканың бірінші заңы
Энергияның сақталу және түрлену жалпы заңының бір саласын жылу құбылыстарына қолдануды термодинамиканың бірінші заңы деп атайды. Денеге жылу берілген (одан алынған) болса, ішкі энергиясы өзгеруі мүмкін.
Барлық заттардың толық энергиясының бір бөлігі ішкі энергия деп аталады. Ішкі энергия u молекулалардың қозғалу жылдамдығына және араларындағы әрекеттесуіне тәуелді болады.
Идеал газдың ішкі энергиясы тек қана бөліктерінің қозғалуына, яғни температураға тәуелді болады, сондықтан өзгерісі температура өзгерісімен анықталады:
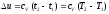 (17)
(17)
Газға жылу берілгенде (алынғанда) газ кеңею (сығылу) мүмкін, яғни көлем өзгеру жұмыс атқарылуы мүмкін.
Сонымен, жалпы жағдайда газға берілген жылу шамасы q ішкі энергиясының өзгеруіне және L жұмысқа шығындалады. Термодинамика бірінші заңының математикалық бейнелеуі мынаған келеді:
q=
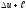 (18)
(18)
(18) өрнек 1 кг газ үшін жазылған.
G кг газ үшін:
Q
=
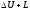 (19)
(19)
Көлем өзгеру жұмыс мынадай интегралдармен анықталады:
-
1 кг
газ
үшін
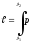 d
d (20)
(20)
-
G кг
газ
үшін
L = G∙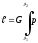 dv
(21)
dv
(21)
Газдың күй өзгеру процесін бейнелеп өту үшін қысым, температура, меншікті көлем деген күй параметрлерден басқа энтальпия және энтропия дейтін күй функциялары қолданылады.
Энтальпия і (кДж/кг, кДж/м3)- заттың бірлік шамасын (1 кг немесе 1 м3) нөл градустан (00 C ) t 0C -қа дейін қысым тұрақтылығында қыздыруға қажетті жылу шамасы болып табылады:
і = cр ∙t (22)
Энтропия s (кДж /(кг. К)) шаманың термодинамикалық процесс барысындағы өзгерісі процесс жылулығының абсолютті температураға қатынасы болып табылады:
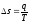 (23)
(23)
Термодинамиканың екінші заңы
Термодинамиканың бірінші заңы бойынша газ кеңею жұмыс орындап шығару үшін оған энергия (жылу) берілу керек. РV- диаграммадағы (2сур.) 1-А-2 кеңею процесінде газға "жылудың ыстық
көзінен" q1 жылу берілген болсын. Сыртқы күштерге қарсы газ кеңею ℓk жұмысын орындайды:
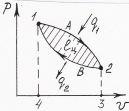
ℓk=
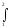 рd
υ
рd
υ
Интеграл шамасы 1А234 фигураның ауданына тең.
Осы
жұмыс
мерзімді
алынып
тұру
үшін
газ
бастапқы
күйіне
қайтарылу
керек,
яғни
сығылу
керек.
2 В
1 сығылу
процесінде
шығындалатын
жұмыс
ℓс=
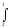 рd
υ.
рd
υ.
2 сурет.
Сығылу жұмысы ℓс 1В 2 3 4 фигураның ауданымен анықталады. 1А2В1 тұйықталған процесс цикл немесе айналма деп аталады. Цикл нәтижесінде алынатын пайдалы жұмыс ℓц кеңею және сығылу жұмыстардың айырымымен анықталады: ℓц =ℓk - ℓс=(1А234) - (1В234)= 1В2В1. Сығылу кезінде газдан жылу q2 "жылу қабылдағышқа" бұрылып әкетіледі. q2 -пайдасыз жылу. Цикл барысында пайдаға айналған жылу
qц = q1- q2 . (24)
Цикл соңында газ бастапқы күйіне оралады, сондықтан күй функциясы - ішкі энергиясы - u өзгеріссіз қалады: Δuц = 0.
Осыны ескергенде термодинамиканың бірінші заңы цикл үшін мына түрге келеді:
qц = Δuц +ℓ ц = ℓ ц .
(24) байланысты есепке алғанда
ℓц = q1- q2
Осындай тура айналмалар ( айналма жүрісі сағат тілі жүрісімен бағыттас) жылу қозғалтқыштарда орындалады. Тиімділігі термиялық пайдалы әсер коэффициентпен ηt сипатталады:
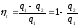 .
. (25)
(25)
q2 ≠0 болғандықтан ηt бірге тең болмайды. Осы жағдайды С.Карно былай тұжырымдаған: денеге әкелінген жылу толығымен пайдалы жұмысқа түрленбейді, өйткені жылудың бөлігі міндетті түрде жылу қабылдағышқа бұрып әкетілу керек.
Осы тұжырым термодинамика екінші заңының мағынасы болып табылады.
Ұсынылатын әдебиеттер:
1 нег.[5-21; 23-29; 38-40]; 9 қос[6-17, 22-26]
Бақылау сұрақтар:
1. Күй параметрлердің (температура, қысым, меншікті көлем, тығыздық) сипаттамасы.
2. Жылу сыйымдылықтың анықтамасы, түрлері.
3. Жылуды, ішкі энергияның өзгерісін, орындалған жұмысты анықтайтын формулалар.
4. Термодинамика бірінші заңының мағынасы мен математикалық бейнесі.
5. Цикл ( айналма) ұғымы.
6. Термодинамика екінші заңының мағынасы.
