
- •Министерство образования и науки Республики Казахстан
- •1.1 Данные о преподавателях:
- •1.2. Данные о дисциплине:
- •Выписка из учебного плана
- •1.5 Краткое описание
- •1.6 Перечень и виды заданий и график их выполнения
- •1.7 Список литературы: Основная литература
- •Дополнительная литература
- •1.8 Контроль и оценка знаний Распределение рейтинговых процентов по видам контроля
- •Календарный график сдачи всех видов контроля по дисциплине «Химия органических и высокомолекулярных соединений»
- •Оценка знаний студентов
- •Вопросы для проведения контроля по 1 модулю:
- •Вопросы для проведения контроля по 2 модулю:
- •Вопросы для проведения контроля по 3 модулю:
- •Вопросы для подготовки к промежуточной аттестации:
- •1.9 Политика и процедура
- •2 Содержание Активного раздаточного материала
- •2.1 Тематический план курса Распределение часов по видам занятий
- •2.2 Конспект лекционных занятий
- •1. Состав. Строение. Изомерия. Номенклатура
- •1. Строение. Изомерия. Номенклатура
- •4. Ориентирующее действие заместителей в бензольном ядре
- •2.3 Лабораторные занятия
- •2.4. Планы занятий в рамках самостоятельной работы студентов под руководством преподавателя (срсп)
- •2.5. План занятий в рамках самостоятельной работы студентов (срс)
- •2.6 Тестовые задания для самоконтроля
- •2.7 Ответы на тестовые вопросы
- •Экзаменационные вопросы по химии высокомолекулярных соединенй
- •Содержание
- •Выходные сведения
1.9 Политика и процедура
Студенты в обязательном порядке должны посещать все виды занятий, отчитываться по всем видам контроля в срок, указанный преподавателем. При несвоевременной сдаче отчетов оценка снижается на один балл.
2 Содержание Активного раздаточного материала
2.1 Тематический план курса Распределение часов по видам занятий
|
Наименование темы |
Количество академических часов | ||||
|
Лекции |
Лабораторные занятия |
СРС |
CРСП | ||
|
Модуль 1 Химия органических соединений | |||||
|
1. |
Введение. Химическая связь. Классификация, номенклатура и применение органических соединений. |
2 |
1 |
3 |
3 |
|
2. |
Углеводороды. |
2 |
1 |
3 |
3 |
|
3. |
Функциональные производные углеводородов. |
2 |
1 |
3 |
3 |
|
4. |
Серу- и азотсодержащие производные углеродов. |
2 |
1 |
3 |
3 |
|
5. |
Элементорганические соединения. Карбоциклические углеводороды и их производные. Ароматические соединения. |
2 |
1 |
3 |
3 |
|
Модуль 2 Химия высокомолекулярных соединений (ВМС). Часть 1. | |||||
|
6. |
Основные понятия химии ВМС. |
2 |
1 |
3 |
3 |
|
7. |
Структура полимеров и особенности строения ВМС. |
2 |
1 |
3 |
3 |
|
8. |
Исследование структуры полимеров физическими методами. |
2 |
1 |
3 |
3 |
|
9. |
Получение ВМС методоми радикальной и ионной полимеризации. |
2 |
1 |
3 |
3 |
|
10. |
Получение ВМС методом поликонденсации. |
2 |
1 |
3 |
3 |
|
Модуль3 Химия высокомолекулярных соединений. Часть2. | |||||
|
11. |
Химические превращения полимеров. |
2 |
1 |
3 |
3 |
|
12. |
Сшивание.Структирование. Деструкция. |
2 |
1 |
3 |
3 |
|
13. |
Деструкция. Деградатация. Старение и стабилизация. |
2 |
1 |
3 |
3 |
|
14. |
Природные, искусственные и синтетические ВМС. |
2 |
1 |
3 |
3 |
|
15. |
Клеи.Клей. Композиционные материалы. Красители и краски. |
2 |
1 |
3 |
3 |
|
Всего часов |
30 |
15 |
45 |
45 | |
2.2 Конспект лекционных занятий
Тема лекции №1: Введение. Химическая связь. Классификация, номенклатура и применение органических соединений
Без химии трудно представить прогресс в какой бы то ни было области хозяйства. Все сферы народного хозяйства пронизаны современной химической наукой и технологией.
Продукты органической химии широко применяются в металлургии при флотационном обогащении руд цветных, редких, редкоземельных и благородных металлов, получении их по сорбционной и экстракционной технологии для нужд электроники, радиотехники и оптики, а также в процессах прокатки и литья; в полиграфии на материалах, предназначенных для издательских работ.
Срсп 1
Предмет органической химии. Органическая химия изучает законы химических превращений, состав, свойства, способы получения и применение органических соединений.
Органическими соединенияминазывают соединения углерода – углеводороды и их производные. Кроме углерода и водорода в органические соединения практически могут входить почти все элементы периодической системы. Однако чаще всего в состав органических соединений входят кислород, галогены, азот, сера, фосфор и некоторые металлы.
Простейшие соединения углерода, такие, как оксиды, угольная кислота и ее соли, относят к неорганическим соединениям и их изучает неорганическая химия.
Соединения углерода выделяют в особую научную дисциплину по ряду причин.
Первая из них – многочисленность органических соединений. К настоящему времени их насчитывают около 5 млн., в то время как число известных соединений всех других элементов не превышает 700 000.
Вторая причина – сложность и своеобразие характера химического поведения органических соединений:
а) органические вещества отличаются известной инертностью и большинство химических реакций с их участием протекает гораздо медленнее, чем ионные реакции, характерные для неорганических веществ;
б) при нагревании даже до сравнительно невысокой температуры (100 0С) многие органические вещества разлагаются;
в) почти все органические соединения горючи, тогда как подавляющее большинство неорганических соединений не обладает горючестью.
Третья причина – большое практическое значение органических соединений: это пища, ткани, стройматериалы, краски, горючие и смазочные материалы, растворители, флотореагенты, сорбенты, экстрагирующие вещества, полупроводники, взрывчатые вещества, полимерные материалы, лекарства и т.д.
Теория химического строения органических соединений А.М. Бутлерова. Вплоть до 20-х годов ХІХ столетия химики считали совершенно невозможным синтез органических веществ из неорганических соединений. В 1840 г. известный русский ученый И.И. Гесс высказал утверждение, что органические вещества образуются по тем же законам, что и неорганические. В 1845 г. Кольбе получил уксусную кислоту из древесного угля, серы, хлора и воды.
Постепенно химики научились получать и более сложные органические вещества. Так, в 1854 г. М. Бертло синтезировал вещества, относящиеся к классу жиров, а в 1861 г. А.М. Бутлеров получил из полиформальдегида и воды сахаристое вещество.
Со временем был накоплен огромный фактический материал, требовавший теоретического обобщения и объяснения возможных путей синтеза органических соединений и связи их свойств со строением.
Основополагающей теорией строения органических соединений явилась теория химического строения, созданная Александром Михайловичем Бутлеровым (1828-1886) и обнародованная им 19 сентября 1861 г. на 36-м съезде немецких естествоиспытателей в докладе «О химическом строении вещества».
Основные положения теории химического строения А. М. Бутлерова можно свести к следующему.
1. Атомы в молекуле органического соединения связаны друг с другом в определенной последовательности.
Свойства вещества зависят от их химического строения, т.е. от порядка соединения атомов в молекуле и характера их взаимного влияния. В результате каждое из веществ имеет свои особые физические и химические свойства.
2. Соединение атомов в молекуле происходит в соответствии с их валентностью. Валентности всех атомов в молекуле взаимно насыщены. Свободных валентностей у атомов в молекуле нет.
3. Атомы углерода способны соединяться между собой и образовывать углеродные цепи различного вида. Эти цепи могут быть открытыми или замкнутыми (кольца, циклы), прямыми или разветвленными.
В зависимости от числа связей, затрачиваемых атомами углерода на соединение друг с другом, цепи могут быть насыщенными (с одинарными связями) или ненасыщенными (с кратными – двойными или тройными связями).
4. Каждое органическое соединение имеет одну определенную формулу строения, отражающую порядок химической связи атомов в реально существующей молекуле. Строение молекулы как реально существующего объекта можно изучить экспериментально химическими и физическими методами.
А.М. Бутлеров провел ряд экспериментальных работ, подтвердив предсказания теории получением изобутана, третичного бутилового спирта и других веществ. Это позволило ему в 1864 г. заявить, что отныне имеется достаточно фактов, чтобы ручаться за возможность синтетического получения любого органического вещества.
Срсп 2
Тетраэдрическая модель атом углерода. Основные представления о химическом строении, заложенные А.М. Бутлеровым, были дополнены Вант-Гоффом и Ле Белем (1874), которые развили идею о пространственном расположении атомов в молекуле органического вещества и поставили вопрос о пространственной конфигурации и конформации молекул. Работа Вант-Гоффа «Химия в пространстве» положила начало плодотворному направлению органической химии – стереохимии, т.е. учению о пространственном строении.
Электронные представления в органической химии. Метод описания движения электронов в атомах и соответствующий математический аппарат был предложен в 1926 г. Шредингером на базе начинавшей формироваться к этому времени квантовой механики. По аналогии с уравнениями, описывающими упругие механические, звуковые и световые волны, уравнение движение электрона по орбитали получило названиеволнового уравнения Шредингера.
Согласно принципам квантовой механики можно определить лишь вероятность нахождения электрона в данной области пространства, окружающего точку с координатами (х, у, z), но не его точные координаты. Обычно функция вероятности обозначается через(х, у,z) и тогда электрон с максимальной вероятностью будет находиться в той области, гдемаксимальна.
Если обозначить решение волнового уравнения Шредингера через (х, у,z) и назвать еговолновой функцией, то2(х, у,z) оказывается пропорциональным(х, у,z). Подобрав соответствующий постоянный числовой множитель, можно получить рaвенство:
2(х, у,z) =(х, у,z),
при этом волновая функция останется решением уравнения Шредингера.
Интерпретация как зарядового облака оказалась очень наглядной при изображениях атомных и молекулярных орбиталей. В этих случаях для каждойсуществует некая граничная поверхность, внутри которой сосредоточено, например, 90 или 99% заряда. Форма этих поверхностей являются важнейшими стереохимическими факторами и определяют ход многих химических реакций.
Вследствие того, что волновая функция прямо связана с распределением электронной плотности, можно утверждать (правда, с некоторой натяжкой), что волновая функцияописывает орбиту движения электрона вокруг ядра. В теории химической связи такие волновые функции получили названиеатомных орбиталей, сокращенно АО.
Наиболее важной является классификация орбиталейпо типамs,р,dи т.д. Все АОs–типа сферически симметричны, поэтому распределение заряда зависит только от радиуса. Орбитали всех других типов не имеют сферической симметрии. Например, имеются три АОр-типа, граничные поверхности которых похожи на гантели. Эти орбитали имеют ясно выраженную направленность, поэтому они могут быть обозначены какрx,рy,рd, гдех,уи zсооветствуют трем осям координат, относительно которых симметрична соответствующаяр-орбиталь. Все трир-орбитали совершенно эквивалентны, за исключением их направления, и все они линейно независимы.
Существует также пять АО d–типа с более сложной конфигурацией. Орбитали других типов в органических соединениях почти не встречаются.
Подразделение атомных (но не молекулярных) орбиталей на типы s, р,d, и т.д. довольно четкое; не существует промежуточных гибридизованных орбиталей междуs–ир-орбиталями. По этой причине целесообразно ввести обазначение типов АО с помощьюквантовых чисел. Набор стационарных состояний электронов определяется квантовыми числами:п,l,m,s. От различных значений этих чисел зависят симметрия и ориентация волновой функциии ее узловые свойства.
Главное квантовое число п определяет общий размер зарядового облака. Это означает, что числопопределяет общий уровень энергии электрона.
Квантовое число l характеризует свойства симметрии АО и связано с моментом импульса движущегося электрона. Квантовое числоlможет иметь значения от 0 до (n-1), т.е.l= 0 приn= 1;l= 0, 1 приn= 2;l= 0, 1, 2 приn= 3 и т.д., что соответствует типам орбиталейs,p,d и т.д. Для нас более важны геометрические характеристики орбиталей, указываемые символамиs,p,d, …, чем цифровые значенияl, поэтому всегда целесообразнее пользоваться первыми.
Магнитное квантовое число ml указывает на количество и направление в пространстве орбиталей данной формы. Оно имеет 2l+ 1 значений: от –l до +l. Так, приl= 0m= 0: возможна только однаs-орбиталь сферической симметрии. Приl= 1m= 1, 0, +1 и, следовательно, возможны триp-орбитали, направленные по трем осям координат (px,py,pz).
Спиновое
квантовое число ms
соответствует двум возможным
ориентациям магнитного момента электрона
в магнитном поле: вдоль силовых линий
или против. Это записывается как -½и +½или значками![]() .
.
Согласно принципу Паули, в атоме не может быть двух электронов с одинаковым значениям всех четырех квантовых чисел, это значит, что одну и ту же АО могут занимать только два электрона с разными значениями спина(спаренные с антипараллельными спинами).
Гибридизация орбиталей. Смысл понятии (а не явлении) о гибридизации орбиталей заключается в том, что близкие по энергии и имеющие общие элементы симметрии молекулярные (но не атомные!) орбитали могут взаимодействовать между собой, образуя так называемыегибридные орбиталис более низкой энергией.
Так, при взаимодействии s-орбитали сpx–орбиталью образуются двеsp-гибридизованные орбитали, имеющиеся, например, у атомов углерода ацетилена, ориентированные по осиx. Такой тип гибридизации называетсяsp-гибридизацией(или, правильнее,дигональной гибридизацией). Если взаимодействуют двеp-орбитали (pxиpy) иs–орбиталь, то три образовавшиесяsp2-орбитали (тригональная, илиsp2-гибридизация) лежат в одной плоскости, образуя между собой угол в 1200. При взаимодействииs–орбитали с тремяр-орбиталями (рх,руирz) четыре образовавшиеся орбитали (тетраэдрическая, илиsp3-гибридизация) направлены к вершинам правильного тетраэдра и образуют между собой угол 109028’.
Энергия образования четырех связей с избытком покрывает те 400-600 кДж/моль, которые требовались для возбуждения атома. В случаях тригональной и дигональной гибридизации одна или соответственно две р-орбитали остаются негибридизованными и имеют вид неискаженных восьмерок.
Движущие силы органических реакций.Совокупность факторов, управляющих распределением электронной плотности и возможностью образования новой, более стабильной системы, обладающей минимальной потенциальной энергией, в конечном счете обуславливает протекание химической реакции, является еедвижущей силой.
Природа и типы химической связи. Развитие теории строения атома позволило создать современную теорию химических связей, которая исходит из предположения, что связь между атомами осуществляется за счет того или иного взаимодействия их электронов. Электронная структура молекул оценивается при помощи квантовохимических расчетов.
Основные химические особенности атома определяются свойствами электронов и их распределением вокруг ядра: то же можно сказать и о молекуле в целом. Следовательно, теория химической связи должна быть прежде всего электронной теорией.
Электроотрицательность элементов. Электроотрицательность атома– это его способность притягивать электроны. Значения электроотрицательности (полученные по Полингу) не имеют значимости констант, а показывают лишь относительную способность атомов притягивать электроны сильнее или слабее при образовании связи с другими атомами.
Атомы, расположенные в ряду электроотрицательности перед углеродом и имеющие значение электроотрицательности меньше чем 2,5, повышают электронную плотность на атоме углерода при образовании связи с ним. Наоборот, атомы, электроотрицательность которых превышает 2,5, понижают электронную плотность на атоме углерода при образовании связи.
Ионная связь. Электронная конфигурация инертного газа для любого атома может образоваться двумя различными способами. Один из них - перенос электронов: атомы одного из элементов отдают электроны, которые переходят к атомам другого элемента. В данном случае между этими атомами образуется так называемаяионная(электровалентная,гетерополярная)связь. Гетерополярная связь существует лишь в кристаллах (что, правда, в последнее время на основании спектроскопических данных тоже подвергается сомнению). Поэтому более правильным было бы говорить «ионное взаимодействие», а не ионная связь.
Отличительными чертами ионных соединений являются мгновенность протекания реакций, диссоциация (распад кристалла, молекулы, радикала или иона на фрагменты, имеющие меньшую молекулярную массу; термическая, фотохимическая и электролитическая) и сольватация (взаимодействие частиц растворённого вещества с молекулами растворителя, проводящее к образованию сольватов) ионов в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов расплавов.
Как правило, гетерополярные связи образуют между собой элементы начала и конца периодов таблицы Менделеева. Это объясняется тем, что различные атомы в разной степени способны принимать на свои орбиты электроны. Элементы седьмой группы, имеющие на внешней орбите семь электронов, легко принимают один электрон, недостающий до полного октета. Элементы же первой группы имеют на внешней орбите всего один электрон, который они легко отдают.
Таким образом, гетерополярная связь возникает между атомами, сильно отличающимися по электроотрицательности (Na-Cl,K-OH).
Ковалентная (гомеополярная) связь– химическая связь, образованная за счет взаимодействия орбиталей неспаренных электронов; наиболее распространенный в органической химии тип связи. Эта связь обладает максимальной прочностью.
Ковалентная связь и соответственно молекула могут быть неполярными, когда оба связанных атома обладают одинаковым сродством к электрону, например Н:Н. Такая связь обладает максимальной прочностью. Она может бытьполярной, когда электронная пара вследствие большего сродства к электрону одного из атомов оттянута в его сторону:
Н→Clили![]()
При таком способе обозначения символы δ- и δ+ (частичные заряды) означают,что на атоме со значком δ- избыточная электронная плотность, а на атоме со значком δ+ она несколько понижена.
Донорно-акцепторная или координационная (часто также используются терминдиполярная) связь. Разновидностью донорно-акцепторной связи является связь азота с кислородом в нитросоединениях илиN–оксидах. В этом случае азот связан с одним кислородным атомом обычной двойной ковалентной связью за счет обобщенных двух электронов азота и двух электронов кислорода, а оставшаяся неподеленная электронная пара (п-электроны) азота образует связь со вторым атомом кислорода, при этом, очевидно на азоте (донор) появляется положительный заряд, а на кислороде (акцептор) – отрицательный. Таким образом, связь между атомом азота и вторым атомом кислорода представляет собой сочетание ковалентной и ионной связей и носит названиесемиполярной связи.
К донорно-акцепторному типу связей относятся и связи в комплексных соединениях. От описанных выше они отличаются лишь меньшей прочностью. Так как передача электронов осуществляется не полностью.
Водородная связь.Присутствию у ряда атомов неподеленной пары электронов обязана своим существованием и так называемаяводородная связь. Она образуется между молекулами, содержащими электроотрицательные атомы (О,N,F, реже Сl, Вr,S), которые имеют неподеленную электронную пару,и молекулами с активными атомами водорода.Активныминазываются атомы водорода, связанные с другим атомом сильно полярной связью. Например,
I→O;
H→S; H→N![]() и т.д.
и т.д.
Атом водорода имеет гораздо меньшие размеры, чем все другие атомы. Он очень слабо экранирован и может вследствие этого подходить очень близко к неподеленным парам электронов других атомов.
Водородная связь (обозначается тремя точками) по своему характеру в основном является электростатической. Энергия водородной связи значительно ниже энергии ковалентной связи (примерно 4-33 кДж/моль), тем не менее она играет значительную роль в определении как химических, так и физических свойств соединений. Водородная связь может оказаться достаточно прочной для существования независимых частиц в растворе например катиона оксония (Н3О)+. Более слабые водородные связи приводят к образованию ассоциированных систем. Наличием водородных связейвтаких соединениях объясняется уменьшение летучести, увеличение вязкости и изменение других физических свойств. Эти явления наблюдаются во многих чистых жидкостях, например, в аммиаке, воде, фтористом водороде, первичныхи вторичных аминах, спиртах, фенолах, минеральных и органических кислотах.
Известны примеры особо прочных внутримолекулярных водородных связей. Такого типа связи возникают, если структура самой молекулы способствует их образованию.
Благодаря водородным связям фиксируются вторичные и третичные структуры белков, образуются связи в двойных спиралях ДНК и т.д. Решающую роль водородных связей часто объясняет малые энергии, необходимые для многих биохимических превращений.
Энергия связей. Энергия, которую надо затратить, чтобы разорвать химическую связь между атомами, называются энергией связи. Эта же энергия выделяется при образовании связи между атомами. Определяют ее термохимическими или спектроскопическими методами. При больших значениях энергии связи они устойчива (С-С, С-Н, Н-Н), при малых – неустойчива (О-О,N-N).
Механизм реакцииописывает последовательность всех происходящих в ее процессе элементарных изменений реагирующих молекул. Это детально расчлененный путь, по которому протекает реакция. Чтобы знать механизм реакции, необходимо знать состояние реакционного комплекса на всем протяжении реакции. Должна быть известна также природа взаимодействия между реагирующими атомами, энергия системы на всем пути реакции и скорость происходящих изменений. Этот объем информации значительно больше того, что известно до настоящего времени даже о простых реакциях, поэтому задачу установления механизма реакции обычно ограничивают более простыми требованиями.
В простейшем случае механизм должен объяснить образование всех продуктов реакции. Для доказательства предложенного механизма реакции часто пользуются методом меченых атомов.
Кинетика реакции.Химической кинетикой называется раздел химии, изучающий скорость химических реакций.
Скорость гомогенных реакций зависит от многих факторов: природы реагирующих веществ, концентрации, температуры, давления, присутствия катализаторов. Задача кинетики состоит в выяснении роли этих факторов и в установлении механизма реакций.
Основной характеристикой в химической кинетике является скорость реакции, определяемая количеством вещества, прореагировавшего в единицу времени в единице объема.
В зависимости от числа реагирующих молекул (частиц), участвующих в элементарном акте реакции, различают мономолекулярные(одномолекулярные),бимолекулярные реакциии т.д. Таким образом, если в стехиометрическом уравнении реакции в левой части приведена только одна молекула вещества, то реакции называетсямономолекулярной: А → В.
Во всех случаях число молекул образующихся продуктов реакции не имеет значения, так как молекулярность определяется только стехиометрическим числом молекул реагирующих веществ.
Кислотность и основность. В органической химии кислотой принято вещество, диссоциирующее с образованием протона (Н), а основанием – вещество, связывающее протон в малодиссоциирующую молекулу. Существует несколько подходов к определению понятий «кислота» и «основность»
Классификация реакций в органической химии. Основные реакции можно подразделить на четыре основных типа: 1) замещение; 2) присоединение; 3) отщепление (элиминирование); 4) перегруппировка. Названия типов реакций говорят сами за себя.
Иногда сложная суммарная реакция может включать несколько типовых реакций, однако отдельные стадии суммарной реакции всегда можно отнести к одному из перечисленных типов.
Как правило, перегруппировки сопровождаются реакциями отщепления или присоединения, что проводит к образованию более стабильного продукта.
Эта классификация охватыват все реакции, однако почти не дает сведений об их механизме.
Как правило, основное органическое вещество, участвующее в реакции называют «субстратом», тогда другой компонент реакции обычно условно рассматривают как «реагент».
Реакции подразделяются также на гетеролитические и гомолитическкие, в зависимости от того, разрываются ли связи «несимметрично». Гетеролитические–химические реакции, происходящие в результате разрыва одних и образования других химических связей без разрыва электронных пар, образующих эти связи;гомолитические- химические реакции, протекающие с разрывом электронных пар старых связей и/или образованием новых за счёт взаимодействия радикалов. Гетеролитические реакции называютионными реакциями, тогда как к гомолитическим процессам относятрадикальные реакции.
Классификация органических соединений. В зависимости от структуры углеродного скелета (углеводородная часть и особенно углеродная часть сложного органического вещества) все органические соединения классифицируются следующим образом.
1. Ациклические (алифатические) соединения. Скелет составлен из непосредственно связанных атомов углерода в виде неразветвленной (нормальной)
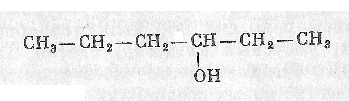
или разветвленной цепи
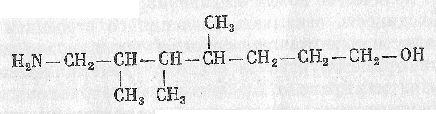
2. Карбоциклические соединения. В их молекулах углеродные цепи замкнуты в цикл:
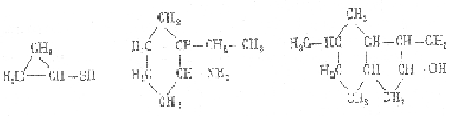
3. Гетероциклические соединения. В циклы молекул этих соединений кроме атомов углерода входят атомы других элементов:
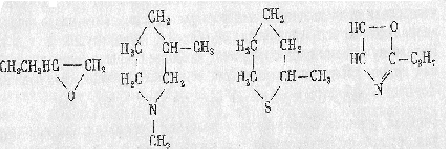
В каждом из этих рядов все соединения распределяются по классам в зависимости от имеющихся в них функциональных групп. Например, класс ациклических спиртов (группа - ОН), класс ациклических аминов (группа - NН2), класс карбоциклических карбоновых кислот (группа - СООН) и т.д.
Основы номенклатуры в органической химии. На первых этапах развития химии вновь открытым соединениям присваивались, как правило,тривиальные названия, чаще связанные с источником получения, чем со структурой и до сих пор являются общепринятыми: муравьиная кислота, уксусный альдегид, ацетон, хлороформ и т.д. В химии природных соединений это часто практикуется и в наши дни. Количество новых соединений росло очень быстро и возникла необходимость связывать названия со строением вещества. В связи с этим появиласьрациональные названия: метилэтилкетон, диметиламин, триметилуксусная кислота, триметилкарбинол и т. п. В этих случаях, как правило, соединение рассматривают какзамещенноетемиили иными радикалами простейшее соединение данного ряда.
На международных съездах химиков была разработана и затем предложена (1957 и 1965 гг.) в качестве официальной научной номенклатуры так называемая номенклатура ИЮПАК(IUPAC–InternationalUnionofPureandAppliedChemistry- Международный союз теоретической и прикладной химии).
В основу названия соединения по этой номенклатуре положена углеродная цепь молекулы, содержащая максимально число функциональных групп (гидроксил, карбоксил, аминогруппа и т. д.). Начало нумерации цепи определяет наиболее старшая функциональная группа. Порядок старшинства основных функций следующий:
COOH › C ≡ N › CHO › C = O › OH › NH2 › NO › Hal
Главная функция обозначается в названия суффиксом: гидроксильная группа –ол; альдегидная –ал; кетонная –они т.д., остальные – префиксами. Например:
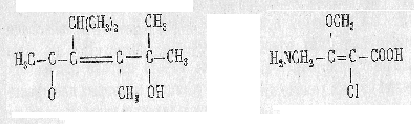
5-окси-4,5 –диметил-3- 2-хлор-4-амино-3-метокси-
изопропилгексан-3-он-2 2-бутеновая кислота
Применение органических соединений в металлургии. Выплавка чугуна и стали, литье и прокатка изделий осуществляются при высоких температурах, получаемых при сжигании органических веществ – кокса и газа. Природный газ и метан используются для обжига и восстановления высокометаллизованных железных окатышей при изготовлении легированных прочных сталей. Почти все металлы платиновой группы, а также германий, кадмий, индий, теллур, рений и другие получают по сорбционно-экстрационной технологии, где в качестве сорбентов применяются органические низкомолекулярные и высокомолекулярные вещества и ионообменные смолы. Разнообразные органические соединения используются для обогащения руд цветных и черных металлов методом флотации.
Органические вещества применяются в составе различных металлургических масел (в гидравлическом, компрессорном, редукторном, трансформаторном, циркуляционном и др.), смазочных и охлаждающих жидкостей, антикоррозионных покрытий, лаков, красок и растворителей.
Основная литература [1] (3-41)
Дополнительная литература [1] (3-147), [2] (3-71)
Контрольные вопросы:
1. Изложите теорию химического строения органических соединений А.М. Бутлерова.
2. Изложите тетраэдрическую модель атома углерода.
3. Расскажите об электронных представлениях в органической химии.
4. Что такое движущая сила органических реакций?
5. Расскажите о природе и типах химической связи.
6. Назовите типы органических реакций и укажите их механизм.
7. Дайте классификацию органических соединений.
8. Изложите основы номенклатур органических соединений: тривиальной, рациональной, заместительной и международной (ИЮПАК).
9. Приведите примеры применения органических веществ в металлургии.
Тема лекции №2: Углеводороды
Углеводородаминазывают органические соединения, состоящие из углерода и водорода. Их общая формулаCnH2m.В зависимости от строения углеродной цепи и соотношенияn:mих подразделяют на ациклические, карбоциклические и гетероциклические соединения. Они могут быть предельными (насыщенными) или непредельными (ненасыщенными), с одной или несколькими кратными связями. Кроме того, среди циклических углеводородов особую группу составляют ароматические углеводороды, отличающиеся рядом специфических свойств.
Предельные, или насыщенные, углеводороды (алканы, парафины). Кпредельным углеводородам– парафинам, илиалканам, - относят соединения с открытой цепью, атомы углерода в которых соединены друг с другом простыми (одинарными) связями. Они до предела насыщены водородом и в обычных условиях мало реакционноспособны (отсюда и их название «парафины» - от лат.parum affinis- малое сродство).
Гомологический ряд. Ряд соединений, обладающих сходными свойствами и строением, называютгомологическим рядом.Для алканов этот ряд начинается с метана как простейшего представителя предельных углеводородов:
CH4- метанC5H12- пентан
C2H6- этанC6H14- гексан
C3H8- пропанC7H16- гептан
C4H10 - бутан С8H18– октан и т. д.
Как видно, каждый последующий член ряда отличаются от предыдущего по составу на группу СН2. Эту группу СН2называютгомологической разностью, а члены ряда называютгомологами. Отсюда можно вывести и общую формулу ряда предельных углеводородов:CnH2n+2.
Строение. В молекулах насыщенных углеводородов атомы углерода находится в состоянииsр3-гибридизации и каждый из них образуют четыре-связи с атомами водорода или углерода.
Первым и простейшим по строению членом гомологического ряда предельных углеводородов является СН4.
Атом углерода в молекуле метана расположен в центре тетраэдра, а атомы водорода – в его вершинах. Все валентные углы между направлениями связей в молекуле метана равны между собой и составляют угол 109028’.
Если от молекулы углеводорода отнять один атом водорода, то получится одновалентный углеводородный остаток, или радикал, алкил. Названия радикалов производят от названий соответствующих углеводородов, заменяя суффикс –ан на –ил. Например: метил –СН3, этил –С2Н5и т. д. Радикал часто обозначают Аlk- (алкил) илиR.
При соединении друг с другом двух метильных радикалов образуется следующий гомолог ряда этан - С2Н6. Структурная формула его имеет вид СН3-СН3.
При отнятии от молекулы этана С2Н6любого из атомов водорода (они все структурно равноценны) образуется одновалентный радикал С2Н5-, или СН3-СН2-, называемыйэтилом.
Изомерия. Четвертый член гомологического ряда предельных углеводородов бутан отличается от трех предыдущих гомологов тем, что имеет два изомера: нормальный бутан снеразветвленной углеродной цепью и изобутан с разветвленной углеродной цепью.
Вид изомерии, когда вещества отличаются друг от друга порядком связи атомов в молекуле, называют структурной изомериейили изомерией углеродного скелета.
Радикалами называются первичными, вторичными и третичными в зависимости от того, у какого атома углерода находится свободная валентность. Если атом углерода связан с одним радикалом, он называется первичным, с двумя радикалами –вторичными, с тремя –третичным.
Первые члены гомологического ряда алканов – метан, этан, пропан – существуют только в одной форме. Они не имеют изомеров. У бутана существуют два изомера. У углеводорода состава C5H12 - пентана известны три изомера: пентан, изопентан и неопентан.
С увеличением числа углеродных атомов в молекуле углеводорода возрастает и число возможных изомеров. Для углеводородов C1-С9изомеры получены, для высших членов ряда получены лишь некоторые.
Различные геометрические формы молекул, переходящие друг в друга путем поворота вокруг простых связей называют конформациямиилиповоротными изомерами (конформерами).
Номенклатура. Первые четыре предельных углеводорода имеютэмпирическиеназвания: метан, этан, пропан, бутан. Начиная с пентана названия углеводородов образуют из греческих и латинских (нонан) числительных добавлением суффикса –ан: пентан, гексан, гептан, октан, нонан, декан, ундекан и т.д.
Сложнее обстоит дело с номенклатурой углеводородов изостроения, для этого используют рациональную и заместительную номенклатуры. В последнее время применяют международную номенклатуру, или номенклатуру ИЮПАК.
Способы получения. Главными источниками получения алканов являются нефть, природные и попутные газы и каменные угли.
1. Предельные углеводороды с небольшим числом углеродных атомов от C1 до С11можно выделить фракционной перегонкой нефти, газа или смесей углеводородов, получаемых гидрированием угля.
2. Гидрирование непредельных углеводородов в присутствии катализаторов – платины, палладия, никеля или хромита меди.
3. Алканы получают реакцией восстановления галогенопроизводных водородом в момент его выделения или водородом, возбужденным катализатором, а также иодоводородом.
4. Синтез алканов можно осуществить по реакции Вюрца (1855) действием металлического натрия на моногалогенопроизводные. Вместо натрия могут быть использованы другие металлы, например литий, магний, цинк.
5. Предельные углеводороды могут быть получены из галогенопроизводных действием металлического лития и солей меди (реакция Кори - Хауса).
Физические свойства алканов определяются их составом и строением. Первые четыре члена гомологического ряда при обычных условиях – газы, С5-С15– жидкости, начиная с С16– твердые тела.
С увеличением молекулярной массы повышается температура плавления и кипения алканов, возрастает плотность. Алканы с нормальной цепью углеродных атомов кипят при более высокой температуре, чем алканы с разветвленной цепью.
Все углеводороды парафинового ряда легче воды и нерастворимы в ней, но хорошо растворимы друг в друге и сами являются хорошими растворителями жиров, масел и других органических соединений.
Закономерность в изменении свойств алканов по мере усложнения состава была открыта немецким ученым К. Шорлеммером.
Химические свойства. Предельные углеводороды при обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с такими активными радикалами, как металлический натрий и перманганат калия. Им свойственны реакции замещения водородных атомов, расщепления, окисления и изомеризации.
Реакции замещения могут протекать по радикальному или ионному механизму. Их условно обозначают буквой S(от лат.subctitutio - замещение). Радикальные и ионные цепные реакции можно затормозить или остановить введением в реакционную систему веществ, легко реагирующих с радикалами или ионами. Такие вещества называютингибиторами.
Рассмотрим некоторые реакции замещения с участием предельных углеводородов.
1. Галогенирование. Наибольшее практическое значение имеют хлорирование и бромирование алканов. В обычных условиях молекулярный хлор и бром практически не реагируют с насыщенными углеводородами. Только в атомарном состоянии они способны вырывать атом водорода из молекулы алкана. Поэтому предварительно необходим разрыв молекулы галогена до свободных радикалов, которые зарождают цепную реакцию.
Стадии зарождения, или инициирования цепи, ее роста и обрыва характерны для всех цепных реакций. Большой вклад в изучение цепных реакций внес Н. Н. Семенов. Его исследования отмечены Нобелевской премии.
В промышленности используют термическое хлорирование алканов при температуре порядка 3000С. Процесс хлорирования алканов в присутствии катализаторов может быть иметь цепной ионный механизм.
Реакция со свободным фтором идет со взрывом. Фторирование алканов проводят фтором (разбавленным азотом или растворителем) или некоторыми неорганическими фторидами.
Иод не способен к реакции прямого замещения водорода в алканах ввиду их высокой эндотермичности.
2. Нитрование. Реакцией нитрования называют замещение атома водорода в алкане нитрогруппой. При обычных условиях предельные углеводороды не взаимодействуют с концентрированными кислотами, в том числе и с азотной кислотой. Но при нагревании алканов до 1400С с разбавленной 10%-ной азотной кислотой с оксидами азота идет реакциянитрования. Впервые такую реакцию осуществил М. И. Коновалов (1888) и она носит его имя. Реакции нитрования сопровождается крекингом углеводородов с образованием ряда нитропроизводных: от нитрометана до нитропроизводного с тем же числом углеродных атомов, что и у исходного углеводорода.
3. Сульфохлорированиеалканов проводит смесью диоксида серы (сернистый газ) и хлора. Инициируется этот процесс фотохимически ультрафиолетовым светом. Идет цепная радикальная реакция.Сульфоокислениепроводят, действуя на алканы диоксидом серы и кислородом.
4. Окисление. При поджигании на воздухе алканы воспламеняются и горят, превращаясь в диоксид углерода и воду. Окисление парафинов при температуре порядка 1500С и в присутствии катализаторов приводит к образованию килотсодержащих органических веществ – спиртов, альдегидов, кетонов, кислот. Окисление высших углеводородов парафинового ряда приводит к образованию высших жирных кислот, спиртов, используемых для мыловарения и флотации руд цветных и черных металлов.
5. Крекинг. Процесс расщепления высококипящих предельных углеводородов при температуре 400-6000С без доступа воздуха на молекулы низших углеводородов носит названиекрекинга. При крекинге предельных углеводородов происходит гомолитический разрыв углерод-углеродных связей и образование насыщенных и ненасыщенных углеводородов с более короткой цепью.
Под воздействием более высоких температур (1000 0С и выше) в результатепиролизапроисходит распад молекул алканов на элементы.
Впервые крекинг нефти осуществлен сотрудником Петербургского политехнического института А. А. Летним (1871-1878), а первый патент на установку для крекинга заявлен инженером В.Г. Шуховым в 1891 г.
В настоящее время различают следующие виды крекинга: жидкофазный, когда мазут подают в печи крекинга в жидком состоянии, парофазный, когда мазут подают в печи в виде пара, и каталитический, при котором сырье разлагается в присутствии катализаторов.
Источники и применение алканов. Главными источниками парафинов являются природные и попутные газы, нефть, каменный уголь и сланцы. Помимо природных источников большое значение имеют также промышленные источники алканов. К ним относятся коксовый газ, содержащий 25-35% метана, крекинговый газ, содержащий 50-75% предельных углеводородов, продуктыгидрогенизации угля и переработки сланцев.
Газы (и природные), в частности метан, кроме применения в промышленности и в быту в качестве топлива, широко используются для синтеза различных органических веществ, синтетических волокон, высокомолекулярных соединений, взрывчатых веществ и т.д. При переработке нефти выделяют следующие продукты: бензины(Ткип = 35-2050С, содержащие углеводороды С5-С9) различных назначений – легкий, средний и тяжелый для авиационных и автомобильных двигателей;керосины(Ткип = 40-700С, содержащие углеводороды С10-С16) подразделяют на осветительные, тракторные и реактивные; нефтяные остатки –мазут, зто смесь углеводородов с 17 углеводородными атомами и более. Из мазута при температуре 3000С и выше отгоняют так называемыесоляровоеитрансформаторное масла, используемые в качестве смазывающих веществ и флотореагентов, из него получают также вазелин и чистый твердый парафин. Остаток после переработки мазута –гудрон – используют для покрытия дорог. Онможет служить также и топливом.
Самыми распространенными в металлургии являются индустриальные масла(применяются для смазки станков, прокатных станов, механизмов, машин, оборудования, служат смазочно-охлаждающими жидкостями при металлорезании, используются для заполнения амортизационных и гидравлических систем и т.д.), которых делят на легкие (менее вязкие), средние и тяжелые. Легкие масла применяют для смазки приборов, а более вязкие (тяжелые) – для смазки механизмов с повышенными нагрузками.
Непредельные углеводороды этиленового ряда (олефины, алкены). Строение алкенов.Непредельными углеводородамиэтиленового ряда (олефинами,алкенами) называют ненасыщенные ациклические углеводороды, содержащие в молекуле одну двойную связь и имеющие общую формулу СпН2п. Название «олефины» происходит от латинского названия этиленаgazolefiant– маслородный газ.
Гомологический ряд этих углеводородов начинается с этилена СН2=СН2. Гомологи этилена образуются путем замещения атомов водорода в этилене на радикалы -СН3, -С2Н5и т.д. Радикалы, образованные из алканов, называюталкенилами.
Номенклатура. Номенклатура алкенов сходна с номенклатурой парафинов. Названия алкенов нормального строения с двойной связью у крайнего атома углерода образуют от названий соответствующих алканов, заменяя в них суффикс –анна –илен. Например, соединение СН3-СН=СН2называют пропилен, а соединение СН3-СН2-СН=СН2– бутилен и т. д. По заместительной (женевской) номенклатуре двойная связь обозначается суффиксом –ени цифрой, после нее указывается положение двойной связи в углеродной цепи. Например, углеводород СН3-СН2-СН=СН2 называют бутен-1. В качестве главной цепи выбирают цепь, включающую двойную связь, даже если эта цепь и не будет самой длинной. Нумерацию атомов углерода в цепи проводят так, чтобы атом углерода, от которого начинается двойная связь, получил наименьший номер. Например,
![]()
пентен-1
По номенклатуре ИЮПАК положение двойной связи указывают цифрой у атома углерода, но не после, а перед названием углеводорода. Так, углеводород пентен-1 по номенклатуре ИЮПАК надо назвать 1-пентен.
Изомерия.
У этиленовых углеводородов помимо
изомерии цепи наблюдается изомерия
положения двойной связи. В случае
бутилена двойная связь в его молекуле
может располагаться в середине цепи:![]() и
тогда углеводород будет называться
бутен-2 по заместительной номенклатуре
или 2-бутен – по Международной номенклатуре.
и
тогда углеводород будет называться
бутен-2 по заместительной номенклатуре
или 2-бутен – по Международной номенклатуре.
Кроме того, у этиленовых углеводородов возможна пространственная, илицис-транс-изомерия. Расположение одинаковых заместителей по одну сторону плоскости двойной связи даетцис-изомер, по разные стороны -транс-изомер. При нагревании, освещении или в присутствии катализаторацис- итранс-изомеры могут переходить друг в друга. Как правило,транс-изомеры более устойчивы и имеют более высокую температуру плавления.
Способы получения. Низшие алкены в небольших количествах входят состав нефтяного газа, высшие – в состав некоторых нефтей. Значительные количества алкенов содержатся в жидких продуктах крекинга и пиролиза нефти.
1. Основным источником получения первых четырех членов ряда алкенов – этилена, пропилена, бутиленов и пентиленов – являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен). Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов.
2. Значительные количества алкенов могут быть получены дегидрогенизацией алканов при повышенной температуре с катализатором.
3. Алкены часто получают из галогенопроизводных отнятием галогеноводорода при действии спиртового раствора шелочи. Направление реакции дегидрогенирования соответствует правилу Л.М. Зайцева(1875) – галоген взаимодействует с атомом водорода, находящимся у наименее гидрогенизированного атома углерода.
4. В лабораторных условиях наиболее распространенным способом получения алкенов является реакция дегидратации(отнятие воды) спиртов при нагревании с водоотнимающими веществами (концентрированная серная или фосфорная кислота) или пропусканием паров спирта над катализаторами (оксид алюминия, оксид тория). Так, из этилового спирта получают этилен:
![]()
5.
Олефины можно получать так называемым
«селективным» гидрированием ацетиленовых
углеводородов над палладиевым
катализатором: СН ≡ СН + Н2 ![]() СН2= СН2
СН2= СН2
ацетилен этилен
Физические свойства. Первые три представителя – этилен,пропилен, бутилен – газы, от С5до С17 – жидкости, высшие представители – твердые тела. Температура плавления и кипения, а также, плотность возрастают с увеличением числа углеродных атомов в молекуле алкена. Однако температура кипения их несколько ниже, чем у соответствующих алканов, а плотность несколько выше. Все олефины легче воды и плохо растворимы в ней. Теплота образования этиленовых углеводородов меньше, чем соответствующих алканов.
Химические свойства. В реакциях присоединения двойная связь выступает как донор электронов. Поэтому для олефинов характерна реакция электрофильного присоединения (АЕ). Рассмотрим характерные реакции алкенов.
1. Гидрирование. Непредельные углеводороды легко присоединяют водород по двойной связивприсутствии катализаторов (Pt,Pd,Ni):
![]()
пропен пропан
Так как для гидрирования необходима адсорбция молекулы алкена на катализаторе, алкены гидрируются тем легче, чем меньше заместителей у двойной связи (правило С. В. Лебедева).
2. Галогенирование. Алкены при обычных условиях присоединяют галогены, особенно легко хлор и бром. В результате образуются дигалогенопроизводные алканов, содержащие галогены у соседних атомов углерода, так называемые вициальные производные (от лат.vicinus- соседний): СН2= СН2+Cl2 →ClСН2- СН2Cl. Фтор реагирует с
1, 2-дихлорэтан
воспламенением. Иод реагируют медленно и то лишь на солнечном свету. Галогены могут присоединяться к олефинам по радикальному или ионному механизму. Реакция этилена с хлором используется для получения растворителя дихлорэтана и в производстве высокомолекулярного соединения винилхлорида.
3. Гидрогалогенирование. Алкены присоединяют галогеноводороды по реакции
электрофильного присоединения: СН2= СН2+ НCl → СН3- СН2Cl
1-хлорпропан
Присоединение галогеноводородов к несимметричным алкенам происходит в соответствии справилом В.В. Марковникова(1869): при присоединении галогеноводородов к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода, а галоген к менее гидрогенизированному, т. е. к тому атому углерода, у которого меньше атомов водорода.
4. Сульфирование. Взаимодействие алкенов с серной кислотой протекает аналогично присоединению галогеноводородов.
5. Гидратация. В присутствии катализаторов (ZnCl2,H2SO4илиH3PO4) при нагревании и давлении алкены присоединяют воду и образуют спирты.
6. Окисление. Алкены легко окисляются. В зависимости от условий окисления образуются разные продукты (диоксид углерода, вода, эпоксиды, гликоли, кетоны, кислоты, озониды).
7. Алкилирование. Сущность этой реакции и состоит в присоединении алкана по двойной связи преимущественно у первичного атома углерода алкена в присутствии серной или фосфорной кислот. Реакции алкилирования используются для получения высокооктанового топлива, применяемого в двигателях внутреннего сгорения.
8. Полимеризация.Реакцией полимеризацииназывают процесс образования высокомолекулярного веществ (полимера) из молекул низкомолекулярного непредельного вещества путем взаимодействия их между собой за счет разрыва кратных связей. Реакция идет без выделения побочных продуктов. Реакция полимеризации открыта А. М. Бутлеровым (1873).
9. Изомеризация. При высоких температурах или в присутствии катализаторов алкены способны изомеризоваться.
Отдельные представители.ЭтиленСН2= СН2– бесцветный газ, почти без запаха, мало растворим в воде, лучше растворим в спирте, т. пл. -169, 20С, т. кип. -103,80С, т. самовоспламенения 5400С. Этилен является одним из важнейших полупродуктов для промышленности органического синтеза (этилового спирта, этиленгликоля, различных галогенопроизводных, оксида этилена, для получения полиэтилена и других соединений).
ПропиленСН2= СН-СН3– газ, мало растворим в воде; т. пл. -187,60С, т. кип. -47,70С,
т. самовоспламенения 4100С. Его получают совместно с этиленом при крекинге и пиролизе нефти, а также из нефтяного газа. Он является полупродуктом для синтеза изопропилового спирта, аллилхлорида, ацетона, глицерина, полипропилена, акрилонитрила и др.
Бутилены – бесцветные газы, используются в производстве синтетического и
изопренового каучука.
Непредельные углеводороды ацетиленового ряда (алкины). Строение алкинов. Ацетиленовыми углеводородами (алкинами) называют непредельные (ненасыщенные) ациклические углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу СnH2n-2.
Гомологический ряд углеводородов начинается с ацетилена НС≡СН. Углеродные атомы, образующие тройную связь, находятся в состоянии sp-гибридизации.
Гомологи ацетилена образуются путем замещения атомов водорода в молекуле ацетилена на радикалы –СН3, -С2Н5 и т.д.
Изомерия. Ацетиленовым углеводородам (алкинам), так же как алкенам, свойственна изомерия цепи и положения кратной связи в ней.
Номенклатура. Принцип построения названий алкинов тот же, что у алкенов. По рациональной номенклатуре в основу названия углеводородов кладется ацетилен, а его гомологи рассматриваются как продукты замещения в ацетилене атомов водорода на соответствующие радикалы. По заместительной номенклатуре названия алкинов имеют суффикс –ин. При составлении названия выбор главной цепи и начало нумерации определяет тройная связь.
Если в молекуле одновременно имеются тройная и двойная связь, то начало нумерация определяет двойная связь.
Наиболее часто встречающиеся радикалы алкинов: этинил НС≡С- и пропаргил НС≡С-СН2.
Способы получения. Алкины получают следующими способами.
1. Из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора едкого кали или амида натрия.
2. Из алкилгалогенидов или ацетиленидов натрия или магния.
3. Ацетилен для технических целей получают в промышленном масштабе из метана в основном двумя способами (высокотемпературным пиролизом метана и окислительным пиролизом метана).
4. Из карбида кальция при разложении его водой.
Физические свойства. Алкины по физическим свойствам напоминают алкены и алканы.Первые два члена гомологического ряда С3–С3 – газы, следующие С4–С16 – жидкости, высшие – твердые тела. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
Химические свойства. Рассмотрим некоторые характерные реакции алкинов.
1. Гидрирование. Гидрирование алкинов осуществляется на тех же катализаторах, что
и алкенов, но с меньшей скоростью.
2. Галогенирование. Реакция галогенирования алкинов идет медленнее, чем алкенов. Образующиеся при этомтранс-дигалогеналкены легко выделяются, так как дальнейшее присоединение галогена (кроме хлора) идет с большим трудом. В случае хлора реакцию ведут в растворителе, так как под воздействием света не исключен взрыв. Обесцвечивание бромной воды является качественной реакцией на кратную связь.
3. Гидрогалогенирование. Присоединение галогеноводородов к алкинам протекает аналогично присоединению их к алкенам непосредственно или в присутствии катализатора, например СuCl2,HgCl2 и др.
При электрофильном присоединении соблюдается правило Марковникова, при радикальном механизме наблюдается противоположное направление присоединения.
4. Гидратация. Присоединение воды ведут в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 г. М.Г. Кучеров. При этом из ацетиленапервоначально образуется виниловый спирт, который затем изомеризуется в ацетальдегид (правило Эльтекова, 1887).
5. Присоединение спиртов. Спирты присоединяются к алкинам в присутствии алкоголятов.
6. Присоединение синильной кислоты. Присоединение синильной кислоты к ацетилену протекает в присутствии хлорида меди (II).
7. Окисление. Реакции окисления ацителеновых углеводородов проходят с разрывом углеродной цепи молекулы по месту тройной связи с образованием органических кислот.
Алкины быстро обесцвечивают раствор перманганата калия, что используется как качественная реакция на тройную связь.
8. Металлирование. При пропускании ацетилена как кислоты через аммиачные растворы оксида серебра, хлорида меди (I) и других соединений тяжелых металлов происходит замещение атомов водорода в ацетилене на металлы с образованиемацетиленидов. Ацетилениды меди, серебра и других тяжелых металлов обладают взрывчатыми свойствами.
9. Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи весьма склонны к реакциям полимеризации (получают винилацетилен, дивинилацетилен, бензол, циклооктатетраен и др.).
10. Изомеризация. Под действием щелочных металлов ацетиленовые углеводороды способны к изомеризации, т.е. к перемещению кратной связи с образованием ацетиленидов.
11. Конденсация. Из ацетилена можно получить по реакции А.Е. Фаворского изопрен.
Применение ацетилена и его производных.Ацетилен – бесцветный газ; т. пл. -80,80С, т. кип. -83,60С. В чистом виде не имеет запаха. Неприятный запах ацетилена, получаемого из карбида кальция, вызван примесями сероводорода и фосфина. Исходным сырьем для его получения являются карбид кальция и метан.
При горении ацетилена в кислороде развивается очень высокая температура (около 30000С), поэтому он широко применяется для автогенной сварки и резки металлов. В последнее время ацетилен широко применяется для органического синтеза различных растворителей, спиртов, эфиров, кислот, каучуков и других продуктов.
ВинилацетиленСН2=СН-С≡CН. При обычных условиях – газ с неприятным запахом, т. пл. -1380С, т. кип. +50С. Растворяется в большинстве органических растворителей, но плохо растворим в воде. Получают его полимеризацией и димеризацией ацетилена. Сам винилацетилен легко окисляется и полимеризуется. Присоединяет галогены, галогеноводороды. Присоединеняя молекулу хлороводорода, превращается в хлоропрен и идет для синтеза полихлоропренового каучука.
Галогенопроизводные углеводородов. Углеводороды, в молекуле которых один или несколько атомов углерода замещены атомами галогенов, называютгалогенопроизводными углеводородов.
Галогенопроизводные классифицируют по характеру входящих в молекулы галогенов, по их числу. Если в молекуле углеводорода находится атом фтора, то такой углеводород называют фторпроизводным. Соответственно могут бытьхлоро-, бромо- и иодопроизводные. В зависимости от числаатомов галогена в молекуле углеводорода различают моно-, ди-, три- и полигалогенопроизводные. Возможны смешанные галогенопроизводные, содержащие атомы различных галогенов.
Строение. Строение моногалогенопроизводных в общем виде может выражено формулой СпН2п+1Х, где Х – этоF,Cl,Br,I. В зависимости от положения атома галогена и характера атома углерода, с которым атомы галогена связаны, различают первичные, вторичные и третичные галогенопроизводные:RCH2Cl,R2CHCl,R2CCl.
Изомерия. Изомерия галогенопроизводных обусловлена изомерией углеродного скелета и положения галогена. Очевидно, что галогенопроизводные имеют большее число изомеров, чем предельные углероды.
Номенклатура. Названия галогенопроизводных по рациональной номенклатуре составляют из названия углеводородного радикала и соответствующего галогена. При этом название галогена может быть поставлено либо перед названием углеводородного радикала, либо после названия.
Названия галогенопроизводных по заместительной (женевской) номенклатуре составляют из названия галогена и радикала, но цифру, указывающую положение галогена в цепи углеводорода, помещают после названия углеводорода. Выбор главной цепи и ее нумерация определяются функциональной группой – в данном случае галогеном.
По номенклатуре ИЮПАК названия галогенопроизводных образуют из названий соответствующих углеводородов, добавляя название галогена. Цифр перед названием галогена указывает его положение в цепи углеводорода.
Если галогенопроизводные имеют два атома галогена, стоящие у одного и того же атома углерода, их называют геминальными, а у рядом стоящих атомов углерода –вицинальными.
Изомерия и номенклатура непредельных галогенопроизводных в принципе не отличаются от изомерии и номенклатуры предельных галогенопроизводных.
Способы получения. Галогенопроизводные получают из предельных углеводородов реакций замещения, из непредельных углеводородов – присоединением галогеноводородов, из спиртов – реакцией с галогеноводородами и галогенидами фосфора.
1. Наиболее важным промышленным способом получения галогенопроизводных алкенов является хлорирование.
2. Получение галогенопроизводных алкенов происходит на холоду и реакция при этом не сопровождается образованием побочных полигалогенопроизводных.
3. Галогенопроизводные получают замещением гидроксильной группы спиртов на галогены.
4. Фтористые производные алкилов получают обменной реакцией из хлористых, бромистых или иодистых алкилов действием фторидов ртути, серебра, кобальта и др.
5. Геминальные дигалогенопроизводные образуются при действии пентагалогенидов фосфора на альдегиды и кетоны.
6. Вициальные дигалогенопроизводные можно получить присоединением галогенов к непредельным углеводородам.
7. Полигалогенопроизводные с атомами галогенов у разных углеродных атомов образуются при действии галогеноводородов, галогенидов фосфора или хлористого тионила на двухатомные или многоатомные спирты.
Физические свойства. Большинство галогенопроизводных – бесцветные жидкости, с характерным запахом, практически нерастворимы в воде, но растворимы в органических растворителях: углеводородах, спиртах, эфире, нерастворимы в концентрированной серной кислоте, поэтому их очищают от примесей спиртов и эфиров встряхиванием с серной кислотой, и которой спирты и эфиры растворяются. Галогенопроизводные сами являются хорошими растворителями.
Химические свойства. Рассмотрим важнейшие реакции галогенопроизводных.
1. Реакция гидрирования. При каталитическом гидрировании галогеналкилов или действии на них водорода в момент выделения происходит замещение атома галогена водородом.
2. Реакция гидролиза. При действии воды на галогеналкилы в щелочной или кислой среде происходит реакция гидролиза и галоген замещается гидроксилом с образованием спирта галогенопроизводной кислоты.
3. Реакция образования простых эфиров. Обмен галогена на алкоксигруппу в реакции с алкоголятами щелочных металлов даст простые эфиры.
4. Реакция образования аминов. Галогеналкилы при взаймодействии с аммиаком образуют соответствующие первичные, вторичные или третичные амины, используемые для экстракции цветных металлов.
5. Реакцией галогеналкилов с солями синильной кислотыполучают цианистые алкилы (нитрилы) и изонитрилы.
6. При нагревании с солями органических кислотгалогеналкилы дают сложные эфиры.
7. Металлический натрийпри действии на галогеналкилы отнимает от их молекул галоген, а освободившиеся радикалы соединяются между собой, образуя более сложные по составу углеводороды (реакция Вюрца).
8. При действии металловгалогеналкилы могут образовывать металлорганические соединения (синтез А.М. Зайцева).
9. При действии спиртового раствора едких щелочейгалогеналкилы отщепляют галогеноводород и образуют алкены.
Отдельные представители и их применение.Хлористый метиленСH2Сl2получают хлорированием метана. Жидкость. Применяется как негорючий и легко летучий растворитель и хладоагент.
ХлороформСНСl3получают действием хлора и щелочи или хлорной извести на спирт или ацетон. Хлороформ – жидкость. Применяется в качестве хладагента в холодильных установках и как растворитель. Раньше применялся в медицине для общего наркоза.
Тетрахлорид углеродаССl4получают из сероуглерода по реакции
2CS2+ 6Cl2→ 2CCl4+ 2S2Cl2
а также высокотемпературным хлорированием метана. Бесцветная жидкость. Применяется в качестве негорючего растворителя при тушении воспламенившихся легких жидкостей. Хороший растворитель жиров, масел, смол, каучука. Применяется для выделения пятен с тканей.
Фторпроизводные углеводороды.
Способы получения. Несмотря на взрывоопасность (реакция сильно экзотермична), разработано много способов синтеза фторпроизводных.
1. Каталитическое фторирование. Смесь паров туглеводородов с азотом пропускают через слой нагретого фторида кобальта (III).
2. Смешанные фторхлоралканы получают из полихлорпроизводных действием
фторводорода или фтора сурьмы (V) в присутствииSbCl5 (реакция Свартса).
3. Действием фтороводорода на олефины:
CH2=CH2+HF→CH3-CH2F
Физические и химические свойства.Фторуглеводороды негорючи, имеют высокую термостойкость (до 4000С) и химически инертны по отношению к кислотам и щелочам. Они устойчивы к окислителям. По химической стойкости высокомолекулярные перфторуглеводороды аналогичны благородным металлам и даже превосходят их.
Отдельные представители.ДифтордихлорметанCF2Cl2 получают по реакции Свартса. Бецветный газ, т. кип. -29,80С, растворяется в воде и органических растворителях; хладоагент – фреон-12 и пропеллент для аэрозольных упаковок; обладает наркотическим действием.
ТетрафторэтиленCF2=CF2 получают из хлороформа и фтороводорода с последующим пиролизом при 650-7000С промежуточного дифторхлорметана. Тетрафторэтилен полимеризуются в присутствии пероксидов в политетрафторэтилен, известный как тефлон или фторпласт-4.
Основная литература [1] (42-89)
Контрольные вопросы:
1. Дайте определение предельных углеводородов (парафины, алканы). Что такое гомологический ряд? Назовите гексан и его изомеры по тривиальной, рациональной, заместительной и международной номенклатурам.
2. Опишите строение молекулы метана.
3. Назовите природные источники получения алканов и методы их синтеза.
4. Перечислите типы реакций, характерные для алканов. Опишите механизм реакций галогенирования, нитрования и окисления.
5. Приведите примеры применения алканов в металлургии.
6. Дайте определение непредельных углеводородов этиленового ряда (олефины, алкены). Перечислите первые члены гомологического ряда. Назовите бутилен и его изомеры по тривиальной, рациональной, заместительной и международной номенклатурам.
7. В чём заключаются особенности электронного строения алкенов по сравнению с алканами?
8. Назовите природные источники получения алкенов и методы их синтеза.
9. Каковы особенности реакционной способности алкенов? Перечислите типы реакций, характерных для алкенов.
10. Укажите особенности протекания химических реакций гидрирования, галогенирования, гидрогалогенирования, окисления и полимеризации алкенов. Изложите правила В.В. Марковникова, Е.Е. Вагнера, С.В. Лебедева.
11. Опишите применение алкенов в металлургии.
12. Дайте определение непредельных углеводородов ацетиленового ряда (алкины). Назовите несколько членов гомологического ряда алкинов. Назовите бутин и его изомеры по тривиальной, рациональной, заместительной и международной номенклатурам.
13. В чём заключаются особенности электронного строения алкинов по сравнению с алкенами?
14. Назовите промышленные получения алкинов.
15. Дайте характеристику реакционной способности алкинов.
16. Укажите особенности протекания химических реакций гидрирования, галогенирования, гидратации, окисления и полимеризации и металлирования алкинов.
17. Приведите примеры применения алкинов в металлургии.
18. Что такое галогенопроизводные? Какова их классификация?
19. Расскажите о номенклатуре галогенопроизводных. Назовите соединение по рациональной, заместительной и международной номенклатурам.
20. Назовите основные способы получения галогенопроизводных предельных и непредельных углеводородов.
21. Как зависят физические свойства галогенопроизводных от положения в таблице Д.И. Менделеева?
22. Дайте характеристику реакционной способностигалогенопроизводных и назовите основные типы свойственных им химических реакций.
23. Приведите примеры применения галогенопроизводныхв металлургии.
Тема лекции №3: Функциональные производные углеводородов
Одноатомные и многоатомные спирты.
Углеводороды, в молекуле которых находится одна или несколько гидроксильных групп ОН, связанных с разными углеродными атомами в цепи, называют спиртами.
Число гидроксильных групп ОН, содержащихся в молекуле спирта, характеризует его атомность. В соответствии с этим спирты бывают одноатомными (алконолы), двухатомными (алкандиолы), трехатомными (алкантриолы) и т.д.
А. Одноатомные спирты
Строение.Изомерия.Номенклатура.
Предельные одноатомные спирты имеют общую формулу СпН2п+1–ОН. В зависимости от того, у какого атома углерода (первичного, вторичного или третичного) находится гидроксильная групп, различают спирты первичные, вторичные и третичные.
Изомерия спиртов обусловлена строением радикала – его изомерией и положением гидроксильной группы.
По рациональной номенклатуре названия спиртов производят от названия соответствующего углеводородного радикала в сочетании со словом «спирт». Например СН3ОН – метиловый спирт, СН3СНОНСН3– изопропиловый спирт.
По правилам заместительной (женевской) номенклатуры спирт называют, добавляя к названию углеводорода окончание –оли цифру, обозначающую номер атома углерода, у которого стоит гидроксил. У непредельных спиртов перед суффиксом –олвставляют суффикс –ен-, указывающий на наличие двойной связи. Аллиловый спирт НО-СН2–СН=СН2будет иметь название пропен-1-ол-3.
В номенклатуре ИЮПАК цифру, указывающую атом углерода, у которого стоит гидроксил, ставят перед названием радикала. Так, метанол, этанол, 1-пропонол, 2-пропонол и т. д. Общее название одноатомных спиртов – алкоголи, илиалканолы.
Способы получения.
1. Гидратация непредельных углеводородов в кислой среде. Из этилена получают этиловый спирт, из пропилена – пропиловый, из изобутилена – третичный бутиловый. Присоединение молекул воды к алкенам идет по правилу Марковникова.
2. Восстановление карбонильных соединений в присутствии Ni,Co,Cu,Pt,Pdи некоторых других катализаторов, что приводит к образованию спиртов: первичных при восстановлении альдегидов и сложных эфиров и вторичных при восстановлении кетонов.
3. Действие магний- или цинкорганических соединений на альдегиды, кетоны и сложные эфиры. Впервые такой синтез с применением цинкорганических соединений был осуществлен А. М. Бутлеровым с его учениками А. М. Зайцевым и Е. Е. Вагнером. Позднее французские ученые П. Барьбье и В. Гриньяр вместо цинкорганических соединений в реакции синтеза спиртов предложили применять магнийорганические соединения.
4. Ферментативное превращение углеводородов, где одновременно с главным продуктом – этиловым спиртом получают первичные спирты С3-С5и другие продукты.
Физические свойства. Предельные одноатомные спирты С1-С11нормального строения – жидкости, температура кипения которых по мере усложнения состава возрастает. Высшие спирты от С12и выше – твердые вещества.
Спирты изостроения кипят при более низкой температуре, чем спирты нормального строения. Низкомолекулярные спирты С1-С3имеют характерный алкогольный запах, жгучий вкус и смешиваются с водой во всех отношениях. По мере усложнения радикала растворимость уменьшается. Средние спирты С4-С6имеют неприятный запах, высшие лишены запаха и практически нерастворимы в воде. Одноатомные спирты изостроения растворяются в воде лучше, чем спирты нормального строения.
Химические свойства. Рассмотрим наиболее характерные реакции спиртов.
1. Образование алкоголятов. При действии на спирты щелочных металлов (натрия или калия) в безводной среде, а также других активных металлов (Ca,Mg,Al) вытесняется гидроксильный водород и образуется твердые вещества – алкоголяты (от лат.alcohol- спирт).
2. Дегидратация. Если на спирты подействовать водоотнимающими веществами,
такими, как серная, фосфорная или щавелевая кислоты, оксидами алюминия и тория, а также некоторыми солями (гидросульфат калия, сульфат меди, хлорид цинка и др.), то происходит межмолекулярное или внутримолекулярное отщепление воды.
3. Этерификация. Образование сложных эфиров происходит в результате взаимодействии спиртов с органическими или минеральными кислотам.
4. Замещение гидроксильной группы галогеном. При пропускании через спирт галогеноводорода в присутствии водоотнимающих веществ (серной кислоты, хлоридов цинка, кальция) гидроксильная группа обменивается на галоген с образованием соответствующего галогенопроизводного (реакция обратима).
5. Окисление. Окисление спиртов осуществляется кислородом воздуха при температуре 300-5000С в присутствии медных или других катализаторов и протекает легче, чем окисление углеводородов.
6. Замещение гидроксильной группы на аминогруппу. При пропускании смеси паров спирта и аммиака над оксидом алюминия или хлоридом цинка при 2500С гидроксильная группа замещается на аминогруппу и образуются амины.
7. Дегидрирование. Пропускание паров спирта над катализатором (медью или серебром) при 3000С приводит к реакции дегидрирования спирта и превращению, например, этилового спирта в уксусный альдегид (окислитель - воздух).
8. Взаимодействие спиртов с магнийгалогеналкилами. Гидроксильные группы спиртов активно взаимодействуют с магнийгалогеналкилами, при этом образуется углеводород.
9. Превращение спиртов в алкены(реакция Л. А. Чугаева) в результате термического разложения метилксантогенатов.
Отдельные представители.Метиловый спирт (метанол)СН3–ОН – бесцветная жидкость, хорошо растворяется в воде; токсичен, в малых количествах (5-10 мл) вызывает слепоту, дозав30 мл может привести к смерти. Метанол получают в промышленности в больших количествах из оксида углерода и водорода при температуре 2500С и давлении 7 МПа на медь-цинк-алюминиевых катализаторах или при температуре 4000С и давлении 20 МПа на цинк-хромовом катализаторе или каталитическим окислением метана. Метанол широко применяется в производстве формальдегида, метилацетата, метил- и диметиланилина, метиламинов, уксусной кислоты и многих красителей, фармацевтических препаратов, душистых и других веществ; прекрасный растворитель, широко применяющийся в лакокрасочной промышленности. В нефтеперерабатывающей промышленности его используют в качестве растворителя при очистке бензинов от меркаптанов, а также при выделении толуола путем азеотропной ректификации.
Этиловый спирт (этанол)СН3СН2ОН – бесцветная жидкость, хорошо растворяется в воде и органических растворителях; расходуется на производство бутадиена и дивинила, для изготовления синтетических каучуков (по С. В. Лебедеву), хлороформа, этилового эфира, этилацетата и других соединений; прекрасный растворитель и экстрагент в цветной металлургии и как горючее в ракетной технике вместе с окислителем (жидким кислородом) и высококонцентрированной азотной кислотой.
Б. Многоатомные спирты (диолы, триолы)
Спирты, содержащие в молекуле несколько гидроксильных групп расположенных у разных атомов углерода, называют многоатомными– двухатомными (диолы, гликоли), трехатомными (триолы, глицерины) и т.д.
Названия гликолей производят от названия этиленовых углеводородов с добавлением слова гликоль, например: этиленгликоль. Гликоли можно получить окислением олефинов (реакция Е. Е. Вагнера), гидролизом дигалогенопроизводных предельных углеводородов или хлоргидринов и гидратацией оксидов.
Глицерин (1,2,3-пропантриол) получают из жиров или синтезом из пропилена либо ацетилена.
Низшие многоатомные спирты – бесцветные, вязкие, сладкие на вкус жидкости, легко растворимые в воде, труднее в органических растворителях, высшие – кристаллические вещества. Они по химическим свойствам аналогичны свойствам одноатомных спиртов. Увеличение числа гидроксильных групп в молекуле усиливает кислотный характер многоатомных спиртов.
Важнейшие реакции: 1. Образование полных и неполных гликолятов и глицератов.
2. Образование полных и неполных сложных эфиров. 3. Взаимодействие с галогеноводородами. 4. Дегидратация. 5. Окисление гликолей.
Отдельные
представители.Этиленгликоль(1,2-этандиол) НО-СН2-СН2-ОН -
бесцветная вязкая, сладкая на вкус
жидкость; т. пл. -13,20С, т. кип. 197,60С,![]() .
Растворяется в воде и в органических
растворителях – спиртах, кетонах, в
глицерине, в уксусной кислоте и др.;
получают его в промышленном масштабе
из этилена; образует простые и сложные
эфиры, некоторые из них широко применяются
как пленкообразующие вещества для лаков
и красок, в производстве пластмасс и
синтетических волокон, например лавсана
(В. В. Коршак).
.
Растворяется в воде и в органических
растворителях – спиртах, кетонах, в
глицерине, в уксусной кислоте и др.;
получают его в промышленном масштабе
из этилена; образует простые и сложные
эфиры, некоторые из них широко применяются
как пленкообразующие вещества для лаков
и красок, в производстве пластмасс и
синтетических волокон, например лавсана
(В. В. Коршак).
Диэтиленгликоль
НОСН2-СН2-О-СН2-СН2-ОН
- жидкость; т. пл. -80С, т. кип. 2450С,![]() ;
смешивается с водой и в органическими
растворителями. Получают его гидратацией
оксида этилена и оксиэтилированием
этиленгликоля; применяется в производстве
полиуретанов, антифризов; используется
в качестве осушителя газов и растворителей
нитратов целлюлозы и полиэфирных смол.
В металлургии его используют в качестве
экстрагента и флотореагента-пенообразователя.
Входит в состав гидравлических тормозных
и смазочных жидкостей.
;
смешивается с водой и в органическими
растворителями. Получают его гидратацией
оксида этилена и оксиэтилированием
этиленгликоля; применяется в производстве
полиуретанов, антифризов; используется
в качестве осушителя газов и растворителей
нитратов целлюлозы и полиэфирных смол.
В металлургии его используют в качестве
экстрагента и флотореагента-пенообразователя.
Входит в состав гидравлических тормозных
и смазочных жидкостей.
Простые эфиры и макроциклические полиэфиры.
А. Простые эфиры (диалкилоксиды). Простыми эфираминазывают производные спиртов, образующиеся в результате замещения водорода гидроксильной группы спирта углеводородным радикалом. Общая формула простых эфировR-O-R’.Радикалы могут быть одинаковые и разные. Эфиры, в которых с кислородом соединены разные углеводородные радикалы, называютсмешанными простыми эфирами.
Строение и изомерия простых эфиров определяются особенностями строения и состава радикалов, входящих в общую формулу эфиров CnH2n+2O.
Способы получения
1. Межмолекулярной дегидратацией спиртов под влиянием серной кислоты.
2. Взаимодействием алкоголятов с галогеналкилами (реакция Вильямсона).
3. Присоединением спиртов к алкенам в кислой среде в присутствии трехфтористого бора.
4. Непредельные простые эфиры получают при нагревании ацетилена со спиртами и твердой щелочью под давлением 1,5-1,6 МПа (реакция А. Е. Фаворского и М. Ф. Шостаковского).
Физические свойства. Простые эфиры, несмотря на большую молекулярную массу, кипят при более низкой температуре, чем соответствующие спирты. Эфиры не смешиваютя с водой, но частично растворяются в ней; хорошие растворители органических веществ, имеют приятный запах.
Химические свойства. Характерные реакции простых эфиров.
1. Разложение эфиров при нагревании с концентрированными иодистоводородной и серной кислотами.
2. Расщепление.
3. Образование оксониевых соединений.
4. Образование гидропероксидов эфиров в результате самоокисления их при хранении в контакте с воздухом, особенно на свету.
5. Гидролиз виниловых эфиров в кислой среде с образованием простого спирта и ацетальдегида.
Важнейшие
представители.Винилэтиловый эфир
СН2=СН-O-СН2CН3– легко сжижающаяся и прозрачная
жидкость; т. пл. -1150С, т. кип. 35,50С,![]() .
Растворяется в органических растворителях
и частично в воде (0,9%). Получают
винилэтиловый эфир взаимодействием
ацетилена с этиловым спиртом.
.
Растворяется в органических растворителях
и частично в воде (0,9%). Получают
винилэтиловый эфир взаимодействием
ацетилена с этиловым спиртом.
Его применяют для получения поливинилового эфира, пластических масс, разложения полимеров, в качестве пластификатора нитратов целлюлозы. Он ускоряет заживление ран (в медицине известен как бальзам М.Ф. Шостаковского).
Диэтиловый
эфир, или просто эфир, этоксиэтан
С2Н5-О-С2Н5 известен
со времен алхимиков. Это бесцветная
прозрачная летучая жидкость с приятным
запахом, т. пл. -116,20С, т. кип. 34,480С,![]() Эфир малорастворим в воде. Диэтиловый
эфир получают дегидратацией этилового
спирта. Применяют в качестве растворителя
многих органических веществ, жиров и
масел, а также нитратов целлюлозы и
поэтому используют при изготовлении
бездымных порохов и твердых ракетных
топлив; является прекрасным экстрагентом
при переработке ядерного горючего, для
разделения плутония и продуктов его
деления, выделения урана из руд;
применяется в медицине при хирургических
операциях.
Эфир малорастворим в воде. Диэтиловый
эфир получают дегидратацией этилового
спирта. Применяют в качестве растворителя
многих органических веществ, жиров и
масел, а также нитратов целлюлозы и
поэтому используют при изготовлении
бездымных порохов и твердых ракетных
топлив; является прекрасным экстрагентом
при переработке ядерного горючего, для
разделения плутония и продуктов его
деления, выделения урана из руд;
применяется в медицине при хирургических
операциях.
Б. Макроциклические полиэфиры – краун-эфиры и криптанды.Краун-эфиры(Педерсен, 1967) представляет собой макроциклические полиэфиры общей формулы [-CH2-CH2-O-]n, гдеn= 3÷20. К ним относятся также циклические полиэфиры, содержащие атомы фосфора, кремния, мышьяка. Наиболее часто используется полиэфир 18-краун-6. Краун-эфиры – это маслообразные или твердые вещества, растворимые в органических растворителях и частично в воде; малотоксичные соединения; применяют для разделения катионов в аналитической химии, получения растворов солей в органических растворителях, в органическом синтезе, в качесве селективных экстрагентов, сорбентов и флотореагентов, а также катализаторов; с их помощью изучают механизмы ионного транспорта в биологических системах.
Криптанды. В 1969г. французский химик Лен опубликовал результаты исследований макроциклических полиэфиров – аминополиэфиры с узловыми атомами азота. Соединения имеют трехмерную внутреннюю полость, которая может включать катион металла. Эти лиганды проявляют большую селективность при косплексообразовании и образуют очень прочные комплексы. Лиганды такого типа получили названиекритандов(от греч.krypte– углубление, пещера). Комплексы криптандов называюткриптатами. Синтезированы макротри- и макротетрациклические криптанды, а также криптанды с узловыми атомами углерода.
В химии краун-эфиры и криптанды выполняют роль катализаторов в реакциях галогенирования, карбоксилирования, алкилирования, окисления и восстановления.
Альдегиды (алканали) и кетоны (алкононы). Альдегиды и кетоны представляют собой производные углеводородов, в молекулах которых содержитсякарбонильная группа, называемая также карбонилом–C(O)-.Альдегидаминазывают соединения с карбонильной группой, в которой атом углерода связан с радикалом и одним атомом водорода. Общая формула альдегидовR-C(O)-H.Кетонаминазывают карбонилсодержащие соединения, в которых углерод карбонильной группы связан с двумя радикалами. Общая формула кетоновR-C(O)-R’. Карбонильную группу называют такжеоксогруппой, а альдегиды и кетоны –оксосоединениями.
Строение и изомерия альдегидов обусловлены строением и изомерией углеводородного радикала.
Названия альдегидов производят по тривиальной номенклатуре от названий кислот, в которые они переходят при окислении, по рациональной номенклатуре – по названию производных уксусного альдегида, по заместительной и международной номенклатурам – от названия соответствующего углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с атома углерода альдегидной группы.
Строение и изомерия кетонов определяются строением и изомерией углеводородных радикалов и положением кетонной группы внутри углеродной цепи.
Названия кетонов по тривиальной номенклатуре производят от названий радикалов, связанных с карбонильной группой, и окончания –кетон. По заместительной номенклатуре кетонную группу обозначают суффиксом –он, а цифрой указывают номер атома углерода карбонильной группы. По международной номенклатуре номер атома углерода карбонильной группы указывают перед названием кетона. Нумерацию атомов углерода цепи начинают от ближайшего к кетонной группе конца цепи.
Общая формула предельных альдегидов и кетонов СпН2пО.
Физические свойства. Простейший альдегид – муравьиный, или формальдегид, метаналь, - газ с весьма резким запахом. Другие низшие альдегиды и кетоны – жидкости, легко растворимые в воде. Альдегиды обладают удушливым запахом, а кетоны пахнут приятно, напоминая запах цветов. Альдегиды и кетоны кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов.
Химические свойства. Благодаря поляризации атом углерода карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Важнейшими из таких реакций являютсяреакции присоединения.
Важнейшие представит ели.Муравьиный альдегидН2С=О - бесцветный газ с резким раздражающим запахом, хорошо растворяется в воде и спиртах, ограниченно в эфире, бензоле, хлороформе, легко вступает в реакции конденсации и полимеризации. Формальдегид сохраняют в виде 40%-ного водного раствора, называемого формалином, или в виде твердых соединений – триоксана (СН2-О-)3и параформальдегида (-СН2-О-)п.
Диметилкетон (ацетон, 2-пропанон) СН3-СО-СН3– бесцветная жидкость с характерным запахом, хорошо смешивается с водой и органическими растворителями. Ацетон является цепным растворителем, применяюшимся в производстве лаков, искусственного шелка, кинопленки, бездымного пороха.
Карбоновые кислоты и их производные. Карбоновыми кислотами называют соединения в молекуле которых содержится одна или несколько функциональных групп –С(О)-ОН. Они состоят из карбонильной –С(О) и гидроксильной –ОН групп и поэтому называютсякарбоксильными группами.По числу карбоксильных групп в молекуле различают одноосновные (монокарбоновые), двухосновные (дикарбовные) и многоосновные (поликарбоновые) кислоты. В зависимости от природы радикала они могут быть предельными, непредельными, ароматическими и др.
А. Предельные одноосновные кислоты. Предельные одноосновные кислоты являются производными предельных углеводородов. Общая формула одноосновных предельных кислот СпН2п+1С(О)ОН или СпН2пО2.
Строение и изомерия предельных одноосновных кислот во многом напоминают строение и изомерию альдегидов, которые при окислении образуют кислоты с тем же углеродным скелетом.
Предельные одноосновные карбоновые кислоты с числом атомов углерода в цепи от одного до трех не имеют изомеров. Кислоты с четырьмя атомами углерода имеют два изомера, у кислот с пятью атомами углерода известно четыре изомера. Число изомеров увеличивается по мере роста длины углеродной цепи.
Для простейших кислот наиболее употребительны тривиальные названия, связанные с природными продуктами, из которых они были впервые получены. Например, муравьиная кислота впервые была получена из выделений муравьев. По рациональной номенклатуре кислоты рассматривают как производные уксусной или другой менее сложной кислоты.
По заместительной и международной номенклатурам название карбоновой кислоты составляется добавлением к названию углеводорода окончания –овая и словакислота.
Способы получения: окисление органических веществ; гидролиз; синтез; оксосинтез. Известно много других способов получения кислот.
Физические свойства. Низшие одноосновные карбоновые кислоты с числом углеродных атомов С1-С3 - подвижные бесцветные жидкости с характерным острым запахом, растворимые в воде. Кислоты состава С4-С9 - маслянистые жидкости с неприятным запахом. По мере возрастания молекулярной массы растворимость кислот в воде уменьшается. Кислоты изостроения растворяются в воде лучше, чем кислоты нормального строения. Высшие кислоты начиная с С10 - твердые вещества без запаха, не растворяются в воде. Температуры плавления и кипения кислот значительно выше, чем у спиртов с одинаковым числом углеродных атомов.
Химические свойства. Для карбоновых кислот (как и спиртов) наиболее характерны реакции, связанные с разрывом связи О-Н и замещением всей гидроксильной группы. В дальнейшем возможны реакции с другими функциональными группами и радикалом кислоты.
Важнейшие
представители.Муравьиная кислота
(метановая ) НС(О)ОН – бесцветная
жидкость с резким запахом, т. пл. 8,30С, т. кип. 100,80С,![]() растворяется
в спирте, эфире, воде.
растворяется
в спирте, эфире, воде.
Муравьиная кислота применяется в качестве растворителя, как протрава при крашении и отделке тканей, бумаги, при выделке кожи, в консервном, спиртовом и пивоваренном производствах, в медицине и в ряде синтезов.
Масляная кислота (н-бутановая) СН3–(СН2)2-С(О)-ОН – прозрачная жидкость, растворяющаяся в воде. Входит в виде эфира с глицерином в состав сливочного масла.
Масляная кислота применяется для получения душистых и ароматизирующих веществ, используемых в парфюмерии и пищевой промышленности, лекарственных средств, эмульгаторов и пластификаторов, флотореагентов.
Мыламиназывают соли щелочных металлов жирных кислот, содержащих 10-18 углеродных атомов.
Б. Непредельные одноосновные кислоты являются производными непредельных углеводородов этиленового и ацетиленового рядов. Общая формула кислот этиленового ряда СпН2п-1С(О)ОН, а кислот ацетиленового и диэтиленового рядов СпН2п-3С(О)ОН.Изомериянепредельных кислот обусловлена изомерией углеродного скелета и положением кратной связи по отношению к карбоксилу. Непредельным кислотам с двойной связью, так же как и этиленовым углеродам, свойственна геометрическая, илицис-транс-изомерия. Их получают синтезом; дегидрогалогенированием галогензамещенных кислот; оксосинтезом.
Физические и химические свойства. Непредельные одноосновные кислоты – вязкие маслянистые жидкости с низкой температурой плавления, высокой температурой кипения и большой плотностью. Кислотность непредельных кислот, выше, чем соответствующих предельных из-за более высоких констант их ионизации. Благодаря наличию кратной связи непредельные кислоты и их эфиры вступают в реакции полимеризации.
Важнейшие
представители. Акриловая кислота
(пропеновая, этиленкарбоновая )
СН2=CН-С(О)ОН –
бесцветная жидкость с резким раздражающим
запахом, т. пл. 12,10С, т. кип. 140,90С, т. всп. 54,40С,![]() смешивается
с водой, спиртом и эфиром.
смешивается
с водой, спиртом и эфиром.
Акриловая кислота используется в производстве полиакриловой кислоты, эфиров кислоты, ионообменных смол.
Метакриловая
кислота (2-метил-2-пропеновая)
СН2=CСН3-С(О)ОН
– бесцветная жидкость с менее резким
запахом, чем у акриловой кислоты; т. пл.
16,00С, т кип. 160,50С,![]() растворяется
в воде и во многих органических
соединениях.
растворяется
в воде и во многих органических
соединениях.
Метакриловая кислота применяется в производстве карбоксильных каучуков, ионообменных смол, органического стекла и клеев.
В. Предельные двухосновные кислоты. Двухосновные кислоты содержат в молекуле две карбоксильные групп, поэтому их называют такжедикарбоновыми кислотами. Общая формулаCnH2n(СОOН)2.
Строение и номенклатура. Первым представителем предельных двухосновных кислот являетсящавелевая кислота, обнаруженная впервые в соке щавеля. Это единственная двухосновная предельная кислота, в которой две карбоксильные группы соединены друг с другом и находятся рядом в положении 1,2, - или в–положении. Поэтому она обладает наиболее высокими кислотными свойствами. Следующий гомолог –малоновая кислота, которая имеет три атома углерода.
Названия кислот обычно производят по тривиальной номенклатуре от названия тех продуктов, в которых они впервые были обнаружены. По современной международной номенклатуре двухатомные кислоты получают окончание -диоваяили –дикарбоновая кислота. Способы получения: окисление двупервичных гликолей; нитрильный синтез.
Физические и химические свойства.Двухосновные предельные кислоты - бесцветные твердые кристаллические вещества, растворимые в воде, спирте и эфире. С возрастанием числа углеродных атомов в цепи растворимость кислот падает. Кислоты с нечетным числом атомов углерода в цепи растворяются лучше, чем кислоты с четным числом. Температура плавления у кислот с четным числом атомов углерода выше, чем у кислот с нечетным числом атомов углерода. Особенность поведения кислот состоит в том, что в реакцию может вступать как два карбоксила, так и один, образуются при этом соответственно нейтральные и кислые соли (например нейтральный оксалат калия КООС-СООК или кислый оксалат калия КООС-СООН), полные и неполные сложные эфиры, полные или неполные хлорангидриды, амиды и т. д.
Важнейшие представители.Щавелевая кислота (этандиовая) НООC-СООН – кристаллическое вещество, выделяющееся в виде кристаллогидрата (СООН)22Н2О, т. пл. 189,50С. Растворяется в воде, спирте и эфире; используют как отбеливающее средство в текстильной промышленности, при очистке урана, для очистки металлов от ржавчины и накипи, чистки медных сплавов, алюминия и серебра, в качестве протравы в кожевенном производстве и как катализаторвреакциях поликонденсации. В металлургии щавелевую кислоту применяют для активации поверхности минералов при флотации руд.
Малоновая кислота (пропандиовая) НООC-СН2-СООН – кристаллическое вещество с т. пл. 135,60С, растворяется в воде, спирте и эфире; применяется для синтеза витаминов В1и В6.
Г. Сложные эфиры являются производными спиртов и кислот. Их общая формулаR-C(O)-OR’. Изомерия сложных эфиров определяется строением радикалов спирта и кислоты. Названия сложных эфиров по рациональной номенклатуре образуют из названий спиртов и кислот, а по заместительной и международной номенклатурам составляют из названия углеводородного радикала и корня латинского названия кислоты с добавлением суффиксаат- или -оатвместо окончания –овая кислота.
Способы получения: реакция этерификации; реакции взаимодействия солей кислот с галогенопроизводными углеводородов; действие спиртов или алкоголятов на галогенангидриды кислот; действие спиртов на ангидриды кислот; присоединение карбоновых кислот к алкенам; присоединение карбоновых кислот к ацетилену; окислительная конденсация этилена и уксусной кислоты на металлорганических катализаторах; взаимодействие первичного спирта с концентрированными кислотами.
Физические свойства. Эфиры низших и средних гомологов – летучие жидкости с приятным цветочным или фруктовым запахом, поэтому их применяют в пищевой и парфюмерной промышленности в качестве эссенций. Сложные эфиры плохо растворяются в воде, значительно хуже, чем образующие их спирты и кислоты; температура кипения их ниже чем соответствующих спиртов и кислот.
Химические свойства, характерны следующие химические реакции: гидролиз; аммонолиз; восстановление; переэтерификация.
Важнейшие представители.Эфиры акриловой и метакриловой кислот. Метиловые эфиры этих кислот используют в промышленности для получения методом полимеризации полиметилакрилата и полиметилметакрилата. Полимер полиметилакрилат применяют для изготовления искусственной кожи, безосколочного скелета триплекс, клея. Полиметилметакрилат используют в производстве органического стекла – плексигласа, так как полимер бесцветен и прозрачен: он применяется в приборостроении, для изготовления различных бытовых, медицинских и санитарных предметов, часовых стекол, зубных протезов, искусственных хрусталиков и т.д.
Жирыпредставляют собой сложные эфиры глицерина и высших жирных кислот (глицериды). Твердые жиры образуются в животных организмах, например, свиной, говяжий, бараний жиры и коровье масло. Жидкие жиры синтезируются растениями из крахмала; растительные масла – льняное, подсолнечное, конопляное, хлопковое и оливковое. Исключением является рыбий жир – жидкий жир животного происхождения. Жиры используют также для фармацевтических целей и в парфюмерии (кремы, помады и др.).
Основная литература [1] (90-172)
Контрольные вопросы:
1. Дайте определение одноатомных и многоатомных спиртов. Опишите их строение и изомерию. Как образуются названия спиртов по рациональной, заместительной и международной номенклатурам?
2. Назовите промышленные способы получения одноатомных и многоатомных спиртов. Напишите схемы реакций Е. Е. Вагнера и Б. А. Казанского.
3. Укажите особенности физических свойств одноатомных и многоатомных спиртов. Что такое индуктивный эффект? Как он проявляется при химических реакциях?
4. Назовите характерные химические реакции одноатомных и многоатомных спиртов. Каковы их особенности в связи с различными строением и свойствами алканолов, диолов и триолов?
5. Приведите примеры важнейших представителей одноатомных и многоатомных спиртов. Укажите их применение в промышленности.
6. Каково применение одноатомных и многоатомных спиртов в металлургии?
7. Что такое простые и смешанные эфиры? Что вы знаете об их строении и номенклатуре?
8.Назовите способы получения простых и смешанных эфиров.
9. Каковы особенности химических свойств простых эфиров, в чем их отличие от спиртов?
10. Что такое макроциклические полиэфиры?
11. Опишите физические и химические свойства краун-эфиров и криптандов.
12. Каково применение макроциклических полиэфиров вметаллургии?
13. Дайте определение альдегидам и кетонам. Наличием какой группы определяются особенности их химического поведения?
14.Назовите альдегиды и кетоны по рациональной, заместительной и международной номенклатурам.
15. Изложите основные способы получения альдегидов и кетонов на основе предельных и непредельных углеводородов, галогенопроизводных углеводородов, спиртов и кислот.
16. Приведите типичные реакции нуклеофильного присоединения, реакции замещения, окисления и восстановления альдегидов и кетонов, а также реакции конденсации и полимеризации.
17. Назовите наиболее важные представители альдегидов и кетонов и укажите их применение.
18. Приведите примеры использования альдегидов и кетонов и их производных в металлургии.
Тема лекции №4: Серу- и азотсодержащие производные углеводородов
Серусодержащие производные углеводородов.
А. Тиолы (тиоспирты, меркаптаны).Тиолы(тиоспирты) представляют собой аналоги обычных спиртов, в молекулах которых место атома кислорода занимает атом серы:R-S-H- тиол, тиоспирт. По заместительной и международной номенклатуре тиоспирты называюттиолами. Их тривиальное название –меркаптаны.
Способы получения
1. Взаимодействие галогенопроизводных с гидросульфидом натрия.
2. Пропускание паров спирта и сероводорода над нагретым оксидом алюминия.
3. Взаимодействие алкенов с сероводородом в кислой среде.
Физические и химические свойства. Тиолы – неприятно пахнущие вещества. Метантиол СН3-SH– газ, остальные тиолы – жидкости. Тиолы обладают более выраженными кислотными свойствами, чем соответствующие спирты, в результате они растворяется в водных растворах щелочей, образуя соли –тиоляты(меркаптиды)R-S-Na.При окислении тиолов в первую очередь окисляется сера, а при окислении спиртов увеличивается степень окисления углерода, а не кислорода.
Применение. Низшие тиоспирты добавляют к природному газу в качестве одоранта для обнаружения его утечки в газопроводах. Додецилмеркаптан С12Н25SHиспользуют как регулятор эмульсионной полимеризации при производстве синтетического каучука. Нефтяные сульфоксиды – прекрасные экстрагенты редких металлов и флотореагенты цветных металлов. СульфонатыR-SO3Hявляются также флотореагентами-пенообразователями.
Б. Сульфиды (тиоэфиры).Тиоэфирыилисульфиды– это двузамещенные органические производныеR-S-R’.
Физические и химические свойства. Тиоэфиры – нейтральные маслянистые жидкости с неприятным запахом. Нерастворимые в воде. Кипят при более высокой температуре, чем соответствующие тиоспирты. По химическим свойствам сульфиды – вещества нейтральные, но более реакционноспособные, чем обычные эфиры. При действии окислителей (А. М. Зайцев, 1866) образуются сульфоксиды или сульфоны в зависимости от количества окислителя.
Сульфиды и сульфоксиды также являются экстрагентами металлов и флотореагентами.
В. Органические сульфокислоты.Органическими сульфокислотаминазывают производные углеводородов, у которых атом водорода замещен остатком серной кислоты.
Получение
1. Энергичным окислением дисульфидов или тиолов.
2. Фотоокислением алканов.
3. Сульфохлорированием алканов. Механизм реакции хлорсульфирования радикальный: под влиянием ультрафиолетового света молекулярный хлор превращается в атомарный, который радикализует углеводород, и начинается цепная реакция.
4. Из олефинов действием гидросульфитов в присутствии пероксидов.
Физические и химические свойства. Алкансульфокислоты – бесцветные кристаллические, гигроскопические вещества, легко растворимые в воде. По химическим свойствам это сильные одноосновные кислоты.
Соли сульфокислот применяют в качестве поверхностно-активных и моющих веществ, эмульгаторов, растворителей и пластификаторов, а также флотореагентов.
Г. Тиоугольные кислоты. К числу производных тиоугольной кислоты относятся дитиоугольная и тритиоугольная кислоты. В свободном виде известна только тритиоугольная кислота. Это легко разлагающаяся при нагревании на сероуглерод и сероводород маслянистая жидкость. Практический интерес представляет соли моноэфиров дитиоугольной кислоты, названныексантогенатами.
Эфиры дитиоугольной кислоты: этил-, изопропил-, бутил- и изобутилксантогенаты – прекрасные флотореагенты-собиратели различных руд.
Нитросоединения.Азотсодержащими производными углеводородов называют такие органические соединения, в молекулах которых содержится одно или несколько азотсодержащих функциональных групп. Из них здесь рассмотрены нитросоединения, амины, нитрилы,изоцианиды (изонитрилы).
Нитросоединенияминазывают производные углеводородов, содержащие в молекуле одну или несколько функциональных нитрогрупп –NО2, связанных непосредственно с атомом углерода. В зависимости от состава радикала, с котoрым соединена нитрогруппа, различают нитросоединения алифатические (предельные и непредельные), алициклические, ароматичеcкие и гетероциклические. По характеру углеродного атома, у которого стоит нитрогруппа, нитросоединения подразделяют на первичные, вторичные и третичные, аналогично спиртом.
Строение электронной оболочки атома азота выражается формулой1s22s22p3. Предельные нитросоединения имеют общую формулуCпH2п+1NО2илиR-NO2. Они изомерны алкилнитритам (эфирам азотистой кислоты) с общей формулойR-O-NO. Нитропроизводные называют по углеводороду, добавляя префикснитро- перед названием органического остатка.
Способы получения
1. Обменная реакция между галогенопроизводным и нитратом серебра (Е. В. Мейер, 1832).
2. Реакция нитрования углеводородов разбавленной азотной кислотой (М. И. Коновалов, 1889). Этот способ получил впоследствии название жидкофазного нитрования.
3. Нитрование проводят при повышенной температуре (около 4000С) концентрированной азотной кислотой, т.е. в присутствии оксидов азота.
4. Газофазное нитрование (в промышленном масштабе) в парах азотной кислоты с диоксидом и тетраоксидом азота при повышенной температуре 450-5000С.
Физические свойства. Нитросоединения углеводородов предельного ряда – жидкости со специфическим запахом, имеют высокие температуры кипения, ядовиты. Они малорастворимы в воде, но хорошо растворяются в органических растворителях и сами являются хорошими растворителями для многих органических веществ. Водные растворы их имеют нейтральную реакцию и не вызывают коррозию металлов. Плотность нитросоединений низших гомологов ряда больше единицы, по мере роста радикала она уменьшается.
Химические свойства.
1. Действие щелочей. Нитросоединения относят к псевдокислотам. 2. Действие кислот. 3. Реакция конденсации. 4. Восстановление нитросоединений атомарным водородом.
Важнейшие
представители. НитрометанСН3NО2– прозрачная жидкость с т. пл. -28,50С, т. кип. 101,20С,![]() малорастворимая
в воде, но растворимая в органических
растворителях, кроме парафинов; это
огне- и взрывоопасное вещество. Применяется
он в качестве растворителя жиров и
восков и экстрагента ароматических
углеводородов, как исходный продукт в
производстве хлорпикрина и нитроспиртов,
а также в качестве окислителя в жидкостных
ракетных двигателях.
малорастворимая
в воде, но растворимая в органических
растворителях, кроме парафинов; это
огне- и взрывоопасное вещество. Применяется
он в качестве растворителя жиров и
восков и экстрагента ароматических
углеводородов, как исходный продукт в
производстве хлорпикрина и нитроспиртов,
а также в качестве окислителя в жидкостных
ракетных двигателях.
ТринитрометанСН3(NО2)3– жидкость с т. пл. 250С, т. кип.
45-470С,![]() ;
смешивается с водой и органическими
растворителями. Тринитрометан используют
в производстве взрывчатых веществ и
при штамповке металлических изделий
взрывом.
;
смешивается с водой и органическими
растворителями. Тринитрометан используют
в производстве взрывчатых веществ и
при штамповке металлических изделий
взрывом.
Амины можно рассматривать как производные аммиака, в котором один или несколько атомов водорода замещены углеводородными радикалами. В зависимости от числа углеводородных радикалов, связанныхс атомом азота, различают амины первичные, вторичные и третичные. Здесь понятия первичный, вторичный и третичный связаны не с характером углеродного атома, а со степенью замещения водорода у атома аммиака. В зависимости от природы радикалов, входящих в состав аминов, их подразделяют на алифатические, или жирные (предельные и непредельные), алициклические, ароматичеcкие и гетероциклические.
Названия аминов производят от названий радикалов, связанных с атомом азота, с добавлением слова -аминили -диамин.
Способы получениявесьма разнообразны
1. Взаимодействие аммиака или аминов со спиртами при повышенной температуре в присутствии (250-3000С) катализаторовAl2O3илиThO2.
2. Взаимодействие аммиака или аминов с галогенозамещенными углеводородами получают смесь солей различных аминов (реакция Гофмана).
3. Восстановление нитрилов, цианзамещенных углеводородов при повышенных температуре и давлении в присутствии мелкораздробленного никеля, платины или палладия.
4. Восстановительное аминирование альдегидов и кетонов.
5. Восстановление нитросоединений водородом в присутствии катализаторов (Pt,Pd,Ni) или другими способами с образованием первичных аминов.
6. Расщепление амидов кислот гипобромитом или гипохлоритом с образованием первичных аминов (Гофман).
7. Восстановлением динитрилов и динитросоединений, а также взаимодействием аммиака с дигалогенидами могут быть получены диамины.
Физические свойства. Алифатические первичные амины с числом углеродных атомов менее трех представляют собой газы, хорошо растворимые в воде и обладающие резким аммиачным запахом. По мере увеличения числа углеродных атомов возрастают температура плавления, температура кипения и плотность, уменьшается их растворимость в воде и ослабевает запах. Моноамины с числом углеродных атомовп 4 ÷12 – бесцветные растворимые в воде жидкости. Высшие амины – твердые вещества, плохо растворимые в воде и почти лишенные запаха. Низщие диамины растворятся в воде, являются более сильными основаниями и имеют более высокие температуры плавления и кипения, чем моноамины.
Химические свойства. Для аминов характерны следующие химические реакции.
1. Взаимодействие с водой и кислотами. 2. Взамодействие с азотистой кислотой.
3. Ацилирование аминов. 4. Алкилирование аминов. 5. Окисление аминов.
Диамины. Соединения, содержащие две аминогруппы в молекуле, называютдиаминами, растворимы в воде и являются более сильными основаниями, чем моноамины.
Важнейшие представители. Простейшие алифатические амины метиламинСН3-NH2, диметиламин (СН3)2NH, диэтиламин (С2Н5 )2NH, диамины и другие применяют при синтезе лекарственных препаратов, ускорителей вулканизации, в производстве инсектицидов, гербицидов, фунгицидов, растворителей, красителей, синтетических волокон и ракетных топлив.
Амины широко применяются в цветной и черной металлургии в процессах флотации и экстракции руд в качестве собирателей, пенообразователей и экстрагентов. К их числу относят высшие жирные амины R-NH2, гдеRсодержит от 7 до 18 атомов углерода.
Синильная кислота, цианиды, нитрилы и изоцианиды.
А.
Синильная кислота, цианиды. Синильная,
илициановодородная, кислота НСN- бесцветная, очень летучая жидкость, с
запахом горького миндаля; т. пл. 13,30С, т. кип. 25,70С,![]() .
Смешивается с водой и многими органическими
соединениями. Сама кислота и ее соли
цианиды – цианид калияNaCNи цианид натрияNaCN- очень
ядовитые вещества.
.
Смешивается с водой и многими органическими
соединениями. Сама кислота и ее соли
цианиды – цианид калияNaCNи цианид натрияNaCN- очень
ядовитые вещества.
Синильная кислота применяется в производстве хлорциана, акрилонитрила, акрилатов, аминокислот и др.
Метод извлечения золота из руд с помощью растворов цианидов калия или натрия был разработан в 1843 г. русским инженером П. Р. Багратионом.
Цианиды используют также при селективной флотации полиметаллических руд, вызывая депрессию цинковых минералов, пирита и медных сульфидов.
Б. Нитрилы и изоцианиды. Нитрилы– производные синильной кислоты, в которой водород замещен на углеводородный радикал. Их общая формулаR-CN.
Нитрилы можно рассматривать и как производные карбоновых кислот, получаемые в результате превращения карбоксильной группы в нитрильную.
Изоцианиды(изонитрилы) имеют строениеR-N![]() С
илиR-
С
илиR-![]() ≡,
т. е. в нитрилах цианогруппа соединена
с углеводородным радикалом атома
углерода, а в изоцианидах – с атомом
азота.
≡,
т. е. в нитрилах цианогруппа соединена
с углеводородным радикалом атома
углерода, а в изоцианидах – с атомом
азота.
Номенклатура. Нитрилы называют по кислотам, в которые они переходят при омылении, или же по углеводородам с добавлением окончания –нитрил.
Названия изоцианидов (изонитрилов) обычно образуют от названий соответствующих углеводородных радикалов с добавлением окончания -изоцианид (-изонитрил).
Способы получения. Нитрилы получают из амидов кислот нагреванием и отнятием воды фосфорным ангидридом либо другими водоотнимающими средствами.
При действии на галогеналкилы солей серебра получают изоцианиды.
Физические свойства. Низшие нитрилы до С11– растворимые в воде жидкости со слабым эфирным запахом, перегоняются без разложения при атмосферном давлении. Температуры кипения нитрилов близки к температурам кипения соответствующих спиртов с тем же числом углеродных атомов. Изоцианиды кипят при более низкой температуре, чем нитрилы.
Химические свойства. Нитрилы и изоцианиды имеют разные химические свойства.
1.Гидролиз. Нитрилы гидролизуются водными растворами минеральных кислот и щелочей с образованием соответствующих органических кислот.
Изоцианиды гидролизуются только растворами минеральных кислот с образованием муравьиной кислоты и амина.
2. Нитрилы и изоцианиды легко восстанавливаются водородом в момент его выделения в первичные амины.
3. Вследствие «ненасыщенности» углеродного атома изонитрила последние способны к реакциям присоединения.
Важнейшие
представители.АцетонитрилСН3-С≡N- жидкость с т. пл. -45,70С, т. кип.
81,60С,![]() ,
смешивается с водой и многими органическими
соединениями, растворяет ацетаты и
нитраты целлюлозы.
,
смешивается с водой и многими органическими
соединениями, растворяет ацетаты и
нитраты целлюлозы.
Ацетонитрил получают дегидратацией ацетата аммония или ацетамида аммонолизом углеводородов. Его используют для различных синтезов – полиакрилатов, полиамидов, применяют в качестве экстрагента при отделении бутадиенов от бутенов, извлечении жирных кислот из растительных и животных масел и др., для удаления смол и фенолов из углеродов нефти.
АкронитрилСН2=СH-C≡N- жидкость с т. пл. -83,50С, т. кип.
77,30С,![]() растворяется в воде и многих органических
растворителях.
растворяется в воде и многих органических
растворителях.
Акронитрил получают окислительным аммонолизом пропилена.
Его применяют в производстве дивинилнитрильного каучука, акриламида и синтетического волокна акрилана (нитрона).
Основная литература [1] (173-198)
Контрольные вопросы:
1. Перечислите основные производные циановодородной кислоты.
2. Изложите основные способы получения нитрилов и изоцианидов.
3. Каковы особенности физических и химических свойств нитрилов и изоцианидов?
4. Назовите примеры использования солей синильной кислоты (цианидов) в гидрометаллургии.
5. Напишите химические реакции, протекающие при извлечении золота из сульфидных минералов.
Тема лекции №5: Элементорганические соединения. Карбоциклические углеводороды
и их производные. Ароматические соединения
Элементорганические соединения. Органические соединения, и молекуле которых находится металл, непосредственно связанной с атомом углерода ковалентной связью, называютэлементорганическимиилиметаллорганическимисоединениями. Общие формулы элементорганических соединенийR-Me,Me-R-Me,R-Me-X(где Х - галоген).
Металлорганические соединения широко применяются в качестве катализаторов горения и реакций полимеризации, в производстве инсектицидов, фунгицидов, антидетонаторов моторного топлива и др. Они привлекают внимание как возможные компоненты ракетных топлив.
Названия элементорганических соединений образуют из названия радикала, связанного с металлом, и названия элемента. Например CH3-CH2-NaCH3-Mg-Br
этилнатрий бромистый метилмагний
1. История получения элементорганических соединений и закономерности их образования.Первые обстоятельные работы по органическим соединениям, содержащим неорганогены, были выполнены в 1837-1843 гг. известным немецким ученым Р Бунзеном. Нагревая диметиларсинхлорид (хлорид какодила) с цинком в атмосфере диоксида углерода, Бунзен получил тетраметилдиарсин (СН3)2Аs-О-As(СН3)2. Позднее его ученик Франкланд (1849) синтезировал иодистый этилцинк.
В 1853 г. Франкланд опубликовал статью «О новом ряде органических тел, содержащих металлы».
В 1860-1870 гг. А. М. Бутлеров провел ряд экспериментальных работ с металлорганическими соединениями с целью подтверждения теории строения органических соединений. А. М. Бутлеров и его ученики (в особенности А. М. Зайцев) в 60-70-х годах ХIХ в. синтезировали с помощью цинкорганических соединений большое число спиртов, кислот и углеводородов с разветвленным скелетом.
В 1899 г. французский ученый П. Барбье провел первые опыты по замене цинка магнием в синтезах А. М. Зайцева и получил положительные результаты. Дальнейшая разработка синтезов магнийорганических соединений связана с именем В. Гриньяра – ученика Барбье.
Большие исследования с элементорганическими соединениями проведены советскими учеными А. Н. Несмеяновым, А. Е. Арбузовым, М.Н. Кабачником, К. А. Андрияновым и др.
Металлы с валентностью выше двух образуют как полные, так и смешанные металлорганические соединения.
Непереходные элементы – неметаллы – галогены, кислород, азот и др. и такие металлы, как натрий, литий, магний, цинк и др., образуют алкильные и подобные им производные со связью углерод – элемент.
Переходные элементы – железо, кобальт, никель, марганец, хром, ванадий, титан и др. – образуют комплексные соединения с непредельными углеводородами и «сэндвичевые» (от англ. sandwich- бутерброд) соединения с циклическими углеводородами.
Редкоземельные элементы и актиноиды не склонны к образованию металлорганических соединений.
2. Способы получения. Элементорганические соединения получают следующими способами.
1. Действие элементов на галогеналкилы.
2. Реакция металлорганических соединений с галогенидами более электроотрицательного элемента.
3. Реакция металлорганических соединений с более электроположительными металлами.
4. Действие галогенидов тяжелых металлов на металлорганические соединениялегких металлов.
3. Магнийорганические соединенияизучены в 1900-1901 гг. В. Гриньяром. Это твердые вещества высокой реакционной способностью Их получают из стружки металлического магния действием галогенопроизводного в присутствии безводного диэтилового эфира. Известны два типа магнийорганических соединений – смешанные магнийорганические соединенияR-Me-Xи полные магнийорганические соединенияR-Me-R. Наиболее часто в органическом синтезе используют эфирные растворы смешанных магнийорганических соединений составаR-Me-X, называемыереактивами Гриньяра. В последние время для проведения реакции Гриньяра в качестве еще более благоприятной среды, чем этиловый эфир, предложены тетрагидрофуран, эфиры гликолей, третичные амины.
Магнийорганические соединения находит свое выражение в способности вступать в реакции замещения иприсоединения. Однако наиболее характерной является реакция присоединения магнийорганических соединений к двойным поляризованным связям. Например, вода, спирты, кислоты, амины разлагают магнийорганические соединения с образованием углеводородов.
4. Алюминийорганические соединения были известны еще 19-м веке, однако интерес к ним сильно возрос после того, как немецкий химик К. Циглер открыл в 1955 г. простой способ их получения из металлического алюминия, водорода и этиловых углеводородов.
Низшие алюминийтриалкилы, в частности триэтилалюминий, - жидкости, воспламеняются на воздухе, растворяются в органических растворителях, бурно реагируют с водой, спиртами, кислотами и галогенами, присоединяются по кратным связям, активно взаимодействуют с олефинами.
Высшие спирты, и в частности додекановый спирт, применяются в качестве активных флотореагентов-вспенивателей при обогащении руд цветных металлов, а также в производстве синтетических моющих средств.
5. Кремнийорганические соединения– весьма термостойкие вещества и потому нашли широкое применение в ракетной технике для покрытия внутренних стенок камеры сгорания двигателей,атакже в самолетостроении в качестве антиразгарного и антикоррозионного покрытия деталей машин.
Первое кремнийорганическое соединение тетраэтоксисилан Si(OC2H5)4было получено М. Эбельманом в 1845 г., а кремнийорганическое вещество, содержащее кремнийуглеродную цепь (С2Н5)4Si, было синтезировано в 1863 г. Ш. Фриделем и Дж. Кафтсом.
Первые два члена гомологического ряда кремневодородов – силан SiН4и дисилан
Si2Н6, аналоги углеводородов метана и этана – газы, последующие - жидкости. Силаны – нестойкие соединения, ядовиты, имеют неприятный запах, на воздухе самовоспламеняются, смешиваются с органическими растворителями, легко гидролизуются водой.
Кремнийорганические соединения, содержащие группы Si– О называютсилоксанами.
Кремнийорганические соединения, содержащие одну или несколько гидроксильных групп, называют как производные силана с добавлением суффиксов –ол, -диол, -триол.
Кремнийорганические соединения, содержащие аминогруппу, называют как производные силазана (силиламины).
Силандиолы легко теряют воду и образуют соединения, называемые силиконами.
Карбоциклические углеводороды и их применение.Карбоциклическими углеводородаминазывают такие органические вещества, в молекулах которых содержатся циклические группировки, образованные только углеродными атомами. Их подразделяют на алициклические и ароматические.
Циклоалканы (циклопарафины). Циклоалканаминазывают предельные алициклические углеводороды, в которых все углеродные атомы цикла соединены друг с другом простыми одинарными связями. По своим свойствам они напоминают обычные цепные предельные углеводороды алканы (парафины), откуда и происходит их название циклоалканы, или циклопарафины.
