
Analiticheskaya_khimia_Ch_2
.pdf
Московский государственный технический университет имени Н.Э. Баумана
АНАЛИТИЧЕСКАЯ ХИМИЯ
Часть 2
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ (ОПТИЧЕСКИЕ, РЕНТГЕНОФАЗОВЫЙ И РЕНТГЕНОСТРУКТУРНЫЙ МЕТОДЫ)
Издательство МГТУ им. Н.Э. Баумана
Московский государственный технический университет имени Н.Э. Баумана
АНАЛИТИЧЕСКАЯ ХИМИЯ
Часть 2
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ (ОПТИЧЕСКИЕ, РЕНТГЕНОФАЗОВЫЙ И РЕНТГЕНОСТРУКТУРНЫЙ МЕТОДЫ)
Методические указания по курсу «Аналитическая химия»
М о с к в а Издательство МГТУ им. Н.Э. Баумана
2 0 0 7
УДК 543.062 ББК 24.4
А64
Рецензент Н.А. Задорожный
Аналитическая химия. – Ч. 2: Количественный анализ (опти- А64 ческие, рентгенофазовый и рентгеноструктурный методы):
Метод. указания по курсу «Аналитическая химия» / А.Д. Смирнов, А.М. Голубев, В.Н. Горячева и др. – М.: Изд-во МГТУим. Н.Э. Баумана, 2007. – 40 с.: ил.
Рассмотрены широко используемые в аналитической химии методы спектрального анализа определения элементного состава вещества по атомным спектрам излучения (метод эмиссионной фотометрии пламени), по атомным спектрам поглощения (метод атомно-абсорбционной спектроскопии пламени) и спектрометрический метод анализа по молекулярным спектрам (метод абсорбционной молекулярной спектроскопии), а также методы рентгенофазового и рентгеноструктурного анализа. Приведены контрольные вопросы по различным методам анализа.
ДлястудентовМГТУим. Н.Э. Баумана. Ил. 8. Табл. 5. Библиогр. 9 наим.
УДК543.062 ББК 24.4
МГТУ им. Н.Э. Баумана, 2007
ВВЕДЕНИЕ
Современный уровень развития науки и техники ставит перед аналитической химией задачу снижения предела обнаружения веществ в пробах до 10–5 … 10–10 %. Низким пределом обнаружения и другими ценными показателями обладают физико-химические методы анализа, чье общее число составляет несколько десятков.
Наибольшее практическое значение имеют следующие группы методов:
1)методы, основанные на взаимодействии электромагнитно-
го излучения с веществом (аналитический сигнал определяется оптической плотностью, показателем преломления и т. п.);
2)электрохимические методы (аналитический сигнал определяется электродвижущей силой, электродным потенциалом, сопротивлением или электропроводностью);
3)термометрические методы (аналитический сигнал определяется теплопроводностью, температурой плавления или кристаллизации);
4)хроматографические методы, использующие различия в скоростях движения компонентов газовой или жидкой смеси.
Наиболее обширной по числу методов и важной по практическому значению является первая группа методов анализа. Она включает оптические методы: эмиссионную атомную спектроскопию, атомно-адсорбционную спектроскопию, а также инфракрасную спектроскопию, спектрофотометрию, рентгенофазовый и рентгеноструктурный анализ и др. Этим методам и посвящена данная работа.
1.ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
1.1.Особенности спектрального анализа
Всовременной науке и технике для определения состава веществ широко используются разнообразные методы, среди которых большое распространение получили спектральные, введенные
3
в практику аналитической химии в 1860 г. немецкими учеными Р.В. Бунзеном и Г.Р. Кирхгофом. Эти ученые впервые установили, что каждому химическому элементу соответствует вполне конкретный, присущий только ему спектр, по интенсивности которого можно судить о количестве рассматриваемого элемента.
С 1860 по 1932 г. методами спектрального анализа было открыто 25 элементов Периодической системы, в том числе цезий, рубидий, 14 редкоземельных элементов, талий, галий, гафний и др. В настоящее время спектральный анализ широко используется в науке и технике, и сейчас вряд ли можно найти область естествознания, в которой он не находил бы применения. Именно методы спектрального анализа наиболее полно удовлетворяют все возрастающим требованиям современного производства. Многоэлементность, экспрессность, низкие пределы обнаружения, возможность определения многих элементов в малых пробах – все это быстро превратило спектральные методы анализа в эффективные методы аналитической химии.
Для качественного определения элементов достаточно удостовериться в наличии или отсутствии их линий в спектрах проб. Как правило, спектры получают в широких диапазонах длин волн, чтобы иметь возможность делать выводы о присутствии возможно большего числа элементов. При количественном анализе сравнивают интенсивности спектральных линий определяемых элементов с интенсивностями тех же самых линий в спектрах стандартных образцов, содержащих определяемые элементы в известных концентрациях.
Современные спектральные приборы имеют автоматизированные системы ввода проб, встроенные ЭВМ, которые управляют процессом проведения анализа и выдают результаты в удобной для пользователя форме. Большие перспективы перед спектральным анализом открылись с использованием лазеров. Оказалось возможным детектировать элементы на уровне единичных атомов, различать отдельные изотопы, проводить анализ на расстоянии в несколько километров от наблюдателя, эффективно выполнять анализ микрообъектов.
Трудности широкого использования лазерной техники связаны с необходимостью применения дорогостоящего оборудования и обслуживания его высококвалифицированным персоналом. Однако традиционные методы спектрального анализа, по-видимому, еще долго будут занимать значительное место в арсенале методов аналитической химии.
4
Рассмотрим широко используемые в аналитической химии методы спектрального анализа при определении элементного состава вещества по атомным спектрам излучения (метод эмиссионной фотометрии пламени), по атомным спектрам поглощения (метод атомно-абсорбционной спектроскопии пламени) и спектрометрический метод анализа по молекулярным спектрам (метод абсорбционной молекулярной спектроскопии).
1.2. Теория атомных спектров
Все современные представления о спектрах электромагнитного излучения основаны на квантовой теории, согласно которой атомная система является устойчивой лишь в определенных стационарных состояниях, соответствующих некоторой последовательности значений энергии Е. Изменение этой энергии связано со скачкообразным переходом системы из одного стационарного состояния в другое. В этом случае может происходить испускание или поглощение квантов электромагнитной энергии. Наряду с этим существуют переходы без испускания или поглощения квантов электромагнитной энергии (безызлучательные переходы). Последние имеют место при соударениях рассматриваемой атомной системы с окружающими ее атомами, молекулами, радикалами и т. д.
Поскольку состояние системы обладает определенной энергией, принято говорить об уровнях энергии и переходах между ними (рис. 1.1). Начало отсчета выбирают произвольно, за нуль, как правило, принимают состояние (уровень) с наименьшей из всех известных состояний энергией (его называют основным, или нормальным, все другие – возбужденными). Переходы между уровнями энергии показывают вертикальными линиями, а их направления – стрелками. Совокупность переходов из состояний с меньшими энергиями (с нижних уровней) в состояния с бóльшими энергиями относительно начальных (на верхние уровни) дает спектр поглощения, с верхних на нижние – спектр испускания. Переходу между дискретными уровнями энергии соответствует определенная спектральная линия, характеризуемаявспектрезначениемчастоты(длиныволны)
ν = |
c |
= |
∆E |
, |
(1.1) |
|
λ |
h |
|||||
|
|
|
|
где ν – частота; с – скорость света; λ– длина волны; ∆E – разность энергиймеждустационарнымиуровнями; h – постояннаяПланка.
5
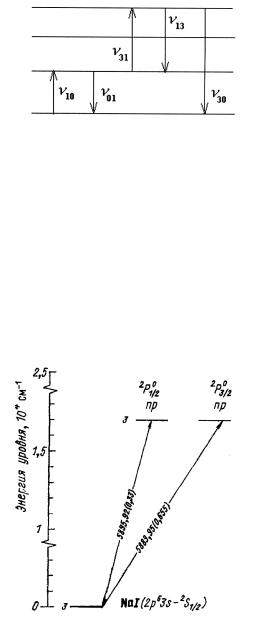
Рис. 1.1. Схема уровней энергии и возможных переходов
На практике используют не частоту, измеряемую в герцах, а волновое число, см–1,
ν = |
1 |
, |
(1.2) |
|
λ |
||||
|
|
|
которое для краткости также именуют частотой. В справочных изданиях часто приводят диаграммы уровней энергий для атомных систем с указанием наиболее часто используемых на практике переходов частоты (длины волны) спектральных линий в ангстремах или нанометрах и силы осциллятора перехода, как это показано для атома натрия(рис. 1.2), гдезначениясилыосцилляторовприведенывскобках.
Рис. 1.2. Спектр атома натрия
6
Каждый переход характеризуется определенной вероятностью. Коэффициент, равный отношению числа спонтанно (самопроизвольно) испущенных за единицу времени фотонов к числу частиц, находящихся в возбужденном состоянии Ni, называют вероятностью спонтанного испускания, или коэффициентом Эйнштейна для спонтанного испускания А. Символом Аik обозначают коэффициент Эйнштейна для перехода системы из состояния с энергией Ei в состояние с энергией Ek. Коэффициент, равный отношению числа поглощенных в единицу времени фотонов nνki к числу частиц Nk c энергией Ек, ум-
ноженному на единицу плотности излучения ρ(νki ), называют коэффициентом Эйнштейна для поглощения Bki, а произведение Bki ρ(νki ), пропорциональное доле частиц, поглощающих фотоны частоты νki , представляет собой вероятность поглощения. Поглоще-
ние фотонов всегда есть процесс вынужденный, поэтому коэффициент Эйнштейна определяется на единицу плотности поглощаемого излучения. Коэффициент, равный отношению числа фотонов, ис-
пускаемых за единицу времени в результате воздействия излучения плотности ρ(νki ), т. е. при вынужденных переходах с верхнего уров-
ня Ei на нижний Ek, к числу частиц, находящихся на верхнем уровне Ei, умноженному на единицу плотности излучения, называют коэффициентом Эйнштейна для вынужденного испускания, а произведениеBik ρ(νki ) – вероятностьювынужденногоиспускания.
Между коэффициентами Аik и Bki существует соотношение
A |
= |
8πhνik3 |
|
g |
k |
B , |
|
|
|
|
|||
ik |
|
c3 |
|
|
|
ki |
|
|
|
gi |
|||
где gk и gi – степени вырождения уровней с энергией Ek Отметим, что
gk Bki = gi Bik .
(1.3)
и Ei.
(1.4)
Интенсивности линий испускания и поглощения излучения определяются соотношениями:
для испускания
Iисп = hνik Aik Ni ; |
(1.5) |
|
7 |

для поглощения
Iпогл = hνki Bki Nk ρ(νki ); |
(1.6) |
для вынужденного испускания |
|
Iвын.исп = hνik Bik Ni ρ(νki ). |
(1.7) |
C точки зрения квантовой теории строения атомных или молекулярных систем каждое i-е состояние с энергией Ei может быть описано с помощью волновой функции ϕi , которая является ре-
шением уравнения Шредингера |
|
Hψ = Eψ, |
(1.8) |
записанного для системы в целом, где |
|
ψ = ∑αiϕi . |
(1.9) |
Здесь αi – коэффициенты, которые пропорциональны вкладу вол-
новой функции каждого состояния в полную волновую функцию ψ всей системы. В этом случае вероятности перехода системы из i-го состояния в k-e пропорциональны квадрату матричного элемента перехода:
2
∫ϕi µϕk dq = Rik2 , (1.10)
где µ−оператор дипольного момента перехода. Коэффициент Эйнштейна, например для испускания, оказывается равным
A |
= |
64π4 |
ν3 |
R2 . |
(1.11) |
|
|||||
ik |
|
3hc3 |
ik |
ik |
|
|
|
|
|
|
Часто в таблицах и диаграммах уровней энергии вероятности переходов характеризуют силой осциллятора f. Эта величина связана с коэффициентом Эйнштейна для испускания следующим соотношением:
8

|
3m c3 |
|
|
|
fik = |
e |
|
Aik , |
(1.12) |
8π2e2νik |
2 |
где me – масса электрона; e – заряд электрона.
Вышеприведенные закономерности основны на допущении что каждый уровень энергии не имеет ширины, т. е. бесконечно узок. В действительности каждый уровень энергии имеет конечную ширину Ε ± ∆Ε. Это приводит к тому, что каждая спектральная линия также имеет конечную ширину, поскольку она возникает при переходе атома (молекулы, иона) с одного уровня энергии конечной ширины на другой. Введенные коэффициенты Эйнштейна характеризуют полную (суммарную) вероятность перехода частицы с одного уровня на другой.
Правила отбора. Вероятность перехода может принимать любое значение, в том числе и нулевое. Она будет отличаться от нуля, если выполняются некоторые соотношения между квантовыми числами. Эти соотношения выявлены в результате квантовомеханического рассмотрения строения атомов, молекул, ионов и называются правилами отбора. В тех случаях, когда значение вероятности переходов равно нулю, говорят, что эти переходы запрещены правилами отбора. Правила отбора бывают строгими, т. е. выполняющимися всегда. Например, изменение главного квантового числа n может быть любым, в то время как для орбитального квантового числа l существует правило отбора ∆l = ±1, когда вероятность такого перехода имеет ненулевое значение. Правила отбора могут быть нестрогими. Выполнение этих правил зависит от степени приближения выбранных моделей строения атомов к реальной действительности. Нестрогим, например, является правило изменения спинового квантового числа.
В первом приближении, когда спины электронов рассматриваются как не зависящие от квантового числа l, изменение спинового квантового числа S должно оставаться тем же при переходе из одного состояния в другое, чтобы вероятность такого перехода была отлична от нуля. Однако наблюдаются спектральные линии, относящиеся к переходам, для которых спиновое квантовое число изменяется на единицу. Интенсивность линий таких переходов значительно слабее, т. е. вероятность таких переходов очень мала, но, тем не менее, она отлична от нуля. Это говорит о том, что при рассмотрении модели строения атома с учетом спинов электронов
9
