
Analiticheskaya_khimia_Ch_2
.pdfили
ln( |
Φ0 |
) = A = kνCl, |
(1.19) |
|
Φ |
|
|
где поглощательная способность, или оптическая плотность А, представляет собой величину, прямо пропорциональную концентрации С поглощающего атома (в данном случае это концентрация атомов, находящихся в основном состоянии); kν – линейный ко-
эффициент поглощения, относящийся к бесконечно узкому интервалу частот ν±dν.
Разновидностью метода атомно-абсорбционного анализа является атомно-абсорбционная спектроскопия пламени. Сущность этого метода заключается в измерении поглощения резонансного излучения свободными атомами определяемого элемента, находящимися в газовой фазе, и определении функциональной зависимости величины поглощения от концентрации определяемого элемента в анализируемой пробе. Для получения свободных атомов анализируемое вещество нагревают до высокой температуры в пламени.
В настоящее время в качестве источников света для атомноабсорбционного анализа наиболее часто используют различные газоразрядные источники, спектр испускания которых совпадает со спектром определяемого атома. В этом случае не представляет труда получить в спектре испускания линии с шириной, меньшей ширины спектральных линий определяемых атомов, поскольку при высоких температурах спектральные линии уширяются.
При работе выбирают в спектре испускания одну из линий, обусловленную переходом на основной уровень (резонансную линию), и определяют ослабление ее интенсивности при прохождении излучения через слой поглощающих атомов. Очевидно, что поглощать данную спектральную линию будут атомы, находящиеся в основном состоянии. Конструкция используемых газоразрядных ламп с полым катодом такова, что в спектре испускания интенсивно проявляются спектральные линии атомов, входящих в состав катода. Изменяя материал катода, можно получать спектры испускания различных атомов. Обычно каждая лампа для атомноабсорбционного анализа дает спектр испускания атомов какоголибо одного элемента (табл. 1.3).
20

Таблица 1.3
Длины волн резонансных линий для ламп с полным катодом различных атомов и пределы обнаружения элементов в пробе
|
Длинаволны |
Пределы |
Элемент |
обнаруже- |
|
резонансной |
нияэлемен- |
|
|
линии, нм |
|
|
|
тов, мкг/мл |
Алюминий |
309,3 |
0,03 |
Барий |
553,5 |
0,02 |
Бериллий |
234,9 |
0,001 |
Бор |
249,8 |
2,5 |
Ванадий |
318,4 |
0,06 |
Висмут |
223,1 |
0,04 |
Вольфрам |
400,9 |
3,0 |
Гадолиний |
407,9 |
0,4 |
Галлий |
287,4 |
0,1 |
Гафний |
286,6 |
8,0 |
Германий |
265,1 |
1,0 |
Гольмий |
410,4 |
0,1 |
Диспрозий |
421,2 |
0,2 |
Европий |
459,4 |
0,04 |
Железо |
248,3 |
0,01 |
Золото |
242,8 |
0,02 |
Индий |
303,9 |
0,05 |
Иридий |
263,9 |
2,0 |
Иттербий |
398,8 |
0,04 |
Иттрий |
410,2 |
0,3 |
Кадмий |
228,8 |
0,001 |
Калий |
766,5 |
0,005 |
Кальций |
422,7 |
0,001 |
Кобальт |
240,7 |
0,01 |
Кремний |
251,6 |
0,08 |
Лантан |
550,1 |
2,0 |
Литий |
670,8 |
0,0006 |
Лютеций |
335,9 |
3,0 |
Магний |
285,2 |
0,0001 |
Марганец |
279,5 |
0,002 |
Медь |
324,8 |
0,002 |
Молибден |
313,3 |
0,03 |
Мышьяк |
193,7 |
0,1 |
Натрий |
589,0 |
0,002 |
|
Длинаволны |
Пределы |
Элемент |
обнаруже- |
|
резонансной |
нияэлемен- |
|
|
линии, нм |
|
|
|
тов, мкг/мл |
Неодим |
463,4 |
2,0 |
Никель |
232,0 |
0,01 |
Ниобий |
334,4 |
1,0 |
Олово |
224,6 |
0,02 |
Осмий |
290,9 |
0,5 |
Палладий |
244,8 |
0,02 |
Платина |
265,9 |
0,1 |
Празеодим |
495,1 |
10,0 |
Рений |
346,1 |
1,0 |
Родий |
343,5 |
0,03 |
Ртуть |
253,7 |
0,5 |
Рубидий |
780,0 |
0,005 |
Рутений |
343,9 |
0,3 |
Самарий |
429,7 |
2,0 |
Свинец |
283,3 |
0,02 |
Селен |
196,1 |
0,1 |
Серебро |
328,1 |
0,02 |
Скандий |
391,2 |
0,1 |
Стронций |
460,7 |
0,01 |
Сурьма |
217,6 |
0,4 |
Тантал |
271,5 |
2,0 |
Таллий |
276,8 |
0,03 |
Теллур |
214,3 |
0,09 |
Тербий |
432,7 |
3,0 |
Титан |
365,4 |
0,09 |
Туллий |
371,8 |
0,2 |
Уран |
358,5 |
30,0 |
Фосфор |
213,6 |
100,0 |
Хром |
357,9 |
0,003 |
Цезий |
852,1 |
0,05 |
Цинк |
213,9 |
0,002 |
Цирконий |
360,1 |
5,0 |
Эрбий |
400,8 |
0,1 |
|
|
|
21
При анализе необходимо иметь целый набор ламп для различных элементов. Идентификацию элементов в пробе проводят последовательной заменой ламп, используя их поочередно в качестве источников излучения. Мерой поглощения излучения служит показание прибора, прокалиброванного в единицах оптической плотности. Оптическая плотность прямо пропорциональна концентрации поглощающих атомов, поэтому градуировочный график строят в координатах: «оптическая плотность – концентрация определяемого вещества». К настоящему времени описаны условия атомно-абсорбционного определения 76 элементов в различных объектах: сплавах, чистых металлах, нефтепродуктах, почвах, биологических жидкостях, водах и т. д. Метод характеризуется низкими пределами обнаружения: позволяет определять элементы с концентрацией 0,1…0,005 мкг/мл с погрешностью 1…4 %.
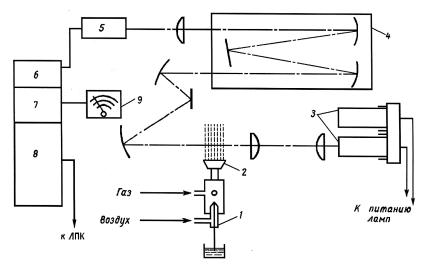
Принципиальная схема одного из атомно-абсорбционных спектрофотометров показана на рис. 1.6.
Рис.1.6. Принципиальная схема спектрофотометра AAS1N:
1 – распылитель; 2 – горелка; 3 – лампы с полым катодом (ЛПК); 4 – монохроматор зеркальный с дифракционной решеткой; 5 – фотоумножитель; 6 – источник питания фотоумножителя; 7 – усилитель фототока; 8 – источник питания ламп с полым катодом; 9 – измерительный прибор
Сравнение атомно-абсорбционного метода с методом эмиссионной фотометрии пламени. Метод атомной абсорбции
22
обладает рядом преимуществ перед методом фотометрии пламени. Число атомов, находящихся в возбужденном состоянии, незначительно по сравнению с их числом в основном состоянии, поэтому переходы атомов с возбужденных уровней, сопровождающиеся поглощением энергии, будут встречаться редко. Это обусловливает простоту спектров поглощения атомноабсорбционного метода. Изменения температуры при анализе в эмиссионном методе сильно сказываются на интенсивности линий. В методе атомной абсорбции число атомов в невозбужденном (основном) состоянии мало меняется с изменением температуры поглощающего вещества.
Чувствительность определения некоторых элементов методом фотометрии пламени незначительна, поскольку аналитические линии этих элементов лежат в ультрафиолетовой области спектра. Поэтому для возбуждения этих спектров требуется энергия, значительно превышающая энергию частиц в пламенах. Для метода атомной абсорбции важна заселенность нижнего, основного, уровня, поэтому на чувствительность определения не влияет спектральная область, где лежат аналитические линии определяемых элементов.
1.5. Спектрофотометрический метод анализа (абсорбционная молекулярная спектроскопия)
Молекулярные спектры поглощения, в отличие от спектров атомов, состоят из более широких полос, так как они представляют собой сумму различного типа переходов, которые могут осуществляться в результате перехода молекулы из основного состояния в возбужденное. Это затрудняет проведение качественного анализа на основании молекулярных спектров (за исключением ИК-спектров), поэтому спектрофотометрический метод обычно используют как метод количественного анализа.
Спектрофотометрический метод основан на избирательном поглощении системой электромагнитных излучений различных участков спектра. Когда имеют дело с растворами, количество поглощенной энергии пропорционально концентрации поглощаемого вещества в растворе. Каждая однородная среда (раствор) обладает способностью избирательно поглощать излучение определенной длины волны. Лучше всего это заметно на системах, обладающих избирательным поглощением в видимом участке спектра: так, по цвету любого окрашенного раствора можно определить, излучение
23
какого цвета им поглощено. Поскольку анализ основан на оценке интенсивности окраски растворов различных концентраций данного вещества, метод получил название колориметрии.
Объектами спектрофотометрического изучения могут быть растворы различных соединений, как органических, так и неорганических. Однако значения поглощений неорганических акваионов обычно малы, поэтому в практике спектрофотометрии необходимо осуществлять химические реакции образования соединений, растворы которых обладают значительно большими поглощающими свойствами – чаще всего это реакции комплексообразования. В общем виде реакцию комплексообразования какого-либо катиона с органическим реагентом, являющимся одноосновной кислотой, можно представить уравнением
Men+ + mHR ↔ MeR(mn−m)+ + mH+
Отсюда следует, что для правильной оценки содержания данного катиона в растворе по величине поглощения комплекса
MeR(mn−m)+ необходимо как можно более полно сдвинуть реакцию в
сторону образования комплекса. Полнота этого смещения равновесия зависит от ряда факторов: константы нестойкости комплекса, избытка реагента, кислотности раствора. Влияние этих факторов предварительно изучают перед использованием данной реакции для количественного определения. Любое спектрофотометрическое определение состоит из двух этапов: проведение в испытуемом растворе необходимых химических реакций в целях получения систем, удобных для фотометрирования, и измерение поглощения приготовленного раствора.
Законы поглощения электромагнитного излучения. В осно-
ве спектрофотометрического метода лежит объединенный закон Бугера – Ламберта – Бера:
A |
= lg |
I0 |
= −lgT = k |
λ |
Cl. |
(1.20) |
|
||||||
λ |
|
Il |
|
|
||
|
|
|
|
|
||
Здесь величины A и T являются основными характеристиками соответственно поглощения и пропускания среды с определенной концентрацией поглощающего вещества при определенной длине волны λ и толщине l поглощающего слоя. В этих величинах
24
градуируют шкалы фотометрических приборов, и, следовательно, их можно измерить. Зависимость показателя A от С при k = const линейная, а показателя T от С – экспоненциальная. Теоретически показатель A изменяется от нуля до бесконечности, а T – от нуля до единицы. Но с достаточной точностью величину A можно измерить лишь в очень узком интервале ее значений: от 0,1 до 1,0. Измеряя поглощение данной системой монохроматических излучений различныхдлинволн, можнополучитьспектрпоглощенияотдлиныволны.
Коэффициент k называют коэффициентом поглощения; он определяет электронное строение поглощающего соединения. Абсолютное значение коэффициента k зависит от способа выражения концентрации веществ в растворе и толщины поглощающего слоя. Если концентрация выражена в молях на литр, а толщина слоя – в сантиметрах, то коэффициент поглощения называется молярным коэффициентом погашения ε: он численно равен оптической плотности раствора с концентрацией 1 М, помещенного в кювету с толщиной слоя 1 см. Его единица измерения – квадратный сантиметр на моль (А – безразмерная величина).
Молярный коэффициент погашения является основной характеристикой поглощения данной системы при данной длине волны. Поскольку поглощение при различных длинах волн различно, коэффициент ε будет меняться с изменением длины волны. Зависимость коэффициентов оптической плотности А и пропускания Т от длины волны λ будет определяться зависимостью коэффициента ε от нее. Абсолютное значение молярного коэффициента погашения
можно вычислить: |
|
ελ = Aλ /Сl. |
(1.21) |
Этот расчет дает средний молярный коэффициент погашения. Поскольку интервал оптических плотностей, которые могут быть измерены с достаточной точностью, весьма мал (0,1< А < 1), выбор интервала концентраций исследуемых растворов и толщины слоя кюветы, в которой находится измеряемый раствор, имеет существенное значение. Из уравнения (1.21) видно, что чем больше величины ε и l, тем меньшие концентрации могут быть использованы для измерения оптической плотности, соответствующей нижней границе этого интервала.
Бесконечное увеличение толщины l на практике невозможно, поэтому понижение предела обнаружения достигается главным образом за счет выбора таких соединений, для которых значения ε
25
достаточно велики. Кроме того, стараются проводить измерения в максимуме поглощения. Обычно значения ε для соединений, используемых в спектрофотометрии, имеют порядок 102…105. Оптические плотности растворов с высокими концентрациями определяемых компонентов могут иметь значения много больше 1,0. Тогда для определения концентраций используют дифференциальный спектрофотометрический метод.
В спектрофотометрии большое значение имеет также закон аддитивности, согласно которому если между различными веществами, находящимися в растворе, отсутствуют взаимодействия и законы поглощения строго выполняются, то оптическая плотность раствора равна сумме оптических плотностей отдельных компонентов в растворе. Соблюдение этого закона является обязательным условием спектрофотометрического анализа многокомпонентных систем.
Методы измерения величин, характеризующихпоглощение излучения и расчета концентрации веществ в растворах.
Оценка абсолютных значений тока I0 и I связана с большими экспериментальными трудностями. Поэтому при измерениях оптических плотностей растворов проводят относительную оценку интенсивности потока излучения, проходящего через испытуемый раствор, и интенсивности потока излучения, проходящего через раствор, поглощение которого условно принимают равным нулю (раствор сравнения, или нулевой раствор). Для определения оптической плотности раствора с неизвестной концентрацией (анализируемого раствора) ее сравнивают с оптической плотностью раствора известной концентрации – эталонного раствора. В процессе измерения как анализируемый, так и эталонные растворы являются испытуемыми. При работе с приборами, позволяющими непосредственно измерять величину А, для расчета концентрации вещества применяют следующие методы.
1. Графический метод. Он основан на построении градуировочного графика в координатах А – С. Для этого при определенной длине волны измеряют оптические плотности серии эталонных растворов, а также анализируемого раствора. Затем по градуировочному графику определяют концентрацию вещества Сх. Обычно градуировочный график представляет собой прямую линию, идущую из начала координат. Следует, однако, иметь в виду, что соблюдение закона Бера не является обязательным условием успешного выполнения количественного определения. Если в некоторых
26
условиях установлена нелинейная зависимость показателя А от концентрации С, то она может служить градуировочным графиком. По этой кривой концентрация определяемого компонента может быть найдена, но для построения кривой необходимо большее число эталонных растворов. Однако при линейной зависимости точность определения наиболее высока.
2. Если заранее известно, что растворы подчиняются закону Бера, то достаточно приготовить два раствора: эталонный с концентрацией Сэ и анализируемый с концентрацией Сх. Для каждого из этих растворов справедливы выражения
Аэ = ε Сэ l, Ах = ε Сх l. |
(1.22) |
Так как значения ε и l для этих растворов одинаковы, то
Аэ |
= |
Cэ |
, откуда C |
x |
= |
Аx Cэ |
. |
(1.23) |
|
А |
|
|
|||||||
|
C |
x |
|
|
А |
|
|||
x |
|
|
|
|
|
э |
|
||
3. Если заранее известно значение показателя ελ, определенное в
совершенно идентичных условиях (степень монохроматичности, длина волны и т. п.), то зная толщину кюветы, можно рассчитать концентрациюпоформулеобъединенногозаконапоглощения:
Cx = |
Аλ |
. |
(1.24) |
|
|||
|
ελl |
|
|
Выбор оптимальных условий проведения фотометрических определений. Как было указано, определяемый компонент часто переводят в соединение, обладающее значительным поглощением. Обычно компонент связывают в комплексное соединение, хотя могут быть использованы реакции окисления-восстановления, азосочетания и другие. Условия проведения этих реакций должны быть предварительно тщательно изучены для обеспечения воспроизводимости и надежности результатов спектрофотометрического анализа. Кроме того, применению достаточно полно разработанной методики измерений с использованием какого-либо прибора должны предшествовать определенные предварительные исследования.
1. Для выбора длины волны λmax, соответствующей наибольшей чувствительности данной реакции, необходимо иметь спек-
27
тральную характеристику (спектр поглощения) изучаемого раствора. При работе на фотоэлектроколориметрах типа ФЭК- Н-57, ФЭК-56, ФЭК-60 спектральную характеристику можно получить измерением поглощения испытуемого раствора последовательно с помощью светофильтров и построением зависимости измеренных величин А от величины λmax пропускания каждого светофильтра.
2.На основании результатов измерений, полученных для длины волны λmax, можно рассчитать ε.
3.Далее следует приготовить ряд эталонных растворов с различной концентрацией элемента, измерить их оптическую плот-
ность при длине волны λmax и построить зависимость в координатах А – С. Линейная зависимость А = f (С) указывает на подчинение растворов закону Бугера – Ламберта – Бера.
4.Если растворы не подчиняются объединенному закону поглощения, то проверяют раздельно соблюдение законов Бугера– Ламберта и Бера: вначале для раствора одной и той же концентрации в кюветах различной толщины l измеряют показаель А и строят график зависимости А от нее. Получение линейной зависимости говорит о соблюдении закона Бугера – Ламберта. Далее строят график в координатах А–С; затем, сохраняя постоянной толщину кюветы, измеряют показатель А для серии растворов с различными концентрациями и находят интервал, в котором зависимость показателя А от конценрации линейная.
5.Следует найти пределы определения минимальных и максимальных концентраций данного вещества. Надежно это можно сделать лишь на основе методов математической статистики. Необходимо выбрать оптимальный размер кювет из набора, прилагаемого к каждому прибору. Поскольку, согласно соотношению (1.21), оптическая плотность зависит от толщины слоя, выбор кювет должен быть сделан с таким расчетом, чтобы значения оптических плотностей для серии эталонных растворов укладывались в интервал 0,1 – 1,0, которому соответствует наименьшая ошибка измерения. На практике поступают следующим образом: наполняют кювету средней толщины (2 или 3 см) раствором с концентрацией, соответствующей середине эталонного ряда, и используют его для выбора оптимальной длины волны (или оптимального светофильтра). Если оптическая плотность, полученная при этом для области максимального поглощения исследуемой системы, соответствует примерно середине оптимального интервала (0,4 – 0,5), то, значит, кювета выбрана удачно; если выходит за границы этого интервала
28
или близка к ним, то нужно взять кювету большей или меньшей толщины.
В последние годы в аналитической химии появился и получил широкое распространение новый метод анализа – атомноионизационный (АИ). Этот метод основан на селективной лазерной ионизации, а объектом исследований являются атомы. Поскольку спектральные ширины линий генерации лазеров могут быть очень узкими, можно подобрать условия, когда будут возбуждаться атомы одного элемента, оставляя атомы другого элемента невозбужденными. Чувствительность этого нового метода настолько высока, что позволяет обнаруживать элементы на уровне единичных атомов, различая отдельные изотопы. Аналитическая лазерная АИ-спектроскопия является новым перспективным методом, который все больше привлекает внимание хи- миков-аналитиков своими основными достоинствами – высокой чувствительностью и селективностью.
Контрольные вопросы
1.Какой процесс лежит в основе эмиссионного спектрального анализа:
а) энергетический переход внутренних электронов в молекуле; б) энергетический переход внешних электронов в молекуле; в) переход внешних электронов в атоме с возбужденного уров-
ни на более низкий; г) переход внешних электронов в атоме с основного уровня на
возбужденный?
2.Что характеризуют квантовые числа n, l, mi, ms?
3.Назовите основные правила отбора.
4.Назовите основные узлы спектральных приборов и укажите их назначение.
5.Элементы какой группы возбуждаются и дают эмиссионный спектр в пламени горючей смеси «пропан – бутан – воздух»:
а) щелочные металлы;
б) редкоземельные элементы (La, Се и др.); в) редкие металлы (Мо, W, V и др.)?
6.Что понимают под разрешающей способностью спектрального прибора?
7.Какой диапазон спектра различает глаз человека?
8.Приведите уравнение, связывающее коэффициент пропускания Т и оптическую плотность А.
29
