
- •В в е д е н и е
- •1 Методика расчета теплофизических характеристик индивидуальных газов
- •1.1 Термодинамические параметры состояния газа
- •1.2 Погрешность определения теплофизических характеристик индивидуальных газов и область пользования результатами расчета
- •1.3 Интерполяция табличных значений теплофизических характеристик
- •2 Методика расчета теплофизических характеристик газовых смесей
- •2.1 Основные свойства газовых смесей
- •2.2 Расчет физических параметров газовой смеси
- •2.7 Расчет удельных теплоемкостей газовой смеси
- •3.2. Методика расчета теплофизических характеристик продуктов сгорания топлив во влажном воздухе при 1
- •3.3 Методика расчета теплофизических характеристик влажного воздуха
- •3.4 Область пользования результатами расчета теплофизических характеристик газовых смесей, продуктов сгорания и влажного воздуха по данным [17]
- •Заключение
- •При различных температурах [23, с. 444 - 446]
- •1 Пример расчета теплофизических характеристик газовой смеси при выполнении курсового проекта по теме
- •Перепада давления”
- •1.3 Вычисляются объемные доли компонентов газовой смеси по формуле:
- •2 Пример расчета теплофизических характеристик газовой смеси при выполнении курсового проекта по теме
- •Термоэлектрическими датчиками”
- •3 Пример расчета теплофизических характеристик газовой смеси при выполнении курсового проекта по теме
- •Манометрическим методом”
- •Оглавление
1.3 Интерполяция табличных значений теплофизических характеристик
В справочнике [17] теплофизические характеристики индивидуальных газов приведены в виде таблиц. Однако иногда могут потребоваться значения теплофизических характеристик при значениях температуры и давления, отличных от табличных. В этом случае применяются дополнительные вычисления, например, линейная интерполяция.
Расчетная формула линейной двумерной (по температуре и давлению) интерполяции таблиц справочника [17] имеет вид:
![]() (2)
(2)
где
![]() - значение искомой теплофизической
характеристики газа при заданной
- значение искомой теплофизической
характеристики газа при заданной
температуре
![]() и давлении
и давлении![]() ;
;
![]() -
ближайшее
меньшее табличное значение давления;
-
ближайшее
меньшее табличное значение давления;
![]() - ближайшее большее
табличное значение давления.
- ближайшее большее
табличное значение давления.
Здесь
![]()
![]()
где
![]() - ближайшее меньшее табличное значение
температуры;
- ближайшее меньшее табличное значение
температуры;
![]() - ближайшее большее
табличное значение температуры;
- ближайшее большее
табличное значение температуры;
![]() - значение
теплофизической характеристики при
температуре
- значение
теплофизической характеристики при
температуре
![]()
и давлении
![]() ;
;
![]() - значение
теплофизической характеристики при
температуре
- значение
теплофизической характеристики при
температуре
![]()
и
давлении
![]() ;
;
![]() - значение
теплофизической характеристики при
температуре
- значение
теплофизической характеристики при
температуре
![]()
и давлении
![]() ;
;
![]() -
значение теплофизической характеристики
при температуре
-
значение теплофизической характеристики
при температуре
![]()
и давлении
![]() .
.
Для большего удобства вычислений можно расположить исходные данные следующим образом
![]()
![]()
![]()
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]()
![]()
Пример.
Определить теплопроводность
![]() азота при температуре
азота при температуре
![]() =
635
=
635
![]() и давлении
и давлении
![]() =
2,7
=
2,7![]() .
.
Решение. Из справочника [17, с. 99] находим значения коэффициента теплопроводности азота при близлежащих значениях температуры и давления и присвоим им следующие обозначения:
![]() = 600
= 600
![]() ;
;![]() =
=![]() = 44,7
= 44,7![]() ;
;
![]() = 700
= 700![]() ;
;![]() =
=![]() = 44,9
= 44,9![]() ;
;
![]() = 2
= 2
![]() ;
;![]() =
=![]() = 50,5
= 50,5![]() ;
;
![]() = 3
= 3
![]() ;
;![]() =
=![]() =
50,7
=
50,7![]() .
.
После подстановки в интерполяционную формулу (2) получаем
![]() = 46,87
= 46,87
![]() .
.
Другие расчетные формулы интерполяции приводятся в математических справочниках в разделах приближенных вычислений.
2 Методика расчета теплофизических характеристик газовых смесей
2.1 Основные свойства газовых смесей
В практике гораздо чаще приходится встречаться не с чистыми газами, а с их смесями. Как известно, газовыми смесями называются механические смеси индивидуальных газов при условии отсутствия в них химических реакций. Если температура и давление одинаковы во всем объеме газа, то считается, что газовая смесь находится в равновесном состоянии. Смесь, состоящая из газов без веществ в конденсированном (жидком или твердом) состоянии, называется гомогенной.
Необходимыми исходными данными для расчета теплофизических свойств гомогенной смеси являются равновесное состояние, сведения о теплофизических свойствах индивидуальных газов и об объемном, массовом или молярном составах смеси.
Поведение реальных газовых смесей строго не подчиняются уравнению состояния идеальных газов. Поэтому для расчета ряда теплофизических параметром реальных газовых смесей широко используются эмпирические формулы. Некоторые же теплофизические характеристики могут успешно определяться по уравнениям, составленным для идеальных газовых смесей, подчиняющихся уравнению Клапейрона, законам Авогадро, Дальтона, Амага.
Для проведения расчетов по газовым смесям необходимо установить следующие основные параметры, характеризующие их состояние:
![]() - число индивидуальных
газов в смеси;
- число индивидуальных
газов в смеси;
![]() -
1, 2, … ,
-
1, 2, … ,
![]() - номер индивидуального газа (компонента);
- номер индивидуального газа (компонента);
![]() - термодинамическая
температура смеси в
- термодинамическая
температура смеси в
![]() ;
;
![]() - абсолютное
давление смеси в
- абсолютное
давление смеси в
![]() ;
;
![]() - парциальное
давление
- парциальное
давление
![]() –го
компонента в смеси в
–го
компонента в смеси в![]() ;
;
![]() - масса газовой
смеси в
- масса газовой
смеси в
![]() ;
;
![]() - масса
- масса
![]() –го
компонента смеси в
–го
компонента смеси в![]() ;
;
![]() -
объем газовой смеси в
-
объем газовой смеси в
![]() ;
;
![]() - приведенный объем
- приведенный объем
![]() –го компонента смеси в
–го компонента смеси в![]() ;
;
![]() - количество молей
всех газов в смеси в
- количество молей
всех газов в смеси в
![]() ;
;
![]() - количество молей
- количество молей
![]() –го
компонента смеси в
–го
компонента смеси в![]() .
.
По закону Дальтона давление смеси идеальных газов равно сумме парциальных давлений индивидуальных газов:
![]()
т. е. каждый газ в смеси находится под своим парциальным давлением.
По закону Амага сумма приведенных объемов равна объему смеси:
![]()
Состав смеси может
быть задан массовыми
![]() ,
объемными
,
объемными![]() или молярными
или молярными![]() долями компонентов.
долями компонентов.
Массовая доля
![]() –го
компонента газовой смеси представляет
собой отношение массы
–го
компонента газовой смеси представляет
собой отношение массы![]()
![]() –го компонента к массе
–го компонента к массе![]() всей смеси:
всей смеси:
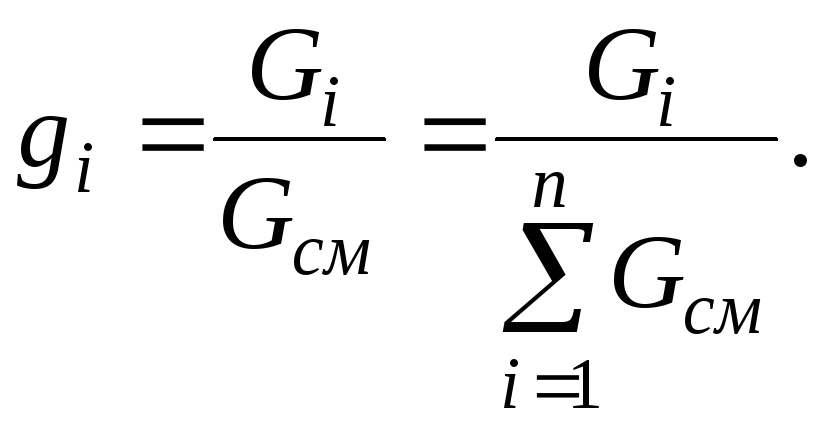
Сумма массовых долей компонентов смеси равна единице:
![]() (3)
(3)
Объемная доля
![]() –го
компонента газовой смеси определяется
отношением приведенного объема
–го
компонента газовой смеси определяется
отношением приведенного объема![]()
![]() –го
компонента к объему
–го
компонента к объему![]() ,
занимаемому всей смесью:
,
занимаемому всей смесью:
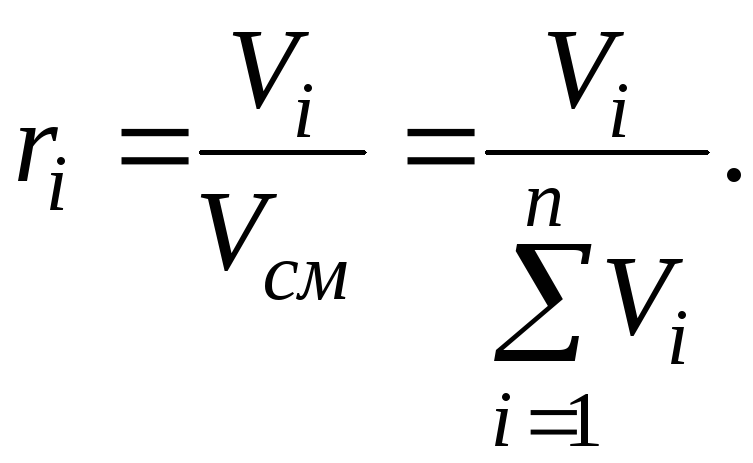
Сумма объемных долей компонентов смеси равна единице:
![]() (4)
(4)
Молярная доля
![]() –го
компонента газовой смеси определяется
отношением количества молей
–го
компонента газовой смеси определяется
отношением количества молей![]()
![]() –го газа к общему количеству молей
–го газа к общему количеству молей![]() всех газов смеси:
всех газов смеси:
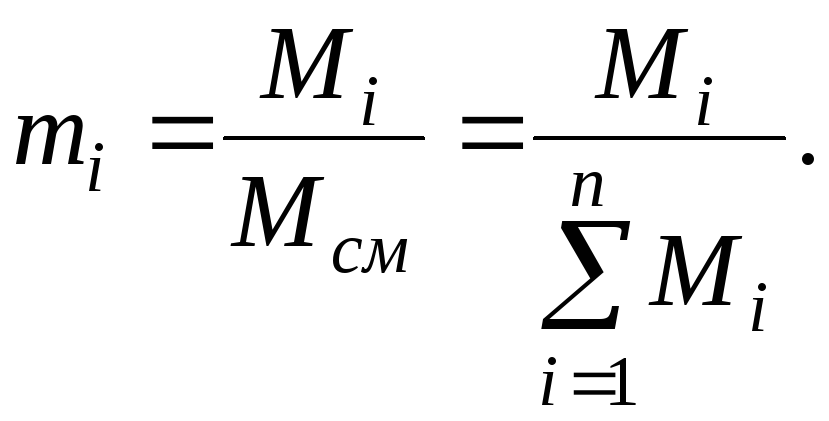
Сумма молярных долей компонентов смеси равна единице т.е.
![]()
Количество молей i –го компонента в газовой смеси определяется следующим соотношением
![]()
![]() ,
,
где
![]() - молярная масса
- молярная масса![]() –го компонента в
–го компонента в![]() .
.
Из закона Авогадро следует, что
![]() (5)
(5)
т. е. молярные и объемные доли численно равны и состав смеси можно задавать также через парциальные давления компонентов.
Между массовыми и объемными (молярными) долями существуют следующие соотношения:
![]()
![]()
где
![]() - газовая постоянная смеси в
- газовая постоянная смеси в![]() ;
;
![]() - газовая постоянная
- газовая постоянная
![]() -го
компонента в
-го
компонента в![]() .
.
Часто на практике массовые, объемные (молярные) доли компонентов выражаются не в долях единицы, а в процентах.
