
atom
.pdfМинистерство образования Российской Федерации
Алтайский государственный технический университет им. И.И.Ползунова
Н.С.Дозорцева, И.Н.Охтеменко
СТРОЕНИЕ АТОМА И ХИМИЧЕСКАЯ СВЯЗЬ
Индивидуальное задание по общей химии для студентов 1 курса нехимических специальностей
Барнаул 2003
УДК 541.6 (076)
Дозорцева Н.C., Охтеменко И.Н. Строение атома и химическая связь: Индивидуальное задание по общей химии для студентов 1 курса нехимических специальностей/ Алт.гос.техн.ун–т им. И.И.Ползунова.– Барнаул: Изд-во АлтГТУ, 2003.– 27с.
Методические указания содержат 60 вариантов заданий для контроля знаний студентов и детальный разбор примеров по данному разделу курса общей химии. Методические указания могут быть использованы студентами нехимических специальностей для самостоятельной подготовки и текущего контроля знаний.
Рассмотрено и одобрено на заседании кфедры Общей Химии.
Протокол №5 от 06.06.2003.
Рецензент Ластовкина Н.П., к.х.н., доцент каф. ОХ им. И.И.Ползунова.
2
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Вопрос 1.
В таблице 1 представлены изотопы элементов ZЭА, где Z – порядковый номер элемента в периодической системе Д.И.Менделеева, А – массовое число.
Таблица 1
Вариант |
ZЭА |
Вариант |
ZЭА |
Вариант |
ZЭА |
1 |
22Ti47 |
11 |
29Cu63 |
21 |
41Nb93 |
3 |
23V50 |
13 |
30Zn65 |
23 |
40Zr91 |
5 |
24Cr52 |
15 |
31Ga70 |
25 |
42Mo96 |
7 |
25Mn54 |
17 |
32Ge72 |
27 |
55Cs133 |
9 |
26Fe56 |
19 |
34Se78 |
29 |
27Сo59 |
|
В таблице 2 |
представлены: валентный слой элемента и массо- |
||||
вое число его изотопа (А). |
|
|
Таблица 2 |
|||
|
|
|
|
|
|
|
|
Вариант |
|
|
Вариант |
|
Вариант |
2 |
А=85;...5s1 |
|
12 |
А=115;... 5s25р1 |
22 |
А=87;...5s2 |
4 |
А=89;...4d15s2 |
|
14 |
А=122;...5s25р3 |
24 |
А=128;... 5s25p4 |
6 |
А=118;...5s25p2 |
|
16 |
А=127;...5s25р5 |
26 |
А=136;...6s2 |
8 |
А=99;...4d55s2 |
|
18 |
А=80;...4s24p5 |
28 |
А=139;...5d16s2 |
10 |
А=112;...4d105s2 |
|
20 |
А=75;...4s24p3 |
30 |
А=45;...3d14s2 |
Для представленных изотопов различных элементов:
1)указать состав ядра атома,
2)написать полную электронную формулу,
3)электроны валентного слоя распределить по квантовым ячейкам в нормальном и возбужденном состояниях (если возбуждение возможно),
4)определить электронное семейство.
Вопрос 2.
В таблице 3 для каждого варианта задания представлены пары элементов. Согласно положению этих элементов в периодической системе Д.И.Менделеева:
3
1)определить и сравнить их свойства (металлические или неметаллические);
2)написать формулы высших оксидов и соответствующих им гидроксидов и сравнить их кислотные или основные свойства.
|
|
|
Таблица 3 |
Вариант |
Элементы |
Вариант |
Элементы |
1 |
3Li и 37Rb |
16 |
11Na и 16S |
2 |
4Be и 38Sr |
17 |
12Mg и 15P |
3 |
5B и 7N |
18 |
13Al и 17Cl |
4 |
6C и 50Sn |
19 |
14Si и 32Ge |
5 |
7N и 15P |
20 |
15P и 51Sb |
6 |
34Se и 42Mo |
21 |
16S и 52Te |
7 |
4Be и 7N |
22 |
17Cl и 53J |
8 |
19K и 55Cs |
23 |
29Cu и 33As |
9 |
20Сa и 30Zn |
24 |
30Zn и 34Se |
10 |
21Sc и 31Ga |
25 |
37Rb и 47Ag |
11 |
22Ti и 32Ge |
26 |
38Sr и 56Ba |
12 |
23V и 33As |
27 |
39K и 49In |
13 |
20Сa и24Cr |
28 |
43Tc и 35J |
14 |
25Mn и 35Br |
29 |
56Ba и 80Hg |
15 |
22Ti и 26Fe |
30 |
48Cd и 52Te |
Вопрос 3.
Для ряда химических соединений, представленных для каждого варианта в таблице 4, определить:
1)тип химической связи,
2)степень окисления и валентность элементов в соединениях.
3)Для соединения, выделенного жирным шрифтом :
а) показать механизм образования химической связи, б) установить “чистая” или гибридная связь и соответственно
тип гибридизации, в) определить угол связи и геометрию молекул,
г) число σ- и π-связей.
д) показать перекрывание электронных облаков при образовании молекулы указанного соединения,
е) указать полярна ли связь и молекула в целом.
4
|
|
|
Таблица 4 |
Вар. |
Соединения |
Вар. |
Соединения |
1 |
LiF; Cl2; MnCl2 |
16 |
CsCl; TiCl2; PbO2 |
2 |
H2; LiCl; SnCl4 |
17 |
CsJ; CrCl2; [NH4]+ |
3 |
SnCl2; O2; LiBr |
18 |
F2O; Li2S; InF3 |
4 |
LiJ; F2; ZnCl2 |
19 |
Na2S; CCl4; CO2 |
5 |
Ag2S; Br2; CdCl2 |
20 |
NO; VF2; CH4 |
6 |
HF; NaBr; BF3 |
21 |
GeCl2; K2S; [SiF6]2– |
7 |
J2; NaCl; AlCl3 |
22 |
GeF4; SO2; AgCl |
8 |
HJ; KCl; ScBr2 |
23 |
PtCl2; CaCl2; SeO3 |
9 |
KF; GaCl3;HBr |
24 |
PtCl2; P2O3; SrF2 |
10 |
PH3; KBr; [BF4]– |
25 |
SnO; InJ3; MgBr2 |
11 |
RbF; AsH3; SiO2 |
26 |
TlJ3; MoO3; GeO |
12 |
KJ; H2S; (HF)2 |
27 |
BiCl3; SnO2; [HgJ4]2– |
13 |
H2Se; RbCl; (H2O)n |
28 |
[AgCl2]–; FeBr2; H2Te |
14 |
RbJ; AsCl3; GeO |
29 |
CoBr2; Br2; FeS |
15 |
N2; CsF; SbCl3 |
30 |
SO3; NiCl2; SrCl2 |
ПРИМЕРЫ ОТВЕТОВ НА ВОПРОСЫ.
Вопрос 1. (см. стр. 3)
Дано: Изотоп 43Tc99. Ядра атомов состоят из протонов 1р1 и нейтронов 0n1. Число протонов в ядре равно заряду ядра атома Z (в то же время Z – порядковый номер элемента в периодической системе), для технеция Z=43. Массовое число изотопа А складывается из числа протонов Z и нейтронов N. Для изотопа 43Tc99 А=99, а число нейтронов
N=A–Z=99–43=56 . Следовательно, состав ядра изотопа 43Tc99
(431р1+560n1).
В электронной формуле элемента указывается состав его электронных оболочек от первой до последней (внешней). Порядок запол-
нения электронами энергетических подуровней согласно правилам Клечковского имеет вид: 1s2> 2s2> 2p6> 3s2> 3p6> 4s2> 3d10> 4p6> 5s2> 4d10> 5p6> 6s2> 5d1> 4f2–14> 5d2–10> 6p6> 7s2> 6d1> 5f2–14> 6d2-7 (всего 108
электронов).
5

У атома Tc 43 электрона заполняют электронные орбитали в порядке: 1s22s22p63s23p64s23d104p65s24d5. Элемент относится к элек-
тронному семейству d-элементов, т.к. последний электрон атома Тс идет на d-подуровнь.
Электронная формула:
Tc – 1s22s22p63s23p63d104s24p6 4d55s2. Валентный слой Tc имеет вид 4d55s2.
Распределение злектронов валентного слоя по квантовым ячейкам:
↑↓
↑ ↑ ↑ ↑ ↑ 5s2
4d5
В возбужденном состоянии:
Tc* – 1s22s22p63s23p63d104s24p6 4d55s15р1.
↑
↑5p1
↑ ↑ ↑ ↑ ↑ 5s1
4d5
2) Дано: А=207, ...6s26p2. Исходя из состава валентного слоя элемента, определим его положение в периодической системе: 6-й период, чет-
вертая группа, главная подгруппа. Это элемент №82 – Pb.
Состав ядра изотопа 82Pb207: (821р1 + 1250n1).
Электронная формула:
83 Pb 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2.
Распределение злектронов валентного слоя по квантовым ячейкам:
Pb – ...6s26p2 нормальное состояние
↑↑
↑↓ 6p2
6s2
Pb*– ...6s16p3 возбужденное состояние.
↑ ↑ ↑
↑ 6p3 6s1
6
Свинец относится к электронному семейству р-элементов
т.к. последний 82-й электрон атома заполняет 6р-подуровень.
Вопрос 2. (см. стр. 3 )
1) Дано: 37Rb и 53J.
Это элементы одного пятого периода, следовательно, имеют одинаковое число (пять) электронных слоев.
37Rb – ...5s1 металл (s-элемент)
53J – ... 5s25р5 неметалл (р-элемент).
Каждый период начинается с s-элемента (металла-восстановителя), затем металлические свойства ослабевают до амфотерных и далее после амфотерного элемента усиливаются неметаллические свойства элементов. Поэтому металлические свойства у рубидия выражены сильнее, чем у йода.
Высшие оксиды (высшая степень окисления элемента равна числу валентных электронов): Rb2O и J2O7.
Rb2O – основный оксид, ему соответствует гидроксид RbOН. J2O7 – кислотный оксид, ему соответствует гидроксид – ки-
слота НJO4.
2) Дано: 13Al и 31Ga.
Оба элемента находятся в III группе, главной подгруппе, следовательно, имеют одинаковое число (три) валентных электронов на внешнем слое.
13Al — ...3s23p1 (р-элемент); 31Ga — ...4s24p1 (р-элемент).
Оба элемента амфотерны, обладают слабыми металлическими и неметаллическими свойствами. В группах металлические свойства элементов сверху вниз увеличиваются, а неметаллические свойства ослабевают. У алюминия внешний электронный слой третий, а у галлия – четвертый, поэтому атому алюминия труднее отдавать свои валентные электроны, чем атому галлия. Следовательно, у Al металлические свойства выражены слабее, чем у Ga, так как Rат(Al)< Rат(Ga).
Оксиды-гидроксиды
Al2O3 — Al(OH)3; HAlO2 – амфотерны Ga 2O3 — Ga(OH)3; HGaO2 – амфотерны.
У Al2O3 — Al(OH)3 основные свойства выражены слабее, а кислот-
ные ярче, чем у Ga 2O3 — Ga(OH)3.
7
Вопрос 3: (см. стр. 4 )
Дан ряд соединений: S2, Rb2S, PbJ2,.
Тип связи следует определять, исходя из значений относительных электроотрицательностей элементов (см. приложение 1). Опре-делив ∆Э.О. (разность электоотрицательностей), можно сделать следующие выводы:
∆Э.О.=0 — связь ковалентная неполярная, так как общая электронная пара не смещена ни к одному ядру взаимодействующих атомов;
∆Э.О.>0 — связь ковалентная полярная, так как общая электронная пара смещена в сторону ядра атома с большей электроотрицательностью.
∆Э.О. >>0 — связь считается ионной. Это крайний случай ковалентной полярной связи, она образуется между атомами элементов с противоположными свойствами, металлом (I гр.) и типичным неме-
таллом (VI, VII гр.).
1) S2. Исходя из значений ∆Э.О. (разности относительных электроотрицательностей), связь S=S ковалентная неполярная, так как общие электронные паря не смещены ни к одному из двух атомов серы.
|
3s23p4; |
|
|
↑↓ |
↑ |
↑ |
|
S – |
В=2. |
↑↓ |
|
|
|||
S – |
3s23p4; |
В=2. |
|
|
→ S=S |
||
|
↑↓ |
↓ |
↓ |
|
|||
|
|
|
↑↓ |
|
|
|
|
Валентность – это способность атомов образовывать химические связи. Количественно валентность равна числу связей, которые атом образует в данном соединении.
В молекуле S2 связь двойная. т.е. каждый атом серы проявляет валентность В(S)=2. В двойной связи (в нашем случае S=S) одна связь
– σ, вторая – π. В образовании связей участвуют “чистые” р2- электроны двух атомов серы.
8
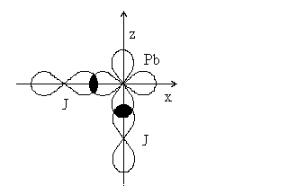
2) Rb2S. Связь между атомами Rb (типичным металлом) и S (типичным неметаллом) является ионной. В молекуле Rb—S—Rb валентность рубидия В(Rb)=1, а валентность серы В(S)=2.
Ионная связь образуется по схеме:
2Rb(5s1) – 2е → 2Rb+(5s0) S(3s23p4) + 2е → S2–(3s23p6)
2Rb+ + S2– → Rb2S
Ионы Rb+ и S2– притягиваются друг к другу за счет сил кулоновского взаимодействия.
3) PbJ2. Связь Pb–J ковалентная полярная ∆Э.О.=2.21- 1.55=0.66; общая электронная пара смещена к ядру атома более электроотрицательного элемента – J.
Pb – 6s26p2; В=2. |
|
|
J – 5s25p5; В=1. |
|||||||||||
|
|
↑ |
|
↑ |
|
|
|
|
|
↑↓ |
↑↓ |
↑ |
|
|
↑↓ |
|
|
|
6p2 |
|
|
|
|
↑↓ |
|
5p5 |
|
|
|
6s2 |
|
|
|
|
|
|
|
|
|
5s2 |
|
|
|
|
|
|
|
В образовании связей у Pb участвуют p2-электроны и p- |
|||||||||||
электроны двух атомов J (связь чистая): |
|
|
|
|||||||||||
|
|
|
|
|
↑ |
↑ |
|
|
|
|
|
|
|
|
Pb |
|
↑↓ |
↓ |
|
↓ |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
J |
|
J |
|
|
|
|
|
|
|
9

Молекула угловая (валентный угол 90°), обе связи σ. Молекула полярна, так как µPbJ2 = µPbJ + µPbJ ≠ 0.
Вопрос 4: (см. варианты на стр.12) По методу валентных связей определить пространственную конфигурацию молекулы PbJ4. Полярна ли молекула в целом? Сколько σ- и π-связей в данной молекуле?
PbJ4 – ковалентная полярная связь. Центральный атом – Pb, образует молекулу в возбужденном состоянии, т.к. возбужденное состояние соответствует валентности свинца, равной четырем.
Pb* – 6s16p3; В=4. |
|
J – 5s25p5; В=1. |
||||||
|
↑ |
↑ |
↑ |
|
|
↑↓ |
↑↓ |
↑ |
↑ |
|
6p3 |
|
|
↑↓ |
|
5p5 |
|
6s1 |
|
|
|
|
5s2 |
|
|
|
В образовании четырех связей Pb–J участвуют четыре гибридных облака атома свинца (тип гибридизации sp3, угол сязи 109°, геометрия молекулы – тетраэдр) и “чистые” р-электроны четырех атомов
J. Все четыре связи – σ-связи, µ PbJ4= 0, молекула неполярна.
10
