
Popov_KSE_1
.pdf
зывающая их между собой. Это и называется ионной химической
связью.
Одно из свойств ионных соединений – способность образовывать кристаллическую решетку, в узлах которой расположены положительные и отрицательные ионы. Типичный представитель вещества с ионной связью – всем известная поваренная соль. Ее формула – NaCl (рисунок 8.3).
Большинство ионных соединений легко разрушаются под внешним воздействием или в химических реакциях. На рисунке 8.4 представлена схема поведения кристаллической решетки NaCl под действием деформирующей силы. На рисунке 8.5 изображен процесс растворения соли в воде.
Рисунок 8.3 – Модель кристаллической решетки хлорида натрия NaCl
Рисунок 8.4 – Схема поведения кристаллической решетки NaCl под действием деформирующей силы
121
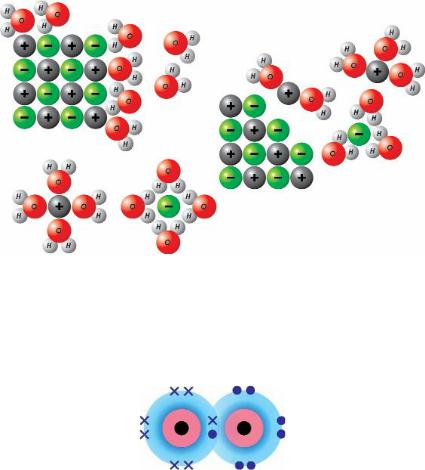
Рисунок 8.5 – Иллюстрация процесса растворения соли в воде
В молекуле хлора Cl2 мы встречаемся с так называемой ковалентной связью между атомами. В такой связи каждый из двух атомов делится с другим одним из своих внешних электронов. При этом оба приобретают восьмой электрон в свою внешнюю оболочку и обретают устойчивую конфигурацию (рисунок 8.6).
Рисунок 8.6 – Схема ковалентной связи
Электроны, образующие общую пару, называются валентными. Для того чтобы орбитали перекрывались, расстояние между ато-
мами должно быть очень маленьким. Этому препятствуют силы отталкивания между их ядрами. Но ковалентная связь достаточно сильна, чтобы удержать атомы в таком положении. Благодаря этому нелегко оторвать атомы с общей орбиталью друг от друга. Таким образом, ковалентная связь является самой сильной химической связью. Именно большая энергия ковалентной связи объясняет феноменальную прочность алмаза, в котором каждый атом углерода ковалентно связан с четырьмя другими (рисунок 8.7).
122

Рисунок 8.7 – Структура алмаза
Металлы – очень распространенный материал современной промышленности. Большая часть машин, станков, инструментов и транспортных средств изготовлена из металла. Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Электроны в металлах делокализованы, то есть не принадлежат какому-либо конкретному атому. Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь (рисунок 8.8).
Рисунок 8.8 – Кристаллическая решетка металла. Показана траектория одного из свободно движущихся электронов
123

Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов (рисунок 8.9). Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в «электронном море» по всему образцу с большой скоростью. Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Рисунок 8.9 – Действие деформирующей силы на кристаллическую решетку металла
Кроме рассмотренных типов химической связи говорят также о сравнительно слабых силах Ван-дер-Ваальса.
Некоторые молекулы (преимущественно с ковалентными связями) обладают так называемым дипольным моментом. Его суть в том, что в одной части молекулы «скапливается» больше электронов, чем в другой. Это приводит к возникновению разности потенциалов на ее концах. Сила притяжения между различными зарядами связывает молекулы между собой, как показано на рисунке 8.10.
Рисунок 8.10 – Схема диполь-дипольного притяжения
124

В настоящий момент термин «Ван-дер-Ваальсовы силы» распространяется на все слабые межмолекулярные силы, кроме водородной связи. Несмотря на то, что водородная связь, возникающая вследствие силы притяжения между атомом водорода и электроотрицательным атомом, представляет собой предельный случай дипольдипольного притяжения, ее, как правило, не относят к силам Ван-дер- Ваальса.
Именно водородные связи объясняют многие уникальные свойства воды и льда (рисунок 8.11).
Рисунок 8.11 – Схема водородной связи в кристалле льда
8.3 Реакционная способность веществ
Почему из атомов углерода иногда образуется рыхлое аморфное вещество – сажа, иногда мало прочный кристалл – графит и очень редко чемпион твердости и красоты – алмаз. Причина – условия протекания реакций синтеза веществ. Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. Поскольку образование связей происходит с выделением, а разрыв связей – с поглощением энергии, то химические реакции сопровождаются выделением и поглощением энергии в виде теплоты. Реакции, идущие с выделением теплоты, называются экзотермическими. Для протекания эндотермических реакций требуется подвод энергии извне.
Важно отметить, что в реакцию вступают не все молекулы (частицы), а только активные, т. е. обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сде-
125
лать активными, если сообщить им необходимую дополнительную энергию (этот процесс называется активацией).
Один из способов активации – увеличение температуры. При повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции (реакционная спо-
собность). Под скоростью химической реакции понимают измене-
ние концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализаторов, а также от некоторых других факторов, например, от давления (для газовых реакций), от измельчения (для твердых тел), от радиоактивного облучения.
Чтобы осуществилось химическое взаимодействие веществ, их молекулы должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала был сформулирован основной закон химической кинетики: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Часто этот закон называют законом действующих масс. Зависимость скорости реакции от температуры определяется
правилом Вант-Гоффа: при повышении температуры на каждые 10º скорость большинства реакций увеличивается в 2 − 4 раза.
Однако стоит помнить, что правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Увеличить реакционную способность веществ можно и с помощью катализаторов. Применять катализаторы выгоднее, чем повышать температуру, тем более, что ее повышение далеко не всегда возможно. Катализаторы – это вещества ускоряющие скорость химических реакций. Вещества, понижающие скорость протекания реакции, называ-
ются ингибиторами.
Факт. Могучее посредничество катализаторов впервые открыл в 1812 г. наш соотечественник К. С. Кирхгоф (1764 − 1833 гг.). Он впервые с помощью катализатора серной кислоты превратил крахмал в сахар.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катали-
126
затором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза).
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. Обычно катализатор – твердое вещество, а реагирующие вещества – газы или жидкости. Примерами могут служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля (твердая фаза).
Автокатализ – это ускорение реакции, обусловленное накоплением промежуточного или конечного продукта, обладающего каталитическим действием в данной реакции, т. е. из-за образующегося в реакции катализатора.
Особую роль играют биологические катализаторы – ферменты. При их участии протекают сложные химические процессы в растительных и животных организмах.
Большинство химических реакций являются реакциями обратимого типа. Обратимыми называются такие реакции, которые протекают в двух взаимно противоположных направлениях. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества,
называются необратимыми.
Примером необратимой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO3 = 2KCl + 3O2 .
Реакция прекратиться тогда, когда весь хлорат калия превратится
вхлорид калия и кислород.
Вуравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить реакция горения:
С+ О2 СО2 .
Впромышленности обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. При химическом равновесии наступает такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой. Например, в
127
реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ – и давление. При изменении одного из этих параметров равновесие нарушается, концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже с иными значениями равновесных концентраций. Подобный переход системы из одного состояния равновесия в другое называется смеще-
нием (или сдвигом) химического равновесия. Если при изменении усло-
вий увеличивается концентрация конечных продуктов, то говорят о смещении равновесия в сторону продуктов реакции. Если же концентрация исходных веществ увеличивается, то равновесие смещается в сторону их образования.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры, давления определяется общим положением, известным под названием принципа Ле Шателье: если на систему, находящуюся в равновесии, произво-
дится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Поясним это на примере реакции синтеза аммиака:
3/2 H2 + 1/2N2 NH3
2 объема 1 объем
Если внешнее воздействие выражается в увеличении концентрации азота или водорода, то оно благоприятствует реакции, вызывающей уменьшение концентрации этих веществ, и следовательно, равновесие сместится в сторону образования аммиака. Соответственно, увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
Поскольку прямая реакция протекает с выделением теплоты, то повышение температуры смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесие сместится в сторону исходных веществ. Понижение температуры вызовет смещение равновесия в сторону продукта реакции.
Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в левой и правой частях урав-
128
нения. В левой части уравнения содержится две молекулы, в правой – одна. Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению числа молекул, то в данном случае равновесие стремится в сторону продукта реакции. Очевидно, уменьшение давления сместит равновесие в сторону исходных веществ.
Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например, N2 + O2 2NO, то изменение давления не вызывает смещения химического равновесия.
Следует заметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
Способы смещения равновесия в желаемом направлении, основанные на принципе Ле Шателье, играют огромную роль в промышленной химии. Синтез аммиака и многие другие промышленные процессы были освоены благодаря применению способов смещения равновесия в направлении, обеспечивающем высокий выход получаемого вещества.
129
Глоссарий к лекции
Атом – наименьшая частица химического элемента, которая еще является носителем его свойств.
Автокатализ – ускорение реакции, обусловленное накоплением промежуточного или конечного продукта, обладающего каталитическим действием в данной реакции, т. е. из-за образующегося в реакции катализатора.
Изотопы – разновидности атомов одного химического элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами, т. е. различаясь числом нейтронов.
Катализаторы – вещества, ускоряющие (в противоположность ингибиторам) скорость химических реакций.
Молекула – наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию.
Мономер – вещество, молекулы которого способны реагировать между собой или с молекулами других веществ с образованием полимера.
Полимеры – вещества, молекулы которых (макромолекулы) состоят из большого числа повторяющихся звеньев.
Ферменты – (иначе энзимы, биокатализаторы) сложные органические вещества белковой природы, содержащиеся в животных и растительных организмах и в миллионы раз ускоряющие химические процессы в них.
Химическая связь – совокупность сил и типов взаимодействий, которые обусловливают существование молекул, кристаллов, молекулярных ионов и радикалов.
Химический элемент – это определенный вид атомов с одинаковым положительным зарядом ядра.
130
