
- •Кафедра химической технологии неметаллических
- •Оглавление
- •1. Формулировка задания
- •1.1. Исследование 1
- •1.2. Исследование 2
- •2. Исходные данные
- •3. Пример решения задания
- •Исследование 1
- •3.1.1. Расчет изменения изобарной теплоемкости () и теплового эффекта реакции ()
- •3.1.3. Расчёт изменения стандартной энергии Гиббса
- •3.1.4. Вывод уравнения зависимости константы равновесия от температуры
- •3.2. Исследование 2
- •3.2.1. Определение числа фаз, независимых компонентов и степеней свободы
- •3.2.2. Определение возможного направления реакции
- •Определение равновесного состава газовой смеси
- •3.2.4. Другие случаи расчета равновесного состава газовой смеси
- •2.2.5. Установление направления смещения равновесия
- •Библиографический список
3.1.3. Расчёт изменения стандартной энергии Гиббса
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса-Гельмгольца:
![]() .
(13)
.
(13)
Найденные по уравнению (13) величины изменения стандартной энергии Гиббса приведены в табл. 5, по данным которой построена зависимость
![]() = f(Т), изображенная
на рис. 4.
= f(Т), изображенная
на рис. 4.
Таблица 5.
Значения изменения стандартной энергии Гиббса (GT) при различных температурах
![]()
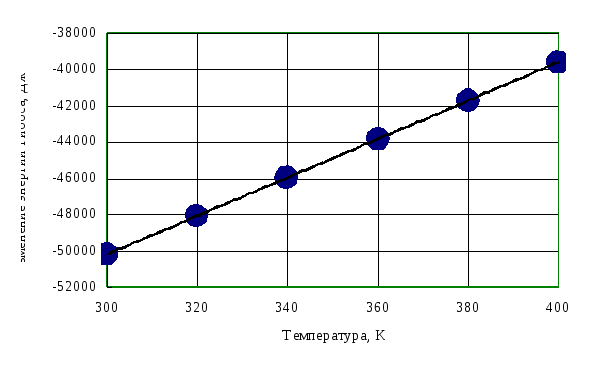
Рис. 4. Зависимость изменения стандартной энергии Гиббса от температуры
В выбранном интервале температур GT имеет отрицательные значения. Это значит, что при стандартных состояниях веществ (активности всех веществ равны единице) возможное протекание процесса слева – направо.
3.1.4. Вывод уравнения зависимости константы равновесия от температуры
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
![]() (14)
(14)
После подстановки выражения (13) в уравнение (14) получим:
![]() .
(15)
.
(15)
Можно
полагать, что в сравнительно небольшом
интервале температур для исследуемой
в данном примере реакции тепловой
эффект реакции (![]() )
и изменение энтропии (
)
и изменение энтропии (![]() )
практически постоянные величины (это
подтверждают и расчеты, приведенные в
табл. 4 и 5). Отсюда уравнение (15) можно
записать в виде:
)
практически постоянные величины (это
подтверждают и расчеты, приведенные в
табл. 4 и 5). Отсюда уравнение (15) можно
записать в виде:
lnKp = (A/T) + B, (16)
где А и В – постоянные, которые соответственно равны:
A = -
![]() /R,
(17)
/R,
(17)
B =
![]() /R
. (18)
/R
. (18)
Уравнение (16) отвечает линейной зависимости lnКp = f(1/T).
В табл.1 (колонка 8) предлагается определить эту зависимость для температурного интервала 300…400 К.
Для построения зависимости lnКp = f(1/T) определим lnKp из уравнения (14) и сведем полученные данные в табл.6. Например, для температуры 320 К расчет будет произведен по следующему уравнению:
![]() lnKp,320
=
lnKp,320
=
![]() /(R•320)
= 45673/(8,31•320)
= 17,18.
/(R•320)
= 45673/(8,31•320)
= 17,18.
Таблица 6
Величины констант равновесия при различных температурах

Для графического определения констант A и B в уравнении (16) по данным табл.6 строим зависимость lnKз = f(1/Т), приведенной на рис.5.
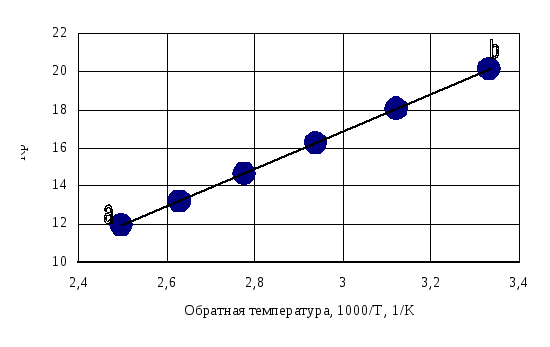
Рис. 5. Зависимость lnKp от обратной температуры для реакции:
FeS + 2HCl = FeCl2 + H2S
График на рис.5 представляет собой прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А в уравнении (16). Для нахождения величины тангенса возьмём на прямой, как это показано на рис. 5, произвольно две точки “а” и ”b” и определим численные значения их ординат и абсцисс. Можно записать:
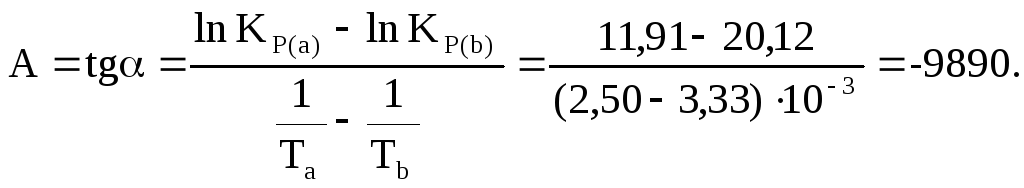
Для определения численного значения В поступим следующим образом. Из табл. 6 возьмём значение lnКp при 1000/T=2,6 (lnKp = 11,5), подставим его вместе с численным коэффициента А, найденным ранее, в уравнение (16), которое предварительно выразим через В.
B = lnKp – A·1/T = 11,91 - (9890·0,0025) = -12,815.
Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид:
lnKp = 9890/T -12,815. (19)
Последнее уравнение позволяет рассчитать значение Кp при любой температуре, если последняя находится в заданном интервале (т.е. 300…400 К).
По значением
коэффициента А и В рассчитаем величину
среднего теплового эффекта реакции
-![]() и
изменения энтропии -
и
изменения энтропии -![]() .
Согласно уравнениям (17 –18)
имеем:
.
Согласно уравнениям (17 –18)
имеем:
![]() = -A•R = -9890•8,31 = -
82186 (Дж);
= -A•R = -9890•8,31 = -
82186 (Дж);
![]() =
B•R = -12,815•8,31 = -106,5 (Дж/К)
=
B•R = -12,815•8,31 = -106,5 (Дж/К)
Полученные данные неплохо согласуются с данными, приведенными в табл. 3 и 4, что указывает на правильность расчетов.
