
- •8.5.2 Соединения ароматического ряда
- •8.5.2.1 Моноароматические соединения
- •1. Дегидроциклизация и дегидрогенизация парафинов:
- •2. Дегидрогенизация циклоалканов:
- •1.2 Алкилирование:
- •8.5.2.2 Полициклические арены с изолированными кольцами
- •2. Реакция Вюрца:
- •3. Димеризация бензола в присутствии солей Pd:
- •1.2 Реакция с амидом натрия:
- •1.3 Взаимодействие с щелочными металлами:
- •8.5.2.3 Полициклические арены с конденсиро-ванными кольцами
- •2. Циклизация ацетилена и бензола:
- •3. Дегидроциклизация алканов:
- •1.4 Окисление:
- •1.5 Гидрирование:
- •9. Реакционные центры и основные механизмы реакций углеводородов
- •1. Генерирование электрофильной частицы
- •3. Стабилизация карбкатиона
- •9.1 Особенности протекания некоторых реакций
- •2. Региоселективность реакций присоединения к несимметричным алкенам и алкинам реагентов типа н–х
- •Современная электронная интерпретация правила Марковникова.
- •4. Стереоспецифичность реакции гидроксилирования алкенов (реакция Вагнера)
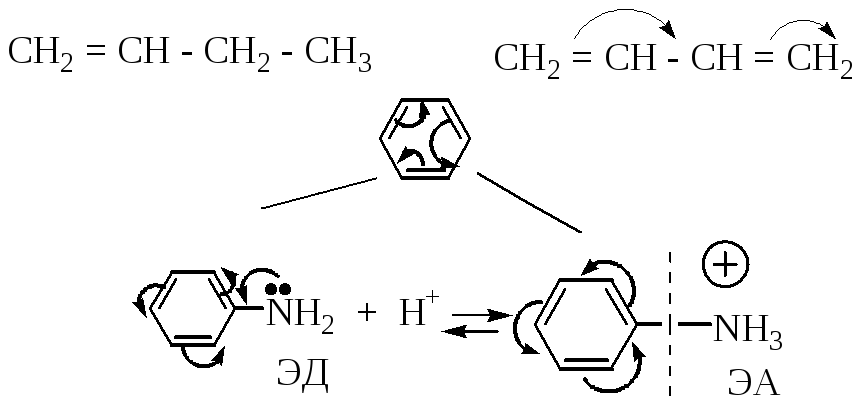
- •5. Химические особенности сопряженных диенов
- •6. Влияние заместителей на реакционную способность и ориентацию в реакциях электрофильного замещения в бензольном кольце
- •Резонансные структуры карбкатиона (3)
- •Примеры
- •9.2 Оптическая спектроскопия
- •Уф – спектр ик – спектр
- •3. Ионизация
- •4. Природа растворителя
- •Примеры
- •Конспект лекций гомофункциональные углеводороды
- •Галогенопроизводные углеводородов
- •1.1 Галогенпроизводные алифатического ряда
- •1. Реакции замещения.
- •3.2.1 Реакции магнийорганических соединений
- •3.2.1.1 Взаимодействие с соединениями, имеющими подвижный атом водорода:
- •1.1. Получение алифатических аминов
- •6. Специальные методы
- •3. Взаимодействие аминов с азотистой кислотой
- •6.1.1 Реакция окисления первичных аминов:
- •6.1.2 Реакция окисления первичного ариламина гидропероксидом трифторацетила:
- •6.2 Реакция окисления вторичных аминов:
- •6.3.2 Ацилирование третичных аминов:
- •7. Реакции с электрофильными реагентами ароматических аминов
- •8. Реакции конденсации
- •8.3 Реакции конденсации третичных аминов:
- •2. Реакции ароматических солей диазония без выделения азота
- •3. Реакции диазоалканов
- •1. Желтого типа:
- •2. Сине-зеленого типа:
- •3. Фуксиново-красного типа:
3. Ионизация
По кислотному типу – батохромный сдвиг с гиперхромным эффектом за счет увеличения электронной плотности.
По основному типу – гипсохромный сдвиг с гипохромным эффектом за счет связывания электронов пиррольного атома и выключения его из сопряжения.
4. Природа растворителя


5. Комплексообразование органических лигандов с ионами металлов. Это влияние проявляется особенно сильно в том случае, если донорно-акцепторная связь комплекса образуется за счет неподеленной пары электронов лиганда, входящих в его сопряженную систему.
Примеры
-
Соединение
λmax
ε
Бутен
Бутадиен-1,3
Бензол
Анилин
Анилиний-катион
Фенол
Фенолят-ион
< 200
217
255
280
254
270
289
230
1430
160
1450
2600



Теория цветности – теория, объясняющая связь цвета вещества и света, поглощаемого веществом.
Таблица 29 – Видимая область электромагнитного излучения
|
Длина волны λ поглощаемого света нм |
Поглощенный спектральный цвет |
Дополнительный цвет |
Тип смещения | |
|
400 – 435 435 – 480 480 – 490 490 – 500 500 – 560 560 – 580 580 – 595 595 – 605 605 – 760 |
фиолетовый синий сине-зеленый зелено-синий зеленый желто-зеленый желтый оранжевый красный |
желто-зеленый желтый оранжевый красный пурпурный фиолетовый синий сине-зеленый зелено-синий |
|
|
Цвет вещества – это результат избирательного поглощения веществом части лучей видимого спектра. Вещество окрашено в проходящем или отраженном свете в цвет, дополнительный к тому, который веществом поглощается.
Например, вещество, поглощающее красные лучи, воспринимается зрительным аппаратом человека зеленым; поглощение желтых лучей дает ощущение синего цвета. Если вещество не способно поглощать лучи видимой части электромагнитного спектра, оно кажется нам бесцветным, т.к. отражаются все лучи, в сумме дающие ощущение белого цвета. Если поглощаются веществом все лучи, вещество кажется черным. Серым вещество воспринимается, если часть лучей поглощается, другая часть – отражается.
Современная электронная интерпретация цветности. Окрашенное вещество – хромоген, хромофором которого является длинная сопряженная система рz-орбиталей с делокализованными р, π-электронами, на концах которой имеются сильные электронодонорные и электроноакцепторные заместители, между которыми распределен ионный заряд (ВПЗ – внутримолекулярный перенос заряда). ЭД и ЭА заместители, которые в классической теории называли ауксохромами, являются частью общего хромофора, обуславливающего окраску соединения. Т. о., понятие об ауксохроме, в свете современных представлений, кажется искусственным. Эти группы, как самостоятельные, выполняют роль кислот или оснований, за счет которых возможно образование растворимых в воде солей, фиксирующихся на ткани, это дает возможность применения некоторых из них в качестве красителей.
Хромофорные свойства азинов, диазинов и триазинов сильно возрастают в результате действия ЭД заместителей или конденсации с бензольными ядрами. Вследствие этого хинолин, акридин и феназин имеют хромофоры, которые лежат в основе целых классов красителей.
|
|
|
|
|
хинолин (λ1= 308 нм,ε1 = 3850) |
акридин (λ1= 351 нм,ε1 = 104) |
феназин (λ1= 362 нм,ε1 = 13200) |
Большую группу хромофоров представляют линейно-циклические системы, в которых недостаточно сильные циклические хромофоры подключаются к концам сопряженной полиеновой цепи. Например, цианиновый краситель из остатков циклического хромофора бензотиазола и линейной цепи метиленовых групп:

В состав линейно-цепного π-хромофора включаютсяπ-электроны полиметиновой цепи и сопряженные через атомы серы, имеющие вакантные 3d-орбитали, бензольные кольца. Атомы азота можно рассматривать как ауксохромы, поляризующие хромофор.
Благодаря наличию кислотных или основных заместителей в составе хромофорной группы красители склонны к галохромии и используются как кислотно-основные индикаторы.
Галохромия (от лат. galos – соль, chromo – цвет) – изменение окраски химического соединения при ионизации. Ионизация, в результате которой усиливаются донорные свойства электронодонорных заместителей или акцепторные свойства электроноацепторных заместителей, приводит к батохромному сдвигу с гиперхромным эффектом.
Пример
Метиловый оранжевый (гелиантин). Получают азосочетанием N,N-диметиланилина (азосоставляющая компонента) с диазотированной сульфаниловой кислотой (диазосоставляющая компонента).

HIndкрасный, λmax= 522 нм ΔрН 4,0-3,1
ПРОГРАММА БЛОКА «ГОМОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ»
Галогенопроизводные углеводородов. Классификация, номенклатура. Изомерия. Способы получения галогеналканов. Прямое галогенирование. Реакции присоединения. Реакции замещения. Галогенметилирование аренов. Физические свойства и строение. Первичные, вторичные и третичные галогеналканы. Электронное строение галогеналканов, индуктивный эффект, дипольные моменты, энергия, полярность и поляризуемость связей С–На1. Химические свойства. Взаимодействие с металлами: натрием, цинком, магнием. Получение реактива Гриньяра, его использование для синтеза. Замещение атома галогена водородом. Нуклеофильное замещение, механизм реакций, движущая сила. Конкурирующие реакции, механизм реакций. Влияние различных факторов на направление реакции (замещение или отщепление). Биологическое действие галогенпроизводных, их применение в народном хозяйстве.
Амины. Классификация, номенклатура и изомерия. Способы получения аминов. Реакции алкилирования, гидролиза. Реакции восстановления. Получение аминов из карбонильных соединений, специфические методы. Физические свойства аминов и их строение. Основность аминов. Химические свойства аминов. Образование солей, реакции ацилирования и алкилирования, взаимодействие с азотистой кислотой, получение изоцианидов, окисление аминов. Реакции с электрофильными реагентами для ароматических аминов, реакции конденсации, изомеризации, гидрирования, получение диазосоединений. Важнейшие представители аминов и их применение.
Оксипроизводные углеводородов. Классификация оксипроизводных углеводородов. Алканолы. Номенклатура. Изомерия. Первичные, вторичные и третичные спирты. Способы получения. Гидролиз, гидратация (механизм, катализаторы). Восстановление. Синтез спиртов при помощи реактивов Гриньяра и окислением металлорганических соединений. Оксосинтез. Физические свойства спиртов. Причина повышения температуры кипения спиртов по сравнению с галогеналканами. Растворимость в воде. Электронное строение, полярность связей C–О и О–Н. Химические свойства спиртов. Реакции с сохранением атома кислорода. Кислотно-основные свойства спиртов. Кислотность. Образование алкоголятов, их свойства. Окисление спиртов. Химическое и каталитическое окисление. Действие окислителей на первичные, вторичные и третичные спирты. Основность и взаимодействие с электрофильными реагентами, образование оксониевых соединений. Нуклеофильное замещение гидроксильной группы. Сравнение реакционной способности первичных, вторичных и третичных спиртов. Алканолы как алкилирующие реагенты аренов. Перегруппировки при реакциях спиртов с кислотами. Промышленные способы получения, свойства и применение метилового и этилового спирта.
Диолы. Изомерия и номенклатура. Получение гликоля и его свойства. Образование гликолятов, окисление, специфические окислители, образование простых, циклических и сложных эфиров. Пинаконы. Получение. Действие сильных кислот на пинаконы, окисление.
Триолы и полиолы. Номенклатура. Глицерин. Получение омылением жиров; из пропилена и ацетилена; из аллилхлорида и аллилового спирта. Кислотно-основные свойства. Образование комплексных соединений с тяжелыми металлами. Реакция с неорганическими и органическими кислотами. Окисление глицерина, превращение в акролеин. Применение многоатомных спиртов.
Фенолы и ароматические спирты. Фенолы. Определение, номенклатура. Способы получения: из природных источников; изопропилбензола; получение реакциями нуклеофильного замещения углеродного цикла; из арендиазониевых солей; прямым гидроксилированием. Окислительное декарбоксилирование карбоновых кислот. Действие на первичные ароматические амины азотистой кислоты. Физические свойства и строение фенола. Электронное строение фенола с учетом индуктивного и мезомерного эффектов. Предельные структуры, мезоформула, дипольные моменты, сравнение длин связей С–ОН этилового спирта и фенола. Влияние заместителей на кислотные свойства кольца. Химические свойства фенолов. Реакции гидроксильной группы. Реакции с электрофильными реагентами в ядре фенола. Получение гидроксиметилфенола и фенолформальдегидной смолы. Гидрирование. Химические средства защиты растений и животных. Пестициды.
Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
Тиолы. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
Общие закономерности строения и химического поведения оксосоединений. Особенности строения и химического поведения оксосоединений. Строение карбонильной группы. Общая схема реакций оксосоединений с участием карбонильной группы, енольной формы и енолят ионов. Реакции нуклеофильного присоединения: механизм и катализ, образование тетраэдричного продукта, его строение в зависимости от строения реагентов и условий реакции. Сравнение реакционной способности оксосоединений.
Оксосоединения. Функциональные карбонильные группы. Классификация карбонильных соединений. Гомологические ряды альдегидов и кетонов. Номенклатура и изомерия. Методы получения. Реакции окисления; гидролиза; гидратации; пиролиза; перегруппировки. Физические свойства и строение. Электронное строение карбонильной группы, ее влияние на углеводородный радикал. Электронодонорные и электроноакцепторные свойства карбонильных соединений. Химические свойства альдегидов и кетонов. Реакции нуклеофильного присоединения. Окислительно-восстановительные реакции. Качественные реакции альдегидов и кетонов. Полимеризация альдегидов. Реакции с участием α-водородного атома. Реакции конденсации. Важнейшие представители. Технические способы получения формальдегида, уксусного альдегида, ацетона. Особые свойства муравьиного альдегида. Применение муравьиного, уксусного альдегида и ацетона.
Монокарбоновые кислоты. Классификация монокарбоновых кислот. Гомологический ряд, номенклатура, изомерия. Методы синтеза. Реакции окисления. Реакции гидролиза. Металлорганический синтез. Реакции карбонилирования. Синтез кислот с увеличением углеродного скелета. Физические свойства и строение карбоновых кислот. Структура и температура кипения, межмолекулярные водородные связи. Электронное строение карбоксильной группы: –I эффект и +М эффект, предельные структуры, мезоформула. Электронное строение карбоксилатаниона, предельные структуры, мезоформула, взаимное влияние гидроксильной и карбоксильной группы. Химические свойства. Кислотные свойства. Сравнение кислотных свойств минеральных кислот, органических кислот, воды и спиртов. Влияние строения радикала и заместителей в цепи на кислотные свойства карбоновых кислот. Реакции карбоновых кислот с нуклеофильными реагентами. Реакции с электрофильными реагентами. Реакции у α-водородного атома. Реакции, приводящие к распаду карбоксильной группы. Дегидратация карбоновых кислот. Отдельные представители. Муравьиная кислота, ее получение, особые свойства, использование. Уксусная кислота, получение, свойства. Пальмитиновая, стеариновая, высшие жирные синтетические кислоты.
Производные карбоновых кислот. Хлорангидриды. Получение. Влияние галогена на реакционную способность карбонильной группы. Хлорангидриды как ацилирующие реагенты. Использование хлорангидридов для получения пероксидов ацилов. Реакции с алкоголятом натрия и ацетатом серебра.
Ангидриды кислот. Получение. Использование ангидридов как ацилирующих средств.
Амиды карбоновых кислот. Электронное строение амидов, влияние сопряжения на основные свойства, строение сопряженной группы. Сравнение основных свойств аминов и амидов. Способы получения амидов. Химические свойства. Гидролиз амидов, взаимодействие с азотистой кислотой, ангидридами минеральных кислот, оксидами металлов.
Сложные эфиры карбоновых кислот. Получение. Гидролиз сложных эфиров (кислый и щелочной катализ). Реакции переэтерификации и аммонолиза. Сложные эфиры в природе, их значение в промышленности.
Дикарбоновые кислоты. Классификация, изомерия, номенклатура дикарбоновых кислот. Методы получения. Окисление, гидролиз, карбонилирование. Химические и физические свойства. Кислотность, ионизация. Реакции получения солей, сложных эфиров, амидов и ангидридов. Отдельные представители. Щавелевая кислота. Соли (оксолаты). Разложение при нагревании с серной кислотой. Отношение к окислителям. Малоновая кислота и малоновый эфир. Подвижность α-водородного атома. Натриймалоновый эфир: получение, строение. Использование малонового эфира для синтеза. Янтарная и адипиновая кислоты, их практическое значение и свойства.
Непредельные карбоновые кислоты. Этилендикарбоновые кислоты. Калассификация, изомерия, номенклатура. Способы получения. Отношение к нагреванию. Химические свойства. Промышленное использование. Стеклопласты. Непредельные дикарбрновые кислоты. Номенклатура. Способы получения. Практическое значение и свойства. Непредельные кислоты жирного ряда. Номенклатура, изомерия. Реакции присоединения к непредельным кислотам через стадию 1,4-присоединенния. Полимеризация эфиров акриловой и метакриловой кислот. Непредельные высшие карбоновые кислоты.
Жиры. Строение жиров. Высшие жирные предельные и непредельные кислоты, входящие с состав жиров. Гидролиз жиров, гидрогенизация. Мыла, получение из жиров. Синтетические моющие средства.



