
атом
.docxМолекула (новолат. molecula, уменьшит. от лат. moles-масса), микрочастица, образованная из двух или большего числа атомов и способная к самостоятельному существованию. Имеет постоянный состав (качественный и количественный) входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать одну молекулу от других, в том числе от молекул того же состава. Молекула, как система, состоящая из взаимодействующих электронов и ядер, может находиться в различных состояниях и переходить из одного состояния в другое вынужденно (под влиянием внешних воздействий) или самопроизвольно. Для всех молекул данного вида характерна некоторая совокупность состояний, которая может служить для идентификации молекул. Как самостоятельное образование молекула обладает в каждом состоянии определенным набором физических свойств, эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества. При химических превращениях молекула одного вещества обмениваются атомами с молекулами другого вещества, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции других типов. Поэтому химия изучает вещества и их превращения в неразрывной связи со строением и состоянием молекул
Обычно молекулой называют электрически нейтральную частицу; если молекула несет электрический заряд (положительный или отрицательный), то говорят о молекулярных ионах (катионах или анионах соответственно). В веществе положительные ионы всегда сосуществуют вместе с отрицательными. Молекулы, находящиеся в состояниях с мультиплетностью, отличной от единицы (как правило, в дублетных состояниях), называют радикалами. Свободные радикалы в обычных условиях, как правило, не могут существовать длительное время. Известны, однако, свободные радикалы сравнительно сложного строения, которые являются достаточно стабильными и могут существовать при обычных условиях.
По числу входящих в молекулу атомных ядер различают молекулы двухатомные, трехатомные и т.д. Если число атомовв молекуле превосходит сотни и тысячи, молекула называется макромолекулой. Сумма масс всех атомов, входящих в состав молекулы, рассматривается как молекулярная масса (смотри также Молекулярная масса полимера. Молекулярно-массовое распределение). По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные.
А́том (от др.-греч. ἄτομος — неделимый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Представление об атомах как неделимых мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых была доказана реальность существования атомов.
Общая характеристика строения атома. Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженныхэлектронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами _ядра атома (линейные размеры атома ~ 10~8см, его ядра ~ 10" -10" 13 см). Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значит. степени условны и зависят от способов их определения (см. Атомные радиусы). Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами (см. Ядро атомное). Положит. заряд протона и отрицат. заряд электрона одинаковы по абс. величине и равны е= 1,60*10-19 Кл; нейтрон не обладает элек-трич. зарядом. Заряд ядра +Ze - осн. характеристика атома, обусловливающая его принадлежность к определенному хим. элементу. Порядковый номер элемента в периодич. системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном атоме число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соотв. в положит. или отрицат. ион, напр. Li+, Li2+ или О-, О2-. Говоря об атомах определенного элемента, подразумевают как нейтральные атомы, так и ионы этого элемента.
Строение атома и свойства веществ. Хим. св-ва определяются строением внеш. электронных оболочек атомов, в к-рых электроны связаны сравнительно слабо (энергии связи от неск. эВ до неск. десятков эВ). Строение внеш. оболочек атомов хим. элементов одной группы (или подгруппы) периодич. системы аналогично, что и обусловливает сходство хим. св-в этих элементов.(1) При увеличении числа электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается; наиб. энергией связи обладают электроны в замкнутой оболочке. Поэтому атомы с одним или неск. электронами в частично заполненной внеш. оболочке отдают их в хим. р-циях. Атомы, к-рым не хватает одного или неск. электронов для образования замкнутой внеш. оболочки, обычно принимают их. Атомы благородных газов, обладающие замкнутыми внеш. оболочками, при обычных условиях не вступают в хим. р-ции.
Строение внутр. оболочек атомов, электроны которых связаны гораздо прочнее (энергия связи 102-104 эВ), проявляется лишь при взаимод. атомов с быстрыми частицами и фотонами высоких энергий. Такие взаимод. определяют характер рентгеновских спектров и рассеяние частиц (электронов,нейтронов) на атомах (см. Дифракционные методы). Масса атома определяет такие его физ. св-ва, как импульс, кинетич. энергия. От механических и связанных с ними магн. и электрич. моментов ядра атома зависят нек-рые тонкие физ. эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий, см Спектроскопия).
1сноска: Электро́нво́льт (редко электроновольт; русское обозначение: эВ, международное: eV) — внесистемная единица энергии, используемая в атомной и ядерной физике, в физике элементарных частиц и в близких и родственных областях науки (биофизике, физической химии, астрофизике и т. п.). В Российской Федерации электронвольт допущен к использованию в качестве внесистемной единицы без ограничения срока с областью применения.
Ядерная модель атома
В начале 20 века в результате изучения катодных лучей были обнаружены отрицательные частицы – электроны с зарядом 1,6.10‾19 Кл, массой 9,11.10‾31 кг, открыто рентгеновское электромагнитное излучение. Обобщив эти открытия, Дж.Томсон в 1897 году предложил свою модель атома – это положительно заряженная сфера, в которую вкраплены отрицательные электроны (подобно изюму в пудинге). Если эта модель верна, тогда металлическая фольга – это пленка положительного электричества, содержащая электроны и поток α- частиц должен легко проникать через нее, не меняя направление.
В 1909 г. сотрудники англ. ученого Э. Резерфорда это проверили. 1 из 100000 α - частиц при прохождении через золотую фольгу рассеивались на большие углы и даже поворачивали обратно. Анализируя результаты эксперимента, Резерфорд сделал вывод, что масса и заряд атома сконцентрированы в малой части объема, называемой ядром. Отклоняются те α - частицы, которые сталкиваются с ядрами. Большинство же α - частиц проходит через пространство между ядрами. Модель строения атома, предложенная Э. Резерфордом, напоминала солнечную систему. Ее называют планетарной моделью. Согласно ей, в центре атома находится положительное ядро, в котором сосредоточена вся масса атома. Вокруг ядра по круговым орбитам движутся электроны. Заряд ядра и число электронов одинаковы, т.е. атом нейтральная частица.
В 1913г. английский физик Мозли измерил длины волн рентгеновских лучей, испускаемых разными металлами в катодной трубке, и построил график зависимости обратного значения квадратного корня из длины волны рентгеновских лучей от порядкового номера элемента. Этот график (рис.1) показывает, что порядковый номер отражает какую-то важную характеристику элемента. Мозли предположил, что этой характеристикой является заряд ядра атома, и что он возрастает на единицу при переходе от одного элемента к следующему за ним по порядку. Он назвал порядковый номер атомным номером - Z.
Закон Мозли:
Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента.
Это закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером.
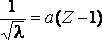 ,
,
где - длина волны, а – постоянная величина, Z– порядковый номер элемента (заряд ядра).
Позже стало известно, что порядковый номер равен числу протонов в ядре. Таким образом, порядковый (атомный) номер равен заряду ядра и он же определяет наличие в нем протонов (положительных частиц). А так как атомы нейтральны, то число электронов в атоме должно быть равно числу протонов. Но массы атомов оказались больше суммарной массы протонов. Для объяснения избытка массы было высказано предположение о существовании нейтронов. Эти частицы должны были иметь ту же массу, что и протон, но нулевой заряд (1,675.10-27 кг). Нейтрон был открыт сотрудником Резерфорда Чедвигом в 1932 г. Было окончательно установлено, что атом состоит из ядра и электронов, а ядро – из протонов и нейтронов. Их сумму называютнуклонным числом или массовым - А.
А = Z + N,
Z- число протонов, N- число нейтронов.
Атомы с различным числом протонов (Z) и нейтронов (N), но с одинаковым числом нуклонов А, называют изобарами. Например,
![]()
Изотопы – атомы с одинаковым числом протонов (Z), но с разным числом нуклонов
![]()
Изотоны – атомы с одинаковым числом нейтронов (N)
![]()
Таким образом, дробные значения атомных масс в периодической системе объясняются наличием изотопов для одного и того же элемента.
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Спектра́льная ли́ния — особенность участка спектра, выражающаяся в локальном повышении (светлые, эмиссионные линии, спектральные максимумы) или понижении (тёмные линии, линии поглощения, спектральные минимумы) уровня сигнала.
Остаточной интенсивностью называют усиление/ослабление излучения в спектральной линии по сравнению с непрерывным спектром.
Функция, характеризующая зависимость остаточной интенсивности от частоты, называется профилем линии.
Рентге́новское излуче́ние — электромагнитные волны, энергия фотонов которых лежит на шкале электромагнитных волн между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн от 10−2 до 102 Å (от 10−12 до 10−8 м).
Фото́н (от др.-греч. φῶς, род. пад. φωτός, «свет») — элементарная частица, квант электромагнитного излучения (в узком смысле —света). Это безмассовая частица, способная существовать в вакууме только двигаясь со скоростью света.
