
- •Газы крови влияют на pH
- •Углекислый газ
- •Кислород
- •Оксигемоглобин
- •Насыщение гемоглобина кислородом
- •Иллюстрация понятий оксигемоглобина (HbO2) и насыщения гемоглобина (HbO2sat) Парциальное давление кислорода (pO2)
- •Кривая диссоциации гемоглобина в норме и при изменении pH и концентрации 2,3-дифосфоглицерата
- •Как удаляются ионы водорода?
- •Источники и пути удаления ионов водорода
- •Быстрая компенсация сдвигов рН Буферные системы
- •Фосфатная буферная система
- •Удаление щелочных эквивалентов фосфатным буфером
- •Бикарбонатная буферная система
- •Белковая буферная система
- •Изменение заряда буферных групп белка при различных рН Гемоглобиновая буферная система
- •Длительная стабилизация сдвигов рН
- •Удаление кислоты через легкие
- •Удаление кислоты через почки
- •Реабсорбция бикарбонат-ионов
- •Реабсорбция бикарбонат-ионов
- •Ацидогенез
- •Реакции ацидогенеза
- •Аммониегенез
- •Реакции аммониегенеза
- •Показатели кислотно-основного состояния
- •Изменение кос - частая ситуация
- •Причины нарушений кислотно-основного состояния
- •Диагностика нарушений кос
- •Использование показателя рСо2 для диагностики нарушений кислотно-основного состояния
Белковая буферная система
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Их вклад в буферизацию плазмы крови около 5%.
В кислой среде подавляется диссоциация СООН‑групп аминокислотных радикалов (в аспарагиновой и глутаминовой кислотах), а группы NH2 (в аргинине и лизине) связывают избыток Н+. При этом белок заряжается положительно.
В щелочной среде усиливается диссоциация COOH‑групп, поступающие в плазму ионы Н+ связывают избыток ОН–‑ионов и pH сохраняется. Белки в данном случае выступают как кислоты и заряжаются отрицательно.
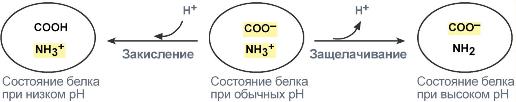
Изменение заряда буферных групп белка при различных рН Гемоглобиновая буферная система
Высокой мощностью в крови обладает гемоглобиновый буфер, на него приходится до 28% всей буферной емкости крови. В качестве кислой части буфера выступает оксигенированный гемоглобин H‑HbO2. Он имеет выраженные кислотные свойства и в 80 раз легче отдает ионы водорода, чем восстановленный Н‑Нb, выступающий как основание. Гемоглобиновый буфер можно рассматривать как часть белкового, но его особенностью является работа в теснейшем контакте с бикарбонатной системой.
Изменение кислотности гемоглобина происходит в тканях и в легких, и вызывается связыванием соответственно H+ или О2. Непосредственный механизм действия буфера заключается в присоединении или отдаче иона H+ остатком гистидина в глобиновой части молекулы (эффект Бора).
В тканях более кислый pH в норме является результатом накопления минеральных (угольной, серной, соляной) и органических кислот (молочной). При компенсации pH данным буфером ионы H+ присоединяются к пришедшему оксигемоглобину (HbО2) и превращают его в H‑HbО2. Это моментально вызывает отдачу оксигемоглобином кислорода (эффект Бора), и он превращается в восстановленный H‑Hb.
НbO2+ Н+ → [H-HbO2] → Н-Hb + O2
В результате снижается количество кислот, в первую очередь Н2СО3, продуцируются ионы НСО3‑ и тканевое пространство подщелачивается.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 → [H-HbO2] → НbO2 + Н+
Работу гемоглобинового буфера рассматривают неотрывно от бикарбонатного буфера:
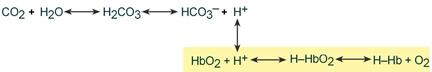
Эффективность гемоглобинового буфера напрямую зависит от активности дыхательной системы (Газообмен в легких и тканях).
Длительная стабилизация сдвигов рН
Медленная компенсация сдвигов величины pH обеспечивается физиологическими системами - регулируемо через легкие и почки, пассивно при участии костной ткани и печени.
Удаление кислоты через легкие
Газообмен в легких заключается в постоянном обмене кислородом и углекислым газом между двумя соприкасающимися компартментами – легочными альвеолами и кровеносными капиллярами. (см также Обмен кислорода и углекислого газа в легких)
Углекислый газ быстро диффундирует из плазмы и эритроцитов в альвеолярное пространство. В то же время в альвеолярном воздухе имеется высокая концентрация кислорода, который, проникая в эритроциты, образует оксигемоглобин – более сильную кислоту, чем угольная. "Кислый" оксигемоглобин отдает ионы Н+ в ассоциацию с ионом HCO3–, образуется H2CO3, которая вступает в карбоангидразную реакцию с появлением СО2, удаляемого в плазму и далее в альвеолы.
Легочная вентиляция обеспечивает удаление CO2 (или, что то же самое H2CO3) и повышение уровня pH. Она эффективна только в тесном контакте с гемоглобиновой и бикарбонатной буферной системами.
Первым фактором для активации дыхательной системы является концентрация ионов Н+, влияющих на периферические (каротидные тельца) и центральные (продолговатый мозг) рецепторы. Закисление крови уже через 1‑2 минуты вызывает стимуляцию дыхательного центра, повышая его активность в 4‑5 раз. И наоборот, снижение кислотности крови понижает активность дыхательного центра в 2‑4 раза.
Вторым фактором регуляции служит концентрация CO2. Чувствительные хеморецепторы для CO2 находятся в продолговатом мозге, в аортальном и каротидных тельцах. В случае хронической гиперкапнии (увеличении CO2) рецепторы дыхательного центра теряют чувствительность к CO2 (десенсибилизация). При этом основным стимулом становится pO2.
Третий регулятор вентиляции – сдвиги концентрации O2. На pO2 реагируют, главным образом, периферические рецепторы каротидного синуса и дуги аорты. Они являются значимыми для легочной вентиляции только при сильном снижении рО2 в артериальной крови (60-70% от нормы).
Необходимо осознать, что компенсация избыточной не бывает. К примеру, если при мышечной работе поступление молочной кислоты и возникновение ацидоза компенсируется гипервентиляцией с удалением угольной кислоты, то при достижении нормального рН дыхательный центр "расслабляется" и снижает интенсивность дыхания. Следовательно, в данных условиях удаление угольной кислоты никогда не превысит поступление молочной, и алкалоз совершенно невозможен.
