
- •Сосудистая стенка обладает двойной функцией
- •Роль эндотелия
- •Соединения, секретируемые интактным эндотелием
- •Соединения, секретируемые поврежденным эндотелием
- •Роль базальной мембраны
- •Тромбоциты - это часть системы свертывания
- •Роль гранул
- •Роль рецепторов
- •Взаимодействие тромбоцитов и сосудистой стенки
- •Адгезия
- •Адгезия тромбоцитов
- •Активация
- •Процессы, происходящие при активации тромбоцита
- •Антагонизм действия простациклинов и тромбоксанов
- •Агрегация
- •Агрегация тромбоцитов Ретракция
- •Плазменные белки коагуляционного гемостаза
- •Факторы свертывания крови
- •Тромбин (фактор II)
- •Функции тромбина в гемостазе
- •Фибриноген (фактор I)
- •Строение фибриногена
- •Фибринстабилизирующий фактор
- •Классическая теория коагуляции
- •Внешний путь свертывания
- •Внешний и внутренний пути свертывания крови Внутренний путь свертывания
- •Каскадно-матричная теория коагуляции
- •1 Стадия – инициация
- •2 Стадия – амплификация
- •Каскадно-матричная теория гемостаза
- •3 Стадия – пропагация
- •Фибрин необходим для формирования стабильного тромба
- •Реакции синтеза нерастворимой фибриновой сети
- •Реакция трансглутаминазы с образованием нерастворимого фибрина
- •Коагуляция тщательно ограничивается
- •Ингибитор пути тканевого фактора
- •Действие ингибитора пути тканевого фактора Протеины c и s
- •Превращение плазминогена в плазмин
- •Регуляция синтеза плазмина из плазминогена Распад фибрина и фибриногена
- •Реакции фибринолиза Ингибиторы фибринолиза
- •Заболевания системы гемостаза Заболевания, связанные с гипокоагуляцией
- •Заболевания, связанные с гиперкоагуляцией
- •Лекарственная регуляция гемостаза Препараты, влияющие на плазменный гемостаз
- •Препараты, влияющие на тромбоцитарный гемостаз
- •Оценка плазменного звена
- •Глобальные тесты оценки гемостаза
Внешний путь свертывания
После повреждения сосуда тканевой фактор (TF), находящийся на клетках, связывает и активирует фактор VII. Образованный комплекс напрямую активирует фактор Х. Далее ф.Ха при участии кофактора Va в присутствии ионов Са2+ формирует комплекс Xa-Va-Ca2+ – протромбиназу, превращающую протромбин в тромбин.
Активность внешнего пути поддерживается за счет механизма положительной обратной связи:
образующийся тромбин активирует V фактор,
фактор Xa в присутствии ионов Cа2+ активирует фактор VII.
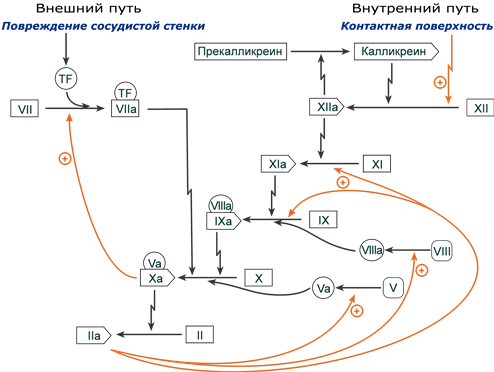
Внешний и внутренний пути свертывания крови Внутренний путь свертывания
Внутренний путь свертывания развертывается на фосфолипидной поверхности тромбоцитов или иных клеток, где в первую очередь происходит сборка комплекса, состоящего из факторов XII, XI, прекалликреина и высокомолекулярного кининогена (ВМК).
1. Активация фактора XII. Связывание фактора XII с тромбопластином (тканевым фактором) изменяет его конформацию, и он приобретает небольшую активность. Это позволяет фактору XIIа начать превращение прекалликреина в калликреин. Затем, в результате действия калликреина накапливается фактор XIIa, и активация калликреина усиливается. Т.о. фактор XIIа и калликреин взаимно активируют друг друга.
Также фактор XII может активироваться фактором VIIa.
2. Активация фактора XI. Фактор XIIa активирует фактор XI.
3. Активация фактора IX. Фактор XIa в присутствии ионов Са2+ локализует на мембране и активирует фактор IX. Фактор IX может также активироваться фактором VIIa. Далее фактор IXa связывается со своим кофактором VIIIа и образует комплекс IXa-VIIIa-Са2+, называемый теназа или теназный комплекс (англ. ten - десять).
4. Активация фактора X. Теназа (комплекс IXa-VIIIa-Са2+) активирует фактор X. Активированный фактор Ха при помощи своего кофактора Va в присутствии ионов Са2+ на фосфолипидной мембране формирует комплекс Xa-Va-Ca2+ – протромбиназу.
5. Активация фактора II (тромбина). Протромбиназа атакует протромбин и последовательно расщепляет две связи в его молекуле, отделяя N-концевой фрагмент, с формированием активного тромбина.
6. Тромбин
превращает фибриноген в фибрин-мономер,
по мере своего образования через обратные положительные связи активирует факторы V, VIII, XI, что поддерживает активность ферментативного каскада.
Каскадно-матричная теория коагуляции
Необходимость создания новой каскадно-матричной (клеточной) теории свертывания крови назрела в результате нестыковок классической теории с данными клинических наблюдений.
Например,
по классической версии отсутствие факторов VIII и IX у больных гемофилиями А и В не должно приводить к кровотечениям, т.к. существует внешний путь активации тромбина. Однако на деле внешнего пути оказывается недостаточно.
отсутствие фактора Хагемана, инициатора внутреннего пути свертывания в классической теории, приводит к тромбофилиям, но не к кровотечениям,
влияние прекалликреина и высокомолекулярного кининогена (активаторов ф.XII) на свертывание крови проявляется только в исследованиях in vitro, и их недостаток у пациента выявляется случайно, т.к. клинически никак не проявляется.
Современная каскадно-матричная (клеточная) теория (2002 г) подразумевает, что в организме "внешний" и "внутренний" пути не изолированы друг от друга, а представляют собой единую систему, имеющую множество прямых и обратных положительных связей и перекрестных влияний отдельных факторов друг на друга.
Взаимодействие факторов свертывания плазмы и образование протромбиназы укладывается в 3 стадии:
Инициация.
Амплификация (лат. amplificatio - расширение, усиление).
Пропагация (лат. propagatio - разведение, распространение).
В результате выполнения трех стадий образуется тромбин, далее превращающий фибриноген в фибрин-мономеры.
По данной клеточной теории "контактные" факторы (ф.ХIIa, калликреин, высокомолекулярный кининоген) имеют весьма ограниченное значение при коагуляции с целью остановки простого кровотечения, но необходимы для формирования фибрина в ходе воспалительной реакции.
