
Лекция_3_Химия
.pdf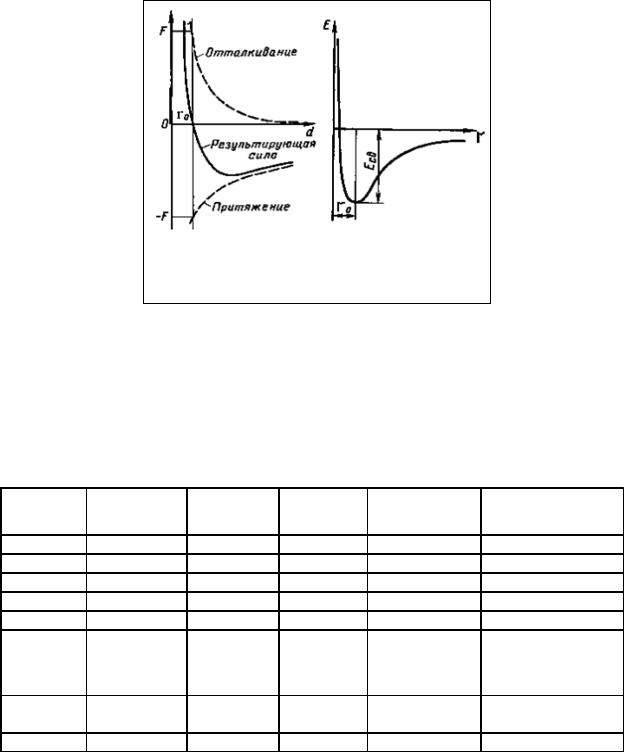
Лекция № 3. Химическая связь. Характеристики химической связи: энергия, длина, валентный угол. Типы связи. Полярность связи. Квантово-механическое описание ковалентной связи. Понятие о методе валентных связей. Гибридизация атомных орбиталей. σ - (cигма) и π (пи )- связи. Геометрическая конфигурация молекул. Полярность связи. Химическая связь в комплексных соединениях
Под химической связью понимается взаимодействие между свободными атомами, приводящее к образованию устойчивых систем – молекул, ионов, кристаллов, комплексов и др. Химическая связь имеет электрическую природу, возникает в результате действия сил притяжения и отталкивания электронов и ядер, сопровождается понижением энергии связанных атомов по сравнению с энергией изолированных атомов (рис.1).
Рис. 1. Зависимость сил взаимодействия между атомами и потенциальной энергии от расстояния между атомами
Положение минимума на кривой потенциальной энергии определяет энергию Есв и длину связи r0, т.е. расстояние между центрами связанных атомов в стабильном состоянии молекулы. Энергия химической связи измеряется сотнями кДж/моль.
Химическая связь также характеризуется валентным углом, который образуют условные линии, исходящие из центра атома в направлении центров других атомов.
В табл. 1 приведены энергии, длины и валентные углы связей для некоторых молекул.
Таблица 1. Количественные характеристики некоторых химических связей
Химическая |
Энергия связи, |
Длина связи, |
|
Валентный |
Геометрическая |
|
Молекула |
конфигурация |
|||||
связь |
кДж/моль |
пм |
угол, град |
|||
|
молекулы |
|||||
|
|
|
|
|
||
H − H |
436 |
74 |
H2 |
180 |
Линейная |
|
H − F |
536 |
100 |
HF |
180 |
Линейная |
|
H − Cl |
432 |
127 |
HCl |
180 |
Линейная |
|
H − O |
460 |
96 |
H2O |
104,5 |
Угловая |
|
H − C |
412 |
109 |
CH4 |
109,5 |
Тетраэдр |
|
|
|
|
|
H-C-H 109,5 |
Пространственная |
|
C − C |
348 |
155 |
C2H6 |
(два тетраэдра, |
||
C-C 180 |
соединенные |
|||||
|
|
|
|
|||
|
|
|
|
H-C-H 120 |
центрами) |
|
C ═ C |
635 |
134 |
C2H4 |
Плоская |
||
C-C 180 |
||||||
|
|
|
|
|
||
C ≡ C |
830 |
120 |
C2H2 |
180 |
Линейная |

Ещё в 1916 году американский химик Г.Н.Льюис высказал идею о том, что химическая связь образуется двумя электронами, причем в большинстве молекул вокруг каждого атома должно находиться восемь электронов (правило октета Льюиса), или четыре пары, одни из которых могут принадлежать данному атому, а другие являются общими для двух атомов, образующих связь.
Наглядные изображения молекул, в которых электроны неподеленных и общих пар указываются точками, называются электронными формулами Льюиса. Если общую пару электронов заменить валентной чертой, то мы получим графические формулы Льюиса:
H – H ; |
|
F–F ; |
H – F |
|
|
|
|
|
||
H |
|
N |
|
H |
|
|
F |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
F |
|
S |
|
F |
|
|
|
|
|
|
|
|
||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
NH3 |
|
|
|
SF4 |
|
|
|||
Модели Льюиса графически просты и понятны, но они не объясняют механизма образования связей, так как основаны на известном составе частицы.
Основными типами химической связи являются ковалентная, ионная и металлическая. Они отличаются характером изменения электронной плотности между атомами, вступающими в связь, что определяет различия в физических и химических свойствах веществ.
Ковалентная связь считается универсальным типом химической связи. Современные теории ковалентной связи основаны на квантово-механическом
описании состояния электрона в молекуле.
Уравнение Шрёдингера для молекулы записывается в виде где Ψмол – волновая функция молекулы.
Аналитическое решение уравнения Шрёдингера для молекулы невозможно по тем же причинам, что и для многоэлектронных атомов. Оно имеет точное решение для молекулярного иона водорода Н2+, который состоит из двух протонов и одного электрона. Между двумя протонами действуют силы отталкивания, между каждым из протонов и электроном - силы притяжения. Частица Н2+ образуется лишь в том случае, если взаимное отталкивание протонов будет компенсировано их притяжением к электрону. Это возможно, если электронная плотность будет расположена между ядрами - в области связывания. В противном случае электрон находится в области антисвязывания, или разрыхления, и частица не образуется.
Приближеннные методы решения уравнения Шрёдингера отличаются способами формирования волновой функции молекулы из волновых функций отдельных атомов. Рассмотрим два метода – метод валентных связей (МВС) и метод молекулярных орбиталей
(ММО).
Метод валентных связей
Метод валентных связей явился результатом развития представлений Льюиса о парноэлектронной связи. Он был разработан В. Гейтлером и Ф. Лондоном применительно к молекуле водорода H2.
Предположим, что имеются два атома водорода А и В с волновыми функциями ΨА и ΨВ, геометрическими образами которых являются две атомные 1s-орбитали. Волновую функцию молекулы, образованной этими двумя атомами, можно представить в первом приближении как произведение атомных волновых функций электронов ΨА(1) и ΨВ(2), находящихся в поле своих ядер:
Ψ = ΨА(1)· ΨВ(2) |
(1) |
Поскольку электроны неразличимы и могут пребывать как в поле ядра атома А , так и

в поле ядра атома В, то волновую функцию молекулы можно выразить более сложной функцией Ψ, учитывающей пребывание электрона (1) в поле ядра атома В ΨВ(1) и электрона
(2) в поле ядра А ΨА(2) :
Ψ = ΨА(1)· ΨВ(2) + ΨА(2)· ΨВ(1) (2)
Использование этой функции (функция Гейтлера–Лондона) позволило рассчитать потенциальную кривую молекулы водорода H2, найти её минимум и межъядерное расстояние.
Полученные В. Гейтлером и Ф. Лондоном результаты оказались в хорошем совпадении с экспериментальными (табл. 2), что определило особую значимость работы, которая показала, что уравнение Шредингера справедливо не только для атомов, но и для молекул, и является фундаментальным. Также было показано, что химическая связь имеет электрическую природу, т. к. рассматривалась только энергия электростатического взаимодействия ядер и электронов.
|
Таблица 2. Энергия и длина связи для молекулы H2 |
|
Результаты |
Энергия связи, кДж/моль |
Межъядерное расстояние, пм |
Расчетные |
- 388 |
74,9 |
Экспериментальные |
- 440 |
74,1 |
Из проведённых расчётов (табл.2) следует, что межъядерное расстояние в молекуле
меньше суммы орбитальных радиусов атомов А и В. Это получило название «перекрывание электронных облаков». В результате такого взаимного перекрывания электронная плотность в области между ядрами увеличивается, что приводит к понижению энергии и образованию химической связи.
Поскольку функция (2) – симметричная, то из принципа Паули следует, что образование молекулы Н2 из двух атомов водорода возможно лишь в том случае, когда спины электронов
атомов антипараллельны. Если же два атома имеют электроны с параллельными спинами, то система должна описываться другой волновой функцией:
Ψ = ΨА(1)· ΨВ(2) - ΨА(2)· ΨВ(1) (3)
и химическая связь между атомами водорода не образуется.
Метод валентных связей основан на положении, что каждые два атома в химической частице удерживаются вместе при помощи одной или нескольких электронных пар, которые локализованы в пространстве между ними.
Каждый электрон характеризуется атомной орбиталью определенной формы и симметрии. При образовании связи атомные орбитали перекрываются, что приводит к повышению электронной плотности между ядрами. Перекрываемые орбитали должны иметь одинаковую симметрию относительно линии, связывающей ядра атомов.
Перекрывание атомных орбиталей вдоль линии связывания приводит к образованию σ-связи. Все σ-связи обладают осевой симметрией относительно линии связи. Атомы могут вращаться вокруг линии связи без нарушения степени перекрывания орбиталей.
При перекрывании атомных орбиталей, перпендикулярных линии связи, образуются связи другой симметрии: π-связи.
С появлением π-связи, не имеющей осевой симметрии, свободное вращение атомов относительно линии связывания становится невозможным, так как оно приводит к разрыву π-связи.
На рис. 2 представлены различные типы перекрывания орбиталей, приводящие к образованию σ- и π- связей.
Кратные связи состоят из одной σ-связи и одной (двойная) или двух (тройная) π- связей.
Геометрическую структуру молекулы определяет совокупность направленных, строго ориентированных в пространстве σ-связей.
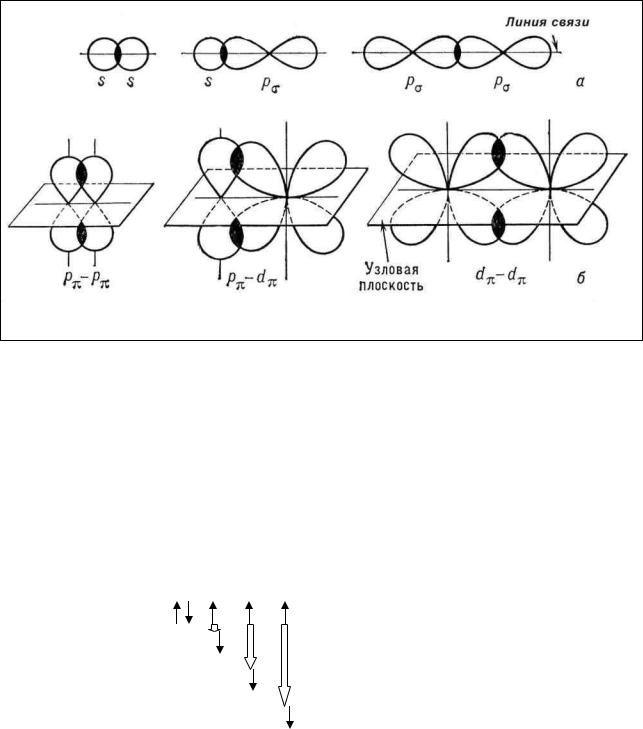
Рис. 2. Схематическое изображение пространственной ориентации орбиталей при образовании (а) σ - связи, (б) π - связи
Из всех типов ковалентной связи наибольшую степень перекрывания и прочность имеют σ-связи, поэтому с точки зрения МВС они первичны и образуются первыми, а π- связи вторичны и характеризуются меньшей прочностью, чем σ-связь.
Число связей между атомами в методе ВС называется кратностью связи.
Механизмы образования ковалентной связи
Различают три механизма образования ковалентной связи - обменный, донорноакцепторный, дативный.
При обменном механизме каждый атом предоставляет в общее пользование по одному электрону, причем спины электронов должны быть противоположными, или, иначе говоря, антипараллельными.
Например, при образовании молекулы аммиака из атомов: N + 3H → NH3 |
три p - |
|||||||||
орбитали азота, на каждой из которых имеется по одному электрону, перекрываются |
с |
|||||||||
одноэлектронными s-орбиталями трех атомов водорода: |
|
|||||||||
N [K2s22p3] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H [1s1] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H [1s1] |
|
|
|
|
|
|
|
|||
H [1s1] |
|
|
|
|||||||
|
|
|
|
|
||||||
В результате спаривания электронов в областях перекрывания орбиталей появляется три пары электронов, связывающих атомы в молекулу.
По донорно-акцепторному механизму перекрываются свободная орбиталь одного атома с орбиталью другого атома, на которой имеется неподеленная пара электронов, поступающая в общее пользование.
По донорно-акцепторному механизму происходит, например, образование комплексного иона [NH4]+ по реакции: NH3 + H+ → [NH4]+ .
Донором электронной пары является атом азота в молекуле аммиака, который предоставляет ее в общее пользование иону водорода, имеющему свободную орбиталь и выполняющему роль акцептора.
В образовавшемся ионе [NH4]+ все четыре ковалентные связи азот − водород равноценны по длине и энергии, несмотря на различие в механизме их образования.

N [K2s22p3]
3 H [1s1]
H+ [1s0]
С позиций донорно-акцепторного механизма можно объяснить многообразие кислородных кислот хлора – HClO, HClO2, HClO3, HClO4, а также образование разнообразных комплексов, например, [BeF4]2-, [CuCl4]2-, [Cu(NH3)4]2+ и др.
Дативный механизм образования связи проявляется в молекулах, атомы которых содержат во внешней электронной оболочке, кроме s- и р-орбиталей, d-орбитали, которые могут выступать в роли и донора, и акцептора электронных пар.
Примером проявления дативного механизма при образования связи служит взаимодействие двух атомов хлора. Два атома хлора, имеющие электронную конфигурацию [Ne]3s23p53d 0 , соединяются в молекулу Cl2 по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, возможно перекрывание 3р-орбитали одного атома хлора, на которой имеется пара электронов, и вакантной 3d-орбитали второго атома хлора, а также наоборот - перекрывание 3р-орбитали второго атома хлора, на которой имеется пара электронов, и вакантной 3d-орбитали первого атома хлора. Проявлением дативного механизма объясняют увеличение энергии связи в молекуле хлора (Есв = 243 кДж/моль) по сравнению с молекулой фтора (Есв = 159 кДж/моль), в которой ковалентная связь образуется только по обменному механизму.
Метод валентных связей позволяет объяснить такие свойства ковалентной связи как
насыщаемость, направленность, целочисленность.
Насыщаемость ковалентной связи определяется количеством неспаренных электронов в стабильном или возбужденном состоянии атома. Принцип Паули запрещает участие одной и той же атомной орбитали дважды в образовании связи. Гейтлер и Лондон квантово-механическим расчетом показали невозможность присоединения третьего атома водорода к молекуле H2 , т.е. существование молекулы H3, поскольку спин третьего электрона будет совпадать по направлению со спином одного из электронов в молекуле H2, что определяет преобладание сил отталкивания.
Направленность ковалентной связи определяется различной формой атомных орбиталей и их перекрыванием в направлении наибольшей электронной плотности, что определяет различную геометрическую конфигурацию частиц.
Направленными являются только σ – связи.
|
Под целочисленностью ( или |
|
кратностью) связи понимается |
|
количество электронных пар, |
|
соединяющих два атома. Например, связь |
|
атомов азота в молекуле N2 |
|
осуществляется тремя парами электронов |
|
N ≡ N, одна из которых образует σ – связь, |
|
а две другие π – связи, имеющие две |
|
области перекрывания. Образование π – |
|
связей происходит при перекрывании |
|
атомных орбиталей, расположенных |
Рис. 3. Образование σ- и π- связей в молекуле азота |
перпендикулярно к σ – связи и |
|
параллельно между собой (рис. 3). |
|
Гибридизация атомных орбиталей
При рассмотрении механизма образования ковалентных химических связей в многоатомных гетероядерных (состоящих из разных атомов) молекулах используют понятие о гибридизации орбиталей центрального атома. Гибридизация является формальным приемом, используемым для квантово-механического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами.
Сущность гипотезы гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (или гибридизованной) орбиталью.
Гибридизации подвергаются близкие по энергии атомные орбитали, она сопровождается выравниванием энергии орбиталей и изменением их формы. Количество образующихся гибридных орбиталей равно количеству орбиталей, участвующих в их создании. Гибридные орбитали, образованные s, p и даже d - орбиталями мало отличаются по форме, несимметричны и выглядят примерно так, как показано на рис. 4.
Гибридные орбитали ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания.
Тип гибридизации орбиталей центрального атома определяет геометрическую форму молекулы или иона (табл. 3).
Таблица 3. Типы гибридизации орбиталей центрального атома
Тип гибридизации |
Геометрическая форма |
Угол между связями, град |
Примеры молекул |
sp |
Линейная |
180 |
BeF2 |
sp2 |
Плоская (треугольная ) |
120 |
BF3 |
sp3 |
Пространственная |
109,5 |
CF4 |
|
(тетраэдрическая) |
|
|
sp3d |
Пространственная |
|
|
(тригонально- |
90 и 120 |
PF5 |
|
|
бипирамидальная) |
|
|
sp3d2 |
Пространственная |
90 |
SF6 |
|
(октаэдрическая) |
|
|
В гибридизации участвуют как одноэлектронные орбитали, образующие связи по обменному механизму, так и орбитали с неподеленными электронными парами, которые связи не образуют, но влияют на геометрическую форму частицы (рис. 5).
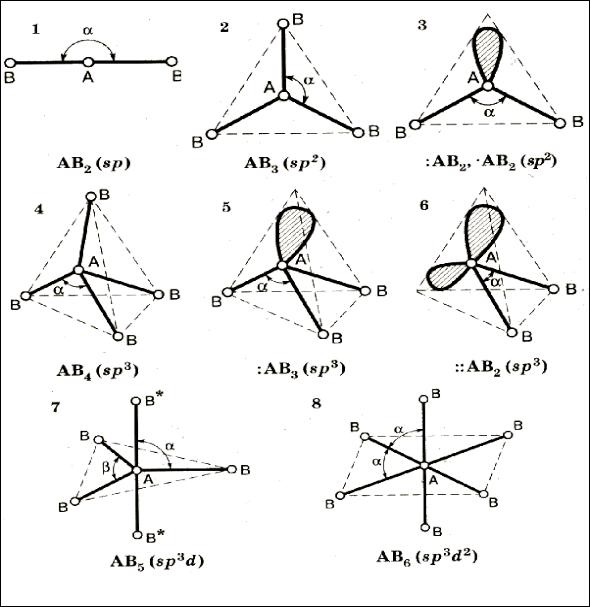
Рис. 5. Расположение атомных орбиталей в пространстве для различных типов гибридизации (двумя точками и штриховкой обозначены орбитали с неподеленными электронными парами )
Тип молекулы в общем виде записывается как ABn Em , где A — центральный атом, B - концевые атомы, E — неподеленные пары электронов.
Геометрическая форма молекулы определяется количеством и расположением в пространстве σ – связей и неподеленных электронных пар.
Наличие π – связей не изменяет геометрии молекулы, хотя несколько более сильное отталкивание между двойными связями приводит к небольшим изменениям углов и энергии связи.
Рассмотрим применение метода валентных связей для объяснение геометрических структур некоторых молекул.
Пример 1. Известно, что молекула SbF3 имеет тригонально-пирамидальную форму с валентным углом F-Sb-F 950. Объясните ее структуру.
Решение. Согласно современным представлениям о химической связи два атома удерживаются вместе парой электронов с противоположными спинами. Отдельная связь может образоваться по обменному механизму, когда каждый атом предоставляет в общее пользование по одному электрону, или по донорно-акцепторному механизму, когда один атом предоставляет пару электронов, а другой атом принимает ее на свою свободную орбиталь.
Центральным атомом в молекуле SbF3 является атом сурьмы Sb, периферическими – атомы фтора F.
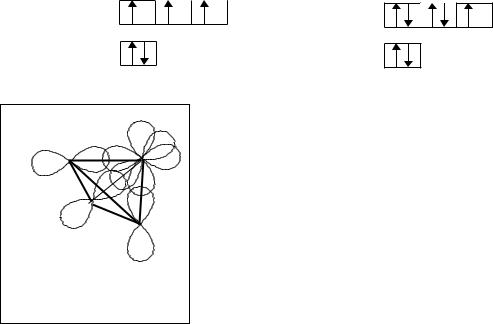
Электронное строение атомов: |
|
||
|
Sb [1s22s22p63s23p63d104s24p64d105s25p3] ≡ [KLMN5s25p3] ≡ [Kr]5s25p3 |
||
|
F [1s22s22p5] ≡ [K2s22p5] ≡ [He]2s22p5 |
|
|
|
Электронно-графические диаграммы внешних уровней атомов: |
||
Sb |
5р |
F 2p |
|
|
5s |
2s |
|
Для образования молекулы SbF3 по обменному механизму атом сурьмы должен |
|||
|
|
предоставить три неспаренных электрона, что соответствует его |
|
|
|
основному состоянию. В основном состоянии атома фтора |
|
|
|
имеется один неспаренный электрон. Связи могут быть |
|
F |
|
образованы перекрыванием p – орбиталей атома Sb и атомов F |
|
Sb |
(рис.6), но валентный угол |
F-Sb-F должен быть равным 90°, что |
|
|
не соответствует экспериментальным данным. |
||
|
|
Согласно теории отталкивания электронных пар валентных |
|
F |
|
орбиталей (теории ОЭПВО), разработанной Гиллеспи, молекула |
|
|
SbF3 относится к типу AB3 E (A – центральный атом Sb, B – три |
||
|
F |
периферических атома F, |
E – неподеленная пара электронов у |
|
атома Sb), для которого |
пространственное распределение |
|
Рис. 6. Образование молекулы |
химических связей должно соответствовать тетраэдрическому |
||
SbF3 без гибридизации АО |
углу 109°28'. Уменьшение валентного угла можно объяснить |
||
более сильным отталкиванием неподеленной парой электронов соседней электронной пары |
|||
по сравнению с отталкиванием, проявляющимся между электронными парами, |
|||
обеспечивающими связь. |
|
|
|
Использование в методе валентных связей гипотезы гибридизации орбиталей |
|||
позволяет точнее определить пространственную конфигурацию молекулы ABn Em. |
|||
Тип |
гибридизации |
орбиталей центрального атома A определяется количеством |
|
связывающих электронных пар, образующих σ – связи с атомом В, наличием неподеленных |
|||
электронных пар, участвующих в гибридизации, и наличием кратных связей, не влияющих |
|||
на тип гибридизации. |
|
|
|
Порядок определения геометрии молекулы ABn Em можно представить следующей |
|||
схемой: |
|
|
|
∙определяем центральный атом (А) и число σ-связей (по числу n концевых атомов В);
∙составляем электронные формулы центрального и концевого атомов;
∙учитываем, что в образовании связей участвуют все валентные электроны атома А и неспаренные электроны атомов В;
∙определяем общее количество валентных электронов как сумму валентных электронов атома А и n атомов В;
∙при наличии в частице кратных связей ( π – связей), каждая из которых образована парой электронов, общее количество электронов, участвующих в их образовании, вычитаем из суммы валентных электронов, так как присутствие π- связей не изменяет тип гибридизации атома;
∙если частица является ионом, то при наличии у нее отрицательного заряда, к сумме валентных электронов добавляем количество электронов, равное отрицательному заряду частицы, а при наличии положительного заряда - отнимаем;
∙определяем общее количество электронных пар, поделив сумму валентных электронов на два, так как каждая связь образуется парой электронов;
∙определяем количество связывающих электронных пар n, которое равно числу
концевых атомов В;
∙определяем количество неподеленных, или несвязывающих, электронных пар m, которое равно разности между общим количеством электронных пар и количеством связывающих электронных пар;
∙записываем тип молекулы ABn Em , например, АВ2Е2;
∙устанавливаем тип гибридизации орбиталей центрального атома, который определяется суммой (n +m);
∙определяем геометрическую форму молекулы, учитывая, что наличие неподеленных электронных пар влияет на пространственное строение молекулы.
В соответствии с предложенной схемой геометрическая конфигурация молекулы SbF3 (пример 1) определяется расположением гибридных орбиталей центрального атома в пространстве, которое рассмотрим следующим образом:
•общее количество электронов, участвующих в образовании связей:
Sb [5s25p3] предоставляет 5 электронов, три атома F [2s22p5] - 3 электрона,
• |
общее количество электронов равно 8; |
8 |
|
|
• |
общее количество электронных пар равно |
=4 |
; |
|
|
|
2 |
|
|
•из них связывающих (определяются числом концевых атомов) три,
• |
несвязывающих - одна (4-3); |
• |
тип молекулы АВ3Е; |
• |
тип гибридизации орбиталей sp3 ; |
•четыре электронные пары в пространстве распределяются по углам тетраэдра.
|
.. |
|
Sb |
F |
F |
|
95 o |
|
F |
Рис. 7. Образование молекулы SbF3 |
|
по МВС с использованием гипотезы |
|
гибридизации атомных орбиталей |
|
Наличие неподеленной пары электронов на несвязывающей орбитали увеличивает отталкивание связывающих электронных пар и приводит к уменьшению валентного угла от 109°28', который соответствует sp3 – гибридизации, до 95°, что определяет геометрическую форму молекулы SbF3 как тригонально-пирамидальную или незавершенную тетраэдрическую (рис.7).
Перекрывание одноэлектронных гибридных орбиталей атома Sb с p-орбиталями атомов F приводит к образованию ковалентных полярных связей σ - типа, электронная плотность которых смещена к более электроотрицательному атому F.
Пример 2. Объясните угловую структуру молекулы воды, валентный угол в которой Н-О-Н равен 104,50.
• Центральный атом – атом кислорода O, который образует две σ-связи с двумя атомами водорода;
• электронные конфигурации атомов: O - [He]2s22p4 ; H - 1s1;
• атом кислорода предоставляет в общее пользование шесть электронов, каждый атом водорода — по одному электрону;
• общее количество валентных электронов: 6+2 = 8;
• в молекуле H2O обе связи одинарные, π – связей нет;
•молекула нейтральна;
•общее количество электронных пар: 8:2 = 4;
•количество связывающих электронных пар – 2;
•количество несвязывающих электронных пар - (4 – 2) = 2;
•тип молекулы - AB2E2, что отвечает sp3 - гибридизации орбиталей атома
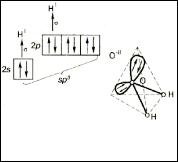
кислорода;
•sp3 - гибридизация орбиталей атома кислорода определяет тетраэдрическое расположение электронных пар в пространстве, а не положение атомов;
•пространственное строение молекулы H2O – угловое, в ней имеется две σ-связи и две несвязывающие электронные пары.
Структура молекулы воды приведена на рис. 8. Наличие двух несвязывающих электронных пар, испытывающих притяжение только к ядру атома кислорода и потому занимающих больший объем, изменяет угол между
связями кислород - водород, уменьшая его от 109,5 o, отвечающего
sp3 — гибридизации, до 104,5o.
Рис. 8. Образование молекулы воды по МВС
Пример 3. Объясните плоскую треугольную структуру молекулы SO3
•Центральный атом – атом серы S, степень окисления которого +6, а концевых атомов кислорода три, что указывает на наличие, кроме трех σ-связей серы с тремя атомами кислорода, еще трех π – связей;
•электронные конфигурации атомов: S - [Ne]3s23p4 ; O - [He]2s22p4 ;
•атом серы предоставляет в общее пользование шесть электронов, каждый атом кислорода — по два электрона;
•общее количество валентных электронов: 6 + 6 = 12;
•в молекуле SO3 есть три π – связи; общее количество электронов, участвующих в их образовании, вычитаем из суммы валентных электронов, так как присутствие π - связей не изменяет тип гибридизации атома: 12 - 6 = 6;
•молекула нейтральна;
•общее количество электронных пар: 6:2 = 3;
•количество связывающих электронных пар – 3;
•количество несвязывающих электронных пар - 0;
•тип молекулы - AB3;
•тип гибридизации орбиталей атома кислорода – sp2;
•пространственное строение молекулы SO3 – плоская, треугольная. Наличие π – связей не изменяет плоской структуры молекулы.
Вслучае sp, sp2, sp3, sp3d 2 гибридизации вершины в многограннике, описывающем геометрию частицы, равноценны, и поэтому кратные связи и неподеленные пары электронов могут занимать любые из них. Однако sp3d-гибридизации отвечает тригональная бипирамида, в которой валентные углы для атомов, расположенных в основании пирамиды
(экваториальной плоскости), равны 120o, а валентные углы с участием атомов, расположенных в вершинах бипирамиды, равны 90o. Эксперимент показывает, что
неподеленные электронные пары всегда располагаются в экваториальной плоскости тригональной бипирамиды. На этом основании делается вывод, что они требуют больше свободного пространства, чем пары электронов, участвующие в образовании связи.
Примером частицы с таким расположением неподеленной электронной пары является тетрафторид серы SF4, который относится к типу AB4E с sp3d – гибридизацией орбиталей атома серы. Неподеленная пара электронов располагается в экваториальной плоскости тригональной бипирамиды. Тетрафторид серы SF4 образует геометрическую фигуру, которая называется бисфеноид (или искаженный тетраэдр).
Полярность ковалентной связи
При образовании ковалентной связи двумя одинаковыми атомами (например, в
