
Лекция_3_Химия
.pdf
молекулах H2, F2) , электроотрицательности которых равны, общая пара электронов одинаково удалена от ядер атомов. Такая связь называется ковалентной неполярной, или симметричной ковалентной.
При образовании связи двумя атомами с разными электроотрицательностями (например, в молекулах HF, NH3), общая пара электронов смещается к более электроотрицательному атому, который приобретает отрицательный эффективный заряд δ, а атом с меньшей электроотрицательностью – положительный δ. Такая связь называется
ковалентной полярной, или несимметричной ковалентной:
В молекуле HF связывающая электронная пара смещена к более электроотрицательному атому фтора:
H + F → Hδ + Fδ −
Эффективный заряд δ определяется отношением фактического заряда к заряду электрона. Для молекулы HF: +δ = +0,43 и -δ = - 0,43.
|
|
Пространственное распределение зарядов приводит к образованию |
+ - |
|
|
|
диполя, обладающего электрическим моментом, по величине которого можно |
|
|
|
судить о степени полярности ковалентной связи. |
Электрический момент диполя (или дипольный момент) представляет собой произведение эффективного заряда q, принимаемого равным заряду электрона q, на величину межъядерного расстояния r : μ = q r.
Размерность [ μ ] = [ Кл∙м ].
Используется также несистемная единица Дебай: 1D = 3,33∙10 – 30 Кл∙м. Электрический момент является векторной величиной. Он направлен от
положительного заряда к отрицательному заряду диполя.
Электрический момент диполя многоатомной молекулы равен векторной сумме электрических моментов ее отдельных химических связей и неподеленных пар электронов
(НЭП): μ мол = ∑ μ связей + ∑μ НЭП.
Если полярные связи расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой CO2, имеющей линейное строение (sp-гибридизация атома C) и электрический момент, равный нулю. Молекула SO2 имеет угловую форму вследствие наличия неподеленной пары электронов при sp2 – гибридизация атома S, поэтому ее электрический момент отличен от нуля (μ = 5,34∙10 – 30 Кл∙м).
Молекулы NH3 и NF3 имеют тетраэдрическую симметрию расположения электронных пар с учетом неподеленной пары атома азота (рис. 5, фиг. 5) и пирамидальное строение. Разность электротрицательностей атомов N - H (Δχ = 0,84) меньше, чем атомов N – F (Δχ = 0,94) и можно было бы ожидать бо льшую величину электрического момента у NF3. Однако эксперимент показывает обратное: μ (NH3) = 4,9∙10 – 30 Кл∙м = 1,46 D, μ (NF3) = 0,7∙10 – 30 Кл∙м = 0,24D . Причиной является вклад в величину электрического момента молекулы неподеленной пары, электрический момент которой всегда направлен от ядра (рис. 9).
N |
N |
NH3 |
NF3 |
Рис. 9. Направление векторов электрических моментов отдельных связей и неподеленной пары электронов в молекулах NH3 и NF3
Химическая связь в комплексных соединениях
Комплексными соединениями (КС) называются соединения сложного состава, в узлах
кристаллической решетки которых находятся группы атомов, способных к самостоятельному существованию в растворе.
Характерной особенностью КС является превышение числа образуемых центральным атомом химических связей над числом электронов, определяющих валентность атома, т.е. связи в КС образуются не только по обменному, но и по донорно-акцепторному механизмам.
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L 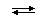 [MLn],
[MLn],
где M – комплексообразователь, представляющий собой нейтральный атом, положительно или отрицательно заряженный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L, называемые лигандами (от латинского "ligare" - связывать).
В комплексных ионах [Cu(NH3)4]2+, [SiF6] 2 -, [Fe(CN)6] 4 -, [BF4] - комплексообразователями являются ионы меди (II), кремния (IV), железа (II), бора (III), лигандами молекулы NH3, ионы F- и CN-. Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания.
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления. Атомы в отрицательной степени окисления выполняют роль комплексообразователей сравнительно редко. Это, например, атом азота (-3) в катионе аммония [NH4]+. Атом — комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], являются нейтральными частицами, так как комплексообразователи — атомы Ni и Fe и лиганды CO нейтральны.
Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса. Так, в комплексном катионе [Cu(NH3)4]2+ внутренняя сфера образована комплексообразователем ионом меди (II) и молекулами аммиака, непосредственно с ним связанными. Внутренняя сфера часто выделяется квадратными скобками.
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, [Al(H2O)6]3+, отрицательный, например, [Fe(CN)6] 4 - или нулевой заряд, например, [Fe(CO)5].
Ионы, нейтрализующие заряд внутренней сферы, но не соединенные ковалентными связями с комплексообразователем, образуют внешнюю сферу комплексного соединения.
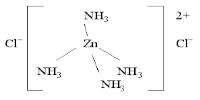
Например, в комплексном соединении [Zn(NH3)4]Cl2 два иона Cl - находятся во внешней сфере:
Внешнесферные ионы Cl- находятся на большем удалении от комплексообразователя, чем внутрисферные молекулы NH3, иначе говоря, расстояние Zn – Cl больше, чем длина химической связи Zn – N. Более того, химическая связь комплексного катиона [Zn(NH3)4]2+ и хлорид-ионов Cl - имеет ионный характер, в то время как молекулы аммиака NH3,
входящие во внутреннюю сферу, образуют с комплексообразователем Zn(II) ковалентные связи – две по обменному и две – по донорно-акцепторному механизму (донором неподеленных пар электронов являются атомы азота в молекуле аммиака). Таким образом, различие между лигандами внутренней сферы и ионами внешней сферы очень существенно.
При растворении в воде комплексные соединения необратимо диссоциируют на ионы: [Cu(NH3)4](OH)2 → [Cu(NH3)4]2+ + 2OH -. Дальнейшая диссоциация комплексного иона [Cu(NH3)4]2+ происходит в очень незначительной степени.
Для объяснения геометрической структуры комплексов используется метод валентных связей.
Рассмотрим применение МВС на примере частицы [BF4] - , которая образуется по реакции: BF3 + 3F - → [BF4] -
Электронные конфигурации атомов бора, фтора и иона фтора:

B [He] 2s22p1 → B* [He] 2s12p2, F [He] 2s22p5 , F¯ [He] 2s22p6
Молекула BF3 образуется по обменному механизму – каждый атом предоставляет в общее пользование по одному электрону. Для образования трех σ-связей атом бора должен иметь три неспаренных электрона, что возможно при переходе его в возбужденное состояние путем промотирования s — электрона второго уровня на свободную p — орбиталь этого же уровня.
Атом бора B* подвергается sp2 – гибридизации, при этом у него остается свободная орбиталь, на которую он принимает электронную пару иона F¯. Молекула BF3 имеет плоскую структуру правильного треугольника, в центре которого находится атом бора, ковалентно связанный с атомами фтора (рис. 5, фиг. 2). Молекула имеет полярные связи B – F, но в целом нейтральна вследствие симметрии структуры: векторная сумма электрических моментов отдельных связей равна нулю.
В частице [BF4] – четвертая связь образуется по донорно-акцепторному механизму, донор - ион F-, акцептор — атом B, при этом атом бора подвергается sp3 – гибридизации. Комплексный ион [BF4] – имеет тетраэдрическую форму (рис. 5, фиг. 4), он вследствие симметрии расположения связей также электронейтрален.
Значение координационного числа (КЧ) комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, растворителя), при которых протекает реакция комплексообразования.
КЧ и геометрическая форма комплекса определяются типом гибридизации орбиталей комплексообразователя и наличием несвязывающих электронных пар (табл. 4).
Таблица 4. Тип гибридизации комплексообразователя и структура комплексных соединений
КЧ |
Тип |
Число электронных пар |
Структура и |
Примеры |
||
гибридизации |
связывающих |
несвязывающих |
формула |
|||
|
|
|||||
2 |
sp |
2 |
0 |
Линейная AL2 |
[Ag(NH3)2]+ |
|
3 |
sp2 |
3 |
0 |
Плоская |
[CO3]2- |
|
|
|
|
|
треугольная AL3 |
|
|
4 |
sp3 |
4 |
0 |
Тетраэдр AL4 |
[BeF4]2- |
|
sp3d 2 |
4 |
2 |
Плоская |
[Cu(NH3)4]2+ |
||
|
|
|
|
квадратная AL4E2 |
|
|
|
d 2sp3 |
|
|
Тригонально- |
|
|
5 |
5 |
0 |
бипирамидальная |
[Fe(CO)5]0 |
||
|
|
|
|
AL5 |
|
|
6 |
sp3d 2 |
6 |
0 |
Октаэдр AL6 |
[SiF6]2- |
|
