
Лекция_1_Химия
.pdf2011/12 у. г.
Лекции по неорганической химии Составила — доц. Ермолаева В.И.
МОДУЛЬ 1: Строение вещества
Лекция № 1. Основные понятия и законы химии. Экспериментальные основы современной модели атома. Вероятностный характер процессов в микромире: корпускулярно-волновой дуализм материи, принцип неопределенностей Гейзенберга, волновое уравнение Э.Шредингера. Волновая функция. Квантовые числа. Атомная орбиталь. Формы орбиталей.
Химия – это наука о веществах и их превращениях. Она включает несколько фундаментальных учений: теорию строения вещества; учение об энергетике химических процессов и их направлении; учение о скорости протекания процессов и возможности ее регулирования.
Неорганическая химия изучает химические элементы и образуемые ими простые и сложные неорганические вещества, а также процессы, в которых вещества изменяются.
Границы между различными разделами химии, а также между химией и другими естественными науками – физикой, математикой, биологией достаточно условны. Так, например, учение о строении атомов и молекул и законах их движения рассматриваются и в химии, и в физике. Изучаемые биологией процессы жизнедеятельности растительных и животных организмов происходят с участием неорганических и органических веществ.
Современный специалист должен уметь осознать химический характер вставшей перед ним проблемы, сформулировать ее на химическом языке перед специалистом-химиком, и понять смысл решений и рекомендаций, полученных от специалиста-химика.
Основные понятия химии
Атом –нейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химический элемент – определенный вид атомов с одинаковым зарядом ядра. Молекула – наименьшая часть данного вещества, обладающая его свойствами и
способная к самостоятельному существованию.
Моль — количество вещества, содержащее число Авогадро NA= 6,02·1023 структурных единиц (атомов, молекул, ионов).
Молярная масса — масса 1 моля вещества, г/моль.
Простые вещества – вещества, образованные из атомов одного элемента. Простые вещества подразделяются на металлы (например, натрий Na, железо Fe) и неметаллы (например, углерод C, кислород O2).
Сложные вещества, или химические соединения, - вещества, образованные атомами разных элементов. Различают двухэлементные, или бинарные, и многоэлементные сложные вещества.
Кбинарным неорганическим соединениям относят соединения элементов с кислородом - оксиды, галогенами (общее название галогениды, подразделяются на фториды, хлориды, бромиды, иодиды), халькогенами (халькогениды - сульфиды, селениды, теллуриды), пниктогенами (нитриды, фосфиды, арсениды), углеродом (карбиды), кремнием (силициды), водородом (гидриды), а также соединения металлов друг с другом – интерметаллиды.
Кмногоэлементным неорганическим соединениям относят гидроксиды (кислоты и
основания), соли, комплексные соединения.
Химические процессы (или реакции) – процессы превращения одних веществ в другие, отличающиеся от исходных составом и свойствами, но не сопровождающиеся изменениями состава ядер атомов. Все многообразие химических процессов можно свести к двум типам:

обменные реакции, в которых не изменяются степени окисления элементов в соединениях, и окислительно-восстановительные, в которых изменяются степени окисления элементов.
Количественные соотношения между веществами, вступившими в реакцию (реагентами), и веществами, образовавшимися в результате реакции (продуктами), описывают основные (стехиометрические) законы химии.
Основные законы химии
Закон сохранения массы веществ (М.В. Ломоносов, 1756 г., А. Лавуазье, 1777 г.) – масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Закон постоянства состава (Ж. Пруст, 1797 г.) – каждое чистое вещество независимо от способа его получения имеет один и тот же состав и свойства.
Закон полностью справедлив только для веществ, имеющих молекулярную структуру, существующих преимущественно в виде жидкостей и газов.
Большинство неорганических веществ имеет немолекулярное строение, так твердый оксид ванадия (II) может иметь состав от VO0,9 до VO1,3 в зависимости от способа его получения. Эти отклонения были обнаружены Н.С. Курнаковым (1912-1913 г.г.), который назвал вещества, имеющие постоянный состав, дальтонидами, а вещества немолекулярного строения – бертоллидами.
Закон кратных отношений (Д. Дальтон, 1803 г.) – если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, приходящиеся на одно и то же массовое количество другого элемента, относятся как небольшие целые числа.
Например, водород с кислородом образуют два соединения – H2O и H2O2, для воды соотношение H:O составляют 2:16 или 1:8, для пероксида водорода это соотношение равно 2:32 или 1:16.
Закон эквивалентов (И. Рихтер, 1792 г) – химические элементы соединяются между собой в строго определенных массовых соотношениях, соответствующих их эквивалентам.
Эквивалент — это реальная или условная частица вещества, эквивалентная одному атому (или иону) водорода в реакции обмена или одному электрону в окислительновосстановительной реакции.
Эквивалентом химического элемента называют такую его массу, которая соединяется с 1,00 частью массы водорода или 8,00 частями массы кислорода или замещает эти массы в соединениях.
За единицу количества вещества, в котором частицами являются эквиваленты, принят моль эквивалентов вещества. Молярная масса моля эквивалентов вещества обозначается МЭ и выражается в г/моль.
Отношение молярной массы эквивалентов вещества к его собственной молярной массе называется фактором эквивалентности (обозначается обычно f ): f =MMэ 1
Число эквивалентности Z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моле этого вещества.
Фактор эквивалентности f связан с числом эквивалентности Z следующим
соотношением: f = |
1 |
. |
|
Z |
M э=M f = M . |
||
Молярная масса эквивалентов вещества равна |
|||
|
|
|
Z |
Для водорода фактор эквивалентности и число эквивалентности равны единице, молярная масса эквивалентов водорода МЭ, H = 1,00 г/моль.
Для кислорода, исходя из реакции H2 + ½ O2 = H2O, молярная масса эквивалентов MЭ,О = 8,00 г/моль.
Число эквивалентности численно равно абсолютному значению степени окисления
иона.
На основании понятий эквивалентов закон эквивалентов формулируется так: массы реагирующих и образующихся веществ относятся между собой как молярные массы
эквивалентов этих веществ. |
|
Для реакции |
А + В = АВ |
|
mA : mB : mАВ = МЭ, A : МЭ, B: МЭ, АB |
где mA , mB , mАВ - массы веществ А, В, АВ ; МЭ, А, МЭ, В, МЭ, АB - молярные массы эквивалентов веществ А , В, АВ.
Закон объемных отношений (Ж. Гей-Люссак, 1808 г.) – объемы вступающих в реакцию газов и образующихся газообразных продуктов относятся друг к другу как небольшие целые числа.
Закон Авогадро (А. Авогадро, 1811 г.) – в равных объемах различных газов при одинаковых физических условиях (температура, давление) содержится одно и то же число молекул.
Согласно этому закону 1 моль идеального газа при нормальных условиях: температура T =273,15К (или 0◦С), давление p=1,01325∙105 Па (или 760 мм. рт. ст.) занимает объем
V = 22,4 л. Эта физическая постоянная называется молярным объемом газа при нормальных условиях и имеет размерность л/моль.
Строение атома
Атомы являются своеобразными элементарными частицами, из которых состоят все вещества.
Атом перестали считать неделимым на рубеже XIX и XX веков. После открытия естественной радиоактивности, катодных лучей и электрона были предложены первые модели строения атома.
Согласно модели первооткрывателя электрона Дж. Томсона (1903г.) атом представляет собой «сферу положительного электричества одинаковой плотности диаметром примерно 1Ǻ (10 – 10 м), в которой равномерно распределены отрицательные электроны, нейтрализующие положительный заряд».
Экспериментальную проверку этой гипотезы предпринял английский физик Э. Резерфорд. На основании своих опытов по рассеянию α-частиц Резерфорд предложил (1911г.) так называемую «планетарную» модель атома – в центре атома имеется
положительно заряженное ядро, в котором сосредоточена почти вся масса атома, вокруг которого по замкнутым орбитам вращаются электроны. Размеры ядра (10 – 14 м) очень малы по сравнению с размерами атома (10 - 10 м).
Модель давала количественные предсказания, совпадающие с данными спектроскопии, но содержала ряд допущений, противоречивших классической электродинамике.
Главное противоречие заключалось в том, что, двигаясь последовательно от точки к точке своей траектории по орбите, электрон постоянно изменяет направление своего движения, что согласно классической электродинамике должно приводить к излучению энергии, уменьшению радиуса орбиты и падению электрона на ядро за миллионные доли секунды, т.е. атом неустойчив, тогда как атомы являются чрезвычайно устойчивыми образованиями.
Н. Бор (1913 г.) дополнил ядерную модель атома, наложив определенные ограничения на формы движения электрона в атоме, сформулировав их в виде постулатов, - электрон в атоме может находиться только в стационарных состояниях с дискретными значениями энергии, в которых он не излучает и не поглощает энергию, при переходе из одного состояния в другое электрон поглощает или испускает квант энергии. Теория Н. Бора содержала внутренние противоречия, так как с одной стороны она базировалась на законах классической физики (законы Ньютона и Кулона), а с другой стороны использовала
квантовые постулаты (учение Эйнштейна о световых квантах и теорию излучения Планка). В основе современного учения о строении атома лежат представления квантовой
механики о вероятностном характере процессов в микромире и двойственной корпускулярно - волновой природе микрочастиц – любая микрочастица обладает как свойствами частицы (корпускулы), так и свойствами волны.
Впервые эта гипотеза была высказана Л. де Бройлем, который предложил уравнение
для определения длины волны λ микрообъекта: = |
h |
, где h – постоянная Планка |
mv |
(h = 6,63∙10 - 34 Дж∙с), m – масса микрообъекта (для электрона m = 9,1∙10-31 кг), v – скорость. Корпускулярно – волновой дуализм не позволяет указать с одинаковой степенью
точности положение (координату х) и скорость перемещения (или импульс px) микрообъекта, что определяет принцип неопределенностей Гейзенберга:
∆ px ∙ ∆x ≥ 2hπ , где дельта (∆) определяет именно физическую неопределенность, а не
экспериментальную погрешность, что позволяет говорить лишь о вероятности пребывания микрообъекта в некоторой точке пространства.
Э. Шрёдингер (1926 г.) для описания движения электрона в атоме предложил волновое
уравнение, которое носит его имя,: |
|
|
|
|
|
|
|
||
( |
¶ 2ψ |
+ |
¶ 2ψ |
+ |
¶ 2ψ |
) + |
8π 2 m |
(E - U )ψ = 0 |
|
¶ x2 |
¶ y2 |
¶ z 2 |
h2 |
||||||
|
|
|
|
|
|||||
где ψ - волновая функция, x ,y, z – декартовы координаты, m – масса электрона, E – полная энергия, U – потенциальная энергия электрона.
Уравнение Шрёдингера часто записывают в операторной форме Ĥ Ψ = E Ψ,
|
h2 |
æ |
¶ 2 |
|
¶ 2 |
|
¶ 2 |
ö |
|
|||||
где Ĥ – оператор Гамильтона: Ĥ = - |
|
|
|
ç |
|
|
+ |
|
|
+ |
|
|
÷ |
+ U |
|
2 |
|
|
2 |
|
2 |
|
2 |
||||||
|
8π |
ç |
¶ x |
|
¶ y |
|
¶ z |
÷ |
|
|||||
|
|
m è |
|
|
|
|
|
ø |
|
|||||
Решение уравнения Шрёдингера сводится к нахождению волновой функции Ψ и соответствующей ей энергии.
Точное решение уравнения Шредингера возможно только для атома водорода, имеющего единственный электрон.
Волновая функция и энергия электрона могут быть найдены при введении некоторых граничных условий n, l, ml , называемых квантовыми числами, каждое из которых имеет определенный набор разрешенных значений.
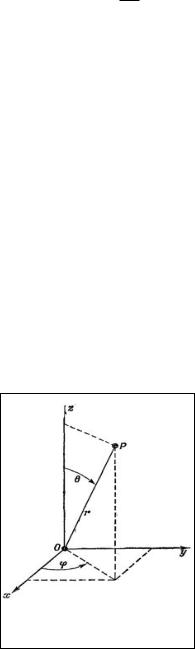
Волновая функция Ψ является функцией пространственных координат (декартовых x, y, z или полярных r, θ, φ) (рис.1), поэтому ее разделяют на три составляющие, каждая из которых зависит только от одной переменной, и при использовании полярных координат электрона она принимает вид:
Ψ(r, θ, φ) = R(r)·Ө(θ)·Φ(φ).
В этом уравнении R(r) является радиальной составляющей, а произведение Ө(θ)·Φ(φ) – угловой составляющей волновой функции.
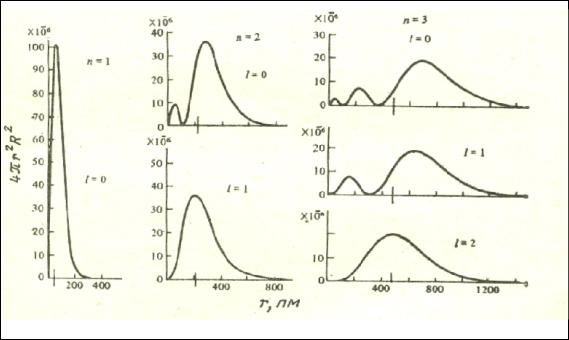
Радиальная составляющей волновой функции характеризует расстояние, на котором вероятность пребывания электрона, определяемая квадратом волновой функции Ψ 2 , максимальна (рис.2).
Наличие нескольких разных по величине максимумов на кривой при n > 1 указывает на некоторую вероятность пребывания электрона и на более близких к ядру расстояниях.
Угловая составляющая волновой определяет форму электронного облака и его
ориентацию в пространстве, она зависит от главного квантового числа n.
Решение, найденное для конкретного набора n, l и ml , называется собственной волновой функцией и соответствует одной атомной орбитали. Ее геометрический образ, представляющий некоторый объем пространства, в котором вероятность пребывания электрона, характеризуемая квадратом волновой функции Ψ 2 , максимальна, также называют атомной орбиталью.
Рис.2. Радиальная составляющая волновой функции Ψ для различных значений n и l
Квантовые числа
Главное квантовое число n может принимать значения ряда натуральных чисел от единицы до бесконечности: 1, 2, 3, …, ∞. Самое низкое значение энергии электрона в атоме водорода (отрицательное по знаку и наибольшее по абсолютному значению) отвечает значению n =1 и составляет E1= - 1312 кДж/моль = - 13,6 эВ. Далее с увеличением значения
n энергия каждого уровня возрастает, при n = ∞ электрон уже не связан с атомом и может
иметь любое значение кинетической энергии.
Главное квантовое число определяет:
•допустимые дискретные значения энергии электрона;
•количество значений энергии (или энергетических уровней);
•количество энергетических подуровней данного уровня;
•размер орбитали, чем больше n, тем более удален электрон от ядра, при этом удаление электрона не меняет формы геометрического образа орбитали;
•в периодической системе элементов соответствует номеру периода, в котором находится химический элемент.
Вмногоэлектронных атомах энергетический уровень с определенным значением
главного квантового числа имеет специальное буквенное обозначение:
первый энергетический уровень соответствует значению n = 1 и обозначается K; второй энергетический уровень соответствует значению n = 2 и обозначается L; третий энергетический уровень соответствует значению n = 3 и обозначается M; четвертый энергетический уровень соответствует значению n = 4 и обозначается N и т.д.
Орбитальное квантовое число l принимает значения, зависящие от величины главного квантового числа n : 0, 1, 2, 3, . . ., (n – 1).

Общее количество значений, принимаемых l , равно n.
Например, при n = 2 орбитальное квантовое число l принимает два значения: 0 и 1.
Орбитальное квантовое число l определяет
•орбитальный угловой момент электрона;
•значение энергии электрона в многоэлектронном атоме, т. е. энергию подуровня;
•форму атомной орбитали.
Числовым значениям l приписывается буквенное обозначение: |
|
|
|||
Числовое значение l |
0 |
1 |
2 |
3 |
4 |
Буквенное обозначение l |
s |
p |
d |
f |
g |
Для орбиталей с l ≥ 0 имеется (2 l + 1) способов, которыми орбиталь данной формы может быть ориентирована в пространстве. При l = 0 — один способ ориентации; при l =1 — три способа и т.д.
В отсутствие магнитного поля все орбитали с одинаковым значением l вырождены, т.е. неразличимы по энергии. Наложение магнитного поля снимает вырождение орбиталей одинаковой формы. В этом случае значения углового момента будут различными вдоль разных осей, что соответствует разной ориентации одинаковых по форме орбиталей в пространстве. Число таких ориентаций во внешнем поле определяет магнитное квантовое число.
Магнитное квантовое число ml принимает значения, зависящие от значения орбитального квантового числа l: { -l, -( l -1), -(l –2), ..., -1, 0, +1, +2, . . ., +l }. Общее количество значений ml равно (2 l + 1).
Магнитное квантовое число определяет:
•ориентацию орбитали в пространстве;
•количество орбиталей с данным значением l, равное (2 l + 1). Следовательно, для l = 1 имеется три значения ml = -1, 0, +1 и возможны три способа
ориентации p – орбиталей вдоль осей x , y, z соответственно обозначаемых px,, py, pz . Для описания атома водорода достаточно трех квантовых чисел, для
многоэлектронного атома необходимо ввести четвертое квантовое число - спиновое квантовое число (спин) ms, поскольку электрон обладает собственным магнитным моментом, который квантуется параллельно или противоположно направлению магнитного поля.
|
Магнитный момент электрона определяется выражением |
μ = 2,00 |
s(s + 1) , |
|||||
где s = ∑ms. |
Разрешенные значения спинового квантового числа |
ms = |
1 |
или |
||||
|
−1 |
|
|
|
|
|
2 |
|
ms = |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
В табл. 1 приведены значения квантовых чисел, обозначения соответствующих им |
|||||||
атомных орбиталей и их количество для различных состояний атома водорода. |
|
|||||||
|
|
Таблица 1. Квантовые состояния электрона в атоме водорода |
||||||
|
Квантовые числа |
|
|
|
Атомные орбитали |
|||
n |
l |
ml |
|
ms |
обозначение |
|
количество |
|
|
|
Стабильное состояние атома водорода |
|
|
||||
1 |
0 |
0 |
+½ |
или - ½ |
|
1s |
|
одна |
|
|
Возбужденные состояния атома водорода |
|
|
||||
2 |
0 |
0 |
+½ |
или - ½ |
|
2s |
|
одна |
1 |
-1, 0, +1 |
+½ |
или - ½ |
|
2p |
|
три |
|
|
|
|
||||||
|
0 |
0 |
+½ |
или - ½ |
|
3s |
|
одна |
3 |
1 |
-1, 0, +1 |
+½ |
или - ½ |
|
3p |
|
три |
|
2 |
-2, -1, 0, +1, +2 |
+½ |
или - ½ |
|
3d |
|
пять |
|
0 |
0 |
+½ |
или - ½ |
4s |
одна |
|
4 |
1 |
-1, 0, +1 |
+½ |
или - ½ |
4p |
три |
|
2 |
-2, -1, 0, +1, +2 |
+½ |
или - ½ |
4d |
пять |
||
|
|||||||
|
3 |
-3, -2, -1, 0, +1, +2, +3 |
+½ |
или - ½ |
4f |
семь |
Электронная конфигурация атома водорода в основном, или стабильном, состоянии выражается формулой 1s1, которой отвечает набор квантовых чисел {1, 0, 0, +½ } или {1, 0, 0, -½ }. Ее можно также изобразить в виде электронно-графической диаграммы (или квантовой ячейки по Хунду), в которой орбиталь изображается квадратом, а электрон – стрелкой, направление которой условно указывает значение спина:
H: 1s1 или
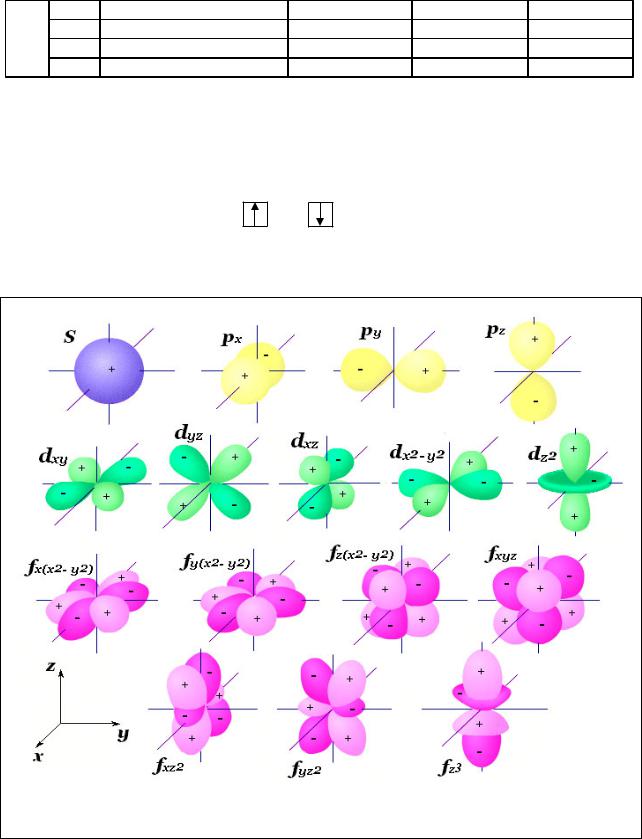
На рис. 3 представлены формы s - , p - , d - , f – орбиталей.
Рис. 3. Форма орбиталей
