
Борман Физическая кинетика атомных процессов в наноструктурах 2011
.pdfПодстановка выражения (7.10) в (7.9) и использование (7.8) дает уравнение движения параметра порядка
|
ξ = λξ + Bξ2 −Γξ3 , |
|
|
|
|
(7.11) |
|||||||
где |
|
|
|
|
|
|
|
−θc ) + θ |
|
−θc |
|
||
λ = A(T)[(E |
a |
/ E |
)(θ |
a |
v |
], |
|||||||
|
|
|
|
v |
|
a |
|
v |
|
||||
B = A(T)[(αEv0 / ΒEa) +1]−1/2, Γ = 2A(T)[1+ (αEv0 / ΒEa)]−1, |
|||||||||||||
|
ΒγE |
a |
(E |
v |
/ T)2 exp(−E0 |
/ T) |
|
|
|||||
A(T) = |
|
|
|
|
|
|
v |
|
. |
||||
|
αEv0[1+ (γEa / κT)] |
|
|||||||||||
|
|
|
|
|
|||||||||
Уравнение (7.11) является уравнением типа Ландау−Гинзбурга, которое используется для описания фазовых переходов первого рода [22, 23]. Поэтому можно сделать вывод, что развитие нестабильности в системе с поверхностными атомами, взаимодействующими с кислородом, происходит как фазовый переход первого рода, сопровождающийся образованием поверхностного оксида. Необходимо отметить, что описание образования оксида на поверхности большинства металлов и полупроводников как фазовый переход первого рода экспериментально подтверждено в ряде работ [4, 8, 14]. Параметром, измеряемым во время эксперимента по началу окисления, является степень покрытия оксидом θок .
Известно [9], что фазовый переход первого рода происходит через образование зародышей новой фазы конечного размера. Для рассмотрения роста зародышей оксида конечного размера уравнение для параметра порядка (7.11) необходимо записать с учетом диффузионных компонент, входящих в (7.1). В методе функционала плотности это соответствует проведению разложения амплиту-
ды моды плотности δn(k, ω) , входящей в функционал вблизи значений kG ≈ kKc = 0 , в ряд по векторам kG. Для уравнений (7.1) это соответствует учету в уравнении (7.11) дополнительного слагаемо-
го D ξ , D =[D + D (αθc |
/ Β2][1+ (αθc |
/ Β)2]−1 |
в правой стороне |
v ок a |
a |
|
|
(7.11). На начальной стадии окисления, когда можно пренебречь взаимодействием островков оксида друг с другом и их перекрыти-
201
ем, степень покрытия связана со средним радиусом островка соотношением:
θ |
ок |
= πNR2 |
, |
(7.12) |
|
|
|
|
где N – плотность островков [14]. Уравнение роста островка можно получить из уравнения для параметра порядка (7.11) с учетом до-
полнительного слагаемого DΔξ [23]. Следуя процедуре, пред-
ложенной в [23], и используя (7.11), уравнение, описывающее рост островков оксида, можно записать в виде:
|
R = 2D(1/ R −1/ R), |
|
|
(7.13) |
|||
|
|
|
|
c |
|
|
|
где R ={D |
/ Ψ}1/2Ψ[3(Ψ−| λ |)]−1 |
и Ψ = 2B2 /(9Γ). |
|||||
c |
|
|
|
|
|
|
|
Выражение для критического радиуса |
Rc |
может быть транс- |
|||||
формировано в традиционную форму [13, 14, 22]: |
|||||||
|
Rc = |
|
|
W |
|
. |
(7.14) |
|
s |
f |
|
|
|||
|
(θa |
−θa |
+ θvEv / Ea) |
|
|||
Здесь W выражается через коэффициенты B и Γ уравнения
(7.11) и могут быть связаны с коэффициентом поверхностного натяжения оксида. Оказывается, что (7.14) формально согласуется с аналогичным уравнением, полученным в [14]. Однако параметры (7.14) не являются феноменологическими, они выражены через параметры исходных кинетических уравнений (7.1). Другое более важное различие состоит в том, что выражение (7.14) включает
член θvEv / Ea , вызывающий быстрое образование оксида вблизи границы зародышеобразования. В самом деле, θv возрастает при
θa → θca(T) = Ev0 / EA(T) (7.2), сопровождая уменьшение Rc (7.14), что приводит к увеличению скорости окисления (7.13).
Это обстоятельство проявляется более явно вблизи θas = θaf . В
этой точке пересыщение (~ θas −θaf ) стремится к нулю, что
приводит к бесконечному критическому радиусу, делая формирование оксида невозможным [10, 13, 14]. Наоборот, член
θvEv  Ea , отвечающий вакансионной неустойчивости, аномально
Ea , отвечающий вакансионной неустойчивости, аномально
202
возрастает при достижении критического значения θa = θca , что приводит к уменьшению Rc и одновременному образованию
оксида.
Из этого следует, что в принципе можно явно наблюдать вакансионную нестабильность на разумном временном периоде,
если проводить измерения вблизи θas = θaf . Однако критическое
давление для окисления металла составляет всего 10−10 Тор [24] при не слишком высоких температурах, тогда как эксперименты по
окислению проводятся при давлении кислорода >10−8 Тор [4, 5, 10, 12, 18]. Таким образом, найти какие-либо заметные экспериментальные результаты, описывающие неустойчивость в металлических системах, не представляется возможным. В то же время, критическое давление кислорода для окисления кремния со-
ставляет [25] около 10−7 −10−6 Тор при T = 700 −800 °C . Поэтому
можно ожидать, что система O-Si обеспечивает условия для наблюдения нестабильности. Необходимо отметить, что образование вакансий, взаимодействующих с кислородом на поверхности кремния, наблюдались недавно с помощью СТМ при 600 °C [26] и
500 −600 °C [27]. Эти наблюдения были объяснены [26], осно-
вываясь на модели окисления, вызванного вакансиями. Кинетические особенности во время начального окисления
кремния, которые могут быть вызваны вакансионной неустойчивостью, обнаружены в [18]. Было установлено, что при высоких температурах ( ≥ 700 °C ) адсорбция кислорода сильно подавлена
при экспозициях ниже 300L, а затем резко возрастает при более высоких экспозициях. При более низких температурах наблюдается режим «нормального» окисления без временной задержки в образовании оксида и без резкого возрастания поглощения кислорода. Этот результат можно объяснить в рамках механизма, предложенного выше. При 700 °C окисление происходит вблизи
критических условий ( p → pc), тогда как при T < 700° – нет (чем меньше температура, тем меньше критическое давление [9]).
203
Действительно из уравнений (7.1) следует, что на начальных стадиях окисления, когда концентрация вакансий θv << θv , концентрации всех дефектов линейно растут с течением времени
|
|
|
|
|
αθ |
(0) |
|
|
≈ γθ (0)t, |
здесь θ0 |
|
θ |
|
≈ Q t = ε, θ |
|
≈ |
V |
|
ε, θ |
|
− равновесная |
||
|
|
Β |
|
|
|||||||
|
a |
a |
ок |
|
|
|
v |
V |
V |
|
концентрация вакансий без учета их взаимодействия друг с другом и с адатомами. При этом режиме концентрация оксида пропорциональна экспозиции ε и мала по сравнению с концентрацией адато-
|
|
|
αθ (0) |
|
θ |
(0) |
|
мов кислорода θ |
ок |
≈ |
V |
ε ~ |
V |
|
ε << ε. Этот режим накопления |
|
|
|
|||||
|
|
Β |
|
θ0 |
|||
|
|
|
|
||||
резко меняется при достижении концентрацей адатомов критического значения: θa = θсa . Из (7.3) следует, что в этом случае скорость нарастания концентрации вакансий δθv ≈ 0 , при этом концентрация адатомов кислорода θa ~ ε , а концентрация оксида
|
αθ |
|
θ |
|
θок ≈ |
V |
ε ~ |
V |
ε ~ ε. Это означает, что при достижении крити- |
|
|
|||
|
Β |
|
θ0 |
|
ческого значения концентрации адатомов реализуется режим непосредственной накачки кислорода из газовой фазы в оксидное со-
стояние, как бы минуя фазу адатомов. Таким образом, при θas < θaf
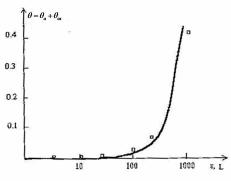
образование оксида сильно подавлено. При этом происходит адсорбция кислорода, сопровожаюшаяся ростом концентрации вакансии (см. (7.1), (7.2), (7.3)). Когда концентрация адатомов достигает критического значения (критическая экспозиция), определяемого соотношеним (7.3), происходит спонтанное формирование вакансий, что приводит к резкому образованию оксида. Этот процесс показан на рис. 7.2.
Сплошная линия отвечает зависимости степени покрытия поверхности кислородом от экспозиции ε (как в эксперименте) θ = θa + θок , где θa вычислено из (7.1), пренебрегая образованием
оксида. Такое приближение оправдано при экспозициях меньших критической; θок вычислено на основе (7.12), (7.13) и (7.14)
204
учитывая, |
что |
E |
0 =1,5 , |
|
|
||
|
|
|
|
v |
|
|
|
Uvv = 0, 3 , |
Uav = 0,5 эВ |
|
|
||||
[28]. |
Все |
необходимые |
|
|
|||
параметры были взяты из |
|
|
|||||
работы [8]. |
|
|
|
|
|
||
Предложенная |
|
модель |
|
|
|||
позволяет |
описать |
лишь |
|
|
|||
начальную |
стадию |
окис- |
|
|
|||
ления, поскольку: |
Ландау− |
|
|
||||
1) разложение |
Рис. 7.2. Кинетика начала окисления |
||||||
Гинзбурга |
справедливо |
Si(111) |
при T = 700 °С . Зависимость |
||||
только |
вблизи |
критиче- |
степени |
покрытия поверхности кисло- |
|||
ской точки [22], |
|
|
|||||
|
|
родом от экспозиции ε. Точки – экспе- |
|||||
2) нельзя использовать |
|||||||
риментальные данные из работы [18]. |
|||||||
линейный |
анализ |
(7.3) |
Сплошная линия – теоретическая зави- |
||||
вдали |
от |
критической |
симость, описанная в тексте |
||||
точки [8, 14]. |
|
|
|
|
|||
Развитая модель неприменима, когда оксидная фаза растет в условиях взаимодейсивия в системе зародышей оксида (островков). Для описания окисления в этом режиме, когда взаимодействием островков нельзя пренебречь, необходимо рассмотреть островки оксида, их взаимодействие, поток адатомов на островок и образование вакансий вблизи периметра островка [14] вместо квазихимических реакций типа (7.1).
7.2. Рост субмонослойного оксида вблизи порога зародышеобразования. Взаимодействие островков
Феноменологическая модель образования островков при окислении
Как уже было отмечено выше, а также в работах [10, 13, 14], что образование оксида на поверхности при субмонослойных покрытиях сопровождается образованием островков оксидной фазы. Результаты экспериментов показывают, что критическая концентра-
ция θc , θc = θaf −θvEv / Ea , при которой начинается образование
205

оксида, близка к единице (θc =0,35−0,70). Поэтому можно считать, что рост островков происходит в условиях малого пересыщения
θ−θс <<1, θ <1 . Эти обстоятельства свидетельствуют о том, что |
|
θс |
|
для описания роста островков оксида можно применить феноменологическую теорию Фолмера−Вебера−Зельдовича фазового перехода первого рода (ФП1) [3, 7], считая критическую концентрацию θc феноменологическим параметром, значение которого определя-
ется экспериментально. Согласно представлениям, развитым в [10, 13, 14], образование субмонослойного оксида происходит путем 2D-роста островков [28, 29]. Нормальный рост островков оксида можно не учитывать, так как коэффициент прилипания кислорода к поверхности SiO2 на три порядка меньше, чем для чистой поверх-
ности Si (100).
В рамках феноменологической теории рост островков оксидной фазы состоит из двух стадий. Первая связана с доставкой кислорода к периметру растущего островка оксида за счет поверхностной диффузии. На второй стадии происходит собственно фазовое превращение – переход продиффундировавших к островку адатомов кислорода в новое (оксидное) фазовое состояние. Если время фазового превращения на границе островка мало по сравнению с временем доставки кислорода, то вокруг островка радиусом R устанавливается равновесная концентрация адатомов [22]:
|
|
|
ρ |
|
|
σ Ω |
a |
|
|
|
С(r = R) = CR |
= CП 1 |
+ |
|
|
; |
ρ= |
|
. |
(7.15) |
|
|
T |
|
||||||||
|
|
|
R |
|
|
|
|
|
||
Здесь СП – равновесная концентрация адсорбированного кислорода в случае плоской границы раздела фаз; σ – энергия, приходящаяся на единицу длины границы островка (коэффициент линейного натяжения); Ωa – площадь, приходящаяся на один адатом; Т – тем-
пература; r – координата в цилиндрической системе координат с центром, совпадающим с центром островка. Совершенно иная ситуация имеет место, когда время фазового превращения может быть сравнимо (либо больше) со временем доставки кислорода. Этот случай может иметь место, например, когда образование оксидной фазы сопровождается структурными изменениями в припо-
206
верхностном слое атомов подложки. Равновесие вокруг островка в этом случае не устанавливается и вводится понятие неравновесной
концентрации адатомов на границе островка C′:
C′ = С(r = R) . |
(7.16) |
Рассмотрим общий случай с произвольным соотношением времени доставки и фазового превращения. Рост образовавшихся островков оксида определяется потоками кислорода к периметру островка в результате поверхностной диффузии ( j1) и прямого попа-
дания из газовой фазы ( j2 ) . Поскольку коэффициент прилипания
кислорода, приходящего из газовой фазы, к поверхности оксида Sок обычно мал по сравнению с коэффициентом прилипания S к чистой поверхности металла, то островки растут латерально лишь за счет присоединения атомов кислорода по периметру (например, при Т = 300 К для никеля Sок/S ≤ 10−3, для железа Sок/S ≤ 10−2). Скорость роста R цилиндрических островков имеет вид
R = Ω |
0 |
( j + j |
2 |
). |
(7.17) |
|
1 |
|
|
||
где Ω0 – площадь, приходящаяся на атом кислорода в оксиде. |
|||||
Для определения диффузионного потока |
j1 найдем концентра- |
||||
цию адатомов кислорода C(r) вокруг островка. На ранних стадиях образования оксидной фазы, когда расстояния между островками много больше диффузной длины адатомов, можно считать, что островки растут изолировано друг от друга. В этом случае величина С(r) определяется потоками адатомов только на данный островок. Изменение концентрации адатомов на поверхности описывается уравнением:
|
|
С = D C − 1 C + QS . |
(7.18) |
Здесь D – |
τ |
|
|
коэффициент поверхностной диффузии |
адатомов; |
||
τ = |
1 |
– время жизни адатома на поверхности, α – частота |
|
α + ΩSQ |
|||
ухода адатома кислорода с поверхности в результате диффузии внутрь образца и (или) десорбции. В общем случае величина α ≈ ε ns(t). Однако вдали от порога зародышеобразования (ПЗО),
207

ns = ns0 и, следовательно, α – величина постоянная. Q – постоянный поток кислорода из газа на поверхность, равный
Q = p / (2πmT )1/2 , |
(7.19) |
где m – масса молекулы, р – давление; Т – температура. Далее будем полагать, что время роста макроскопических островков велико по сравнению с временем диффузии адатомов. Поэтому концентрация адатомов вблизи островка определяется из квазистационарного решения уравнения .(7.18) с граничными условиями: (7.16) и С(r → ∞) < ∞ (означающее конечное значение концентрации ада-
томов на больших расстояниях от островка) и равна:
|
|
|
|
|
K |
(r L) |
|
||
С(r) = С −(С −С/ ) |
|
||||||||
|
0 |
|
. |
(7.20) |
|||||
K |
0 |
(R L) |
|||||||
|
|
|
|
|
|
|
|
|
|
Здесь L ≡ (D τ)1/2 – характерная длина диффузии за время жизни адатома на поверхности; Ki (x) – функция Макдональда i-го по-
рядка; С – концентрация на больших расстояниях от островка, равная, исходя из (7.18):
С |
= QSτ. |
(7.21) |
Используя решение (7.21), легко определить поток адсорбированного кислорода к границе островка:
j1 = D |
∂C |
|
|
= |
D ( |
|
−С/ ) |
K1 |
(R L) |
. |
(7.22) |
|
|||||||||||
|
|
С |
|||||||||
|
|
|
|
|
|||||||
|
∂r |
|
r=R |
|
L |
|
|
K0 (R L) |
|
||
|
|
|
|
||||||||
Поток кислорода на периметр островка, учитывающий прямой захват кислорода из газовой фазы, имеет вид:
j2 =[QS (1−ΩaC′)−αC′] A. |
(7.23) |
Здесь A – расстояние от границы островка, на которое происходит прямой захват, S – коэффициент прилипания кислорода вблизи
островка. Слагаемое αC′ описывает уход кислорода с границы поверхности островка.
Процессу перехода адатомов кислорода в новую фазу на границе островка отвечает поток j3 . Будем считать, следуя [9], что этот
поток пропорционален разнице концентраций непосредственно окружающих зародыш адатомов кислорода C′ и равновесной CR :
208

j3 = ϑ(C′ −CR ) , |
(7.24) |
где ϑ – скорость перехода адатома кислорода в островок оксида. Стационарная концентрация адатомов C′ определяется из условия непрерывности потока:
j3 = j1 + j2 . |
(7.25) |
Подставляя в (7.25) выражения для потоков (7.22)−(7.24), получим следующее выражения для концентрации C′ :
|
|
|
|
|
|
D |
|
K1 |
(R L) |
|
|
|
|
||
|
ϑСR +С |
+ QSA |
|
|
|||||||||||
С/ = |
|
L K0 |
(R L) |
. |
(7.26) |
||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
A |
||||||
|
|
D K |
(R L) |
|
|
||||||||||
|
ϑ+ |
|
|
1 |
|
+ |
|
|
|
|
|||||
L |
K0 |
(R L) |
τ−1 |
|
|
||||||||||
Из (7.26) видно, что в случае малых времен фазового превращения (ϑ → ∞) концентрация адатомов на границе островка стремится к
равновесному значению (7.16): C′ → CR .
Используя выражения для потоков j1, j2 ((7.22), (7.23)) и вы-
численное значение неравновесной концентрации C′ (7.26), получим, учитывая (7.15), следующее выражение для скорости роста изолированного островка:
|
|
|
|
|
|
|
K |
|
|
(R L) |
|
1 |
|
|
|
1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||||||||||
|
R = β−1 |
Q |
+ D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
. |
|
(7.27) |
|||||
|
|
|
|
|
|
(R L) |
R |
R |
|
|||||||||||||||||||
|
|
|
|
|
0 K |
0 |
|
|
|
|
|
|||||||||||||||||
Здесь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
||||||
|
|
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = Ω ρС |
D |
A |
|
|
|||||||
D |
≡ Ω ρС |
|
; |
Q ≡ Ω ρС |
|
|
|
; |
(7.28) |
|||||||||||||||||||
П L |
|
|
|
|
||||||||||||||||||||||||
0 |
0 |
|
|
|
|
|
|
|
0 |
|
|
|
П τ |
|
|
|
0 |
|
|
П L L |
|
|
||||||
|
β−1 = |
|
|
|
|
|
|
ϑ |
|
|
|
|
|
|
|
; |
|
|
|
|
|
(7.29) |
||||||
|
ϑ+ A |
+ |
|
D K1 (R L) |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
τ |
|
|
|
|
L |
|
K0 (R L) |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
R = |
|
|
ρСП |
. |
|
|
|
|
|
|
|
|
|
|
(7.30) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
c |
|
С |
−С |
П |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Из (7.27) видно, что при размере островка, большем величины Rc ,
будет происходить рост островка (R > 0) , а при R < Rc – его рас-
209

пад (R < 0) , т.е. величина Rc (7.30) представляет собой критический размер островка оксида.
Наличие коэффициента β−1 в (7.27) связано с конечным време-
нем фазового превращения. Этот коэффициент равен отношению скорости перехода адатомов в островок (ϑ) к скорости ухода ки-
слорода с границы островка по всем механизмам. Когда скорость
перехода |
в островок превышает |
скорости ухода (т.е. |
||||||
ϑ >> D |
K1 |
(R L) |
, αA, ASQΩa), то согласно (7.29) имеем β−1 →1, |
|||||
|
|
|||||||
L K0 |
(R L) |
|
|
|
|
|
||
что отвечает классической постановке задачи [9]. |
(R L) |
|||||||
|
|
|
|
|
K1 |
|||
Соотношение первого (Q) и второго D |
|
|
слагаемо- |
|||||
|
|
|
|
|
0 |
K0 |
|
|
|
|
|
|
|
|
(R L) |
||
го в (7.27) равняется отношению потоков прямого попадания ( j2)
|
|
|
j |
2 |
=Q D |
K |
(R L) |
|
K |
0 |
(R L) |
|
A |
|
и диффузионного потока |
( j ) |
|
|
1 |
|
= |
|
|
|
|
||||
|
1 |
|
j1 |
|
K0 |
(R L) |
|
K1 (R L) L |
||||||
и определяет механизм доставки кислорода к растущему островку
оксида. При |
L |
K1 |
(R L) |
>> A |
рост островка происходит путем |
|
|
(R L) |
|||||
|
|
K |
0 |
|
|
|
|
|
|
|
|
|
|
диффузионной доставки кислорода, а в обратном предельном случае островок растет за счет прямого попадания кислорода из газовой фазы на его периметр.
Для того чтобы происходил рост островков оксида, необходимо
чтобы текущее значение концентрации адатомов C превышало критическое значение CП . (При C < CП согласно (7.27) всегда
R < 0 , т.е. возникающий флуктуационным образом зародыш оксидной фазы любого размера в любом случае будет распадаться.)
Концентрация адатомов на поверхности C определяется потоком кислорода из газовой фазы и скоростью ухода адатомов с поверх-
ности. Приравняв выражения для концентрации C (7.21) значению CП и учитывая (7.19), получим выражение для критического давления:
210
