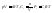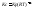- •3. Связь периодич. Закона со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •4. Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •7. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11.Полярность связи. Полярность молекул и дипольный момент.
- •12. Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •21.Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •23.Изотерма химической реакции. Стандартное изменение свободной энергии.
- •25.Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •27.Скорость химической реакции. Закон действующих масс. Физический смысл константы скорости.
21.Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
∆G – Энергия Гиббса(T и p – const), ∆F – Энергия Гельмгольца(V и T – const) Две противоположные тенденции процессов - ∆H – изменение энтальпии и ∆S – изменение энтропии - не могут быть критериями самопроизвольного протекания процесса. Для изобарно-изотермических процессов их объединяет функция, называемая Энергией Гиббса: ∆G=∆H−T∆S; ∆G=−A
∆G<0, процесс самопроизвольный ∆G=0, динамическое равновесие
∆G>0, прямой процесс невозможен, возможен только обратный
Энергия Гельмгольца – характеризует предел и направление самопроизвольного течения химической реакции при изохорно-изотермических условиях, которое возможно при соблюдении неравенства deltaF < 0 ∆F=∆U−T∆S
22. Условия самопроизвольного протекания химических реакций.
В химических системах вещества стремятся к минимуму внутренней энергии. Экзотермические реакции протекают самопроизвольно, так как вещества при их окончании достигают своего минимума внутренней энергии. Но также самопроизвольно протекают и эндотермические реакции - это растворение солей. Макросостояние системы тем более вероятно, чем большим числом микросостояний оно может быть описано. Условия самопроизвольного протекания реакций: 1. стремление системы к достижению минимального значения внутренней энергии 2. стремление системы к более вероятному своему состоянию. Но часто происходит столкновение этих двух определяющих факторов, и возникает состояние, называемое химическим равновесием. Функция, которая учитывает оба этих фактора – энергия Гиббса. Самопроизвольно протекают те процессы, энергия Гиббса которых равна отрицательному значению. Если температура мала, то энтальпия равна энергии Гиббса и самопроизвольно протекают экзотермические реакции. Если высокая температура, то отрицательное значение имеет энергия Гиббса и реакции протекают самопроизвольно. Необратимые реакции протекают до полного израсходования одного из реагентов. Обратимые протекают во взаимопротивоположных направлениях. В состоянии химического равновесия система достигает своего минимального значения энергии и энергия Гиббса, как и константа химического равновесия, равна нулю.
23.Изотерма химической реакции. Стандартное изменение свободной энергии.
Для
реакции, протекающей в изобарно-изотермическихусловиях, в некотором неравновесном
исходном состоянииэнергии
Гиббсаилихимические
потенциалыреагирующих веществ и
продуктов реакции в общем случае не
одинаковы, их разность (ΔGT)
может быть рассчитана по уравнению:
![]() где
где![]() —
отношение парциальных давлений
участников реакции в исходном состоянии
в степенях, равных их стехиометрическим
коэффициентам; R —универсальная
газовая постоянная. Это уравнение
называютуравнением
изотермы химической реакции.
Оно позволяет рассчитать изменение
энергии Гиббса при протекании процесса
и определить направление протекания
реакции: при
—
отношение парциальных давлений
участников реакции в исходном состоянии
в степенях, равных их стехиометрическим
коэффициентам; R —универсальная
газовая постоянная. Это уравнение
называютуравнением
изотермы химической реакции.
Оно позволяет рассчитать изменение
энергии Гиббса при протекании процесса
и определить направление протекания
реакции: при
![]()
![]() —
реакция идёт в прямом направлении,
слева направо; при
—
реакция идёт в прямом направлении,
слева направо; при![]()
![]() —
реакция достигла равновесного состояния;
при
—
реакция достигла равновесного состояния;
при![]()
![]() —
реакция идёт в обратном направлении.
константа равновесия может быть
рассчитана по уравнению:
—
реакция идёт в обратном направлении.
константа равновесия может быть
рассчитана по уравнению:![]()
24.
Константа химического равновесия.
Различные способы выражения констант
равновесия. Соотношение между константами.
Рассмотрим
гомогенную химическую реакцию:
 Реакции протекают до полного исчезновения
исходных веществ, а останавливаются
при достижении определенного состояния
равновесия. Условия химического
равновесия:
Реакции протекают до полного исчезновения
исходных веществ, а останавливаются
при достижении определенного состояния
равновесия. Условия химического
равновесия: Равновесные
давления участников реакции:
Равновесные
давления участников реакции:
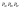 Согласно закону действующих масс
Согласно закону действующих масс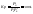
 константа
равновесия, выраженная через парциальные
давления.
Размерность
константа
равновесия, выраженная через парциальные
давления.
Размерность
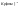 .
.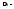 изменение числа молей при протекании
реакции.При написании констант равновесия
гетерогенных реакции учитываются
парциальные давления только газообразных
участников реакций, поскольку давления
пара конденсированных фаз малы по
сравнению с газообразными компонентами.
Пример.
изменение числа молей при протекании
реакции.При написании констант равновесия
гетерогенных реакции учитываются
парциальные давления только газообразных
участников реакций, поскольку давления
пара конденсированных фаз малы по
сравнению с газообразными компонентами.
Пример.
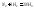

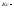 константа
равновесия, выраженная через концентрации.
константа
равновесия, выраженная через концентрации.
 Кроме
того существуют
Кроме
того существуют
 где а-активности, н-мольная доля.
Соотношения между константами равновесия:
где а-активности, н-мольная доля.
Соотношения между константами равновесия: