
- •3. Связь периодич. Закона со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •4. Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •7. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11.Полярность связи. Полярность молекул и дипольный момент.
- •12. Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •21.Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •23.Изотерма химической реакции. Стандартное изменение свободной энергии.
- •25.Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •27.Скорость химической реакции. Закон действующих масс. Физический смысл константы скорости.
11.Полярность связи. Полярность молекул и дипольный момент.
Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи. Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда). Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны. Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы. Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.
12. Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора. Если одна из двух молекул имеет атом со свободными орбиталями, а другая атом с прой неопределенных электронов, то мнежду ними возникает Д-А взаимодействие.
Комплексное соединение – сложные соединения, у которых имеются ковалентные связи, образованные по ДАМ . Рассмотрим пример [Cu(NH3)4]SO4. Cu-комплексообразователь, 4-координационное число. ( )- внутренняя сфера, [ ]-внешняя сфера, NH3-лиганды.
Координационное число для комплексного соединения имеет тот же смысл, что валентность в обычных соединениях. Принимает значения от 1-12 (кроме 10 и 11).
13. Межмолекулярное взаимодействие. Водородная связь.
Водородная связь — вид химической связи между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом (в составе той же молекулы или в другой молекуле). Обычно изображается точками или пунктиром на структурных схемах. Водородная связь по прочности превосходит вандерваальсово взаимодействие, и ее энергия составляет 8—40 кДж/моль. Однако она обычно на порядок слабее ковалентной связи. Водородная связь характерна для соединений водорода с наиболее электроотрицательными элементами: фтора, кислорода, азота, хлора и серы. Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах. Молекула воды образует четыре водородные связи, чем объясняются особенности строения воды и льда, а также многие аномальные свойства воды: 1) макс. плотность при температуре +4 2) вода обладает наибольшей теплоемкостью из известных жидкостей. При нагреве воды значительная часть энергии затрачивается на разрыв связей, отсюда и повышенная теплоемкость. Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия. Различают ориентационное, индукционное и дисперсионное взаимодействия. Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие.Энергиятакого взаимодействия обратно пропорциональна кубу расстояния между диполями.Дисперсионное притяжение (лондоновские силы). Взаимодействие между мгновенным и наведенным диполем. При сближении молекул ориентация микродиполей перестает быть независимой и их появление и исчезновение в разных молекулах происходит в такт друг другу. Синхронное появление и исчезновение микродиполей разных молекул сопровождается их притяжением. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная молекула деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной молекулы. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
14. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
Система
- это тело или группа тел, находящиеся
во взаимодействии, которые мысленно
выделены из окружающей среды. Бывают
гомогенными (однородные) и гетерогенными
(неоднородные).Изолированная
система не имеет обмена веществ и
энергий с окружающей средой.
Закрытая
– не имеет только массообмена (необратимый
перенос массы компонента смеси в
пределах одной или неск. фаз).
Открытая
– имеет и энерго- и массообмен.Фаза
- совокупность всех гомогенных частей
системы, одинаковых по составу и всем
физ. и хим. свойствам, не зависящим от
количества вещества. Фазы отделены
друг от друга поверхностями раздела,
на которых все свойства фазы резко
скачком меняются.
Компоненты
– составные части системы, химически
индивидуальные вещества, составляющие
данную систему и способные к
самостоятельному существованию, будучи
изолированными от других частей системы.
Состояние
системы определяется набором переменных
величин - параметров.
Различают параметры интенсивные и
экстенсивные. Интенсивные - не зависят
от массы или числа частиц в-ва. (P,T), а
экстенсивные - зависят (V, E).
Функции
состояния - это термодинамические
функции, значения которых зависят
только от состояния системы и не зависят
от пути, по которому система пришла в
данное состояние. Изменение функции
состояния
![]() Наиболее
важными функциями являются внутренняя
энергия
системы U и энтальпия
H
(теплосодержание)
Наиболее
важными функциями являются внутренняя
энергия
системы U и энтальпия
H
(теплосодержание)
![]() Внутр. энергия
– общий запас энергии: энергия
поступательного и вращательного
движения, энергия колебаний, внутриядерная
энергия, за исключением кинетической
энергии системы в целом и потенциальной
энергии положения системы.
Энтальпия
— это свойство вещества, указывающее
количество энергии, которую можно
преобразовать в теплоту.
Энтальпия
— это термодинамическое свойство
вещества, которое указывает уровень
энергии, сохраненной в его молекулярной
структуре. Это значит, что, хотя вещество
может обладать энергией на основании
температуры и давления, не всю ее можно
преобразовать в теплоту. Часть внутренней
энергии всегда остается в веществе и
поддерживает его молекулярную структуру.
стандартное
давление
для газов, жидкостей, и твёрдых тел,
равное 105
Па(750мм
рт. ст.);
стандартная
температура
для газов, равная 273,15 К(0° С);
стандартная
молярность
для растворов, равная 1 моль•л−1.
При
этих условиях константа
диссоциациидистиллированнойводысоставляет 1,0×10−14.
Внутр. энергия
– общий запас энергии: энергия
поступательного и вращательного
движения, энергия колебаний, внутриядерная
энергия, за исключением кинетической
энергии системы в целом и потенциальной
энергии положения системы.
Энтальпия
— это свойство вещества, указывающее
количество энергии, которую можно
преобразовать в теплоту.
Энтальпия
— это термодинамическое свойство
вещества, которое указывает уровень
энергии, сохраненной в его молекулярной
структуре. Это значит, что, хотя вещество
может обладать энергией на основании
температуры и давления, не всю ее можно
преобразовать в теплоту. Часть внутренней
энергии всегда остается в веществе и
поддерживает его молекулярную структуру.
стандартное
давление
для газов, жидкостей, и твёрдых тел,
равное 105
Па(750мм
рт. ст.);
стандартная
температура
для газов, равная 273,15 К(0° С);
стандартная
молярность
для растворов, равная 1 моль•л−1.
При
этих условиях константа
диссоциациидистиллированнойводысоставляет 1,0×10−14.
15. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
Существует
множество формулировок первого закона:
В изолированной
системе общий запас энергии сохраняется
постоянным. Поскольку работа является
одной из форм перехода энергии, то,
следовательно, невозможно создание
вечного двигателя первого рода (машины,
совершающей работу без затраты энергии).
Математическая формулировка:
![]() При
протеканииизобарического
процесса:
При
протеканииизобарического
процесса:
![]()
![]() При
протекании изохорического
процесса:
При
протекании изохорического
процесса:
![]() При
протекании изотермического
процесса:
При
протекании изотермического
процесса:
![]() При
протекании кругового
процесса:
При
протекании кругового
процесса:
![]()
Термохимия
– область физ. химии, занимающаяся
изучением энергет. эффектов реакций.
Если в уравнении указан ее энергетический
эффект – это термохимическое
ур-е.
V=const,
![]() p=const,
p=const,
![]() Русский
ученый Гесс (1840) дал формулировку
основному
закону термохимии:
тепловой эффект реакции, протекающей
при постоянном объеме или при постоянном
давлении, не зависит от пути реакции
(от ее промежуточных стадий), а определяется
только природой и состоянием исходных
веществ и продуктов реакции.
Этот
закон – прямое следствие первого закона
термодинамики.
С
помощью закона Гесса можно вычислять
теплоты различных реакций, не проводя
самих реакций.
Русский
ученый Гесс (1840) дал формулировку
основному
закону термохимии:
тепловой эффект реакции, протекающей
при постоянном объеме или при постоянном
давлении, не зависит от пути реакции
(от ее промежуточных стадий), а определяется
только природой и состоянием исходных
веществ и продуктов реакции.
Этот
закон – прямое следствие первого закона
термодинамики.
С
помощью закона Гесса можно вычислять
теплоты различных реакций, не проводя
самих реакций.
Например:
![]()
Вывод: теплота испарения одного моля воды равна 44 Дж.
16. Стандартная энтальпия образования. Следствия из закона Гесса.
Под
стандартной
теплотой (энтальпией) образования
понимают тепловой эффект реакции
образования одного моля вещества из
простых веществ, его составляющих,
находящихся в устойчивых стандартных
состояниях. Стандартная энтальпия
образования обозначается ΔHfO.
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции. Следствия из закона Гесса:
1. Тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции. Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов. Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
2. Тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции. В настоящее время известны теплоты образования свыше 6000 веществ. Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм.
17.
Зависимость теплового эффекта химической
реакции от температуры (закон Кирхгофа).
Продифференцируем
уравнения
 и
и по Т, причем в первом случае возьмем
постоянный V, а во втором – Р.
по Т, причем в первом случае возьмем
постоянный V, а во втором – Р.


Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса (правило Кирхгоффа). Интегрируя полученные выше дифф уравнения, получаем:
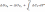
 В небольшом
диапазоне температур можно ограничиться
первым членом степенного ряда для С, и
тогда она будет постоянной.
В небольшом
диапазоне температур можно ограничиться
первым членом степенного ряда для С, и
тогда она будет постоянной.
18. Второе начало термодинамики. Понятие об энтропии. Термодинамическая вероятность. Приведённое тепло. Неравенство и тождество Клаузиуса.
Невозможен
самопроизвольный переход тепла от
менее нагретого тела более нагретому.
Невозможно создание вечного двигателя
2го рода(машины, которая периодически
превращает тепло среды при пост.
температуре в работу. Термодинамический
КПД:
![]() Для
изолированных систем критерием,
позволяющим судить о направлении
процессов и об условиях равновесия,
является функция-S-энтропия.
Процессы протекают в сторону увеличения
энтропии. При равновесии энтропия
достигает максимума. Обратное протекание
процессов не может быть самопроизвольным
– требуется затрата работы извне. Физ.
смысл функции состояния энтропии легче
всего проиллюстрировать на примере
кипения жидкости. При нагреве: Т и U
увеличиваются до тех пор, пока жидкость
не закипит. При этом поглощается теплота
испарения, затрачиваемая на увеличение
беспорядка в системе. Таким образом,
энтропия – мера упорядоченности
состояния системы.
Для
изолированных систем критерием,
позволяющим судить о направлении
процессов и об условиях равновесия,
является функция-S-энтропия.
Процессы протекают в сторону увеличения
энтропии. При равновесии энтропия
достигает максимума. Обратное протекание
процессов не может быть самопроизвольным
– требуется затрата работы извне. Физ.
смысл функции состояния энтропии легче
всего проиллюстрировать на примере
кипения жидкости. При нагреве: Т и U
увеличиваются до тех пор, пока жидкость
не закипит. При этом поглощается теплота
испарения, затрачиваемая на увеличение
беспорядка в системе. Таким образом,
энтропия – мера упорядоченности
состояния системы.
![]() -2е
начало термодинамики
для обратимых процессов. В изолированной
системе процессы самопроизвольные,
протекают в сторону увеличения энтропии
-2е
начало термодинамики
для обратимых процессов. В изолированной
системе процессы самопроизвольные,
протекают в сторону увеличения энтропии![]() Внеизолированных–возможно
Внеизолированных–возможно
![]() Термодинамическая
вероятность (или статический вес)
— число способов, которыми может быть
реализовано состояние физической
системы.Неравенство
Клаузиуса
(1854): Количество теплоты, полученное
системой при любом круговом процессе,
делённое на абсолютную температуру,
при которой оно было получено (приведённое
количество теплоты),
неположительно.
Термодинамическая
вероятность (или статический вес)
— число способов, которыми может быть
реализовано состояние физической
системы.Неравенство
Клаузиуса
(1854): Количество теплоты, полученное
системой при любом круговом процессе,
делённое на абсолютную температуру,
при которой оно было получено (приведённое
количество теплоты),
неположительно.![]()
19.Тепловая
теорема Нернста. Постулат Планка. Расчёт
абсолютного значения энтропии. Понятие
вырождения идеального газа. Теорема
Нернста
утверждает, что изменение энтропии в
обратимой хим. р-ции между в-вами в
конденсир. состоянии, стремится к нулю
при T![]() 0:
0:![]() Основываясь на этом, Планк в 1911 году
постулировал: “При абсолютном нуле
температуры энтропия не только имеет
наименьшее значение, но просто равна
нулю”.Постулат
Планка
формулируется следующим образом:
«Энтропия правильно сформированного
кристалла чистого вещества
при абсолютном нуле температуры
равна нулю» Абсолютное
значение энтропии
позволяет
установить третье
начало термодинамики,
или Нернста теорему: при стремлении
абсолютной температуры
к нулю разность DS для любого вещества
стремится к нулю независимо от внешних
параметров. Поэтому: энтропию
всех веществ
при абсолютном нуле температуры
можно принять равной нулю (эту формулировку
теоремы Нернста предложил в 1911 М. Планк).
Основываясь на ней, за начальную точку
отсчёта энтропии
принимают So
= 0 при Т = 0.
Вырожденный
газ
- газ, свойства которого существенно
отличаются от свойств классического
идеального газа вследствие
квантовомеханического влияния одинаковых
частиц друг на друга. Это взаимное
влияние частиц обусловлено не силовыми
взаимодействиями, отсутствующими у
идеального газа, а тождественностью
(неразличимостью) одинаковых частиц в
квантовой механике. В результате такого
влияния заполнение частицами возможных
уровней энергии даже в идеальном газе
зависит от наличия на данном уровне
других частиц. Поэтому теплоёмкость и
давление такого газа иначе зависят от
температуры, чем у идеального классического
газа; по-другому выражается Энтропия,Свободная
энергияи т. д. Вырождение газа
наступает при понижении его температуры
до некоторого значения, называемого
температурой вырождения. Полное
вырождение соответствует абсолютному
нулю температуры. Влияние тождественности
частиц сказывается тем существеннее,
чем меньше среднее расстояние между
частицамиr
по сравнению с длиной Волны
де Бройлячастиц λ =h/mv
(m
— масса частицы, v
— её скорость, h
— Планка
постоянная)
Основываясь на этом, Планк в 1911 году
постулировал: “При абсолютном нуле
температуры энтропия не только имеет
наименьшее значение, но просто равна
нулю”.Постулат
Планка
формулируется следующим образом:
«Энтропия правильно сформированного
кристалла чистого вещества
при абсолютном нуле температуры
равна нулю» Абсолютное
значение энтропии
позволяет
установить третье
начало термодинамики,
или Нернста теорему: при стремлении
абсолютной температуры
к нулю разность DS для любого вещества
стремится к нулю независимо от внешних
параметров. Поэтому: энтропию
всех веществ
при абсолютном нуле температуры
можно принять равной нулю (эту формулировку
теоремы Нернста предложил в 1911 М. Планк).
Основываясь на ней, за начальную точку
отсчёта энтропии
принимают So
= 0 при Т = 0.
Вырожденный
газ
- газ, свойства которого существенно
отличаются от свойств классического
идеального газа вследствие
квантовомеханического влияния одинаковых
частиц друг на друга. Это взаимное
влияние частиц обусловлено не силовыми
взаимодействиями, отсутствующими у
идеального газа, а тождественностью
(неразличимостью) одинаковых частиц в
квантовой механике. В результате такого
влияния заполнение частицами возможных
уровней энергии даже в идеальном газе
зависит от наличия на данном уровне
других частиц. Поэтому теплоёмкость и
давление такого газа иначе зависят от
температуры, чем у идеального классического
газа; по-другому выражается Энтропия,Свободная
энергияи т. д. Вырождение газа
наступает при понижении его температуры
до некоторого значения, называемого
температурой вырождения. Полное
вырождение соответствует абсолютному
нулю температуры. Влияние тождественности
частиц сказывается тем существеннее,
чем меньше среднее расстояние между
частицамиr
по сравнению с длиной Волны
де Бройлячастиц λ =h/mv
(m
— масса частицы, v
— её скорость, h
— Планка
постоянная)
20.Объединенная
формула первого и второго начала
термодинамики. Свободная энергия Гиббса
и Гельмгольца. Условия самопроизвольного
протекания химических реакций. Первый
закон. Теплота,
подведенная к системе, расходуется на
приращение внутренней энергии системы
и на работу системы над окружающей
средой.![]() Второй закон. (Несколько
формулировок): в изолированных системах
самопроизвольно идут процессы, которые
сопровождаются возрастанием энтропии:
Второй закон. (Несколько
формулировок): в изолированных системах
самопроизвольно идут процессы, которые
сопровождаются возрастанием энтропии:
![]() Энтропия
– термодинамическая функция,
характеризующая меру неупорядоченности
состояния системы. Она используется
для суждения о направлении самопроизвольно
протекающих процессах. Обобщенный
закон. Для каждой изолированной
термодинамической системы существует
состояние термодинамического равновесия,
которого она при фиксированных внешних
условиях с течением времени самопроизвольно
достигает. TdS>dU+pd Энергия
Гельмгольца. Максимальная
работа, которую может совершить система
при равновесном проведении процесса,
равна изменению энергии Гельмгольца
реакции
Энтропия
– термодинамическая функция,
характеризующая меру неупорядоченности
состояния системы. Она используется
для суждения о направлении самопроизвольно
протекающих процессах. Обобщенный
закон. Для каждой изолированной
термодинамической системы существует
состояние термодинамического равновесия,
которого она при фиксированных внешних
условиях с течением времени самопроизвольно
достигает. TdS>dU+pd Энергия
Гельмгольца. Максимальная
работа, которую может совершить система
при равновесном проведении процесса,
равна изменению энергии Гельмгольца
реакции
![]()
![]() Энергия
Гельмгольца равна
Энергия
Гельмгольца равна![]()
![]() называютсвязанной
энергией.
Она характеризует предел самопроизвольного
течения реакции, которое возможно при
называютсвязанной
энергией.
Она характеризует предел самопроизвольного
течения реакции, которое возможно при
![]() Энергия
Гиббса. Энтальпийный
и энтропийный факторы, характеризующие
процессы, объединены функцией - энергия
Гиббса.
Энергия
Гиббса. Энтальпийный
и энтропийный факторы, характеризующие
процессы, объединены функцией - энергия
Гиббса.![]() Поскольку энергию Гиббса можно превратить
в работу, то ее называютсвободной
энергией.
Поскольку энергию Гиббса можно превратить
в работу, то ее называютсвободной
энергией.
![]() Химическая
реакция возможна, если энергия Гиббса
уменьшается (<0).Энергия Гиббса
образования вещества – изменение
энергии Гиббса системы при образовании
1 моль вещества из простых веществ,
устойчивых при 298 К.
Химическая
реакция возможна, если энергия Гиббса
уменьшается (<0).Энергия Гиббса
образования вещества – изменение
энергии Гиббса системы при образовании
1 моль вещества из простых веществ,
устойчивых при 298 К.
