
ПРЕДИСЛОВИЕ
Значительные успехи медицинской науки, достигнутые в последние годы, послужили основой к внедрению новых, более радикальных методов хирургического лечения различных органов человеческого организма, в том числе печени и жел-чевыводящей системы.
Внедрение последних достижений науки в хирургическую практику вызвало необходимость пересмотра некоторых принципов лечения отдельных заболеваний печени и желче-выводящей системы, изъятия из практики устаревших методов исследования и замены их новыми, позволяющими более глубоко проникнуть в суть патологического процесса, выяснить его характер и определить объем необходимой хирургической помощи.
Накопленный за последние годы опыт операций на печени и желче-выводящей системе способствовал разработке новых методов хирургического лечения, рост анестезиологической и реаниматологической службы позволил расширить объем оперативных вмешательств при тяжелой патологии печени, желчных протоков с явлениями печеночной недостаточности и добиться хороших результатов.
Наконец, хирургия печени и желчных протоков получила новый путь развития, идущий по направлению полного замещения или временного подключения здоровой печени при
нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью.
Многие вопросы хирургии печени и желчных протоков изложены в отдельных работах отечественных и зарубежных авторов (А. Т. Лид-ский, 1963; И. М. Тальман, 1963; И. Н. Ищенко, 1966; В. С. Шапкин, 1967; С. А. Боровков, 1968; Б. А. Петров и Э. И. Гальперин, 1971; Б. В. Петровский, 1972; В. М. Ситенко и А. И. Нечай, 1972; В. В. Виноградов, В. А. Вишневский и В. И. Кочиашвили, 1972; Caunaud, 1957; Puestow, 1957; Hess, 1961; Ton That Tung, 1962; Mallet— Guy и соавт., 1970; Warren и соавт., 1971; Way и соавт., 1972, и др.). Однако они отражают лишь отдельные разделы хирургического лечения и не представляют собой цельной картины патологии этого важного участка пищеварительной системы.
Настоящая книга посвящена подробному изложению клиники, диагностики, современных методов исследования, консервативному и хирургическому лечению заболеваний печени и желчевыводящих путей, технике оперативных вмешательств.
В книге подробно изложены такие разделы, как травма печени и желчных протоков, абсцессы печени, портальная гипертензия, в том числе циррозы, опухоли печени и желчевыводящих протоков, жедчекамен-
ная болезнь и воспалительные заболевания желчных путей. Подробно описана техника операций при циррозах печени и опухолях, методика резекции печени, долей, сегментов, восстановительные операции при рубцовом сужении желчных путей всех локализаций, в том числе оригинальные методики А. А. Шалимова.
Книга написана на основании обобщения большого личного опыта авторов, а также данных отечественной и зарубежной литературы. В ней помимо хирургических методов
лечения заболеваний печени и жел-чевыводящих протоков представлены новые методы обследования, дооперационная подготовка и послеоперационное ведение больных, уточнены показания к различного рода хирургическим вмешательствам. В решении всех вопросов авторы старались использовать новейшие достижения медицинских знаний, не избегая спорных вопросов.
Авторы будут благодарны за критические замечания и пожелания.
Авторы
Глава первая
К РАТКИЕ
СВЕДЕНИЯ О ХИРУРГИЧЕСКОЙ АНАТОМИИПЕЧЕНИ
И ЖЕЛЧНЫХ ПРОТОКОВ
РАТКИЕ
СВЕДЕНИЯ О ХИРУРГИЧЕСКОЙ АНАТОМИИПЕЧЕНИ
И ЖЕЛЧНЫХ ПРОТОКОВ
Правильное решение задач хирургического лечения заболеваний печени и желчевыводящих путей возможно при условии знания анатомии этих органов.
Печень начинает развиваться на 3-й неделе эмбриональной жизни из выпячивания первичной кишечной трубки. Дистальная часть этого дивертикула, дифференцируясь, в последующем образует печеночную ткань и внутрипеченочные желчные протоки, а проксимальная — дает начало развитию желчного пузыря и внепеченочных желчных протоков.
Брюшинный покров и связки печени. Указанный дивертикул, распространяясь между 2 слоями мезодермы, занимает в брюшной полости место, свободное от других органов — правое подреберье. Таким образом, печень имеет почти полный перитонеальный покров, идущий от соседних органов в процессе перемещения дивертикула у эмбриона и образует с ними соединения в виде связок (рис. 1а, б).
Под брюшинным покровом непосредственно на печени лежит фиброзная оболочка — глиссонова капсула.
Серповидная связка распространяется между выпуклой частью печени и диафрагмой почти в сагиттальной плоскости.
Круглая связка (lig. teres hepa-tis) сливается с передним краем серповидной связки и залегает в бо-
розде пупочной вены (sulcus v. um-bilicalis) на нижней поверхности печени. Покидая борозду пупочной вены круглая связка идет по задней поверхности передней брюшной стенки и заканчивается в области пупка. Круглая связка у плода содержит пупочные функционирующие сосуды, у взрослого — запустевшую пупочную вену, которая примерно у 70% больных поддается реканализации жестким зондом. По ходу вены во время бужирования встречается суженный участок на границе между пупочной и парамедианной веной, которая является ее продолжением. Венечная связка печени располагается во фронтальной плоскости по обе стороны от серповидной между нижней поверхностью задних отделов диафрагмы и верхне-задним отделом диафрагмальной поверхности печени. В то время как часть венечной связки, располагающаяся слева от серповидной, имеет близкое расположение листков, листки правой ее части расходятся на значительном расстоянии, образуя таким образом соединение с диафрагмой в виде печеночно-диафрагмальной связки и с правой почкой в виде печеночно-почечной, в медиальной части которой проходит нижняя полая вена (v. cava inferior). Часть печени, располагающаяся между печеночно-диафрагмальной и печеночно-почечной связками, остается свободной от брюшинного покрова и носит название
4
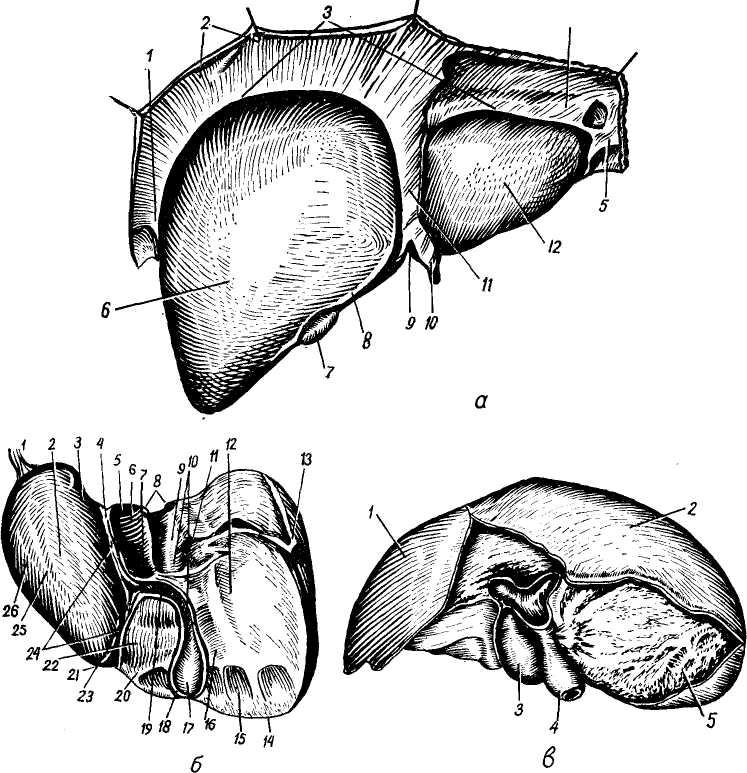
забрюшинного поля печени (area nu-da) (рис. 1,в). Эта часть задней поверхности печени непосредственно сращена с поясничным и частично с реберным отделами диафрагмы. Верхняя граница этого пространства проходит справа по IX межре-
берыо от паравертебральной линии до средней лопаточной, наружная идет по средней лопаточной линии справа и заканчивается на уровне нижнего края XI ребра, затем вдоль нижнего края XI ребра, доходит до правой паравертебральной линии.
Сращение внебрюшинного поля печени с прилежащими тканями позволяет производить в этом месте пункционную биопсию печени. Ее производят ниже XI ребра справа, отступя 5—6 см от позвоночника. Игла проходит между плеврой и диафрагмой, что является менее опасным, чем пункция передней части диафрагмальной поверхности печени.
Треугольные связки. Слева продолжением венечной связки является левая треугольная связка (lig. triangulare sinistrum), соединяющая левую долю печени и нижнюю поверхность диафрагмы, распространяется она во фронтальной плоскости, располагаясь на 3—4 см кпереди от брюшинного отдела пищевода. Продолжением венечной связки справа является правая треугольная (lig. triangulare dextrum), соединяющая правую долю печени и диафрагму.
Малый сальник (omentum minus) представляет собой дублика-туру брюшины, переходящую с печени на прилежащие органы. Сюда входят печеночно-желудочная, пе-ченочно-двенадцатиперстная и желу-дочно-диафрагмальная связки (lig. gastrophrenicum). В практике печеночной хирургии наиболее важное значение имеет печеночно-две-надцатиперстная связка, которая слева продолжается в печеночно-же-лудочную, а справа заканчивается свободным краем. Кзади от нее располагается сальниковая сумка (bursa omentalis) с входящим в нее отверстием — foramen epiploicum.
В толще печеночно-двенадцати-перстной связки проходят кровеносные и лимфатические сосуды, желчные протоки и нервы. У края ее справа расположен общий желчный проток, слева от него находится печеночная артерия, между ними и кзади — воротная вена. Печеночно-двенадцатиперстная связка ограничивает вход в сальниковую сумку спереди, задней стенкой (foramen epiploieum) является полая вена, покрытая брюшиной.
Брюшинные карманы. Печень, диафрагма, связки печени и окружающие печень органы образуют ряд брюшинных карманов, топография которых имеет практическое значение как для дренирования их с целью профилактики образования абсцессов, так и для отыскивания и вскрытия уже образовавшихся гнойников в послеоперационном периоде.
Правое поддиафрагмалъное пространство делится венечной связкой на переднее и заднее. Переднее под-диафрагмальное пространство образуется: снизу — диафрагмальной поверхностью правой доли печени, сверху — диафрагмой, слева — серповидной связкой печени, сзади — передним листком правой венечной связки. Это пространство под правой треугольной связкой у правого края печени имеет сообщение с вну-трибрюшинным . запеченочным пространством. Заднее правое подди-афрагмальное пространство, отграничено: спереди — печенью, сверху — нижним краем венечной связки и снизу — париетальным листком брюшины.
Левое поддиафрагмалъное пространство находится между диафрагмальной поверхностью левой доли печени снизу, диафрагмой сверху, левой венечной связкой сзади и серповидной связкой справа.
Правое подпеченочное пространство является частым местом локализации гнойников при прободении желчного пузыря, а также местом скопления желчи и крови в послеоперационном периоде при недостаточной герметизации желчных протоков после их вскрытия или недостаточном гемостазе, особенно у больных желтухой при пониженных процессах свертывания крови. Сверху и спереди это пространство прикрыто нижней поверхностью правой доли печени, снизу прилежащими органами (поперечно-ободочная кишка и верхняя горизонтальная часть двенадцатиперстной кишки), париетальная брюшина выстилает зад-
нюю стенку этого пространства, латеральным краем его является по-чечно-печеночная связка, медиальным — печеночно-двенадцатиперст-ная; через винслово отверстие правое подпеченочное пространство сообщается е сальниковой сумкой.
Левое подпеченочное пространство образовано сверху — нижней поверхностью левой доли печени, справа — круглой связкой, слева — задним листком левой венечной связки, задней стенкой этого пространства является малый сальник и часть малой кривизны желудка.
Внешняя топография печени. На положение печени в брюшной полости влияет конфигурация тела и движения диафрагмы, с которой она тесно связана. В положении лежа различают следующие границы печени: верхней точкой по правой средне-ключичной линии является место соединения V ребра с хрящом, нижняя точка находится справа по средне-подмышечной линии на 1,5—2 см ниже дуги X ребра, слева крайняя точка располагается на 5 см влево от средней линии на уровне хряща VI ребра. Соединив эти точки слегка выпуклой линией, можно получить очертания верхней границы печени. Нижний край печени выступает из-под реберной дуги только у детей до 3-летнего возраста и у астеников. Сзади верхняя граница печени проецируется на уровне нижнего края IX грудного позвонка, а нижняя — на уровне средины XI. В процессе перемещения диафрагмы амплитуда смещения печени 3—4 см.
Долевое и сегментарное строение печени. По классическому описанию печени она делится на правую (большую) и левую (меньшую) доли или половины по месту прикрепления серповидной связки. С учетом деления кровеносных сосудов и желчных ходов внутри печени такое деление не является истинно анатомическим.
На висцеральной поверхности печени есть ряд борозд и ямок от вдав-ления соседних органов и сосудов.
Центральное место занимают ворота печени (porta hepatis). В этой области борозды расположены в виде буквы Н. Здесь расположены ветви воротной вены и печеночной артерии, идущие в поперечном направлении, а также печеночные протоки и место прикрепления малого сальника. В этой зоне все сосуды и желчные протоки обычно лежат вне паренхимы печени и более легко доступны хирургической обработке. В связи с тем, что сосуды и желчные протоки, распространяющиеся от ворот печени в левую продольную борозду, более доступны, чем в других частях печени, к ее воротам в последнее время стали относить и левую сагиттальную борозду (В. С. Шап-кин, 1964; В. Ф. Забродская, 1965; А. И. Краковский, 1966).
Левая сагиттальная борозда (fissura sagittalis sinistra) является продолжением серповидной связки на висцеральной поверхности печени и содержит впереди в fissira lig. teretis круглую связку печени, а в заднем отделе fissura lig. venosi — венозную связку Аранция (lig. ve-nosum), которая является облитери-рованным венозным протоком Аранция, функционирующим у плода между воротной и нижней полой веной.
Правая сагиттальная борозда проходит через ложе желчного пузыря спереди и сзади через край sulcus venae cave.
Кзади от поперечной линии расположена хвостатая доля, кпереди — квадратная (см. рис. 1,в).
Левая сагиттальная борозда фактически является границей деления печени на 2 половины, так как квадратную и хвостатую доли принято относить к правой половине.
Деление печени на 4 доли по внешним ориентирам предложено в 1884 г» Van Haller и принято в международной анатомической номенклатуре. Однако хирургов мало удовлетворяет деление печени лишь по внешним признакам, ибо для правильного выполнения резекции печени необ-
ходимо иссечение ткани в рамках определенных участков, не нарушив при этом ни желчеоттока, ни кровообращения соседних участков. В связи с этим Rex (1888), а затем Cantlie (1898) предложили деление печени на доли с учетом расположения сосудов и желчных протоков. Линия, разделяющая печень на две половины, в этом случае проходит по верхней поверхности печени не у места прикрепления серповидной связки, а вправо от нее и распространяется от средины ямки ложа желчного пузыря у переднего края печени к основанию средней печеночной вены у заднего ее края. Плоскость, проходящая через эту междолевую щель по отношению к нижней поверхности печени, находится под углом 55—90°, открытым в сторону левой доли. По этой предположительной бессосудистой плоскости производят иссечение половины печени (гемигепатэктомия). На висцеральной поверхности ее эта линия соответствует левой сагиттальной борозде. Существование этой бессосудистой зоны подтвердили А. В. Мельников (1922), Martens (1921), Mc Indol и Gonseller (1927), Healy и Schoray (1953), Gans (1955), Couinaud (1957).
Однако деление печени на 2 половины удовлетворяет хирурга лишь для выполнения гемигепатэктомии, для удаления же небольших участков печени необходимо более дробное деление органа с тем же строгим учетом желчеоттока и кровоснабжения. В связи с тем, что ход ветвей воротной вены, печеночной артерии и желчных протоков совпадает, деление печени с учетом ветвления системы воротной вены (портальный тип) является более анатомическим, нежели деление ее с учетом ветвления печеночных вен (кавальный тип), с ходом которых не совпадает направление сосудов портальной системы. Кроме того вариабельность сосудов воротной вены незначительна и практического значения не имеет.
Учитывая вышеизложенное, получило наиболее широкое распространение деление печени на участки (сегменты) с учетом разветвления портальной системы, предложенное Couinaud (1957). По этой классификации печень делят на 2 половины: правую и левую, 5 секторов и 8 сегментов (рис. 2, табл. 1).
Таблица 1 Деление печени по Куино
|
Половины печени |
Сектор |
Сегмент |
|
Правая Левая |
Латеральный Парамедианный Латеральный Па рамедианный Дорсальный |
VI, VIГ V, VIII II III, IV I |
Сегментом и сектором называется участок печени, имеющий относительно самостоятельное кровоснабжение, желчный отток, инервацию и лимфообращение. Так называемые «бессосудистые щели» между этими образованиями являются условными, особенно в отношении сосудов, анастомозы же между желчными протоками в бороздах между долями, сегментами и секторами отсутствуют. Одним из важных моментов с хирургической точки зрения является обнаружение глиссоновой «ножки»: для каждого сегмента, сектора и доли — это участок, где тесно прилегают друг к другу ветви воротной вены, печеночной артерии и печеночного протока, имеющие отношение к строго определенному участку печени и окружен одной соединительнотканной оболочкой. Пережатие этой «ножки» во время операции или введение в сосуды красящего вещества (раствор метиленовой сини) вызывает изменение цвета соответствующего участка печени и этим уточняется граница резекции. Доступ к «ножке» обычно осуществляется со стороны ворот печени через малососудистые борозды (портальные щели), являющиеся границами секторов и сегментов.
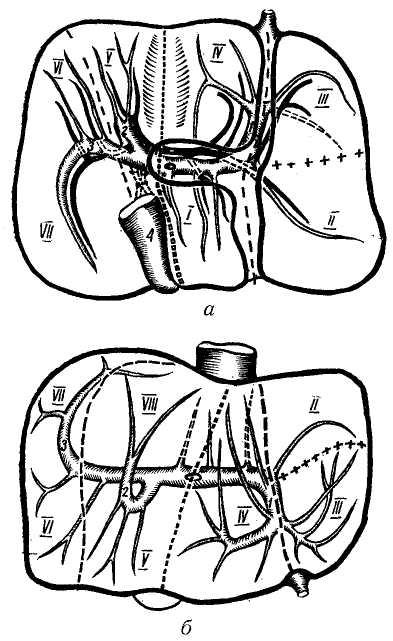
В связи с тем, что существуют индивидуальные различия ветвления внутрипеченочных сосудов и желчных протоков, есть различия и в величине, взаиморасположенности и даже в количестве сегментов, нет окончательной согласованности исследователей о числе, величине и проекции сегментов на поверхности печени. Наиболее распространенные классификации Healey, Schray (1953), Reifferse-heid (1957), Couinaud (1957) имеют много общего, но наиболее удовлетворяющей интересы практического хирурга является классификация Couinaud.
Левая половина печени состоит из парамедианного, латерального и дорсального секторов, включающих I, II, III и IV сегменты. Границей между секторами является левая портальная щель. На висцеральной поверхности она начинается у ворот печени, пересекает борозду пупочной вены и, переходя на левую долю печени, делит ее на II и III сегменты. На диафрагмалыюй поверхности левая портальная щель соответствует межсегментарной борозде, отделяющей III сегмент от II.
Левый парамедианный сектор включает квадратную долю и большую часть левой (III и IV сегменты), граница между ними проходит по борозде пупочной вены. Как видно из данных рис. 2, проекция III сегмента на висцеральную и диафрагмальную поверхности различна, так как плоскость, проходящая через межсегментарную борозду, проходит косо сверху—вниз и сзади — вперед, обусловливая этим наслаивание задних отделов III сегмента на переднюю часть II сегмента, однако размеры как III, так и II сегмента могут быть индивидуально изменчивы. IV сегмент левого парамедианного сектора соответствует квадратной доле, по несколько превышает ее величину. Проекция его на диафрагмальную поверхность распространяется над воротами печени и хвостатой долей (I сегмент, дорсальный сектор). Медиальной границей его является междолевая борозда. Размеры IV сегмента также-индивидуально изменчивы и коррелируют с величиной соседних V и VIII сегментов парамедианного правого сектора.
Левый латеральный сектор включает лишь один II сегмент и отграничивается в заднем отделе левой доли левой портальной бороздой справа и медиально-задним отделом борозды пупочной вены.
Дорсальный сектор также включает один I сегмент и соответствует хвостатой доле. По особенностям
желчеоттока и кровообращения дорсальный сектор нельзя отнести к одной из двух долей. Он отделен от соседних сегментов так называемой дорсальной бороздой. В состав ее входят: слева — задний отдел борозды пупочной вены, спереди — борозда ворот печени и справа — борозда нижней полой вены.
Правая половина печени состоит из правого парамедианного и латерального сектора, включающих V, VI, VII, VIII сегменты. Правая портальная щель, делящая правую долю печени на секторы, не совпадает с имеющимися анатомическими образованиями и проводится условно. На диафрагмальной поверхности проекцию ее отыскивают, разделив расстояние от междолевой борозды до правого края печени на 3 части, при этом линия, проведенная через правую крайнюю точку, и будет правой портальной щелью. У переднего края печени эта линия начинается по средине расстояния между междолевой бороздой и правым краем печени, не подвержена значительным индивидуальным колебаниям, в дорсальной части правая портальная щель оканчивается более постоянно — у места впадения правой печеночной вены в нижнюю полую.
На висцеральной поверхности печени правой портальпой щели соответствует условная линия, проведенная правее ямки желчного пузыря и ворот печени.
Как правило, в здоровой печени в области правой портальной щели не отмечается сосудистых анастомозов, последние появляются только при портальной гипертензии (цирроз печени).
Плоскость, проходящая между правым парамедианным и латеральным секторами, образует с висцеральной поверхностью печени угол в 30—45°, открытый вправо. Глиссо-новые «ножки» обоих секторов находятся в правой портальной щели.
Оба сектора правой доли напоминают клинья, обращенные острым
краем в сторону ворот печени, а основаниями их являются для правого парамедианного сектора в основном диафрагмальная поверхность, а для правого латерального — висцеральная поверхность печени, правый и задний ее край.
Правый парамедианный сектор включает V и VIII сегменты, латеральный — VI и VII сегмент. Меж-сегменторными щелями оба сектора делятся на передние (V и VI) и задние (VII и VIII) сегменты, причем V, VI и VII сегменты проецируются как на диафрагмальную, так и на висцеральную поверхности печени, в то время как VIII сегмент на висцеральной поверхности не виден.
Размеры всех секторов и сегментов индивидуально изменчивы и варьируют в значительной степени, однако всегда при уменьшении одного, увеличивается другой и наоборот, поэтому при секторальных или сегментарных резекциях в первую очередь необходимо ориентироваться на глис-соновую «ножку» и, пережав ее или введя красящее вещество в сосуд, следует установить по изменению цвета соответствующего участка печени границы возможной резекции.
Все сектора и соответствующие сегменты как бы веерообразно расположены вокруг ворот печени, как основного коллектора кровоснабжения и желчеоттока. Как правило, каждая доля, каждый сектор или сегмент имеют свои собственные сосуды и желчные протоки, входящие в состав соответствующей глиссоно-вой «ножки», но зачастую, как показали исследования Г. Е. Островер-хова, В. Ф. Забродской и О. А. Умб-румянц (1966), в состав «ножки» одного сектора попадают сосуды и желчные протоки соседнего сектора или сегмента, поэтому лигирование «ножки» одного сегмента может привести к выключению кровообращения или желчеоттока в соседних сегментах, о чем постоянно должен помнить хирург, оперирующий па печени. Задача несколько облегчается тем,
что сосуды и желчные протоки соседних участков печени обычно располагаются в проксимальных отделах глиссоновой «ножки» у основания и поэтому лигирование «ножки» в ди-стальном ее отделе является безопасным.
Венозная система печени включает воротную вену и вены печени.
Воротная вена (v. portae) является одним из наиболее крупных по объему элементов сосудистой системы. Представлена она венозным стволом длиной 6—8 см, шириной — 1 —1,5 см и собирает кровь из всех непарных органов брюшной полости. Воротная вена образуется в большинстве случаев из слияния верхней брыжеечной вены (v. mesenterica superior) и селезеночной (v. lienalis). Кроме того, в воротную вену впадают v. pancreatoduodenalis sup., v. prepylorica, v. gastrica dex. et sin., а иногда даже v. mesenterica inferior u v. colica media. После слияния этих вен позади головки поджелудочной железы и верхней горизонтальной части двенадцатиперстной кишки, обычно на уровне L] и L2, воротная вена в толще lig. he-patoduodenale, располагаясь позади печеночной артерии и протока, подходит к воротам печени. Позади воротной вены располагается нижняя полая. Разделяют их 2 плотные мембраны, брюшинный покров и частично хвостатая доля печени.
В воротах печени портальная вена делится на 2 ветви — широкую правую, вступающую в правую долю, и узкую левую, идущую в поперечном направлении от ворот печени влево, она несет кровь к левой и квадратной долям. В ряде случаев воротная вена делится перед вступлением в ткань печени на 3, иногда на 4 ветви. После разделения воротной вены от правой ветви отходит правая парамедианная и латеральная ветви, V сегмент и частично VIII снабжаются первой ветвью, вторая, снабжает VI и VII сегменты.
Правая долевая воротная вена посылает небольшие веточки к хвостатой доле (I сегмент), о чем необходимо помнить при резекции с рассечением нижнезаднего края междолевой борозды. Ветвь воротной вены, идущая в левую долю печени, состоит из 2 отрезков — поперечного и пе-реднезадпего. Последний находится в левой сагиттальной борозде и имеет 2 рога — левый парамедианный и левый латеральный, идущие к соответствующим секторам. Воротная вена левого парамедиапного сектора распределяется в III и IV сегментах. Воротная вена левого латерального сектора (II сегмент) представляет собой сравнительно небольшую, идущую косо кзади и влево к левой треугольной связке, ветвь воротной вены. Дорсальный сектор (I сегмент) имеет портальное кровоснабжение как из правой долевой воротной вены, так и из левой одновременно, однако ветви левой воротной вены в этих случаях являются основными.
Вены печени являются составной частью ее венозной системы. Начинается она с центральных веп долек печени, которые сливаются с центральными венами других долек, образуя сублобулярные вены, последние, сливаясь, образуют сборные, идущие из различных сегментов печени. Сборные вены, сливаясь, образуют 3 главные вены печени (правую, левую и среднюю). Правая печеночная вена собирает кровь из правой доли, левая — из левой, средняя — из квадратной и хвостатой доли. Обычно (у 60% больных) средняя и левая печеночные вены сливаются, образуя единый ствол до впадения в нижнюю полую. Правая, как правило, всегда впадает в нижнюю полую вену прямо. Печеночные вены тонкостенны и легко ранимы. Повреждения их крупных ветвей сопровождаются обильным кровотечением и угрозой воздушной эмболии в связи с присасывающим действием грудной полости и зиянии просвета сосудов.
Артериальная система печени. Источником артериального кровоснабжения печени является чревный ствол (truncus coeliacus), от которого отходит общая печеночная артерия (a. hepatica communis). Последняя идет вдоль правой ножки диафрагмы и на уровне пилорического отдела желудка у верхней части двенадцатиперстной кишки делится на 3 ветви: собственную печеночную (a. hepatica propria), правую желудочную (a. gastrica dextra) и желудочно-двенадцатиперстную (a. gastro-duo-denalis).
Собственно печеночная артерия располагается в печеночно-двенадца-типерстной связке впереди воротной вены и слева от общего печеночного протока. Необходимо помнить, что у пожилых людей ствол печеночной артерии иногда удлиняется и извивается, в связи с чем петля ее может заходить на переднюю поверхность холедоха (И. М. Тальман, 1963). Доходя до ворот печени, печеночная артерия несколько слева от линии деления печени на 2 доли делится на левую и правую ветви. У 50— 60% больных место деления совпадает с местом слияния печеночных протоков. Число ветвей варьирует от 2 (20%) до 3-5 (80%). Место разветвления сосуда особенно тщательно должно быть исследовано при иссечении левой половины печени и квадратной доли. В тех случаях, когда собственная печеночная артерия делится на 3 ветви, средняя (a. hepatica media) снабжает кровью квадратную долю печени (IV сегмент).
В многочисленных работах С. П. Федорова (1924—1934) указывается на наличие лишь у 55% людей типичного расположения печеночной артерии и ее ветвей, описанное нами выше. Основываясь на данных Рио-Бранко, С. П. Федоров представляет варианты хода печеночной артерии и ее ветвей у остальных 45% людей.
I вариант: от конца печеночной артерии отходят сразу 4 ветви: же-
лудочно-двенадцатиперстная, пилори-ческая, правая и левая печеночные артерии (20%).
II вариант: общая печеночная артерия отходит от верхней брыже ечной позади воротной вены, а за тем делится на желудочно-двенадца- типерстпую и собственную печеноч ную артерию (5%).
III вариант: левая печеночная артерия отходит от чревного ствола, а правая является его продолжением, от которого отходят желудочно-две- надцатиперстная и правая желудоч ная артерии (10%).
IV вариант: правая печеночная артерия отходит от верхней брыжееч ной артерии, а левая — от ствола чревной, от которой отходят желу- дочно-двенадцатиперстная и правая желудочная артерии (10%).
Немаловажное значение для хирургической практики имеет аномальное расположение печеночной артерии. Так, по данным С. П. Федорова (1934), у 'каждого 5-го, а по данным Schumacher (1928), у каждого 3-го больного во время операции на печеночном протоке обнаруживается, что его переднюю поверхность пересекает артериальный ствол, который в одних случаях является печеночной артерией, в других — пузырной. Очень удачна в этом отношении схема Рио-Бранко (рис. 3).
Внутриорганно печеночные артерии идут и разветвляются вместе с венозными сосудами и печеночными протоками.
Остается и до настоящего времени полностью не выясненным вопрос о сосудистых анастомозах между левой и правой долями печени.
Наличие внутрипеченочных артериальных анастомозов между отдельными половинами печени некоторые исследователи отрицают вовсе (Healy, Schray, 1953) и, наоборот, Martens (1920),Segall (1941) и Gans (1956) находят их.
Исследования И. Н. Ищенко и О. Е. Алексеенко (1964), проведенные на 100 препаратах печени, пока-
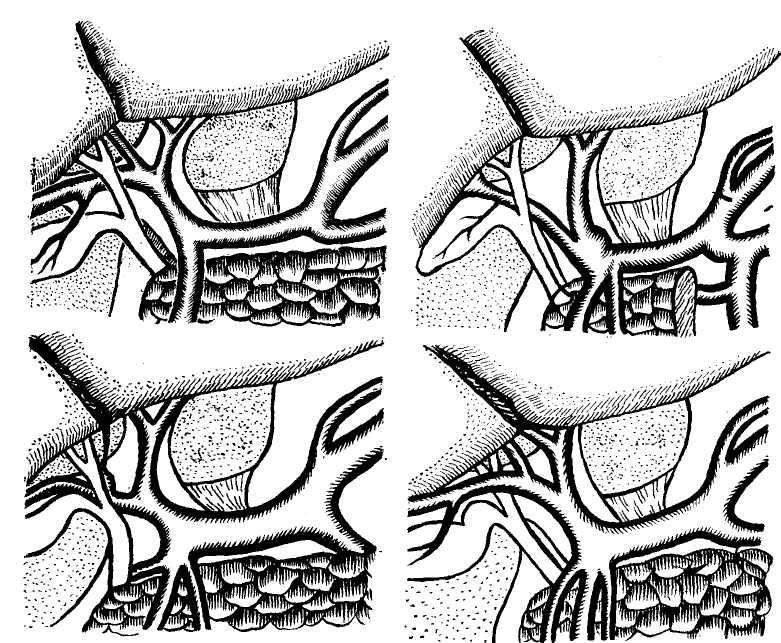
Рис. 3. Отношение правой печеночной артерии к печеночному протоку (по Rio—Branca)
зали, что внутриорганные ветвления ходящие от a. hepatica communis.
артериальных сосудов не всегда со- При перевязке последней до отхо-
ответствуют внешнему делению пече- ждения указанных выше ветвей кол-
ни на 4 доли и имеются мелкие ана- латеральное кровообращение в пе-
стомозы вне ткани печени. Однако чени может восстановиться. В. Ф.Пар-
при рассечении ее по линии деления фентьева (1960) обнаружила анасто-
половин струйного кровотечения не мозы между a. hepatica propria и
бывает, что свидетельствует об от- добавочными артериями печени, что
сутствии прямых внутриорганных дало ей повод утверждать безопас-
анастомозов и указывает на необ- ность перевязки a. hepatica propria
ходимость обязательного проведения при наличии добавочных артерий
лобэктомии или сегментарной резек- печени.
ции при перевязке магистральных От правой ветви собственной пе-
сосудов во избежание непредвиден- ченочной артерии отходит пузырная
ных некрозов паренхимы печени. (a. cystica—64—91 %), в остальных
Обнаруженные отдельными исследо- случаях она может отходить от верх-
вателями внутриорганные анастомо- ней брыжеечной, собственной пече-
зы представляют собой сосуды мало- ночной, левой и общей печеночной
го калибра, обычно, недостаточного желудочно-дуоденальной, желудоч-
для восстановления коллатерального но-салышковой. Иногда наблюдает-
кровообращения. Внешнеорганные ется парность пузырной артерии
анастомозы представляют a.a. gas- (рис. 4). Сосуд идет по левой поверх-
troduodenalis и gastrica dextra, от- ности желчного пузыря от шейки ко
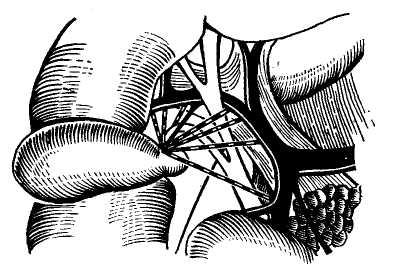
Лимфатическая система. Существует сеть поверхностных и глубоких лимфатических сосудов печени. Лимфатические сосуды с правой верхней поверхности печени, сливаясь в более крупные стволы у правой треугольной связки, прободают диафрагму и впадают в грудной проток. С левой верхней поверхности сосуды проникают в грудную полость в области левой треугольной связки. С нижней поверхности печени лимфатические сосуды идут к воротам печени. Сюда же оттекает лимфа по глубоким сосудам из ткани печени, где они расположены вместе с желче-выводящей и сосудистой системами. В воротах печени и вдоль печеночно-дуоденальной связки концентрируется основное количество лимфы и лимфатических узлов, из которых 2 имеют значение в хирургическом аспекте. Постоянный лимфоузел на левой поверхности пузырной шейки (железа Maskagni) имеет значение как ориентир пузырной артерии, которая проходит по этому узлу. Второй располагается в печеночно-дуо-денальной связке сразу же над двенадцатиперстной кишкой или на правой боковой поверхности холедоха под правым краем двенадцатиперстной кишки. Этот узел является ориентиром для отыскивания дистально-го конца холедоха при повторных операциях.
В дальнейшем лимфоотток идет вдоль воротной вены, собирая лимфу с нижней поверхности печени, головки поджелудочной железы, а затем вступает в аортальные лимфоузлы, а оттуда в грудной проток.
Иннервация печени осуществляется из 2 источников. Элементы парасимпатической системы идут от правого блуждающего нерва. Симпатическая иннервация происходит за счет веточек pi. sollaris, главным образом через правый п. splanchi-
Рис. 4. Схема вариантов начала и хода пузырной артерии (по Rio—Branco).
cus. Веточки солнечного сплетения, оплетая печеночную артерию, образуют plexus hepaticus.
Из правой веточки сплетения, идущей к желчному пузырю, образуется пузырное сплетение. Такие же веточки симпатической системы идут к холедоху, располагаясь на боковой и задней его поверхности. Веточки блуждающего нерва вплетаются в указанные сплетения, проходя предварительно через солнечное сплетение, и не отличаются от симпатических волокон.
Желчевыводящая система печени. Печеночная ткань состоит из множества долек, разделенных между собой прослойками соединительной ткани,в которой проходят желчные протоки, разветвления воротной вены, печеночной артерии и нервов, оплетающих дольки густой сеткой. Печеночные клетки в дольках расположены так, что один полюс их обращен к кровеносным сосудам, другой — к желчным канальцам.
Внутрипеченочные желчные ходы идут параллельно разветвлениям воротной вены и печеночной артерии, соединяясь между собой, образуют более крупные внутрипеченочные протоки и в конечном итоге формируют внеорганные печеночные протоки для правой и левой долей печени.
Установлено, что в правой доле для оттока желчи из переднего и заднего сегмента имеется 2 главных
протока — передний сегментарный и задний, которые в свою очередь образовались из слияния протоков верхних и нижних зон — субсегментов. Передний и задний протоки распространяются к воротам печени, причем задний расположен несколько выше и является более длинным. Сливаясь, они образуют правый печеночный проток. В ряде случаев (28 %) слияния не происходит, и нижний сегментарный проток рассматривается как правый дополнительный печеночный, что является неправильным, так как в этих случаях проток не является дополнительным — он осуществляет отток желчи из определен- ного участка печени.
Часто в ложе желчного пузыря можно найти тонкий проток, осуществляющий отток из V сегмента правой доли и имеющий непосредственную связь с правым печеночным протоком. Повреждение его во время холецистэктомии является нежелательным. Прямого сообщения этого протока с желчным пузырем не установлено.
Отток желчи из левой доли, подобно правой, осуществляется по 2 сегментарным протокам — латеральному и медиальному.
Латеральный сегментарный проток осуществляет отток желчи из левой анатомической доли и образуется путем слияния протоков верхних и нижних зон. Место слияния расположено по линии левой сагиттальной борозды (в 50%) или несколько правее от нее (42 %), (Schwartz, 1964).
Медиальный проток образуется из нескольких протоков верхних и нижних зон (обычно по 2) и присоединяется к латеральному в воротах печени, образуя левый печеночный проток.
В хвостатой доле протоки делятся на 2 системы. Из правого отдела желчь оттекает в правый печеночный проток, из левого — в левый. Вну-трипеченочного сообщения между левым и правым печеночными протока-
ми в области хвостатой доли не установлено.
Печеночные протоки (ductus he-paticus dex. et sin). Обычно слияние левого и правого протока хотя и происходит чаще (у 95% больных) вне печени в 0,75 — 1,5 см от ее поверхности, а иногда и дальше, все же у ряда больных (5%) слияние происходит в печеночной паренхиме (И. М. Тальман, 1965). Левый печеночный проток шире и длиннее правого. Диаметр левого печеночного протока 4—5 мм, длина — 2,5—5 еж с колебаниями от 1 до 10 см. Расположен левый печеночный проток впереди правого края воротной вены, спереди его довольно часто перекрещивает пузырная артерия и правая ветвь печеночной артерии. Левый печеночный проток собирает желчь из I, II, III, IV сегментов печени, правый дренирует V, VI, VII, VIII сегменты. Хотя следует оговориться, что I сегмент отдает веточки желчных ходов, впадающие непосредственно и в левый, и в правый печеночные протоки.
Изучение внутрипеченочной архитектоники желчных протоков и проекций этих протоков на поверхности печени (А. Ф. Ханжинов, 1958; Г. Е. Островерхов, В. В. Виноградов, В. Ф. Забродская, 1966; А. И. Краковский, 1966) послужило основанием для создания точных схем отыскивания наиболее доступных внутрипеченочных протоков и создания билиодегистивных анастомозов (о чем речь будет идти в соответствующей главе). Указанные исследования потребовали пересмотра вопроса о резекции части печени и целой доли для отыскивания внутри-печеночных желчных протоков, предлагаемые Е. С.Футуряноми Б. М.Шубиным (1966), Longmire (1948), Couinaud (1953), Dogliotti (1958).
Общий печеночный проток. После слияния в воротах печени правого и левого печеночных протоков образуется общий печеночный (ductus hepaticus communis).
В тех случаях, когда слияние печеночных протоков бывает у края двенадцатиперстной кишки, оба протока идут параллельно, а пузырный может впадать в один из них на различном уровне. Общий печеночный проток идет в составе печеночно-две-надцатиперстной связки по ее правому краю впереди правого края воротной вены. Диаметр его около 4 мм, длина колеблется от 1 до 10 см (обычно 3—7 см) в зависимости от места слияния печеночных протоков и уровня впадения пузырного протока.
Общий желчный проток. От места впадения пузырного протока к двенадцатиперстной кишке идет общий желчный проток ductus choledochus или холедох. Длина его колеблется в зависимости от уровня впадения пузырного протока (в среднем 5— 8 см). Диаметр протока 5 мм. Перед входом в ткань поджелудочной железы холедох несколько расширяется, затем постепенно суживается, проходя через ткань железы особенно в месте впадения в двенадцатиперстную кишку. В патологических условиях холедох способен расширяться до 2—3 см и более. Стенка его тонкая и состоит из адвентиции, фиброзного слоя, небольшого количества пучков гладких мышечных волокон и толстой слизистой оболочки с большим количеством слизистых желез.
Общепризнанным является деление холедоха на 4 части.
Супрадуоденальная часть — от места впадения пузырного протока до верхнего края двенадцатиперстной кишки (0,3—3,2 см).
Ретродуоденальная часть хо ледоха (около 1,8 см). Находится позади верхней горизонтальной час ти двенадцатиперстной кишки до вступления протока в поджелудочную железу. Слева от холедоха находится воротная вена, под ним, отделенная тонким слоем соединительной ткани, нижняя полая.
Панкреатическая часть — дли ной около 3 см, расположена между
головкой поджелудочной железы и двенадцатиперстной кишкой. Чаще (у 90% людей) холедох проходит через поджелудочную железу, у части он располагается на ее дорсальной поверхности.
Следует сказать, что холедох, проходя через поджелудочную железу, чаще имеет желоб и не полностью окружен паренхимой железы, как сообщает И. М. Тальман (1963), хотя Hess (1961), наоборот, отмечает, что у 90% людей холедох в этой части находится внутри паренхимы поджелудочной железы.
4. Интрамуральная часть холедоха. Внедрение его в двенадцатиперстную кишку происходит по левому медиальному краю вертикального ее отдела на границе с задней стенкой в 12—14 см от привратника при измерении по кишке (М. Д. Ани-ханова, 1960; И. М. Тальман, 1963), то есть в средней части вертикального отдела. В ряде случаев место впадения может находиться и в 2 еж от пилоруса или даже в желудке, а также в области flexura duodeno jejuna Us (Hess, 1955; Hen-rard, 1957; Arianoff, 1958). Bayens (1960) на 210 препаратах констатировал расположение места впадения холедоха в дуоденум в верхней горизонтальной части ее у 8 больных, в верхней половине вертикальной части — у 34, в нижней — у 112, у перехода в нижнюю горизонтальную часть — у 36, в нижней горизонтальной части — у 6, слева от средней линии около двенадцати-перстно-тонкокишечного изгиба — у 4 больных. Все это, безусловно, необходимо иметь в виду при оперативных вмешательствах на большом дуоденальном соске и дистальном отделе холедоха.
Чем выше место впадения холедоха, тем он прямее прободает стенку кишки, а в связи с изменением угла впадения в сторону прямого создается и большая предрасположенность к дуоденально-папилляр-ному рефлюксу.
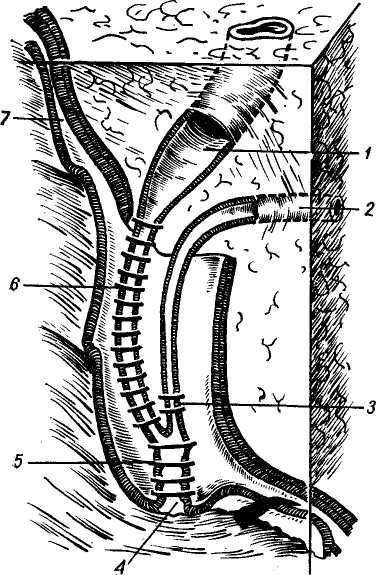
Рис. 5. Большей дуоденальный сосок (схема по В. В. Виноградову).
1 — общий желчный проток; 2 — главный панкреатический проток; 3 — мускулатура панкреатического протока; 4 — устье большого дуоденального соска; 5 — ампула большого дуоденального соска и мускулатура сфинктера Одди; 6 — мускулатура общего желчного протока; 7 — мышечный слой стенки двенадцатиперстной кишки.
Четвертная, внутристеночная часть холедоха имеет протяженность 10— 15 мм и косо прободает стенку двенадцатиперстной кишки, образуя со стороны слизистой оболочки большой дуоденальный сосок (papulla duode-ni major — Vateri).
Большой дуоденальный сосок. В месте прохождения стенки кишки холедох несколько суживается и затем в подслизистом слое расширяется, образуя ампулярное расширение длиной 9 мм, иногда — 4,5 мм (Vater, 1920; Lichtman, 1953). Ампула заканчивается в просвете кишки сосочком величиной с просяное зерно. Сосочек располагается на продольной складке, образованной самой слизистой оболочкой. В дуоденальном
сосочке имеется мышечный аппарат, состоящий из циркулярных и продольных волокон — сфинктера Одди. Продольные волокна разделяются на восходящие и нисходящие, при этом восходящие являются продолжением мышечных волокон двенадцатиперстной кишки, а нисходящие идут по дуоденальной стороне холедоха и заканчиваются на одном уровне с циркулярными волокнами (рис. 5).
Рядом с холедохом несколько ниже его прободают стенку дуоденум и выводной проток поджелудочной железы (ductus Wirsungianus). Слияние холедоха и панкреатического протока очень непостоянно как в смысле места слияния, так и в смысле угла впадения. Этот вопрос достаточно изучен многочисленными исследователями (С. П. Федоров, 1918; А. В. Мельников, 1922, 1935; И. И. Киселев, 1939; Opie, 1901; Ludd, 1931; Milbourn, 1944; Hjorth, 1947; Caroli и Nora, 1951; Hess, 1955; Hewman с соавт., 1965, и др.), что позволило принять деление всех вариантов на 3 группы, предложенное Milbourn и в 1944 г.
Холедох соединяется с панкре атическим протоком до вершины со ска. В этом случае может быть ам пула, в которую впадают оба протока, или ампулу образует холедох, а про ток поджелудочной железы впадает в него (86 %).
Соединение протоков отсут ствует, но впадают они в ампулу об щим отверстием (6%).
Оба протока впадают самосто ятельно и даже на расстоянии 1— 2 см друг от друга (8%).
Schumacher (1928) предложил свою схему вариаций соединения холедоха с выводным протоком поджелудочной железы (рис. 6). Ввиду нередких вмешательств на соске двенадцатиперстной кишки эта схема имеет определенный практический интерес.
Сам сосочек является терминальным отделом общего желчного про-
(по Schumacher).
тока, длина его от 2 до 12 мм. Кровоснабжение большого сосочка двенадцатиперстной кишки происходит за счет мелких ветвей желудочно-двенадцатиперстной, поджелудочно-двенадцатиперстной и верхней брыжеечной артерии.
Желчный пузырь (vesica felle) расположен в продольной борозде нижней поверхности печени. Этот тонкостенный орган покрыт в большинстве
случаев па 2/3 брюшиной, а на 1/3
прилегает к печени.
Стенка желчного пузыря состоит из серозной, слизистой оболочек, субсерозного и фибромускулярного слоев. Грушевидный по форме желчный пузырь имеет 3 отдела: дно (fundus), тело (corpus) и шейку (col-lum vesicae felle). Обычно у места перехода тела желчного пузыря в шейку имеется изгиб. Здесь же вблизи шейки стенка желчного пузыря образует 1, реже 2 кармана, которые часто являются местом расположения камней и сдавления ими пузырного протока. Вследствие деятельности мышечных волокон, расположенных в шейке и пузырном протоке, благодаря изгибу между ними, имеется перепад давления между полостью желчного пузыря и желчными протоками. Располагается обычно желчный пузырь на висцеральной поверхности печени в sulcus vesicae felle.
Кроме типичного расположения желчного пузыря, встречаются и значительные отклонения в его топографоанатомическом положении,
Отсутствие желчного пузыря (агенезия) встречается редко. По дан ным Me Ilrath (1964), в литературе до 1962 года описано всего 143 таких случая.
Внутрипеченочное расположе ние желчного пузыря, когда он пол ностью или частично находится в па ренхиме печени. Эта патология встре чается от 2 (Ф. И. Валькер, 1959) до 13,2% больных (И. И. Сосновкин, 1960).
3. Дистопия желчного пузыря встречается относительно редко. С. П. Федоров (1933) находил его в круглой связке печени, под левой долей и у серповидной связки. Bachlth (1944) обнаружил желчный пузырь под двенадцатиперстной кишкой, В. И. Гордиенко (1953) — в левой доле печени и т. д.
4. Удвоение желчного пузыря, по данным Borkus (1962), встречается у 0,02% больных. Особенно следует помнить об аномалиях впадения в желчный пузырь печеночного протока, пересечение которого без перевязки ведет к развитию желчного перитонита, а перевязка выключает из функции участок печени, дающий отток желчи через него. Kher (1913) и Andersen с соавторами (1960) отмечают возможность впадения правого печеночного протока в пузырный, Holzamer (1960) и Eisold (1961) — возможность впадения пузырного протока в двенадцатиперстную кишку без сообщения с печеночным протоком.
Пузырный проток представляет собой несколько суженную в передне-
Рис. 7. Варианты слияния пузырного и печеночного протоков по И. Л. Брегадзе
и А . И. Иванову.
заднем направлении трубку длиной ченочному (на протяжении 1 — 5 см и
от 3 до 10 мм, берущую начало от более) и впадает под очень острым
поверхности шейки желчного пузыря, углом.
обращенной к воротам печени, где 3-й тип (8—33%) — пузырный
он изгибаясь направляется к ним, проток спирально обходит печеноч-
а затем под углом уходит вниз к пе- ньтй сзади и впадает в заднюю или
ченочному протоку. Просвет прокси- левую, а иногда и переднюю его
мального отрезка пузырного прото- поверхность. Б. И. Школьник (1959)
ка напоминает своим видом штопор на 250 трупах взрослых людей тща-
неправильной формы вследствие спи- тельно изучил варианты слияния тер-
ралеобразного строения его слизи- минального отдела пузырного и пе-
стой оболочки. ченочного протока и при этом уста-
Руге, Kunze, Descomps, Eisend- новил, что у 141 больного это слияние
rath (1956) различают 3 основных располагалось ниже внешнеопреде-
типа соединения пузырного протока ляемого соприкосновения стенки на
■с печеночным: 4—8 мм, у 92 — на 15 мм, у 8 —
1-й тип (33—80%) — короткий пу- на 25—30 мм, а у 10% больных сди-
зырный проток впадает в общий пе- яние происходило позади двенадца-
ченочный на его правой боковой по- типерстной кишки. И. Л. Брегадзе,
верхности под умеренно острым А. И. Иванов (1961) также изучали
углом. варианты слияния пузырного и пе-
2-й тип (12—49%) — длинный пу- ченочного протоков и представили
зырный проток идет параллельно пе- следующую схему (рис. 7).
Глава вторая
Ф УНКЦИОНАЛЬНЫЕ
И СПЕЦИАЛЬНЫЕ МЕТОДЫИССЛЕДОВАНИЯ
ПЕЧЕНИ И ЖЕЛЧНЫХ ПРОТОКОВ
УНКЦИОНАЛЬНЫЕ
И СПЕЦИАЛЬНЫЕ МЕТОДЫИССЛЕДОВАНИЯ
ПЕЧЕНИ И ЖЕЛЧНЫХ ПРОТОКОВ
Объем и характер специальных исследований в каждом частном случае определяется предварительным диагнозом. Однако окончательная диагностика и выбор наиболее подходящего метода лечения в настоящее время невозможны без применения комплекса функциональных и морфологических методов исследования.
ИССЛЕДОВАНИЯ ДО ОПЕРАЦИИ
Целью этих исследований является уточнение диагноза и оценка функционального состояния печени и желчных путей, обоснование показаний к хирургическому вмешательству и выявление возможных противопоказаний к нему.
Биохимические исследования. К настоящему времени предложено большое количество функциональных биохимических проб печени, но систематизация и окончательная клиническая оценка их еще не завершена.
Наибольшие успехи достигнуты в изучении пигментного и белкового обменов, имеют определенное значение и пробы, отражающие состояние обмена жиров и углеводов. В последнее десятилетие все большее значение придается изучению ферментов печени.
Поскольку для практических целей приходится ограничить набор функциональных проб гепатобилиар-ной системы минимальным количе-
ством тестов, мы в настоящем разделе обсуждаем лишь наиболее чувствительные и практически ценные показатели.
Билирубин. Определение его содержания в сыворотке крови является наиболее точным методом оценки пигментной функции печени. Различают 2 фракции билирубина — непрямой (гемобилирубин) и прямой (холебилирубин). Последний дает покраснение сыворотки крови при добавлении к ней диазореактива Эрли-ха, сразу (реакция прямая, быстрая) или через 3—5 минут (реакция прямая, замедленная). Непрямой билирубин дает покраснение сыворотки только после предварительной обработки ее спиртом (реакция непрямая).
Непрямой билирубин образуется в ретикулоэндотелиальной системе из гемоглобина, поступающего в сыворотку вследствие гемолиза, постоянно происходящего в организме в определенных пределах. Считается, что непрямой билирубин содержит белковый компонент, не растворяется в воде и поэтому не выделяется почками. Проходя через печень, он освобождается от этого белка и превращается в водорастворимый прямой билирубин, который и выделяется с желчью в кишечник.
В настоящее время утверждается, что непрямой билирубин, проходя через печень, соединяется с глю-куроновой кислотой, превращаясь в
моноглюкуронид-билирубин (пигмент I, прямой билирубин I) и ди-глюкуронид-билирубин (пигмент II, прямой билирубин II). Поэтому некоторые авторы считают более правильным именовать непрямой билирубин свободным, а прямой — связанным. Предполагается, что диглю-куронид-билирубин образуется исключительно в печени, в то время как моноглюкуронид-билирубин может быть и внепеченочного происхождения.
В норме прямой билирубин сыворотки составляет не более 25% от общего билирубина, непрямой билирубин — 75% и более. Отдельные авторы считают, что в норме прямой билирубин в сыворотке крови отсутствует.
Прямой билирубин желчи под влиянием окислительных процессов частично превращается в уробилин, а основная часть в толстой кишке — в стеркобилин и в таком виде выделяется с калом. Часть уробилина в кишечнике всасывается и, возвращаясь через систему воротной вены в печень, снова превращается в билирубин. Незначительная часть уробилина выделяется с мочой.
Повышение содержания билирубина в крови сверх нормы может быть результатом повышенного распада эритроцитов (гемолитическая желтуха), неспособности печеночных клеток к переработке и выделению билирубина (паренхиматозная желтуха) или следствием препятствия на пути оттока желчи (механическая желтуха).
Определение фракций билирубина помогает до некоторой степени дифференцировать различные формы желтух. Для гемолитической желтухи характерно избыточное содержание в крови непрямого билирубина, увеличение количества стеркобилина в кале и уробилина в моче. При полной непроходимости главных желчных путей исчезают стеркобилин в кале и уробилин в моче, резко увеличивается содержание прямого и непрямого билирубина крови, по-
являются желчные пигменты в моче. Следует отметить, что в норме моча не содержит такого количества желчных пигментов, которые улавливались бы обычными лабораторными методами. Почечный порог для прямого билирубина равен 0,8 — 2 мг%.
Видимая глазом желтушная окраска кожных покровов, слизистых оболочек и конъюнктив определяется при содержании общего билирубина выше 2 мг%. Если видимой желтухи нет, но содержание билирубина в крови выше нормы, то говорят о так называемой скрытой или субклинической желтухе.
Моча в присутствии желчных пигментов приобретает темный желто-зеленый цвет, а кал при отсутствии в нем стеркобилина теряет коричневую окраску и становится бело-глинистого цвета.
На высоте паренхиматозной желтухи, как и при механической, отмечается уменьшение или даже полное исчезновение стеркобилина в кале и уробилина в моче, увеличение билирубина в моче. В крови увеличивается количество преимущественно прямого билирубина.
Определение прямого и непрямого билирубина позволяет отличить только гемолитическую желтуху, при которой это соотношение составляет 25%, а при механической или паренхиматозной — более 40%. Дифференцировать с уверенностью механическую и паренхиматозную желтуху только на основании этих фракций — уробилина в моче и стеркобилина в кале — невозможно. Новые исследования с раздельным определением глюкуронидов билирубина якобы дают такую возможность. Известно, что при желтухах процесс глюкуро-нидирования нарушается и в первую очередь нарушается образование ди-глюкуронид-билирубина, в связи с этим установлено, что, если в норме на долю пигмента II приходится 70% прямого билирубина, а на долю пигмента I — 30 %, то при механической желтухе или этот процесс вовсе
не нарушается, или увеличивается количество пигмента II до 79%, при паренхиматозной желтухе, наоборот, повышается содержание пигмента I до 42% относительно пигмента II.
Однако диагностическое значение этих исследований еще не может считаться общепризнанным. То же можно сказать и в отношение эфиро-растворимой фракции билирубина, появление которой предположительно считалось признаком непроходимости холедоха вследствие периам-пулярного рака.
Более ценной для дифференциальной диагностики оказалась предни-золоновая проба: в течение 5—8 дней вводят преднизолон (около 300 мг на курс) и повторяют исследование билирубина. При паренхиматозной желтухе определяется отчетливое снижение уровня сывороточного билирубина и улучшение самочувствия больного, в то время как при механической желтухе внепеченочного происхождения содержание его практически не меняется или снижается медленно и незначительно.
Наибольшее распространение для определения сывороточного билирубина получил метод ван ден Берга. Однако этот метод не дает возможности количественного определения прямого и непрямого билирубина. Б этом отношении выгодно отличается метод Ендрассика, которому и отдается предпочтение в настоящее время.
Трансаминазы (аминоферазы). Наиболее изучены и широко используются для диагностических целей 2 траисаминазы — глютаминоаланино-вая, или глютаминопировиноград-ная трапсаминазы (ГАЛТ, ГПТ) и глютамииоаспарагиновая, или глю-таминощавелевокислая трансамина-за (ГАСТ, ГЩТ). Они являются представителями индикаторных ферментов, выполняют определенные внутриклеточные функции и сосредоточены в цитоплазме (ГПТ) или в обеих клеточных структурах —
цитоплазме и митохондриях (ГЩТ). Наибольшая часть трансаминаз — печеночного происхождения. Особенно это относится к ГПТ.
Наряду с печеночными клетками трансаминазы в больших количествах содержатся в мышцах и других тканях. Поэтому повышение уровня индикаторных ферментов в сыворотке наблюдается не только при болезнях печени, но и при выраженных дистрофических изменениях органов и систем богатых этими ферментами,— инфаркте миокарда, остром панкреатите, гемолитических состояниях, ревматическом миокардите, остром нефрите, обширных травмах и других состояниях.
Трансаминазы частично проникают через клеточные мембраны и поэтому даже в нормальных условиях небольшое количество их находится в плазме крови. ГПТ сравнительно легко проходит клеточную мембрану, ГЩТ — медленно. В сыворотке крови они быстро разрушаются. Нормальное содержание ГПТ и ГЩТ в сыворотке крови от 0 до 40 ед., соотношение ГПТ/ТЩТ (коэффициент де Ритиса) 1,3—1,4.
Индикаторная гиперферментемия в первую очередь свидетельствует о повышении проницаемости клеточных мембран, а не о некрозе клеток, как предполагали ранее (А. И. Ха-занов, 1968).
Наиболее высокие цифры трансаминаз (до 120—440 ед.) отмечаются при болезни Боткина и быстро текущих циррозах печени (почти у 100% больных) с максимумом повышения на 2—3-й неделе заболевания. К 5—6-й неделе болезни Боткина уровень трансамипаз нормализуется. Коэффициент де Ритиса при остром вирусном гепатите снижается до 0,65 и ниже. Ценным является закономерное повышение трансаминаз еще в преджелтушном периоде, а также при безжелтушных формах болезни Боткина.
При механической желтухе иногда наблюдается подъем трансами-
наз, но он бывает кратковременным и менее высоким (до 60—80 ед. с коэффициентом де Ритиса 0,8). Более умеренное повышение трансаминаз со снижением коэффициента де Ритиса ниже 1,0 наблюдается в некоторых случаях хронического гепатита, при первичном и метастатическом раке печени. При явных циррозах печени в активной фазе повышение ГПТ отмечено у 60,2% больных (А. И. Хазанов, 1968).
Исследование сывороточных трансаминаз является довольно чувствительным и ценным методом дифференциальной диагностики желтух и поэтому широко применяется в клинической практике.
Фруктозе- 1-фосфаталъдолаза (мо-нофосфатфруктоалъдолаза). В норме этот фермент в сыворотке отсутствует или активность его составляет лишь 0,5—2,8 ед. в 100 мл сыворотки крови (3. А. Бондарь, 1970). При острых гепатитах активность его возрастает в 12—30 раз (Д. М. Брагинский, 1965), в то время как при механической желтухе, метастазах рака в печень и пораженных желчных путях гиперферментэмия отсутствует, а при циррозах печени подъем фермента незначителен (А. И. Хазанов, 1965).
Сорбитдегидрогеназа. Она является также «органоспецифическим» ферментом печени и «ведет» себя почти аналогично фруктозо-1-фосфаталь-долазе. При циррозах печени и хронических гепатитах активность его колеблется в пределах 1,3— 3,5 ед.
Диагностическое значение этих 2 ферментов при заболеваниях печени приравнивается к результатам исследования глютаминопировиноградной трансамина зы.
Глютаминовая дегидрогеназа.
Это — чисто митохондриальный фермент и появляется в сыворотке крови только при разрушении печеночных клеток. Исследование глютаминовой дегидрогеназы позволяет поэтому обнаруживать некротические изменения
при остром гепатите в период обострений хронических гепатитов и особенно циррозов печени, а также в ранних стадиях острой закупорки желчных путей.
Большинство исследователей
очень высоко оценивают диагностическое значение глютаминовой дегидрогеназы, потому что быстрое и существенное возрастание ее активности может наблюдаться при отсутствии гипертрансаминаземии и нормальных показателях фруктозо-1-фосфатальдолазы, сорбитдегидроге-назы и щелочной фосфатазы.
Щелочная фосфатаза. ЩФ — один из экскреционных ферментов печени, имеющий значение в диагностике заболеваний печени. Печень вырабатывает лишь небольшую часть щелочной фосфатазы (примерно до 10%), остальная часть этого фермента вырабатывается преимущественно в костной системе. Однако в нормальных условиях почти вся щелочная фосфатаза выделяется печенью в желчь. При нарушениях оттока желчи концентрация этого фермента в сыворотке возрастает, на чем и основывается диагностическая ценность определения щелочной фосфатазы.
При определении по методу Бо-данского нормальное содержание ще-лочпой фосфатазы составляет 2— 5 ед., по методу Кинга-Армстронга — 3—14 ед.
По данным А. И. Хазаиова, отчетливое повышение щелочной фосфатазы свыше 10 ед. по Боданскому наблюдается в 61 % случаев механической желтухи, в 26,1% —болезни Боткина, в 8,6% — циррозов печени и в 63,1 % случаев метастатического рака печени.
Диагностическая ценность гипер-фосфатаземии несколько снижается тем обстоятельством, что отчетливое повышение щелочной фосфатазы обнаруживается относительно поздно»— на 4—10-й день обтурационной желтухи. Следует также учитывать, что иногда значительное повышение щелочной фосфатазы наблюдается при
воспалительных заболеваниях костной системы и переломах.
Хининоксидаза. В крови здорового человека активной хининоксида-зы практически не содержится. Значительная ферментемия возникает при активном циррозе печени и паренхиматозной желтухе (от 10 до 40 ед.). При механических желтухах выраженного изменения активности хи-ниноксидазы не происходит. Результаты исследования этого фермента равноценны результатам осадочных реакций (Linder и Sachs, 1963).
Холинэстераза. Определение этого фермента имеет значение для функционального исследования печени, так как активность холинэстеразы существенно уменьшается при поражениях паренхимы печени, в то время, как при механической желтухе (в начальных стадиях) она в пределах нормы.
В норме у здоровых людей уровень холинэстеразы колеблется от 0,285 до 0,490 усл. ед.
Наиболее резко холинэстераза снижается при циррозах печени. Тяжелое течение острого гепатита ведет к снижению активности фермента до 0,006 ед., а характер изменения активности в процессе болезни имеет значение в определении прогноза заболевания.
При доброкачественном течении гепатита или при хроническом активность фермента относительно невелика, но при переходе хронического гепатита в цирроз снижение активности становится отчетливым. Это отражает нарушение синтетических процессов в печени. Довольно низкая активность фермента отмечена при первичном раке, особенно с вовлечением паренхимы печени, а также, хотя и в меньшей мере, при метастатическом ее поражении.
Холестерин. Исследование холестерина сыворотки является тестом для определения роли печени в ли-пидном обмене, так как печень играет доминирующую роль в синтезе холестерина (из уксусной и пирови-
ноградной кислот) и она же в основ-ном регулирует уровень холестерина в крови. Кроме того, в печени осуществляется эстерификация холестерина — соединение его с жирными кислотами.
Небольшая часть холестерина выделяется с желчью в неизмененном виде, большая часть превращается в желчные кислоты.
Общее содержание холестерина в сыворотке крови 150—200 мг%. Эфиры холестерина составляют 90— 130 мг%, свободный холестерин — в среднем около 60 мг% (20—40% общего холестерина). Коэффициент эстерификации (отношение эфиров холестерина к общему холестерину) в норме равен 0,6—0,8. Этот коэффициент является ценным тестом, отражающим состояние функции печени.
При холестазе (механическая желтуха, острые холангиолитические гепатиты, хронические холангиогепа-титы, билиарные циррозы печени) наряду с другими составными частями желчи накапливается в крови и холестерин. В этом отношении имеется явный параллелизм между ги-перхолестеринемией, гипербилируби-немией и гиперфосфатаземией.
При тяжелых паренхиматозных поражениях печени (острые гепатиты, циррозы, активная дистрофия и диффузные опухоли) наблюдается резкое снижение уровня сывороточного холестерина — признак печеночной недостаточности, а значительное падение коэффициента эстерификации (до 0,3—0,2) является уже плохим прогностическим признаком. Напротив, нарастание этого коэффициента в процессе заболевания следует расценивать как благоприятный признак. Считается, что феномен снижения холестеринэстеров зависит от блокады особого фермента — эсте-разы.
При механической желтухе, хо-лангиогепатите и первичном били-арном циррозе количество эфиров холестерина у большинства больных
пропорционально общему холестерину, и для практической работы можно ограничиться именно этим исследованием.
Исследование углеводного обмена. Поддержание постоянства уровня сахара в крови является одной из важнейших функций печени, и в этом отношении она имеет огромные резервные возможности. Тем не менее, при тяжелых поражениях (гепатиты, циррозы, первичный рак) иногда наблюдается гипогликемия печеночного происхождения. Мы сами наблюдали снижение уровня сахара до 22 мг% у больной с первичной гепатомой. Несколько чаще при поражениях печени наблюдается гипергликемия и патологические гли-кемические кривые при нагрузке глюкозой. Но диагностическая ценность гликемических кривых крайне мала, так как на их формирование, кроме состояния печени, влияет множество других факторов, например, состояние островков поджелудочной железы.
Более специфичной для печени является проба па толерантность к галактозе, так как печень является единственным органом, усваивающим этот моносахарид.
Выделение с мочой более 2 г галактозы делает пробу положительной и говорит о наличии гепатита или активного цирроза, в то время как при неосложненной обтурационной желтухе и хроническом неактивном циррозе уровень выделения ее нормальный (King, Aitkin, 1940; Schwartz, 1964; Warren, 1968). Однако эта проба не является достаточно чувствительной, чтобы найти широкое клиническое применение.
Общий белок сыворотки и его фракции. Количественное и качественное определение общего белка сыворотки и его фракций в значительной мере свидетельствует о нарушении функции печени, которая играет исключительную роль в белковом обмене. Снижение функции печени в первую очередь проявляет-
ся снижением уровня альбумина в сыворотке крови. По динамике содержания альбумина можно судить также об эффективности медикаментозного лечения, а определение качества циркулирующего белка и его составных частей в значительной мере помогает проводить целенаправленную коррекцию его дефицита у больных с хроническими поражениями печени и желчных протоков до операции, во время вмешательства и после него.
У здоровых людей количество общих циркулирующих белков 200— 250 г. Нормальное содержание альбумина в сыворотке крови соответствует 7,0—8,0 з%, а общее количество циркулирующих альбуминов колеблется от 1,36 до 2,12 г/кг веса. Если уровень альбумина падает ниже 2,8 г%, развиваются периферические отеки и асцит вследствие резкого снижения онкотического давления плазмы. Плохим прогностическим признаком является невозможность повысить уровень альбумина медикаментозной терапией выше 3 г%.
Большие компенсаторные возможности организма приводят к тому, что снижение альбумина может не отразиться на количестве общего белка в сыворотке крови — дефицит альбумина с избытком компенсируется повышением уровня глобулинов, которые образуются в основном в ре-тикулоэндотелиальной системе и плазматических клетках и менее зависимы от нарушения функции печени. Однако при тяжелых обтурационных желтухах образование глобулинов запаздывает, и наступает резкая ги-попротеинемия.
Уровень общего белка является в основном показателем питания. Соотношение же между альбуминами и глобулинами (коэффициент А/Г) отражает и понижение уровня альбуминов, и компенсаторное повышение глобулинов. В норме коэффициент А/Г равен 1,2—2,0.
Определение количества циркулирующих белков (КЦБ). При расче-
те общих циркулирующих белков учитывается плазматический объем крови (ПО) и количество белков в г% (Р). Плазматический объем, входящий в состав объема крови (ОК) вместе с глобулярным (ГО), определяется или методом разведения красителя Т-1824 (синяя Эванса), полиглюкином, или радиоизотопным методом с помощью сывороточного альбумина, меченного I131 или более точным методом с глобулином, меченым I131. У здоровых людей плазматический объем составляет 40—48 мл/кг. Количество общих циркулирующих белков определяется по формуле:
11ОхР(пг%)
100
КЦБ — ■
При расчетах коррекции КЦБ необходимо знать его дефицит, то есть сравнить полученные данные с теоретическими расчетами у данного больного, приняв его за здорового человека. Зная количество общих циркулирующих белков и количество альбуминов в г%, можно легко рассчитать количество циркулирующих альбуминов и производить их соответствующую коррекцию.
Осадочные пробы. При диспроте-инемии нарушается коллоидная стабильность сыворотки — добавление электролита легче, чем в норме, вызывает выпадение осадка. Благодаря своей простоте пробы коллоидной стабильности (осадочные пробы) нашли широкое распространение при заболеваниях печени. Из большого числа осадочных проб выгодно отличается возможностью цифрового выражения ее результатов тимоловая проба. Исследование основано на определении степени помутнения сыворотки крови электрофотометрическим способом через 30 минут после добавления тимолового реактива по сравнению со стандартным раствором. Положительная проба зависит от увеличения а- и р-глобулинов, а также р*-липопротеинов и жира сыворотки. Проба отображает в большей степени воспалительную реак-
цию и в меньшей — непосредственные печеночпоклеточные изменения.
Нормальные показатели тимоловой пробы от 0 до 40 ед. (по С. Кола-рову и И. Тодорову). При остром гепатите и активном постпекроти-ческом циррозе печени тимоловая проба достигает 80—150 ед., при хронических гепатитах и портальных циррозах печени она дает более умеренные патологические показатели, а при механической желтухе — нормальные данные (проба отрицательная). При длительной желтухе тимоловая проба дает высокие показатели, хотя в общем белковообразователь-ная функция печени может оставаться ненарушенной.
Кефалин-холестериновая проба. Исследование также зависит от количественных и качественных изменений протеинов сыворотки. Положительная реакция возникает при отсутствии лабильных стабилизирующих факторов, входящих в электро-форетическую фракцию альбумина (а-глобулина). Эти стабилизирующие факторы исчезают быстрее, чем альбумин сыворотки, в связи с чем положительная реакция может наблюдаться в первые 48 часов после острого заболевания печени и наоборот, реакция становится нормальной в первые несколько дней после выздоровления. Проба положительна при гепатите и циррозе с активным распадом печеночной ткани. Отрицательной она отмечена при желтухе, связанной с механической непроходимостью внепеченочных желчных протоков без вторичного цирроза. Кефалин-холестериновую пробу выражают в условных единицах свето-поглощаемости, полученных в результате умножения показателей ФЭК на 100. Норма — до 20 ед.
Активность протромбина. Определение активности протромбина основано на реакции свертывания ок-салатной плазмы при добавлении тромбопластина и хлористого кальция. Учет ведут по времени свертываемости (протромбиновое время по
методу Квика). В норме оно составляет 19—21 секунду.
Отношение протромбинового времени исследуемой крови к протром-биновому времени крови здорового человека, выраженное в виде процентов, составляет протромбиновый индекс. В норме он равен 80—100%. При тяжелых острых поражениях паренхимы печени, в том числе и при болезни Боткина, протромбиновый индекс обычно бывает снижен. При хронических гепатитах и циррозах печени отмечаются различные колебания этого показателя в зависимости от формы и стадии заболевания. Протромбиновый индекс при паренхиматозной и механической желтухе бывает пониженным. Для паренхиматозной желтухи считается характерным отсутствие увеличения протромбинового индекса после парентерального введения витамина К, что свидетельствует о печеночной недостаточности. При механической желтухе и очаговых поражениях печени введение витамина К, как и в норме, повышает протромбиновый индекс, в связи с чем Lord предложил пробу, основанную на том, что парентеральное введение 10 мг витамина К при механической желтухе через 24 часа дает резкое повышение уровня протромбина, которое стойко держится в течение нескольких суток, в то время как такое же введение при паренхиматозной желтухе дает увеличение протромбина лишь до 10%. Если же протромбиновая активность низкая (70% и ниже) и введение 10 мг витамина К не дает ее повышения, а остается в пределах 20—30%, вводят дополнительно 40 мг витамина К (проба Келлера) и, если в этих случаях через 24 часа протромбиновый показатель остается также низким, то это уже указывает на наличие резкого нарушения функции почек.
Определение протромбинового индекса является сравнительно мало чувствительной функциональной пробой печени, так как патологиче-
ские изменения наблюдаются лишь в поздних стадиях поражений.
Метод тромбоэластографии, который в последнее время используют для изучения свертывающей и антисвертывающей системы, позволяет визуально оценить отдельные фазы процесса свертывания. При поражении печени, сопровождающемся геморрагическим диатезом, страдают все фазы и особенно вторая.
Аминокислоты. Повышение содержания аминокислот в сыворотке крови и моче при болезнях печени невелико и непостоянно, и поэтому к настоящему времени исследование аминокислот еще не приобрело существенного диагностического значения. Только при тяжелых диффузных поражениях печени количество их повышается более или менее отчетливо. Механическая желтуха и умеренные очаговые поражения печени не дают характерных изменений «аминокислотного зеркала».
Аммиак. Печень является основным органом, удаляющим аммиак из организма. В венозной крови здорового человека содержится его мало или вовсе нет. Повышение уровня аммиака в сыворотке является не только следствием гепатоцеллюляр-ной недостаточности, но и зависит от повышенного всасывания азотистых веществ из кишечника (после желудочно-кишечного кровотечения) и наличия спонтанных или специально наложенных портокавальных анастомозов. В связи с этим определение аммиака приобретает все большее значение в диагностике портально-пе-ченочной недостаточности при циррозах печени.
Уровень его выражается в микрограммах азота аммиака на 100 мл крови, определяемого методом изометрической перегонки Конвея (Conway, 1950). Нормальный уровень аммиака в крови от 11 до 120 мкг на 100 мл крови или в среднем 40—60 мкг.
Микроэлементы. Известное значение для функциональной диагно-
стики заболеваний печени имеет исследование железа и меди в сыворотке крови. Они содержатся в небольших количествах, измеряемых в а% и связаны с белком. Печень играет роль депо для железа и меди. Нормальное содержание сывороточного железа 60—140 у%, меди — 80— 120 у%. Медь выделяется большей частью с желчью.
Диагностическое значение определения железа и меди в сыворотке крови состоит в следующем. Содержание железа часто повышается (свыше 200 у%) при остром гепатите и остается в пределах нормы в большинстве случаев механической желтухи. Резкое снижение железа отмечено при раке печени. По данным 3. А. Бондарь и других исследователей, повышение сывороточного железа при желтухе выше 300 у% практически исключает обтурацион-ную природу желтухи. Содержание меди, наоборот, резко повышается при механической желтухе и незначительно повышается при остром гепатите.
Большое клиническое значение имеет соотношение меди к железу (коэффициент медь/железо). В норме он равен 0,8—1,0, при механической желтухе повышается до 1,2— 1,3, а при паренхиматозной — понижается до 0,1—0,7.
Таким образом, определение железа и меди в сыворотке крови имеет положительное дифференциально-диагностическое значение при исследовании больных с желтухами неясного происхождения.
Бромсульфалеиновая проба. Проба с нагрузкой бромсульфалеином (бромфталеином, бромталеином) имеет целью исследование выделительной функции печени и основана на том, что вводимая внутривенно краска выделяется печенью с желчью. При поражении печени очищение крови от краски замедляется.
Суть бромсульфалеиновой пробы состоит в том, что натощак медленно вводят 5% стерильный раствор бром-
сульфалеина из расчета 5 мг на 1 кг веса. Пробы крови берут из вены другой руки через 3 и 45 минут после окончания инъекции. Проба считается отрицательной, если через 45 минут в крови остается не более 5% краски. Задержка более 6% краски расценивается как положительный (патологический) результат пробы. Процент задержки выделения бром-сульфалеина в общем пропорционален тяжести поражения печени.
В последние годы бромсульфалеиновая проба получила некоторое видоизменение (Tichy, 1964; 1970, Pelican и соавт., 1971) — процент задержки определяется дополнительно (кроме 3 и 45 минут) на 30-й минуте после введения красителя. Проба получила название двойной задержки бромсульфалеина и у 82% больных дает адекватные клиническим проявлениям данные, кроме того она позволяет с большей точностью определить не только тяжесть функционального нарушения печени, но и оценить его тип (портальный или билиарный).
Бромсульфалеиновую пробу применяют в основном при безжелтушных заболеваниях. Так как замедленное выведение краски наблюдается даже при самых небольших поражениях печени, эта проба относится к ценнейшим функциональным ее исследованиям.
Уевиридиновая проба. Наряду с бромсульфалеиновой пробой в последнее время стали применять пробу, оценивающую поглотительно-выделительную функцию печени с помощью красителя уевиридина. Краситель в крови определяется в 5 пробах взятых между 3-й и 7-й минутами после внутривенной инъекции из расчета 0,3 мг на 1 кг веса. Интенсивность окраски сыворотки определяется на спектрометре по сравнению с пробой крови, взятой до инъекции красителя. Диагностическое значение имеет период полувыделения красителя и кривые выделения, представленные графически. Так отме-
чено, что период полувыделения у больных с компенсированным циррозом печени находится между 4-й и 6-й минутами, с декомпенсирован-ным — между 7-й и 8-й минутами и при наличии дистрофических изменений — между 9-й и 25-й минутами. Еще большую перспективу проба приобретает при автоматической регистрации результатов исследования (Seifert, Janecki, 1966).
Специальные и функциональные методы дооперационной диагностики. Хроматическое дуоденальное зондирование. Для функционального исследования желчного пузыря и протоков широко применяют дуоденальное зондирование с сульфатом магния. Введенный в двенадцатиперстную кишку, он вызывает расслабление сфинктера Одди и сокращение желчного пузыря. Для оценки результата систематически регистрируют: 1) наличие или отсутствие болевой реакции на введение сульфата магния (при нормальной функции сфинктера такой реакции не должно быть); 2) время появления пузырной желчи (она поступает в двенадцатиперстную кишку спустя 5—11 минут после введения сульфата магния, в норме около 40—60 минут); 3) объем пузырной порции желчи (около 50— 70 мл).
Появление болевой реакции, отсутствие или замедление оттока пузырной желчи, увеличение ее объема являются признаками, указывающими па непроходимость или повышенное сопротивление сфинктера Одди. Разумеется, в дифференциально диагностическом отношении следует иметь в виду и эвакуаторную функцию желчного пузыря, проходимость пузырного, печеночных и общего желчного протоков, а также паренхиматозные поражения печени. Сопоставление результатов зондирования с данными последующей холе-цистохолангиографии способствует уточнению функциональной оценки сфинктера Одди.
Для определения патологии желч-
ного пузыря, пузырного протока и сфинктера Одди мы у 100 больных применили хроматическое дуоденальное зондирование или пробу Дальгра-до Фебрес. Эта методика основана на том, что метиленовая синька, принятая внутрь, обесцвечивается в печени и выделяется с желчью. При последующем поступлении в желчный пузырь она вновь окисляется и принимает первоначальную окраску. Благодаря этому пузырная желчь приобретает сине-зеленый (малахитовый) цвет. Так как восстановление цвета метиленовой синьки происходит только в желчном пузыре, то появление желчи, окрашенной в сине-зеленый цвет, точно соответствует началу раскрытия сфинктера Одди и тонического сокращения желчного пузыря в ответ на интрадуоденаль-ное введение сернокислой магнезии. Прекращение истечения окрашенной желчи свидетельствует об окончании периода сокращения желчного пузыря. Печеночная желчь имеет обычную окраску, пузырная — сине-зеленый, не мешающий микроскопическому исследованию.
В техническом исполнении хроматическое дуоденальное зондирование отличается от обычного только тем, что за 14 часов до начала исследования больной принимает в желатиновой или крахмальной капсуле 0,15— 0,2 г метиленовой синьки.
Г. И. Дихтенко (1971) предлагает новую методику ускоренного хроматического дуоденального зондирования с внутривенным введением 0,4% раствора индигокармина. Методика хроматического зондирования дает более точное представление о начале и конце истечения пузырной желчи. Отсутствие истечения окрашенной желчи у 80% больных свидетельствует о патологии пузырного протока и отключении желчного пузыря. У больных с постхолецистэкто-мическим синдромом окрашивание желчи свидетельствовало или о наличии оставленной части желчного пузыря, или о застое желчи в холе-
дохе при его расширении, связанном со стенозирующим папиллитом. Все эти данные свидетельствуют о перспективности данного метода.
Радиоизотопные исследования печени. В последнее время известные методы исследования функции печени при различной патологии дополнились радиоизотопными, позволяющими довольно часто получать объективные данные о поглотительной и выделительной функции печени, нарушении кровообращения и проходимости желчевыводящей системы. Применение практически безвредных радиоактивных изотопов, простота методов и возможность производить их у всех взрослых больных независимо от тяжести общего состояния даже в амбулаторных условиях делают эти методы ценными и перспективными.
Проба бенгальской
розой, меченной I131. Бенгальская роза избирательно поглощается и накапливается полигональными клетками печени и выделяется затем с желчью в кишечник. В связи с включением в ее состав радиоактивного йода возможна графическая запись скорости, уровня накопления и выделения краски печенью. Это осуществляется автоматически при помощи колламированного сцинтил-ляционного счетчика. Датчик прибора устанавливают над поверхностью печени. Второй датчик помещают над областью сердца или у головы в области ушной раковины, третий — над передней брюшной стенкой в проекции дуоденального изгиба.
Регистрация гамма-излучения в указанных 3 точках осуществляется непрерывно в течение 60—90 минут с момента внутривенного введения меченой бенгальской розы. Доза вводимого радиоактивного вещества соответствует 1 мккюри на 10 кг веса. При обтурационных желтухах и циррозах печени исследование затем дополняется регистрацией радиоактивности через каждые 2—4 часа в течение 24—72 часов.
По полученным кривым определяются следующие показатели: остаточная радиоактивность крови на 25-й минуте после введения препарата (в норме она должна быть не более 50% от радиоактивности на 4-й минуте); угол подъема гепатограммы (45° и более); время максимального накопления краски в печени (не более 32 минут); время выделения краски в кишечник (не более 30 минут).
Патологические состояния печени характеризуются замедлением клиренса крови, накоплением изотопа в печени и выделением его в кишечник. При механической внепеченоч-ной желтухе (если еще не наступило поражение паренхимы печени) отмечаются нормальные параметры поглощения и резко нарушается вследствие задержки желчи кривая выделения. Степень задержки находится в прямой зависимости от степени обтура-ции. В сочетании с клиническими и лабораторными данными проба с бенгальской розой, меченной I131, является существенным подспорьем в постановке правильного диагноза при желтухе неясного происхожден-ния. Портальный цирроз дает увеличение времени выделения до 6—9 часов, а билиарный цирроз — и того более. Нарушения определяются даже на самых ранних стадиях заболевания.
При помощи пробы с бенгальской розой, меченной I131, нам удалось также выяснить ряд параметров, наиболее достоверно определяющих степень функциональных нарушений печени при различных ее поражениях. Определение степени нарушения функцин печени необходимо для решения вопроса операбельности больного вообще и для выбора метода оперативного вмешательства в частности. Мы выделили 3 степени функциональных расстройств печени, которые представлены в табл. 2.
Приведенные данные в ряде случаев не полностью аналогичны данным клиники и определениям функ-
Таблица 2
Определение функции печени при помощи бенгальской розы, меченной I131
|
|
|
Степень функциональных |
расстройств | |
|
Наименование показателей |
Норма |
1 |
2 |
3 |
|
Время полуочищения крови от изото- |
|
|
|
|
|
па (в минутах) |
18,5 Т 1,4 |
30—40 |
50—70 |
80—100 |
|
Угол накопления изотопа (в градусах) |
45,2 ± 1,8 |
40—35 |
30—25 |
20—10 |
|
Время максимального накопления изо- |
|
|
|
|
|
топа в печени (в минутах) |
32,4 ± 1,6 |
40—50 |
50—60 |
60—70 |
|
Скорость накопления (импульсы |
|
|
|
|
|
в минуту) |
59,0 ± 2,5 |
до 40 |
до 30 |
до 20 |
|
Начало выделения изотопа из печени |
|
|
|
|
|
(в минутах) |
50,2 ± 2,1 |
60-65 |
70—75 |
80—90 |
|
Поступление изотопа в кишечник |
|
|
|
|
|
(в минутах) |
30,5 ± 1,5 |
до 40 |
до 50 |
60—70 |
ции печени биохимическими методами, однако даже основываясь на сравнительно небольшом опыте (500 исследований), мы можем сказать, что данный метод является чувствительным и надежным способом определения функционального состояния печеночной паренхимы и позволяет выявить наличие предрасположенности больных к развитию печеночной недостаточности в послеоперационном периоде.
Скеннирование печени. Метод (при наличии специальной электронной аппаратуры) прост и позволяет довольно точно определить функциональное состояние различных сегментов печени, ее положение, форму, размеры, выявить ее очаговые поражения (опухоли, метастазы, абсцессы, паразитарные и непаразитарные кисты, участки фиброза и др.). Для получения скеннограмм печени используют различные радиоактивные препараты, но чаще всего применяют коллоидное золото Аи198. После внутривенного введения регистрируют с помощью скеннера накопление изотопа в печени. Запись скеннограмм производится на высоте поглощения меченых соединений. Одновременная регистрация радиоактивности над селезенкой позволяет определить так называемый пече-ночно-селезеночный индекс, который в норме равен 4 j 1 — 10 ; 1.
При правильной технике исследования скеннирование позволяет определить объемное образование в печени диаметром около 2 см на глубине до 5 ел и образования не менее 4 еж в диаметре на глубине 10 см от поверхности печени. Хронические диффузные заболевания печени дают равномерное или беспорядочное понижение радиоактивности во всех сегментах печени. Цирроз проявляется уменьшением размеров изображения печени, резким снижением радиоактивности над ней и понижением неченочно-селезеночного индекса. Имеются указания, что этот индекс имеет определенное прогностическое значение: индекс ниже 1,5 свидетельствует о прогрессировании цирроза, при индексе 2,5 и больше — прогноз более благоприятен.
В последнее время используют цветное скеииирование, дающее более точные результаты. Находит клиническое применение также скеннирование желчного пузыря (Е. Д. Фур-маненко, А. С. Шпонтак и С. А. Шалимов, 1973).
В заключение следует подчеркнуть, что радиоизотопное исследование печени является единственным методом, позволяющим получить представление одновременно о нескольких функциях органа.
Рентгенологические исследования. Обзорная рентгенография органов жи-
вота является первоначальным и обязательным методом специального обследования больного с патологией печени и желчных путей. Уже при этом исследовании могут быть обнаружены обызвествленные камни желчного пузыря, эхинококковые кисты и абсцессы печени. Обнаружение газа в желчных путях на обзорных рентгенограммах может свидетельствовать о недостаточности клапанной функции сфинктера Одди, о наличии спонтанного желчно-кишечного свища или ранее наложенного анастомоза. Кроме того, обзорная рентгенограмма дает отчетливое представление о положении, размерах и форме печени и селезенки, а также у ряда больных позволяет судить о возможной патологии соседних органов (обызвествленные камни поджелудочной железы, почек, мочевого пузыря).
Иногда для правильной трактовки необходимо иметь снимки в боковых проекциях, снимки на фоне пнев-моперитонеума и штевморетропери-тонеума. Все эти мероприятия способствуют целенаправленному назначению более сложных исследований и правильной трактовке контрастных рентгенограмм.
Исследование сен пищевода и кар-диального отдела желудка. Показаниями к применению данного исследования является наличие гепатоли-еналытого синдрома различной этиологии, портальная гипертензия, асцит, неясные пищеводно-желудочные кровотечения. Приготовление контрастного вещества для этой цели отличается от обычного тем, что взвесь сернокислого бария должна быть более вязкой, чтобы получить лучшее обволакивание слизистой оболочки и более рельефное ее изображение. Исследование проводят в положениях стоя и лежа, а также в косых проекциях после частичного опорожнения пищевода и расслабления его стенок. Наличие округлых или овальных дефектов наполнения, располагающихся группами или цепочками, а также нечеткость и расширение пище-
вода являются постоянными признаками варикозного расширения его вен.
Исследование желудка и двенадцатиперстной кишки. Грыжа пищеводного отверстия диафрагмы, язва желудка и двенадцатиперстной кишки, гастрит, дуоденит, дуоденальные дивертикулы, желчно-кишечные фистулы, дуоденобилиарный рефлюкс, колит нередко сочетаются с патологией печени и желчных путей и это обусловливает необходимость рентгеновского исследования желудочно-кишечного тракта у всех больных.
Для желудка является общепринятой методика рентгеновского исследования, но для двенадцатиперстной кишки этого недостаточно, и поэтому широко распространена гипотоническая, или релаксационная ду-оденография (в условиях искусственной гипотонии двенадцатиперстной кишки).
Если больной перенес трансдуоденальную сфинктеропластику или наложение холедоходуоденального анастомоза, то исследование необходимо проводить в положении Трен-деленбурга или гиперпрессии брюшной стенки — ретроградное заполнение желчных путей контрастной взвесью и затем (на снимках через 15 и 30 минут при вертикальном положении больного) возвращение ее в кишку свидетельствует о хорошем результате бывшей операции. Чрезмерное расширение и замедленное опорожнение холедоха являются признаками, указывающими на сужение билиодигестивного анастомоза или рестеноз сфинктера Одди. Задержка остатка контрастной взвеси под холе-доходуоденальным анастомозом является признаком ретродуоденального «слепого мешка».
При раке головки поджелудочной железы отмечается сглаженность складок медиального контура вертикальной части кишки, ригидность ее стенки на этом уровне (при раздувании через зонд), «симптом двойного занавеса», «симптом перевернутой 3».
В более поздних стадиях поражения определяется дефект наполнения вплоть до циркулярного сужения. Рак большого дуоденального сосочка при размере опухоли более 1 см проявляется дефектом наполнения с неровными краями в соответствующей зоне двенадцатиперстной кишки.
Различные вдавления и деформации по передненаружному контуру верхнего отдела нисходящей части двенадцатиперстной кишки свидетельствуют об увеличении желчного пузыря вследствие его опухоли или переполнения желчью при обтурации холедоха. Расширение дуоденальной петли может быть признаком увеличения головки поджелудочной железы вследствие хронического панкреатита, опухоли или панкреатической кисты.
Гипотоническая дуоденография является очень ценным методом и для обнаружения дуоденальных дивертикулов, которые нередко локализуются в области фатерова сосочка и являются причинным фактором для заболеваний желчных путей и поджелудочной железы.
Холецистохолангиография. Принцип этого исследования основан на способности печени выделять с желчью рентгеноконтрастные йодистые препараты после их перорального или внутривенного введения. Для пероральной холецистографии применяют билитраст и его импортные аналоги — холевид (Югославия) и иопагност (Чехословакия). Для внутривенной холангирграфии используют отечественный препарат: би-лигност, а также импортные—холе-графин, билиграфин, адипиодон и другие.
Выделение указанных препаратов с желчью в большой мере зависит от состояния печени, степени нарушения ее поглотительно-выделительной функции. При желтухах с повышением сывороточного билирубина сверх 1 мг% уже не удается получить достаточного контрастирования желчного пузыря и протоков, а при гиперби-
лирубинемии более 2 мг% контрастирование, как правило, не удается вовсе, и данное исследование в таких случаях нецелесообразно. Отмечено также, что при гипоальбуминемии ниже 3,5 г% и снижении коэффициента А/Г ниже 1,0 холангиография не удается — все контрастное вещество выделяется почками.
Учитывая указанные факты, перед данным исследованием следует всегда обратить внимание на состояние функций печени и по возможности улучшить их. С этой целью Э. И. Гальперин и М. М. Островская (1964) рекомендуют следующую подготовку больного:
В течение 3 дней перед исследованием назначают диету, обогащенную углеводами, а внутривенно вводят 40% раствор глюкозы с аскорбиновой кислотой. Накануне исследования раствор глюкозы вводят дважды — утром и вечером. Кишечник очищают с помощью касторового масла, карболена и очистительной клизмы. Для опорожнения желчного пузыря накануне исследования больной принимает 2 яичных желтка.
Если производят пероральную холе-цистографию, то билитраст в количестве 3—4 г больной принимает за 14—15 часов до исследования. Утром делают первый снимок, больному дают два яичных желтка для сокращения желчного пузыря. Через 1,5 часа после этого снимок повторяют.
При патологии желчного пузыря метод пероральной холецистографии у 50—70% больных дает отрицательные результаты или неотчетливое его контрастирование. Контрастирование холедоха наблюдается крайне редко, только при отсутствии поражения гепатобилиарной системы.
Более эффективна внутривенная холангиография. После предварительной пробы на индивидуальную переносимость билигност в дозе 40— 60 мл 20% раствора медленно вводят в вену. Одновременно с контрастным веществом вводят 30 мл 40% раствора глюкозы с аскорбиновой кислотой. Рентгенограммы делают через 30, 60 и 120 минут после введения билигноста. Затем на 120-й минуте под контролем экрана делают 3—4 прицельных снимка желчного пузы-
ря с дозированной компрессией. После дачи желтков повторяют снимки для выяснения сократительной функции желчного пузыря.
Внутривенная холангиография дает отчетливое контрастирование внутри- и внепеченочных желчных протоков и желчного пузыря. В большинстве случаев она позволяет выявить камни пузыря и протоков, определить степень дилатации их, деформации стенок и сужения.
При исследовании больных, ранее перенесших холецистэктомию и имеющих пониженную функцию печени, применяют так называемую инфузионную холангиографию. Методика отличается тем, что билигност (1 мл 20% раствора на 1 кг веса) вводят капельно в 150 мл 5% глюкозы в течение 25—30 минут. При таком способе совершенно безопасно удается вводить до 80—100 мл билигноста и получить достаточное контрастирование протоков даже при повышенных цифрах билирубина и низком содержании белка. Если контрастирование недостаточное, внутривенно вводят 0,5 мл раствора морфина. Вызывая спазм сфинктера Одди, он способствует большему накоплению билигноста в желчи. Томография также существенно повышает разрешающую способность внутривенной и инфузионной холангиографии и находит все более широкое применение. Наш опыт применения инфузионной холангиографии у 183 больных убедительно подтверждает высокую диагностическую ценность и безопасность этого исследования.
Следует, однако, отметить, что приблизительно у 15—20% людей внутривенная и инфузионная холангиография не дает достаточных сведений для диагноза. В ряде случаев вообще не наступает видимого контрастирования желчных путей. Кроме того, иногда наблюдаются побочные реакции на билигност — озноб, жар, тошнота, боль в эпигастральной области, кожный зуд, коллапс, кратковременный ларингоспазм. В та-
ких случаях хорошо вводить хлористый кальций, десенсибилизирующие и антигистаминные препараты (димедрол, супрастин, пипольфен, диазолин). Все эти явления кратко-временны и не представляют серьезной опасности для здоровья.
Абсолютными противопоказаниями к внутривенной холангиографии являются острые заболевания печени и почек, атрофия печени, анурия, тяжелые формы базедовой болезни, тетания, декомпенсированные пороки сердечно-сосудистой системы, непереносимость йодистых препаратов. Относительными противопоказаниями являются подострые и тяжелые хронические заболевания печени, острый холангит, панкреатит.
Чрескожная чреспеченочная холангиография. У больных желтухой применять внутривенную и инфузионную холангиографию не только бесполезно, но даже опасно, так как она может спровоцировать развитие печеночной недостаточности. Так, Hess в 1961 г. сообщал о 28 случаях смерти после внутривенной холангиографии у больных желтухой. В подобных условиях единственной возможностью для до-операционной рентгенодиагностики состояния желчных путей является чрескожная чреспеченочная холангиография. Принцип этого метода заключается в прямой пункции расширенных внутрипеченочных желчных ходов, через которые осуществляется введение контрастного вещества.
В нашей стране к настоящему времени накоплен уже большой опыт применения чрескожной чреспеченоч-ной холангиографии (Б. А. Ланда, 1961; В. В. Виноградов с соавт., 1963; Л. М. Шор, И. Б. Розанов и 3. А. Топчиашвили, 1966; Ф. А. Братин, 1968; А. А. Шалимов и Г. А. Клименко, 1968; А. А. Шалимов и соавт., 1969; В. В. Виноградов и соавт., 1969). Однако реальная возможность серьезных осложнений, которые не всегда можно предусмотреть, заставляет многих отказываться от использования этого метода.
Наш опыт применения чрескож-ной чреспеченочной холангиографии у 160 больных позволяет утверждать, что ценность сведений, полученных при данном исследовании, значительно превышает риск осложнений, который при соблюдении необходимых условий и осторолшости является относительно небольшим.
Применение чрескожной чреспеченочной холангиографии показано при неясном диагнозе у больных желтухой. Этот метод позволяет до лапаротомии поставить точный топический и этиологический диагноз нарушений оттока желчи. Исключительно ценной чрескожная чрес-печеночная холапгиография является при холедохолитиазе, при нарушениях проходимости большого дуоденального сосочка и, в особенности, при повторных операциях на желчных путях, когда приходится встречаться с особенно сложными анатомическими взаимоотношениями.
Из множества предложенных пункционных доступов мы отдаем предпочтение боковому межреберному доступу:
Берут длинную иглу диаметром 1 — 1,5 мм. Вкол ее производят в VIII или IX межреберье справа, в промежутке между передней и средней подмышечной линиями. Затем во время дыхательной паузы игла быстро продвигается на глубину около 15 см в направлении на мечевидный отросток. Если конец иглы попал в желчный ход, то по ней вытекает желчь. Если же этого не случилось, иглу медленно, миллиметр за миллиметром, потягивают обратно, пока из нее не появится желчь. После этого с помощью аппарата Вальд-мана измеряют остаточное давление в желчных путях и под контролем рентгеноскопии (рештенотелевиденвя) медленно вводят 20—60 мл 35% раствора кардиотраста или другого аналогичного вещества (ги-пак, урографин, верографин, диодот, три-умбрен и др.), подогретого до температуры тела. Наблюдение за прохождением контрастного вещества проводят в течение 10—15 минут, а в наиболее демонстративные моменты производят кинохолангиогра-фию и отдельные снимки.
В конце исследования желчь максимально отсасывают через иглу, а при извлечении иглы в пункционный канал через ее просвет вводят специальную пасту,
изготовленную на основе окислительной целлюлозы.
Эта паста разработана сотрудниками Харьковского научно-исследо- ] вательского института общей и неот- i ложной хирургии в содружестве с 1 сотрудниками Харьковского химико-фармацевтического института. Она ■ обладает выраженным гемостатиче-ским и пломбирующим действием. С тех пор как мы стали применять эту пасту, не было случаев кровотечения и просачивания желчи из пунк-ционного канала печени в брюшную полость.
Благодаря отчетливому контрастированию внутри- и внепеченочных желчных ходов чрескожная чреспе-ченочная холангиография обладает высокой дифференциально-диагностической точностью и у большинства больных позволяет с большой достоверностью до операции судить о периоде заболевания, уровне обту-рации желчных путей, а также выбрать наиболее правильный способ оперативного лечения, а иногда отказаться от него.
При опухолях внепеченочных желчных протоков на холангиограм-мах отмечается полный обрыв контрастной ткани, чаще в виде воронки, суженной частью направленной диста льно, на уровне расположения опухоли. У ряда больных виден краевой дефект наполнения протока.
Рак большого дуоденального соска чаще всего является препятствием к прохождению контраста в двенадцатиперстную кишку, иногда он проходит в виде узкой струи, огибает опухоль и попадает в дуоденум. Попадание контраста в вирсунгов проток может служить отличительным признаком опухоли большого дуоденального соска от опухоли головки поджелудочной железы, при которой может наблюдаться полный отрыв тени в протоках на уровне дистальных его отделов и ворот печени в зависимости от вовлечения в процесс гепато-дуоденальной связки.
Полное прерывание тени контраста на различном уровне внепече-ночных желчных протоков дает и закупорка их одним или несколькими камнями, иногда верхний полюс камня создает вид полулунного дефекта наполнения, а вентильный камень на фоне расширенного протока и дефекта наполнения создает картину частичного прохождения контраста в дистальный отдел протока и двенадцатиперстную кишку.
Полный блок проходимости контраста создает рубцовый стеноз желчных протоков. Чаще всего в этих случаях расширение тени проксимального отдела протока заканчивается извитым сужением каналов с ровными краями (этим картина отличается от ракового поражения, при котором контуры канала изъедены и зазубрены, как и при хроническом панкреатите). При неполных стенозах этот извитый ход заканчивается тенью контраста в двенадцатиперстной кишке. Рубцовое поражение обычно занимает 1,5—2 см протока с резким расширением надстенотического участка вне- и внутрипеченочных протоков с наличием контрастной тени желчного пузыря или без нее в зависимости от уровня стеноза и причины его возникновения (рубцовый стеноз холедоха после холецистэк-томии).
Незаменимым методом доопера-ционной диагностики является чрес-кожная гепатохолангиография при врожденной атрезии желчных путей, которая позволяет в большинстве случаев определить вид атрезии и составить план предстоящей операции. Если при первой пункции получить желчь не удается, делают повторные в несколько другом направлении, ориентируясь на область ворот печени. Если же 3—4 попытки оказываются безуспешными, можно предполагать, что желтуха паренхиматозного происхождения и расширения желчных ходов нет. В таком случае исследование заканчивается пункци-онной биопсией печени.
Хотя с усовершенствованием техники и появлением рентгенотелевизи-онной аппаратуры риск осложнений сведен к минимуму, при резко выраженной желчной гипертензии мы все же рекомендовали чрескожную чрес-печеночную холангиографию проводить непосредственно перед операцией, чтобы полностью исключить опасность желчного перитонита. Она особенно реальна при полной закупорке главного желчного протока опухолью. При холелитиазе, рубцовых стриктурах холедоха и стенозе сфинктера Одди, когда непроходимость желчных путей частично сохранена, серьезных осложнений мы не наблюдали, несмотря на то что исследование у большинства больных не сопровождалось операцией в тот же день.
После окончания чрескожной чреспеченочной холангиографии больной должен быть под постоянным врачебным контролем. При появлении признаков подтекания желчи в брюшную полость (сильная боль, симптомы раздражения брюшины) необходима срочная лапаротомия для устранения препятствия к оттоку желчи в кишечник и дренирования брюшной полости. Своевременное оперативное вмешательство в таких случаях предотвращает развитие желчного перитонита.
У неоперабельных больных с резко выраженной холемией или когда операция требует длительной подготовки и не может быть выполнена тотчас по другим обстоятельствам, чрескожную чреспеченочную холангиографию следует заканчивать так называемой пункционной холангио-стомией. Ее можно выполнить в 2 вариантах.
1. Тонкую инъекционную иглу удаляют, а по ее ходу вводят длинную иглу Вира с насаженным на нее полиэтиленовым катетером, так что выстоит лишь кончик иглы. Кожу и поверхностную фасцию в месте пункции предварительно рассекают остроконечным скальпелем. Под контролем рентгеноскопии иглу
и катетер продвигают в направлении крупного внутрипеченочного желчного хода. Иглу тотчас извлекают обратно, так что в печеночной ткани остается только полиэтиленовый катетер. Если он не попал в желчный ход, то его медленно подтягивают, пока не потечет желчь. После этого катетер подшивают к коже и оставляют в качестве наружного желчного дренажа.
2. Вместо тонкой инъекционной иглы в крупный внутрипеченочный желчный ход вводят под контролем рентгеноскопии толстую канюлю с просветом в 1,5—\,8мм. Через просвет этой канюли вводят тонкий полиэтиленовый катетер. Затем канюлю удаляют, а катетер остается в качестве дренажа.
Правильно введенный полиэтиленовый катетер обтурирует пункцион-ный канал в печени, предотвращая кровотечение и просачивание желчи в брюшную полость, дренирует желчь наружу. Это приводит к уменьшению желтухи, нормализации функции печени и процессов свертывания крови. Через холангиостомическую трубку можно вводить антибиотики (при холангите) или в процессе динамического наблюдения производить контрольные холангиографии.
После пункционной холангиосто-мии необходимы постельный режим и внимательное наблюдение за больным, так как возможно подтекание желчи мимо катетера вследствие его вторичного смещения.
Из существенных осложнений мы трижды (до введения в практику указанной выше пасты) наблюдали обильное истечение желчи в брюшную полость, 1 раз — кровоизлияние в брюшную полость и 1 раз — тяжелую вспышку хронического хо-лангита у больной, ранее перенесшей 4-кратную пластику холедоха.
Противопоказаниями к чрескож-ной чреспеченочной холангиографии являются геморрагический диатез, непереносимость препаратов йода, острые заболевания почек, эхинокок-
коз печени. Относительными противопоказаниями мы считали гнойный холангит и абсцессы печени, гнойные процессы в правой плевральной полости и в нижней доле правого легкого.
Фистулохолангиография. При наличии дренажной трубки в протоках или наружного желчного свища после операций холантиографию осуществляют при введении контрастного раствора через фистулу. Фистулохолангиография, как и чрескож-ная чреспеченочная холангиография, дает возможность получить снимки высокого качества. Обычно обнаруживается, что обильное истечение желчи из дренажа или существование свища обусловлено остаточной патологией — камнями холедоха и большого дуоденального сосочка, стенозом сфинктера Одди. Фистулогра-фия позволяет обнаружить послеоперационные стриктуры желчных протоков, оценить их характер и протяженность, а также наметить наиболее рациональный план реконструктивной операции. Наш опыт 180 холангиографии через дренажи и фистулы показывает исключительную роль этого метода для постановки диагноза, определения прогноза заболевания и выбора наиболее подходящего срока для удаления дренажа.
Спленопортография. Принцип этого метода состоит в чрескожной пункции селезенки, введении в ее пульпу концентрированного раствора контрастного вещества и серийной рентгенографии системы воротной вены. Обычно спленопортография сочетается со спленопортоманометрией, так как практически давление в селезенке соответствует давлению в воротной вене.
Благодаря отчетливому изображению селезеночной, воротной вены, а также внутрипеченочных разветвлений последней, спленопортография в сочетании с манометрией является ценным диагностическим приемом и позволяет установить наличие и степень портальной гипертензии, диф-
ференцировать внутрипеченочный и пнепеченочный блок портальной системы, обнаружить очаговые поражения печени.
Спленопортографию применяют при пищеводно-желудочных кровотечениях неясной этиологии, сплено-мегалиях неизвестного происхождения, для определения причины нарушений портального кровообращения, при подозрении на тромбоз или сдав-ление селезеночной и воротной вен (хронический панкреатит и рак поджелудочной железы), для оценки пригодности селезеночной и воротной вен к наложению венозных анастомозов, выявления путей коллатерального кровотока, функции наложенного портокавального анастомоза, выявления раковых метастазов, эхинококка и абсцессов печени.
Противопоказано применение спленопортографии при непереносимости препаратов йода, острых заболеваниях паренхимы печени, тяжелой почечной недостаточности, резких нарушений свертывания крови-Исследование может быть проведено с использованием обычной рентгеновской аппаратуры, но в настоящее время мы, как и при чрескожной чреспеченочной холангиографии, пользовались ангиографической установкой с электронно-оптическим преобразователем и рентгенотелевизи-онной приставкой. Это позволяет производить исследование в незатем-ненной комнате, с минимальным облучением больного и персонала.
Положение больного — лежа на спине, левая рука запрокинута за голову. Пальпацией, перкуссией и рентгеноскопией уточняем границы селезенки. При спленомегалии пункцию ее производят ниже реберной дуги, при нормальных размерах — в VIII или IX межреберье, между средней и задней подмышечными линиями. Иглу диаметром 1,5—2 мм направляют внутрь и наискось снизу вверх. После того как она проходит брюшную стенку, больной задерживает дыхание, и иглу вводят в
пульпу селезенки на глубину 2 — 2,5 см. Дыхательные движения иглы и появление из нее крови свидетельствуют о правильном ее положении. К ней подключают аппарат Вальд-мана и производят манометрию. В норме давление в селезенке 80—140 мм вод. ст. После этого под контролем рентгенотелевидения мы производили пробную инъекцию контрастного вещества, для удостоверения правильного положения иглы. Подключали ее с помощью гибкой трубки к автоматическому инъектору. Среднее количество вводимого контрастного раствора — 40 мл, инъекционное давление — 2 — 3 кг/см2. Сериограф включают после введения 2/з заданной дозы контрастного вещества-Производится 5—6 снимков с интервалом в 1 секунду. При отсутствии автоматического инъектора, контрастное вещество вводят плавно шприцом в течение 4—7 секунд (20— 30 мл) и с интервалом 1,5—2 секунды делают 3—4 рентгеновских снимка. В качестве контрастного вещества используют диодон, гипак, кардио-траст в концентрациях 70—75%. В последнее время стали вводить би-лиграфин (20 мл 50% раствора) или билигност (30 мл 20% раствора) в этих случаях снимок, сделанный через 4 секунды, является спленопор-тограммой, через 15—25 минут — холангиограммой, а через 1,5—2 часа — холецистограммой. Исследование носит название спленопортохо-лангиографии. После исследования иглу удаляют. Во время проявления снимков больной остается на месте под постоянным наблюдением врача. К месту пункции прикладывают пузырь со льдом. Через 15—20 минут на каталке больного доставляют в палату. В течение суток назначают постельный режим и строгое врачебное наблюдение с регистрацией пульса и артериального давления. На 140 спленографий мы лишь 1 раз наблюдали внутрибрюшное кровотечение, потребовавшее экстренной спленэкто-мии. Других серьезных осложнений
не отмечалось. Попадание контрастного вещества под капсулу селезенки или в брюшную полость вызывало иногда выраженную болезненность в левом подреберье с иррадиацией в надплечье и шею.
Применение местной анестезии с премедикацией у взрослых и общего обезболивания с добавлением миоре-лаксантов у маленьких детей, правильная техника исследования и согласованность действий хирурга и рентгенолога позволяет избежать осложнений и получить высококачественные снимки.
Т рансумбиликалъная портография. Этот метод исследования применим по тем же показаниям, что и спленопортография, но преимущественно у больных с удаленной селезенкой, при технических неудачах сплепопортографии и пониженной свертываемости крови, когда пункция селезенки грозит кровотечением. Пупочную вену обнажают срединным разрезом длиной около 4 см на 2— 3 см выше пупка. Вскрытия брюшной полости при этом не требуется, вена в в^де плотного тяжа расположена под апоневрозом, в рыхлой пред-брюшинной клетчатке, несколько справа от срединной линии. Ее берут на лигатуру и вскрывают. Чаще она облитерирована и выделения крови из нее нет. Бужирование по направлению к печени производят металлическими бужами или моче-точниковыми катетерами. После преодоления некоторого препятствия на глубине около 5—6 см по ходу вены и получения характерного ощущения «проваливания», из просвета вены после извлечения зонда начинает поступать кровь. Иногда это отмечают лишь после введения в вену полиэтиленового катетера и отсасывания через него крови шприцом. Катетер вводят на глубину до 7 см. После измерения портального давления вводят контрастное вещество и на сернографе делают рентгеносним-ки. Исследования можно производить также на обычном рентгенов-
ском аппарате. Для этого лучше вводить контрастное вещество шприцом в 2 приема по 20—30 мл, каждую дозу за 2—3 секунды. После введения 1-й дозы делают снимок, затем, быстро заменив кассету, через 2— 3 секунды после введения 2-й дозы делают второй (Г. Е. Островерхов с соавт., 1969). Данная методика позволяет получить исследования сосудов воротной вены, включая мелкие сосуды паренхимы печени 5— 7-го порядка и более. После исследования катетер удаляют, вену перевязывают, а рану брюшной стенки зашивают наглухо.
Илеопортография (мезентериалъ-ная портография). Этот метод применяется в случаях, когда спленопортография или трансумбиликальная портография по каким-либо причинам невозможны (например, после спле-нэктомии и использования пупочной вены во время прежней операции). Исследование производят в операционной. После небольшой лапарото-мии в правой подвздошной области в рану выводят петлю подвздошной кишки. Выделяют одну из ее вен диаметром 2—2,5 мм. Дистальную часть ее перевязывают, а в проксимальную вводят полиэтиленовый катетер на глубину 2—4 см. Производят флебоманометрию, отражающую давление в портальной системе. Шприцем плавно вводят 15—20 мл контрастного вещества и делают снимок. Катетер удаляют, центральный конец вены перевязывают, лапаротом-ную рану закрывают наглухо.
По сути, это исследование представляет собой настоящую полостную операцию и чаще всего производят во время основного хирургического вмешательства. Поэтому оно лишь условно может быть отнесено к дооперационным методам исследования.
Селективная целиакография и ангиография верхней брыжеечной артерии. Метод избирательной арте-риографии при заболеваниях печени находит все более широкое при-
. менение в нашей стране (X. Д. Кулиева и Ю. Д. Волынский, 1963; Г. Г. Шаповальянц, 1967; А. А. Шалимов с соавт., 1968; Г. А. Клименко, 1969).
Рентгеноконтрастный катетер Эд-мана с заранее сделанным изгибом его кончика вводят в аорту по методике Сельдингера через правую или левую бедренную артерию. После удаления проволочного проводника кончик катетера приобретает первоначальный изгиб и относительно легко вводят под контролем рентгеноте-левидения в чревной ствол или, если необходимо, в верхнюю брыжеечную артерию. Положение внутреннего катетера проверяют с помощью пробной инъекции 3—4 мл контрастного раствора. Затем наружный конец катетера подключают к автоматическому инъектору и вводят 30 мл контрастного вещества (кардиотраст, ди-одон, гипак, верографин и т. п.) под давлением 3—4 кг/см2. Серио-граф включается автоматически при введении 2/3 дозы контрастного раствора. Первые 4 снимка производят с интервалом 0,5 секунды, последующие 4 — с интервалом в 1 секунду. Если необходимо зафиксировать и венозную фазу ангиографии, производят еще 2—4 снимка с интервалом 1—2 секунды.
Ввиду вариабельности артериального снабжения печени нередко после целиакографии возникает необходимость дополнительной ангиографии верхней брыжеечной артерии. В таких случаях кончик катетера переводят в эту артерию и аналогичным способом производят мезентерико-графию.
После проявления снимков катетер удаляют, а место пункции бедренной артерии прижимают пальцем на 20—30 минут. Больного на каталке доставляют в палату, в течение суток он соблюдает строгий постельный режим.
Описанная методика позволяет получить на пленке артериальную, капиллярную (паренхиматозную) и
венозную фазы ангиографии. Благодаря этому легко распознаются анатомические варианты печеночных артерий, диагностируется цирроз печени и ( в венозную фазу) состояние портальной гемодинамики, удается распознать очаговые поражения и травмы печени. Венозные фазы целиакографии и мезентерикографии по характеру информации тождественны спленопортографии и илеопорто-графии соответственно.
Первичные злокачественные опухоли печени, как правило, богато васкуляризованы и поэтому легко обнаруживаются на ангиограммах. Характерным признаком является наличие «опухолевых сосудов», которые распознаются по их беспорядочному расположению, узурациям и отсутствию постепенного сужения к периферии. Опухолевые сосуды пенетрируют новообразование со всех сторон, имеют частые обрывы и неправильные расширения так называемые «опухолевые лужицы». Контрастное вещество длительно задерживается в них и в капиллярной фазе дает интенсивное пятнистое затенение опухоли. В венозной фазе соответственно расположению новообразования определяется бессосудистая зона, так как вены инфильтрированы опухолью и не проникают в ее массу.
Метастатические новообразования печени также получают кровоснабжение за счет печеночных артерий, но они не обнаруживают такого большого числа патологических опухолевых сосудов, как первичные гепато-карциномы, и поэтому труднее выявляются. Характерным признаком является полукруглое смещение артериальных веточек, особенно выраженное по периферии метастаза, а также тупые углы бифуркаций сосудов у метастазов. Во время капиллярной фазы определяются различной величины дефекты затенения печени, которые придают гепатограмме пятнистую структуру. У ряда больных, отмечается увеличение размеров пе~-
чени. Затруднена оценка гепатограм-мы при множественных небольших или единичных метастазах. В связи с этим отрицательная гепатограмма не исключает наличия небольших метастатических очагов. Тем не менее, диагностическая эффективность селективной артериографии печени в выявлении метастазов выше, чем возможности всех остальных методов.
Дифференциация между злокачественными опухолями и кистами печени основывается на том, что паразитарные и непаразитарные кисты являются бессосудистыми новообразованиями сферической формы и довольно четко отграничены от здоровой ткани. На ангиограммах определяется дугообразное смещение артерий в сторону роста кисты, но никогда не бывает узураций и ампутаций сосудов, характерных для опухолей.
Ангиографические данные при циррозах печени больше зависят от стадии процесса и размеров печени, чем от гистологического типа и этиологии цирроза. В ранних стадиях, при жировой инфильтрации и увеличении печени, определяется расширение, удлинение и выпрямление печеночных артерий, в то время как в стадиях фиброза и сморщивания печени ее артерии суживаются и свертываются в виде «штопоров». При далеко зашедших стадиях цирроза деформация сосудов становится особенно выраженной, а периферические участки печени оказываются полностью бессосудистыми. Большое значение при ангиографии цирро-тически измененной печени имеет оценка внепеченочных изменений. Спленомегалия, расширение селезеночной и верхней брыжеечной артерий, усиление сосудистого рисунка и капиллярного окрашивания в системе верхней брыжеечной артерии — довольно постоянные и характерные признаки портального застоя. В венозной фазе можно определить расширение вен портальной системы и наличие коллатералей.
Реогепатография. Реография, или электроплетизмография печени, — это исследование функции кровообращения, основанное на регистрации изменений сопротивления ее ткани проходящему через нее электрическому току. Запись реограммы осуществляется при расположении электродов над областью печени. Имеется зависимость между изменениями сопротивления живых тканей, в том числе и печени, электрическому току и колебаниям, кровенаполнения сосудов исследуемого органа в соответствии с фазами сердечного цикла. При поражениях печени, особенно при циррозе, кровенаполнение ее нарушается, это сказывается на характере реогепатограммы. Для того чтобы сопоставить реограммы с фазами сердечного цикла, производят синхронную запись ЭКГ во II стандартном отведении.
У здорового человека главная систолическая волна реогепатограммы имеет крутое восходящее колено, вершина ее соответствует зубцу Т на электрокардиограмме и начинается через 0,1—0,18 секунды после зубца Q (ЭКГ). Длительность подъема систолической волны равна 0,3 секунды.
Реографический индекс, характеризующий амплитуду систолической волны, больше 1,0.
При циррозах печени отмечается значительное снижение амплитуды систолической волны вплоть до ее нивелирования при тяжелых формах. Иногда реографическая кривая бывает деформирована, с систолическим плато в виде горизонтальной линии, в ряде случаев с наличием на ней мелких волн. У части больных с циррозом печени на реогепатограмме отмечается подъем волны в диастоле (Л. И. Геллер, 1967) и куполообразный характер кривой с продолжительной платообразной вершиной (В. С. Гинсбург с соавт., 1970). Реографический индекс колеблется в пределах 0,3—0,7. Выраженные изменения на реогепатограммах при
поражениях печени отмечены даже в тех случаях, когда клинические признаки еще незначительные, а биохимические показатели удовлетворительные (В. С. Груминский, 1966; Л. И. Геллер, 1967). Однако опыт клинической оценки реогепатограмм невелик и заключения авторов, по данным литературы, весьма неуверенны.
Пункционная биопсия печени. Предложены различные типы игл для пункционной биопсии печени (А. Ф. Блюгер и М. П. Синельникова, 1962; X. X. Мансуров и С. Н. Кутчак, 1964; В. А. Шусь, 1967; Silverman, 1938; Roholm и Jersen, 1939; Menghini, 1959). Чаще всего используют принцип Мен-гини как наиболее простой и достаточно падежный. Применяют иглу с заостренным торцом и стилетом. Диаметр ее — от 1 до 2 мм. Под местной анестезией иглу со стилетом проводят транспариеталыш к поверхности печени. Затем стилет удаляют, а к игле присоединяют сухой шприц. Коротким энергичным толчком при одновременной аспирации шприцем иглу внедряют в ткань печени на глубину 2—3 см и сразу же извлекают. Получается столбик печеночной ткани, вполне пригодный для приготовления из него гистологических срезов.
При подозрении на механическую желтуху мы применяли иглу Шуся. Благодаря своей конструкции и прилагаемому к ней винтовому шприцу, эта игла позволяет сочетать пунк-ционную биопсию с чрескожной чрес-печеночной холангиографией и пломбировать пункционный канал гемо-статической массой. Хотя это и усложняет исследования, но зато надежно предупреждает кровотечение и развитие желчного перитонита. Выбор места пункции зависит от размеров печени. При гепатомегалии мы использовали передние подреберные доступы, обычно в правом ребер-но-мечевидном углу. Иглу направляют вверх и кзади. При неувеличен-
нои печени пункцию производили справа в VIII—IX межреберье, в промежутке между передней и средней подмышечными линиями в пределах печеночной тупости, или использовали забрюшинное поле печени. Обычно иглу вводят в печень по направлению на мечевидный отросток, как это было описано для чрескожной чреспеченочной холангио-графии.
Более чем на 100 биопсий мы только в одном случае наблюдали серьезное осложнение вследствие технической погрешности — ранение желчного пузыря с желчеисте-чением в брюшную полость.
Как показывает опыт многих исследователей и наши собственные наблюдения, пункционная биопсия печени является хорошим методом, позволяющим различить внутри- и внепеченочный холестаз. Однако интерпретация морфологических данных иногда чрезвычайно сложна, что в значительной степени снижает ценность этого метода в дифференциальной диагностике желтух. При вну-трипеченочном холестазе патологические процессы захватывают все би-лиарное дерево, отмечаются пролифе-ративные и атрофические изменения эпителия междольковых желчных ходов, расширяется их просвет, определяются желчные тромбы и экстравазаты. Наряду с этим определяется и пролиферация стромы. Внутрипе-ченочный холестаз, охватывая желчные капилляры, не выходит за пределы долек.
Механическая желтуха отличается отсутствием пролиферативной реакции ретикулоэндотелия и дистрофических изменений паренхимы, определяется холестаз, который, однако, трудно отличить от внутрипе-ченочного (3. А. Бондарь, 1970).
Особую ценность пункционная биопсия приобретает для прижизненной идентификации морфологических вариантов цирроза печени — постнекротического, портального и билиар-ного. Пункционная биопсия позво-
ляет выявить признаки активности цирроза и прогрессирование цирро-тического процесса, о чем свидетельствует выраженная воспалительная реакция вокруг очагов гибели клеток печени и проникновение инфильтрации в паренхиму, выраженная вас-куляризация, активная ее регенерация.
Еще большее значение пункцион-ная биопсия печени приобретает в связи с внедрением гистохимических методов и электронной микроскопии.
Лапароскопия. Метод лапароскопии к настоящему времени хорошо разработан и находит широкое применение в отделениях гепатологиче-ского профиля (А. С. Логинов, 1964; В. В. Виноградов, 1964, и др.).
Исследование (лапароскопия) может быть произведено как под наркозом, так и под местной потенцированной анестезией.
На границе наружной и средней трети линии, соединяющей пупок с передней верхней остью левой подвздошной кости, делают пункцию брюшной полости и через иглу пнев-моторакалышм аппаратом или шприцем Жане вводят воздух или кислород от 2 до 3,5 л. Затем троакаром производят лапароцинтез в точке, расположенной на 3—4 см влево и выше пупка. После удаления стилета вводят лапароскоп под углом 60° к брюшной стенке по направлению к правому соску. Ориентиром в брюшной полости служит круглая связка печени. Осмотр производят по ходу часовой стрелки, начиная с правой доли печени.
При лапароскопии хорошо виден цвет печени, зеленоватый при обту-рационной желтухе, красноватый при остром гепатите и «пестрый» при хроническом. Определяются также поверхность печени и характер ее краев. Метастатические опухолевые узлы имеют беловато-желтый и желтовато-красный цвет. Виден желчный пузырь, спавшийся при опухоли в воротах печени и резко растянутый при обтурации на уровнехоледоха.
Нередко лапароскопию сочетают с пункционной биопсией печени или чрескожной чреспеченочной холан-гиографией (холецистохолангиографи-ей). Это позволяет визуально контролировать возможное кровотечение и желчеистечение из пуикционного канала и своевременно предпринять необходимые профилактические меры. Мы, однако, у большинства больных предпочитали производить эти исследования «вслепую», так как это значительно проще, и, как правило, исключает необходимость последующей лапароскопии.
Она не всегда может быть произведена у больных, ранее перенесших операции на органах верхнего отдела брюшной полости. Тем не менее этот метод является очень ценным и заслуживающим самого широкого клинического применения.
Фибродуоденоскопия. В последние годы в практику диагностики хирургических заболеваний все больше внедряются методы прямых эндоскопических исследований. Особенно популярной стала эндоскопия органов пищеварительного тракта после изобретения фиброскопа. Для практики печеночной хирургии особую ценность приобрела фибродуоденоскопия. Для этой цели используют фибродуодено-скоп «Олимпус» (тип В). Перед исследованием больного подвергали премедикации (за 30—40 минут внутримышечно вводили 2 мл 0,1% раствора метацина, за 5 минут — внутривенно 1,5—2 мл 0,1% раствора сернокислого 'атропина и 4 мл 10% раствора глюконата кальция). Непосредственно перед исследованием анестезию глоточного кольца проводили 1 % раствором дикаина. После введения фиброскопа в двенадцатиперстную кишку отыскивали большой дуоденальный сосок, который находится обычно на медиальной поверхности нисходящего отдела дуоденум в нижней трети продольной складки и выступает в просвет в виде невысокого скошенного холма с основанием треугольной формы,
иногда сосок расположен не на его вершине, а несколько ниже, ближе к задней стенке. По форме большой дуоденальный сосок чаще всего выглядит удлиненным (42%), полукруглым (30%) или плоским (22%) (Gat-ton, 1972). Форма его нередко зависит от тонуса кишки. Цвет большого дуоденального соска от бледно-розового до гиперемированного, иногда он покрыт белым налетом (хронический папиллит), легко кровоточит, в ряде случаев имеет изъязвления (рак). Отверстие чаще точечное, иногда достигает 0,2—0,7 мм. При отсутствии патологических изменений в протоках желчь выделяется в виде желтой струйки, при желтухе поступление желчи не отмечается. Примерно у 1/4 больных большой дуоденальный сосок обнаружить не удается. После осмотра области соска под визуальным контролем производят его канюлирование тефлоновым зондом, через который под контролем телевизионного экрана вводят контрастное вещество (60% раствор верографина, 70% раствор урографи-на или 50% раствор гипака). Для контрастирования панкреатического протока достаточно 2—5 мл контраста, для желчных протоков — 20— 40 мл, в ряде случаев удается контрастировать и желчный .рузырь.
Наш опыт фибродуоденоскопиче-ских исследований (более 100) позволяет высоко оценить диагностические возможности этого сравнительно нового метода для определения уровня блокады желчных протоков, наличия заболеваний самого соска, диагностики патологии панкреатического протока, однако метод имеет и свои существенные недостатки, к сожалению, сокращающие показания к его применению.
Во-первых, не удается измерять давление в желчных протоках и учесть время опорожнения, что исключает диагностику этим методом стенозирующих папиллитов.
Во-вторых, не всегда удается контрастировать желчный пузырь даже
при отсутствии окклюзии его протока, что в значительной мере затрудняет диагностику заболеваний желчного пузыря и выработку плана оперативного вмешательства.
В-третьих, наиболее грозным предостережением к увлечению этим методом является повышение уровня амилазы в сыворотке крови и моче после подобных исследований (от 20 до 70% случаев, по данным различных авторов). И хотя мы не наблюдали развития тяжелых острых панкреатитов, однако выраженная болевая реакция с повышением температуры, ознобом и амилазурией свидетельствовали о неблагоприятном влиянии исследования на гепато-билиарно-панкреатическую систему у ряда больных.
Ретроградное контрастирование желчных протоков следует применять лишь у ограниченного контингента больных с рецидивирующими формами желтухи неясной этиологии, когда причину ее нельзя установить другими методами исследования.
ИССЛЕДОВАНИЯ ВО ВРЕМЯ ОПЕРАЦИИ
Несмотря на то что современные способы дооперационного исследования дают возможность с высокой точностью определить диагноз, окончательное представление о характере патологии печени и желчных путей хирург может получить лишь во время операции. От этого зависит выбор основного оперативного вмешательства, и поэтому операционная диагностика имеет важное значение.
Осмотр и пальпация. Для операции следует выбирать разрез, дающий не только хороший доступ к печени и желчным путям, но и позволяющий провести тщательное и полное обследование остальных органов брюшной полости, чтобы исключить заболевания, симулирующие поражение печени и желчных путей. По-
 сле
вскрытия брюшной полости тщательно
разделяют имеющиеся сращения,
чтобы сделать хорошо видимыми желчный
пузырь и печеночно-две-надцатиперстную
связку с ее элементами. При повторных
операциях нужно
быть осторожным, чтобы не повредить
органы брюшной полости, спаянные
с париетальной брюшиной. Передняя
поверхность печени, сальник,
желудок и поперечно-ободочная
кишка с осторожностью отделяются
от брюшной стенки. Печеночный изгиб
толстой кишки, двенадцатиперстная
кишка, желудок и сальник
обычно бывают плотно сращены с
нижней поверхностью печени. Эти органы
необходимо отделить от печени
острым путем. Лучше всего начинать его
вдоль переднего края печени, справа
палево. Отделение должно
быть произведено далеко кзади,
чтобы подойти к винслову отверстию.
Часто наблюдаются плотные
спайки между двенадцатиперстной
кишкой, пузырным ложем и воротами
печени. Здесь необходима наибольшая
осторожность, чтобы при отделении
двенадцатиперстной кишки
не нарушить ее серозный покров и
не вскрыть желчные протоки и кровеносные
сосуды.
сле
вскрытия брюшной полости тщательно
разделяют имеющиеся сращения,
чтобы сделать хорошо видимыми желчный
пузырь и печеночно-две-надцатиперстную
связку с ее элементами. При повторных
операциях нужно
быть осторожным, чтобы не повредить
органы брюшной полости, спаянные
с париетальной брюшиной. Передняя
поверхность печени, сальник,
желудок и поперечно-ободочная
кишка с осторожностью отделяются
от брюшной стенки. Печеночный изгиб
толстой кишки, двенадцатиперстная
кишка, желудок и сальник
обычно бывают плотно сращены с
нижней поверхностью печени. Эти органы
необходимо отделить от печени
острым путем. Лучше всего начинать его
вдоль переднего края печени, справа
палево. Отделение должно
быть произведено далеко кзади,
чтобы подойти к винслову отверстию.
Часто наблюдаются плотные
спайки между двенадцатиперстной
кишкой, пузырным ложем и воротами
печени. Здесь необходима наибольшая
осторожность, чтобы при отделении
двенадцатиперстной кишки
не нарушить ее серозный покров и
не вскрыть желчные протоки и кровеносные
сосуды.
После этого производят внимательную ревизию органов брюшной полости. Начинать осмотр и пальпацию следует с печени. Исследованию подлежит как видимая часть, так и невидимая область купола, правая гепатокостальная область и левая доля. Определяют размеры печени, ее внешний вид и консистенцию.
Затем хирург тщательно осматривает и пальпирует желчный пузырь, для определения в нем камней, их количества и размеров. Тщательно исследуют желудок и двенадцатиперстную кишку (возможность язвенной болезни), пищеводное отверстие диафрагмы, для исключения диафрагмальной грыжи. Далее исследование продолжается осмотром селезенки и почек. Затем приподни-
мают поперечную ободочную кишку и осматривают все толстые и тонкие кишки, червеобразный отросток, органы малого таза. Такое широкое исследование следует проводить систематически, чтобы не пропустить сопутствующие заболевания.
Тракцией за круглую связку печень подтягивают книзу и кпереди, чтобы возможно большую часть печени отвернуть кверху вокруг правого реберного края. От этого внепе-чеиочные желчные пути и связанные с ними сосуды приближаются к передней брюшной стенке и становятся более доступными для дальнейшего исследования.
Между печенью и печеночным изгибом толстой, двенадцатиперстной кишек и правой почкой прокладывают большую влажную салфетку, а поверх нее — печеночное зеркало. Вторую салфетку прокладывают между печенью и дистальным отделом желудка и двенадцатиперстной кишкой. Ассистент, стоящий напротив хирурга, слева от больного, сильно оттягивает желудок и двенадцатиперстную кишку книзу, положив указательный палец слева, а остальные 3 пальца справа от общего желчного протока.
Затем хирург захватывает шейку желчного пузыря окончатым зажимом, слегка потягивает за нее и начинает препаровку ножницами. Действуя больше тупым методом, он вскрывает брюшину над пузырным протоком и сдвигает ее в сторону. Препаровка продолжается книзу вдоль пузырного протока до его устья. Рассекают брюшину поверх общего желчного протока, подводя под нее изогнутый зажим и раздвигая его бранши. Диссекцию продолжают до тех пор, пока не будет совершенно изолирован пузырный проток и станет хорошо видимым то место, где он впадает в общий желчный.
При этом оценивают ширину пузырного протока (в норме имеет диаметр, равный толщине спички) и общего желчного (диаметр по-
следнего равен 4—8 мм). Расширение пузырного протока и множественные мелкие камни в желчном пузыре свидетельствуют, в частности, о том, что эти камни скорее всего свободно проходят в общий желчный проток. Расширение последнего свыше 10 мм следует рассматривать как признак желчной гипертензии. Если же диаметр холедоха колеблется между 8 и 10 мм, то необходимо в дальнейшем тщательно его исследовать, так как очень вероятно наличие препятствия к оттоку желчи, скорее всего в области сфинктера Одди.
Следует иметь в виду, что нормальный калибр общего желчного протока при одновременном увеличении желчного пузыря еще не исключает возможность патологии сфинктера Одди. Желчный пузырь обладает функцией предохранительного клапана, расширяясь, он играет декомпрессивную роль и предохраняет протоки от их расширения.
После осмотра хирург помещает указательный палец в винслово отверстие, пальпирует дистальный отрезок пузырного протока и холедох между указательным и большим пальцами. Надо внимательно искать камни, которые могут быть мелкими и очень подвижными, замазкообраз-ную желчь, которая обычно нечетко пальпируется, а также определить пальпаторно толщину стенки общего желчного протока и ее напряжение. Хирург должен абсолютно точно идентифицировать общий желчный проток. При воспалении и повторных операциях это иногда трудно, так как проток по внешнему виду мало отличается от воротной вены. Хорошим ориентиром может быть культя пузырного протока после холецистэк-томии, которую всегда следует найти во время диссекции и иссечь, если она слишком длинная. В сомнительных случаях хирург должен аспирацией желчи при помощи шприца и иглы подтвердить свою уверенность, что он имеет дело с общим желчным протоком.
При обнаружении склеротичного желчного пузыря небольших размеров и симптомах холедохолитиаза следующим этапом операционной диагностики является исследование терминального сегмента холедоха и поджелудочной железы. Для этого, как и для вероятной последущей сфинктсропластики, необходима мобилизация двенадцатиперстной кишки по Кохеру. Рассекают брюшину вдоль выпуклого края двенадцатиперстной кишки, начиная от места прикрепления брыжейки поперечно-ободочной кишки и доходя кверху до винслова отверстия. Предварительно целесообразно ножницами рассечь сращения и низвести печеночный изгиб толстой кишки, чтобы освободить нисходящую часть двенадцатиперстной от проходящей в поперечном направлении брыжейки поперечно-ободочной кишки. При этом следует остерегаться повреждения средней ободочной артерии. Затем, расслаивая пальцами забрюшинную клетчатку, приподнимают двенадцатиперстную кишку вместе с головкой поджелудочной железы и отворачивают их влево. Тогда становятся видимыми нижняя полая вена и задняя поверхность головки поджелудочной железы, а также место внедрения в последнюю ретродуоденального отдела холедоха.
Низведение печеночного изгиба и мобилизация по Кохеру обычно легко выполнимы и происходят бескровно. Даже у полных больных эти приемы позволяют вывести двенадцатиперстную кишку до плоскости кожного разреза.
Помещая 4 пальца левой руки позади двенадцатиперстной кишки, а большой впереди, хирург может уверенно пальпировать область большого дуоденального соска и головку поджелудочной железы. Нормальный сосок не прощупывается, фиброти-чески измененный пальпируется в виде отчетливого уплотнения. Камни соска определяются довольно четко. Можно попытаться сместить их квер-
ху в холедох, но форсировать это мероприятие не следует. Рак большого дуоденального соска иногда довольно трудно отличить от рубцо-вого стеноза и камня, но при известном опыте и настороженности это вполне возможно.
Если возникает необходимость осмотреть всю поджелудочную железу, то следует широко раскрыть сальниковую сумку путем рассечения между лигатурами желудочно-ободочной связки у большой кривизны желудка.
При хроническом панкреатите, вызванном стенозом сфинктера Од-ди, поджелудочная железа поражена на всем протяжении, она бывает увеличенной или, наоборот, уменьшенной, атрофированной. Консистенция ее плотная, а при далеко зашедшем фиброзе становится хрящевой плотности, рисунок долек исчезает, капсула утолщена, поверхность бугристая. Почти всегда в сальниковой сумке бывают значительные сращения. Иногда фиброз определяется отдельными очагами, между которыми ткань железы относительно нормальная. Иногда при сильном расширении вирсунгова протока он прощупывается в виде зыбкого тяжа. Часто определяются интрапанкреатические псевдокисты, которые нередко ошибочно расценивают как злокачественные опухоли.
На основании своего опыта и некоторых данных литературы мы считали, что осмотр и осторожная пальпация желчных протоков и поджелудочной железы являются довольно точными методами операционной диагностики. Однако на результаты этих исследований влияют многие факторы. Так, если головка поджелудочной железы плотная и узловатая, то определить камни в дистальном отделе холедоха трудно. Точность исследования значительно понижается также из-за плотных спаек после предыдущих хирургических вмешательств и воспалительных процессов.
Поскольку же успех хирургического вмешательства целиком зависит
от точности диагноза и полноты one-ративного пособия, то вполне оправдано применение любых других спо- собов, помогающих это осуществить. В этом отношении большое диагностическое значение имеют холан-гиоманометрия, дебитометрия желчных путей и холангиография во время операции.
Холангиоманометрия и дебитометрия. Холангиоманометрию чаще всего применяют в сочетании с операционной холангиографией, и эти 2 метода объединены под общим названием «рентгеноманометрия». Как известно, были описаны 2 ее основных метода. Метод Mallet—Guy разделяет манометрическое и холангиогра-фическое исследования и при помощи воздушного манометра, соединенного с записывающим барабаном, позволяет сделать графическую запись стабилизации давления после гипер-прессии до 400—600 мм вод. ст. Метод Mallet — Guy сочетает холан-гиографическое и манометрическое исследование с помощью аппарата, заполненного рентгеноконтрастным веществом и дающего возможность получить постоянное перфузионное давление.
Метод Mallet-Guy позволяет определить только остаточное давление. В норме, по данным автора, в общем желчном протоке оно равно 80— 140 мм вод. ст. Это определение гораздо проще и в то же время достаточно полно отображает функциональное состояние сфинктера Одди и вне-печеночных желчных протоков. Поэтому метод Mallet—Guy в разных модификациях получил наибольшее распространение и хорошо описан в нашей литературе (В. В. Виноградов и соавт., 1966). Особенного внимания заслуживает наиболее простая методика 3. А. Цхакая (1962) и В. П. Захарова (1972), при которой используется манометрическая трубка с тройником (рис. 8).
В противоположность манометрическому исследованию, метод деби-тометрии менее известен, он еще не
Рис. 8. .Манометрия желчного протока:
а) по 3. А. Цхакая — длина манометрической трубки 75 см, диаметр 7 мм; б) устройство манометра и
дебитометра по В. В. Виноградову. 1 — водяной манометр; 2 —дсбитометр; 3 — сосуде перфузион
ной жидкостью; 4, — нивелир; 5 — резиновые трубки; в — интубационная канюля.
получил должного распространения 2) при постоянном оттоке в еди-
и по-разному оценивается разными ницу времени регистрировать необ-
хирургами (Э. И. Гальперин и ходимое для этого давление.
М. Д. Куничан, 1969; В. Н. Ларин и Выбранное авторами первого из
И. Ф. Корниенко, 1971; В. В. Вино- указанных способов давление в 300 мм
градов и В. Н. Корнеев, 1972). вод. ст. соответствует секретор-
Принцип метода дебитометрии ос- ному давлению печени и определя- нован на том, что через определенное ется как стандартное давление. Ко- сечение (в данном случае сечение—от- личество жидкости, протекающей че- верстие функционирующего большого рез сосочек в течение 1-й минуты дуоденального соска) при определен- при стандартном давлении и получи ном давлении будет оттекать опреде- ло название дебита, ленное количество жидкости. Если Как отмечает Mattig, против де- при постоянном давлении изменяется битометрии этим способом теоретиче- сечение отверстия, то изменяется и ски могут быть предъявлены некото- количество оттекающей жидкости, рые возражения. Так как в желчных Если же меняется площадь сечения, путях с нормальной функцией сос- количество оттекающей жидкости ка давление колеблется от 60 до остается неизменным и соответствую- 150 мм вод. ст. (в среднем 100 мм щим образом изменяется давление, вод. ст.), то давление в 300 мм вод.
Исходя из этого, к определению ст. подвергает сосочек нефизиоло-
функции большого дуоденального со- гической нагрузке. Кроме того, точ-
ска можно подойти принципиально ное измерение количества нротекаю-
2 путями: щей жидкости технически сложнее
1) при постоянном давлении и является менее точным, чем изме-
измерять количество протекающей рение давления перфузии. Поэтому
жидкости в единицу времени; с физиологической и измерительно-
технической стороны лучшим представляется 2-й путь. С помощью пер-фузионного аппарата в желчные протоки вводят постоянное количество жидкости, равное 2 мл/мин. (по расчетам, такое количество жидкости должен пропускать большой дуоденальный сосок при постоянном токе, чтобы обеспечить отток суточного количества желчи и панкреатического сока). Возникающее при этом давление регистрируется чувствительным электроманометром.
Мы использовали для дебитомет-рии прибор Вальдмана, с помощью которого определяли и остаточное давление.
Перед лапаротомией пулевая точка прибора устанавливается на уровне фатерова сосочка, который приблизительно соответствует середине боковой поверхности тела больного, лежащего на спине. После лапарото-мии и удаления желчного пузыря, без излишней травматизации и зондирования холедоха, которые могли бы вызвать отек и спазм сфинктера Одди, пузырный проток интубируют хлорвиниловой трубкой диаметром 2—3 мм , на которой его временно перевязывают.
Если холецистэктомия была сделана раньше, то можно использовать избыточную культю пузырного протока. Если и этого условия пет, то холедох пунктируется толстой иглой, собственный дебит которой должен быть предварительно проверен.
Затем желчные пути заполняют физиологическим раствором под давлением 300 мм вод. ст. и производят троекратное измерение остаточного давления. Давление, равное 150—160 мм вод. ст., должно вызывать подозрение на наличие препятствия к оттоку желчи и требует уточнения диагноза с помощью дальнейшего исследования. Давление выше 160 мм вод. ст. является достоверным признаком желчной гипертензии и свидетельствует о необходимости хирургической коррекции.
Для дебитометрии градуирован- ный сосуд с физиологическим раство- ром но отношению к шкале прибора устанавливается таким образом, чтобы уровень жидкости в нем соответствовал отметке 300 мм. Трехходовым краном открывают свободный отток физиологического раствора из сосуда. Последний по мере вытекания жидкости перемещают вдоль шкалы вверх так, чтобы уровень жидкости постоянно соответствовал 300 мм. Отмечают объем жидкости в миллилитрах, вытекающей из сосуда за 1 минуту. Дебит ниже 20 мл/мин вызывает подозрение на затруднение оттока желчи и требует проведения дальнейшей холангиографии, ниже 15 мл мин — указывает на нарушение оттока, требующее лечения.
Следует учитывать, что на показателях холангиоманометрии и дебитометрии может существенно сказываться местная травма в области пузырного и общего желчного протоков. Осторожная пальпация мало влияет на эти показатели, но препаровка пузырного протока и особенно холедоха сопровождается рассечением многочисленных ветвей печеночного сплетения. Это приводит к временному понижению тонуса сфинктера и, следовательно, к некоторому понижению остаточного давления и увеличению дебита. Зондирование общего желчного протока и большого дуоденального сосочка вызывает отек последнего и спазм сфинктера Одди, то есть повышение остаточного давления и уменьшение дебита. Поэтому, если предполагаются указанные функциональные исследования, необходимо ограничиваться наименьшей травмой до их проведения. Пузырный проток в таких случаях следует ка-нюлировать, надрезая его, и измерения производить до холецистэктомии. Предварительно допускается лишь самое осторожное пальпаторное исследование желчных путей.
По нашим данным, дебитометрия является более чувствительным методом по сравнению с холангиоманомет-
рией, так как нередко даже при нормальных показателях остаточного давления дебит оказывается пониженным. Это соответствует и замедленному понижению водяного столба в манометрической трубке.
Применяя указанные чувствительные функциональные методы, необходимо учитывать также и то, что давление в желчных путях и показатели дебитометрии могут значительно изменяться под влиянием различных медикаментов, применяемых для подготовки к операции и наркоза. Остаточное давление в желчных путях повышается, а дебит уменьшается от морфина, не изменяется от до-лантина, скополамина, фепергана, барбитуратов, сукцинилхолинхло-рида, закиси азота, флюатана и претерпевает обратные изменения от атропина, хлорпромазина, кураре, эфира и амилнитрита (И. Литтманн, 1970). Исходя и.ч этого, следует избегать применения тех медикаментов, которые могли бы повлиять на результаты холангиоманометрии и дебитометрии.
Операционная холангиография. После измерения остаточного давления и дебита в желчные пути инъекционным шприцем под слабым давлением вводят контрастное вещество (20 мл 35% раствора кардиотраста, верографина и др.) и делают несколько снимков. Серия их необходима потому, что достоверность одного снимка может быть сомнительной. Сделанный в фазе сокращения сфинктера Одди, отдельный снимок может дать повод к гипердиагностике, так как холангиограмма в фазе сокращения имитирует его спазм или стеноз. Кроме того, важно, чтобы контрастный раствор был теплым и вводился под небольшим давлением. Несоблюдение этого правила может привести к нарушению тонуса сфинктера и ложным выводам.
Холангиография показывает калибр холедоха и наличие камней в желчных путях, а также характерное для стеноза конусовидное сужение
терминального сегмента сосочка. При полной закупорке большого дуоденального соска вклиненным камнем и некоторых формах стеноза сфинктера Одди, сопровождающих запущенный холелитиаз, холедох может быть расширен до 3 см. Однако при типичных формах стенозирую-щего оддита расширение более умеренное — до 12—16 мм.
На холангиограмме можно четко определить степень, характер и протяженность стеноза, а также наличие билионанкреатического рефлюкса, который мы наблюдали приблизительно в 40% случаев холангиографии при стенозе сфинктера Одди. Обнаружение рефлюкса при холангиографии дает возможность оценить ширину вирсунгова протока и определить, нет ли стеноза его терминального отдела .
Некоторые исследователи (Я. С. Котигер, 1967; А. П. Багателия, 1967) полагают, что рефлюкс желчи в панкреатические протоки является нормальным физиологическим явлением. Однако мы на основании своих многочисленных операционных и послеоперационных исследований с использованием рентгенотеле-видения и кинематографии разделяли мнение других исследователей (Dou-bilet и Mulhollaud, 1948; Mallet-Guy, 1960; Bevilacqua и Gallioli, 1967), которые считают, что рефлюкс связан с нарушениями тонуса сфинктера. По нашему мнению, при осторожном и медленном заполнении желчных протоков контрастным веществом его регургитации в вирсунгов проток не должно быть, так как давление в нем выше, чем в желчных путях (Nielubowicz, 1968). Однако при быстром и тугом заполнении холедоха может наступить спазм нормального сфинктера Одди с рефлюк-сом желчи в вирсунгов проток. Если же такой рефлюкс наблюдается при введении контрастного вещества под давлением не выше 300 мм вод. ст., это рассматривается как патологический признак, свидетельствую-
щий о папиллите, гипертонии или органическом стенозе сфинктера Од-ди. Аналогичное мнение высказывают В. И. Петров и О. Б. Поремб-ский (1964), В. П. Захаров (1971), А. В. Смирнов с соавт. (1972).
Характерно, что билиопанкреати-ческий рефлюкс наблюдается лишь у больных с легкой или умеренной дилатацией холедоха, то есть в ранних стадиях стеноза сфинктера Од-ди. При далеко зашедших стенозах с резким расширением холедоха реф-люкса мы не наблюдали. На этом основании можно сделать вывод, что рефлюкс в вирсунгов проток является ранним признаком нарушения проходимости сфинктера Одди, когда стенозирующий процесс еще локализован только вблизи отверстия большого дуоденального соска.
Mallet—Guy обсуждал и другой механизм рефлюкса желчи и дуоденального содержимого в вирсунгов проток. Речь идет о недостаточном тонусе всего сфинктерного аппарата, который делает возможным пассивный рефлюкс в вирсунгов проток. Хотя имеются сообщения об экспериментальном подтверждении такой возможности, все же предположение Mallet—Guy нуждается в дальнейшей проверке.
Наряду с билиопанкреатическим рефлюксом, который виден при хо-лангиографии, существует также папкреатобилиарный. Это подтверждается фактами увеличения уровня амилазы в желчи. Ретроградное забрасывание панкреатического сока в желчные пути вызывает расширение последних, их воспаление и про-потевание пузырной желчи в свободную брюшную полость, то есть ведет к желчному перитониту без перфорации желчного пузыря (Mallet— Guy; Bevilacqua и Gallioli).
При дифференциальном диагнозе доброкачественный стеноз сфинктера Одди следует прежде всего отличать от рака большого дуоденального соска. В то время, как рубцовый стеноз имеет на холангиограмме конусовид-
ные очертания, для рака характерно поперечное расположение линии обрыва контрастной тени с изъеденны- ми краями. Стеноз сфинктера никог- да не приводит к полной непрохо- димости большого дуоденального со- ска, если одновременно нет ущемлен- ного камня. Карцинома же вызывает полную закупорку протока.
При панкреатите с выраженным фиброзом головки поджелудочной железы также может обнаруживаться конусовидный («стреловидный») стеноз, но его протяженность явно больше — 2,5—3 см. Иногда обнаруживается трубчатый стеноз. Для него характерно начало у верхнего края головки поджелудочной железы, протяженность суженного участка значительно длиннее, чем при стенозе сфинктера Одди. Сосок в подобном случае может быть нормальным. Панкреатический трубчатый стеноз даже в далеко зашедпшх случаях не бывает тотальным, и это отличает его от непроходимости холедоха при карциноме головки поджелудочной железы.
Очень ценным признаком, на который другие исследователи почти не обращают особого внимания, является рефлюкс контрастного вещества во внутрипеченочные желчные ходы. При нормальной проходимости большого дуоденального сосочка контрастное вещество свободно оттекает в двенадцатиперстную кишку и не забрасывается в печеночные протоки. Лишь при чрезмерном повышении давления могут заполняться главные протоки. При стенозе сфинктера Одди контрастное вещество легче затекает кверху, чем в двенадцатиперстную кишку и туго выполняет даже мелкие внутрипеченочные ходы.
Несколько замечаний в отношении технического исполнения операционной холангиографии. Кассету с пленкой помещают под больным. В операционной это не совсем удобно и не дает достаточно качественных снимков. Поэтому применяется следующая техника холангиографии (Whi-tesall и Williams, 1971):
После мобилизации двенадцатиперстной кишки по Кохеру пленку размерами 6,25 х 7,5 см, обвернутую черной бума- гой, заключенную в полиэтиленовый па- кет и стерилизованную газом, помещают позади головки поджелудочной железы. В дальнейшем техника не отличается от обычной.
Этот метод дает возможность получить очень четкое изображение ди-стальных отделов общего желчного и панкреатического протоков.
Метод операционной холангиогра-фии достиг своего наивысшего развития благодаря применению новейшей рентгеновской аппаратуры с электронно-оптическим усилителем изображения и телевидением. Такая аппаратура значительно сокращает время исследования и позволяет наблюдать за заполнением и опорожнением желчных путей. На экране телевизора в незатемненной операционной вся бригада хирургов может наблюдать сокращение сфинктера Одди и характер поступления контрастного вещества в двенадцатиперстную кишку.
Хотя отдельные авторы (А. И. Не-чай, 1965) высказывают мнение о малой ценности и даже о вредности широкого применения описанных методов якобы ввиду опасности гипердиагностики, по нашему мнению, комплексное применение холангиомано-метрии, дебитометрии и холангио-графии во время операции, расширяет кругозор хирурга и улучшает диагностику поражений сфинктера Одди. Это способствует тому, что у каждого больного может быть произведена соответствующая операция в полном объеме. Наблюдения над большим числом людей после холецистэкто-мии показывают, что в настоящее время хирурги производят слишком мало подобных исследований. Современная хирургия желчных путей неотделима от этих тонких функциональных диагностических методов. Они должны быть применены в большинстве случаев первичных операций на желчных путях, а при повторных операциях — обязательными.
Зондирование большого дуоденального соска. Многие исследователи в диагностике стеноза сфинктера Одди придают первостепенное значение результатам зондирования сосочка через культю пузырного протока или холедохотомическое отверстие. Считают, что если зонд диаметром 3— 4 мм не проходит через ампулу сосочка или встречает значительное сопротивление, то имеется стеноз сфинктера Одди. Однако это правило требует критической оценки.
Во-первых, сила руки, толкающей зонд, не может быть точно измерена и скорее всего она во много раз превышает те физиологические давления, которые характерны для нормального желчетока. Во-вторых, камни фатерова сосочка иногда располагаются в дивертикулообразных углублениях и могут совершенно не препятствовать прохождению зонда и, следовательно, не диагностируются. И, в-третьих, даже при совершенно нормальной функциональной проходимости сфинктерного сегмента холе-доха и отверстия большого дуоденального соска зонд может не пройти в двенадцатиперстную кишку, задерживаясь в изгибах просвета или в слизистых складках ампулы.
Исходя из этого, мы не оценивали значение этого механического приема и таких функциональных методов, как холангиоманометрия, де-битометрия и операционная холангио-графия. Однако в общем комплексе исследований этот прием мы применяли систематически, сопоставляя его данные с результатами других исследований. Особенно ценным оказывается зондирование для определения локализации большого дуоденального соска и последующего хода операции. Пальпация холедоха и большого дуоденального соска на зонде значительно улучшает диагностику мелких камней, ускользающих от обычной пальпации — возникает характерное ощущение трения камня о металл (рис. 9).
Следует иметь в виду одно очень
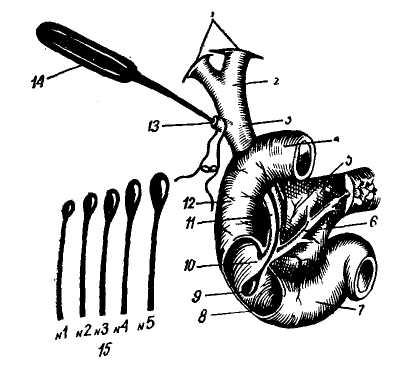
I — правый и левый печеночные протоки; 2 — общий печеночный проток; 3 — супрадуоденаль- ный отдел общего желчного протока; 4 — верх негоризонтальный отдел двенадцатиперстной киш ки; 5 — гололка поджелудочной железы; 6' — глав ный выводной проток поджелудочной железы; 7 — нижнегоризонтальный отдел двенадцатипер стной кишки; 8 — вскрыт просвет папиллярной зоны двенадцатиперстной кишки; » — олива зон да, проведенная через культю пузырного протока и большой дуоденальный сосок в двенадцатипер стную кишку; 10 — большой дуоденальный сосок;
II — панкреатический отдел общего желчного протока; 12 — вертикальный отдел двенадцатипе рстной кишки; 13 — культя пузырного протока; 14 — рукоятка зонда; 15 — набор зондов Доли- отти с разными диаметрами олив (но В. И. Ко-
чиашвили).
важное обстоятельство; зондирование большого дуоденального соска — процедура довольно травматичная и вызывает существенные изменения тонуса сфинктера Одди. Поэтому зондирование применяется в последнюю очередь.
Холедохоскопия. Недостаточная диагностическая эффективность перечисленных методов исследования привела к необходимости эндоскопического осмотра желчных протоков, особенно внимание хирургов привлек этот метод в связи с появлением эластических холедохоскопов (фи-брохоледохоскоп).
Холедохоскоп чаще вводят через разрез стенки холедоха в супрадуо-денальной его части. Осмотр возможен только после тщательного про-
мывания протоков под давлением, что уже само по себе усложняет методику, приводит к инфицированию брюшной полости, а в ряде случаев и к нарушению гемодинамики.
Введение холедохоскопа через пузырный проток значительно упрощает методику, однако это не всегда удается. Так В. Р. Пульмалису (1966) удалось выполнить его лишь у 25% больных. Короткий, суженный скле-розированный холедох, острый панкреатит являются противопоказаниями для холедохоскопии.
Холедохоскопия позволяет произвести осмотр слизистой оболочки (в норме она бледно-розовая), увидеть мелкие камни, прочно сидящие на стенке протока в виде темных пятен, оценить состояние устья большого дуоденального соска (в норме имеет вид звездчатой щели, при воспалении — воронки), отметить наличие даже небольшого количества замазки.
Возможность визуальной оценки состояния большого дуоденального соска и удаления мелких камней из желчных протоков под контролем зрения делает метод холангиоскопии особенно ценным, хотя и его, естественно, следует применять только как один из методов комплексной диагностики.
Г. Г. Караванов (1965) и М. 3. Сигал, Г. И. Дряженков (1968) применяют трансиллюминационное исследование желчных протоков. Однако мы не располагали соответствующим опытом, чтобы дать собственную оценку этому методу.
Заключая эту главу, можем отметить, что современная хирургия печени и желчных путей располагает достаточным запасом эффективных методов диагностики как до операции, так и на операционном столе. Правильное, систематическое и целенаправленное использование их позволит хирургу поставить более точный обоснованный диагноз и избежать многих ошибок, которые встречаются все еще часто.
Глава третья
Х ИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ ВРОЖДЕННЫХ ЗАБОЛЕВАНИЙПЕЧЕНИ
И ЖЕЛЧНЫХ ПРОТОКОВ
ИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ ВРОЖДЕННЫХ ЗАБОЛЕВАНИЙПЕЧЕНИ
И ЖЕЛЧНЫХ ПРОТОКОВ
С аномалиями развития печени хирургу чаще приходится сталкиваться случайно во время операций по поводу патологии других органов брюшной полости (М. П. Посто-лов, В. Ф. Юрьева, 1948; П. И. Юр-женко, 1954; Г. А. Баиров и соавт., 1970, и др.). Такие аномалии, как недоразвитие долей печени (чаще левой), добавочная печень или добавочные ее доли, странгуляционные борозды, многодольчатое строение, врожденная киста — практически не сказываются на развитии организма, не вызывают функциональных нарушений и чаще всего не требуют хирургической помощи. Аномалии развития желчного пузыря и пузырного протока требуют оперативного лечения лишь в случае возникновения осложнений. Аномалии же развития желчных протоков нуждаются всегда в срочной хирургической коррекции. Врожденные кисты печени. Ки-стообразное поражение чаще охватывает несколько органов брюшной полости, а киста печени является частью этого диффузного процесса. Она обычно встречается у взрослых, что связано с бессимптомностью течения заболевания до определенного времени и медленным ростом кист. Они в основном локализуются на нижней поверхности правой доли печени, но не исключаются и другие локализации. Растут кисты чаще всего в сторону брюшной полости, хотя могут полностью находиться
и в паренхиме печени. В широких пределах колеблется и их размер.
Характерным клиническим признаком является увеличение живота. У детей это единственный признак. У взрослых увеличение кисты может сопровождаться сдавленнем соседних органов, ее разрывом, нагноением и желтухой. Более поздним признаком является определение циркулярной тени на рентгенограмме при кальцификации стенок кисты.
В дооперационном периоде кисту печени следует дифференцировать с кистой яичников, почек, брыжейки, а также с опухолевыми процессами брюшной полости и пищеварительного тракта. Обнаружение кисты является показанием к операции, во время которой и устанавливают правильный диагноз. На операции наружная поверхность кисты гладкая, скользящая, в отличие от эхинококковой, отмечается низкое внутреннее давление жидкости, содержащей небольшое количество крови и желчи, отчего цвет ее может колебаться от светлого до желто-коричцевого. Стенка кисты обычно представлена плотным фиброзным слоем, покрытым изнутри цилиндрическим, уплощенным эпителием, подобным эпителиальной выстилке внутрипеченочных протоков. В наружном слое часто попадаются рассеянные между фиброзной сеткой соединительной ткани печеночные клетки и элементы желчных протоков (Schwartz, 1964).

Рис. 10. Аномалии желчных протоков.
а — добавочные печеночные протоки; б — циды абберантных желчных протоков, исходящих из
правой доли печени (схема по Olivier).
Хирургическое вмешательство за- Кисты больших размеров с нагное-
ключается или в радикальном иссе- нием и явлениями воспаления подле-
чении кисты, что не всегда выполнимо жат вскрытию и наружному дрени-
из-за большой травматичности, или рованию. В последнее время в прак-
в демукозации и ушивании оболочки тику оперативного лечения кист пе-
изнутри после обработки йодом с ис- чени внедрен внутренний дренаж пу-
сечением избытков ткани кисты и по- тем наложения анастомоза между
следующим наружным дренировали- кистой и желудком (Monheimer, 1953)
ем для предотвращения скопления или тонким кишечником (А. А. Ша-
секрета между листками оболочки, лимов, 1956).
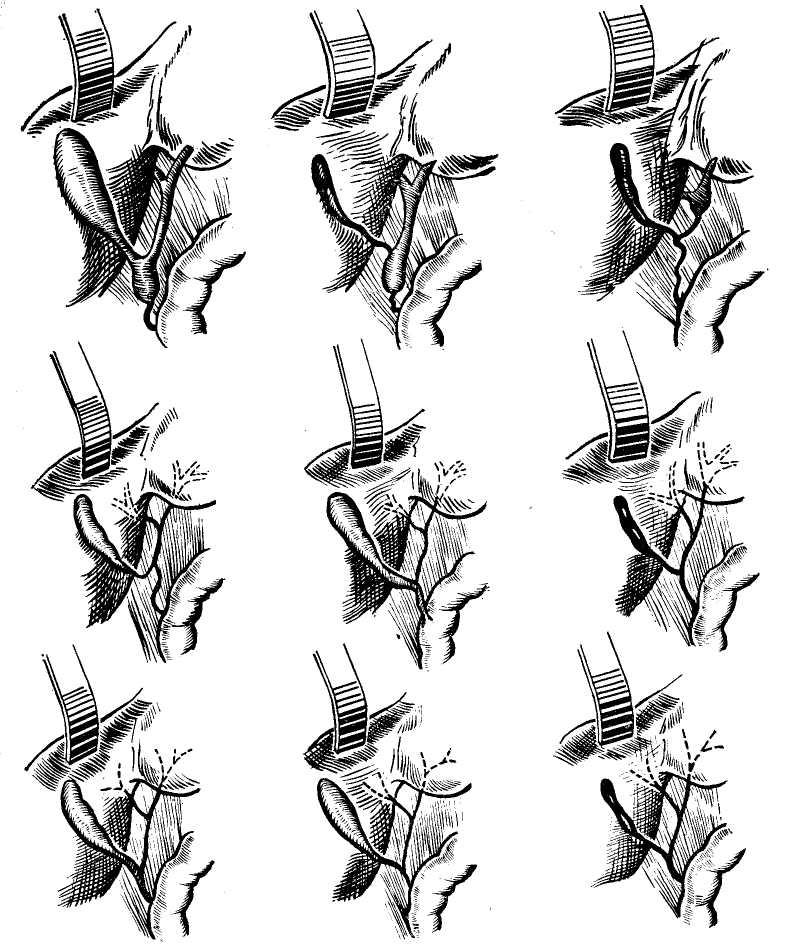
Рис. 11. Виды атрезий желчных протоков (по Г. А. Ваирову).
Врожденные пороки развития К ним относятся: атрезий желч-
желчевыводящих путей. По данным ных протоков, пороки развития об-
большинства авторов (Г. А. Баиров, щего желчного протока (рис. 10),
1968; Eisendrath, 1918; Lanraan, желчного пузыря и пузырного про-
1948; Everett, 1954; Kissewetter, тока.
1956, и др.), аномалии развития желч- Атрезия желчных протоков. Эта
ных протоков и желчного пузыря аномалия встречается у 1 ребенка
составляют 6—8%. из 20—30 тыс. новорожденных и
представляет собой один из тяжелых пороков развития. Различные причины, нарушающие нормальное развитие плода (с 4-й недели до 5 месяцев внутриутробной жизни), ведут к образованию различных вариантов атрезий.
Все виды атрезий желчных протоков можно разделить на 2 группы;
I. Атрезия внутрипеченочных желчных протоков.
Полная атрезия внутри-внепе- ченочных желчных протоков.
Атрезия внутрипеченочных желчных протоков при наличии желч ного пузыря.
Атрезия внутрипеченочных желчных протоков и наличие всех наружных желчных протоков.
II. Атрезия наружных желчных протоков.
Атрезия дистального отдела общего желчного протока.
Атрезия только печеночных протоков при наличии желчного пу зыря, общего и пузырного протоков.
3. Атрезия общего желчного, пузырного протоков и желчного пу зыря при сохранении общего печеноч ного и долевых протоков.
Атрезия желчного пузыря, об щего желчного и части печеночного протока.
Полная атрезия всех наружных желчных протоков.
Атрезия всех наружных желч ных протоков и наличие недоразвито го протока желчного пузыря.
В основу этого деления атрезий желчных протоков положена классификация Г. А. Баирова (1968) с учетом всех вариантов атрезий, которые встречались в нашей клинике и в хирургической практике до настоящего времени (рис. 11).
Мы наблюдали 15 больных с врожденной атрезией желчных путей, которые распределились следующим образом:
1 — полная атрезия внутрипеченочных и внепеченочных желчных протоков — 6 детей; 2 — атрезия внепеченочных желчных протоков
при наличии желчного пузыря — 1; 3 — атрезия только дистального отдела общего желчного протока — 5; 4 — атрезия общего желчного протока при сохраненности общего печеночного и долевых протоков — 2; 5 — полная атрезия всех наружных желчных протоков — 1 ребенок.
Основным клиническим признаком атрезий желчных протоков является желтуха, появляющаяся у ребенка в момент рождения и интенсивно прогрессирующая. Вскоре кожа, склеры, видимые слизистые оболочки приобретают шафранный оттенок. В крови отмечается быстрое нарастание билирубина (реакция прямая, быстрая), количество которого достигает 15—35 мг%. Желтуха не исчезает и не теряет своей интенсивности, в последующие 2—3 недели появляются кровоизлияния на коже и слизистых оболочках, умеренная анемия. Ребенка беспокоит кожный зуд, крик затихает только во время кормления, иногда наоборот возникает вялость и сонливость. В связи с отсутствием желчи в кишечнике нарушается всасывание жирорастворимых витаминов А, Д и К — развивается их дефицит (кератомаляция, рахит, кровоточивость).
С 1,5-месячного возраста страдает общее состояние, кожа сухая, ребенок не набирает положенного веса. За счет постоянного метеоризма и увеличения печени растет объем живота. Печень обычно к концу 1-го месяца увеличивается в 2—3 раза, край ее плотный, заостренный. Развивающийся билиарный цирроз печени приводит к внутрипеченочно-му блоку воротной вены, с последующим (в 2—3 месяца) увеличением селезенки, асцитом. Портальная ги-пертензия быстро ведет к образованию варикозно расширенных вен пищевода и желудка, которые в сочетании с пониженной свертываемостью крови ведут к желудочно-пище-водным кровотечениям. Повышенное внутрибрюшное давление у подавляющего большинства детей при-
водит к образованию пупочных и паховых грыж.
Вторым характерным признаком является обесцвеченный с рождения кал, хотя первичный стул может иметь нормальную зеленоватую окраску. У некоторых больных в более позднем периоде появляется слабое окрашивание кала, что связано с выделением некоторого количества желчных пигментов железами кишечного тракта, стеркобилин в кале отсутствует.
Моча темного цвета из-за увеличения в ней билирубина, в то время как уробилин и уробилиноген отсутствуют.
Нарушение функции печени отмечается в более поздние стадии заболевания (2-месячном возрасте). Повышается активность трансаминаз, особенно глютаминовооксалатовой до 400—500 ед. Еще позже увеличивается количество щелочной фосфа-тазы (более 20 ед.), снижается общий белок, становятся патологическими сахарные кривые, падает протром-биновый индекс, снижается количество фибриногена. Постепенно к 3 месяцам жизни ребенка нарушаются все функции печени, развивается печеночная недостаточность, нарастает кахексия и присоединяется инфекция. Дети погибают не доживая до 6 месяцев.
Наличие желтухи в периоде новорожденное™ — явление не редкое, поэтому приходится срочно в течение первых 3—5 недель поставить правильный диагноз и в одних случаях проводить консервативное лечение, исключив порок развития, в других — подвергнуть ребенка операции, не откладывая ее на более длительный срок.
В связи с этим для хирурга необходимо знание клинического течения желтух новорожденных, не связанных с атрезией желчных путей.
Физиологическая желтуха. 2/3 новорожденных переносят это состояние, связанное с повышенным разрушением эритроцитов плода в процес-
се их замещения новыми и функциональной недостаточностью печени, которая еще не в состоянии интенсивно выделять желчный пигмент. Жел-туха достигает своей наибольшей интенсивности к 5-му дню после родов и постепенно исчезает в течение 2 недель. Иногда она носит затяжной характер, особенно у недоношенных. Билирубин крови редко превышает 10 мг%, моча всегда наряду с желчными пигментами содержит уробилиноген. Стул несколько бледнее, но обычно окрашен.
Гемолитическая болезнь новорожденных в результате резус-конфликта, либо групповой несовместимости крови плода и матери проявляется выраженной желтухой, которая развивается вскоре после рождения. У детей с гемолитической желтухой отмечаются высокие цифры непрямого билирубина. Страдает общее состояние, прогрессирует анемия, отмечается увеличение печени и селезенки. Обменные переливания крови спасают жизнь ребенка, способствуют уменьшению желтухи и снижению уровня билирубина. Для дифференциального диагноза имеет значение определение групп крови матери и ребенка и резус-принадлежности.
При тяжелых формах гемолитической болезни, с желтухой более 10 дней, большое количество желчного пигмента делает желчь вязкой, она забивает собой желчные канальцы и протоки, вызывая частичную или полную непроходимость желчевыво-дящей системы. Введение в двенадцатиперстную кишку раствора сернокислой магнезии (Г. А. Баиров, 1957; Moore, 1953; Gellis с соавт., 1954, др.) или внутривенно деколи-на (Gross, 1953; Schwartz, 1964) являются как лечебным средством, так и дифференциально-диагностическим мероприятием. Иногда введение желчегонных средств не дает должного эффекта и, в связи с полной непроходимостью желчевыводящего тракта, возникает необходимость операции
с промыванием протоков физиологи-гическим раствором.
В легких случаях подобной закупорки желчная «пробка» рассасывается самостоятельно без медикаментозного лечения.
Септические заболевания у новорожденных часто сопровождаются желтухой (поражение клеток печеночной паренхимы). Заболевание протекает с тяжелым общим состоянием, высокой температурой, увеличением печени, изменениями со стороны крови. Решающим в диагностике является посев крови. Кроме того, часто обнаруживается источник инфекции у новорожденных (нагноение пупочной рапы) или у матери. Стул при септической желтухе окрашен.
При позднем поступлении ребенка, невозможности определить источник инфекции и отсутствии анамнестических данных прогрессирующая желтуха иногда заставляет прибегать к пункционной биопсии печени.
Послеродовой гепатит у новорожденных—заболевание, встречающееся крайне редко и сопровождающееся разлитой желтухой, темной мочой и ахолическим стулом. Заболевание протекает остро — уже через несколько дней интенсивность желтухи уменьшается и характерная лимонная окраска с красноватым оттенком исчезает. В анамнезе — гепатит у матери. Характерно увеличение печени и селезенки с первых дней заболевания. Функциональные тесты печени для дифференциальной диагностики дают очень мало. При биопсии печени диагностическое значение имеет обнаружение многоядерных клеток печени. Трудность для распознавания представляют больные с хронической формой гепатита (примерно 10% острой формы). В этих случаях лучше произвести диагностическую лапаротомию.
Другие заболевания новорожденных. Перемещение заразного начала от матери к плоду имеет место и при токсонлазмозе, проявляющимся у но-
ворожденного желтухой, увеличением печени, гидроцефалией, иногда энцефалитом и другими мозговыми явлениями. Положительные серологические пробы, обнаружение каль-цификатов в черепе окончательно решают вопрос о природе заболевания.
Желтуха у новорожденного может быть и проявлением листереллеза. Петехиальные высыпания, нормальная окраска стула и подтверждение диагноза агглютинационными пробами является достаточным для исключения атрезии желчных протоков.
Желтуха, резко выраженная с первых дней, сопровождающаяся увеличением печени и селезенки может являться также признаком врожденной гемолитической анемии. Заболевание протекает тяжело, встречается крайне редко, но очень сходно по клинической картине с пороками развития желчных протоков. Микро-цитоз с уменьшением осмотической стойкости эритроцитов является характерным для данного заболевания.
Наконец, механическая желтуха у новорожденных может быть при сдавлении желчных протоков увеличенными лимфатическими узлами (Г. А. Баиров, 1970). Однако такая желтуха развивается постепенно и не сразу после рождения (к 2 месяцам). Стул окрашен до полного сдав-ления протоков. В затруднительных случаях при позднем поступлении ребенка показана лапароскопия.
Рентгенологические методы контрастных исследований для дифференциальной диагностики желтух у новорожденных, к сожалению, из-за большого желчестаза, отсутствия внутри- или внепеченочных протоков желаемых результатов не дают.
Лапароскопия из-за недостаточного поля обозрения, особенно при атрезии проксимальных отделов желчных протоков, практически лишена смысла.
Функциональные методы исследования практического значения для дифференциальной диагностики жел-
тух у новорожденных не имеют. Исследование сывороточного билирубина в динамике свидетельствует о характере течения болезни и в ряде случаев о необходимости оперативного вмешательства.
Пункционная биопсия дает ценное представление о характере процесса в печени, поскольку при пороках развития желчных протоков отмечается дезорганизация дольчатых образований, увеличение фиброзной ткани и пролиферация желчных протоков с внутрипеченочным стазом, а при гепатитах на первый план выступает разрушение структуры долек с набуханием клеток паренхимы и появление многоядерных гигантских клеток; пролиферация желчных протоков не наблюдается.
В последнее время для дифференциальной диагностики желтух у новорожденных применили бенгальский розовый I131 (Brent и Geppert, 1959; Schwartz, 1964), с последующим исследованием уровня радиоактивности в стуле, что имеет прямое отношение к степени проходимости желчевыводящих путей.
Лучшими сроками для оперативного лечения больных с атрезией желчных протоков является 2-я и 3-я недели жизни ребенка, за это время возможно правильно поставить диагноз, а изменения со стороны печеночных клеток еще обратимы. Идеальной, конечно, была бы операция сразу после рождения, однако, поставить диагноз в короткий срок практически невозможно.
Степень операбельности во многом зависит от вида атрезии и сочетаемости с другими пороками (пороки развития желудочно-кишечного тракта, сердца, почек и др.). До 1957 г. операбельными считались всего 12— 16% больных (Svensen, Ticher, 1952; Gross, 1953; Unger, 1956, и др.), обычно дети с атрезиями лишь ди-стальных отделов желчных протоков. После внедрения Г. А. Баировым (1956—1957) оперативного лечения больных с высокими формами атре-
зий путем создания анастомозов желудочно-кишечного тракта с внутри-печеночными желчными протоками, операбельными стали 65—70% детей. Безусловно, степень радикальной операбельности новорожденных с атрезией желчных протоков находится в прямой зависимости от высоты и протяженности атрезии, считая от двенадцатиперстной кишки. Атрезия же внутрипеченочных желчных протоков практически не позволяет выполнить радикальную операцию.
Сочетание пороков значительно отягощает операцию и послеоперационное течение. Операция у таких детей требует индивидуального подхода с учетом тяжести вмешательства и жизненной необходимости устранения порока.
В предоперационной подготовке следует учесть недостаток организма в витаминах (К, С, В), белках (переливание нативной плазмы, альбумина, протеина), степень интоксикации (переливание растворов глюкозы). Обязательное введение желчегонных средств и раствора сернокислой магнезии в двенадцатиперстную кишку или деколи-на внутривенно (в течение одной недели) — для ликвидации желчеста-за, который может быть и без атрезии желчных протоков (повышенный распад эритроцитов). За несколько дней до вмешательства назначают антибиотики широкого спектра действия.
Мероприятия, направленные на уменьшение метеоризма в доопера-ционпом периоде, наряду с оксиге-нотерапией являются необходимыми и для предупреждения пневмонии.
До 1951 г. оперативное лечение пороков развития желчных протоков оставалось малоутешительным. Но уже в 1951 г., как отмечает Г. А. Ба-иров (1968), в литературе были сообщения о 35 детях, выздоровевших после операции.
Личный опыт Г. А. Баирова за 13 лет (1955—1968), охватывающий 56 операций по поводу атрезии желч-
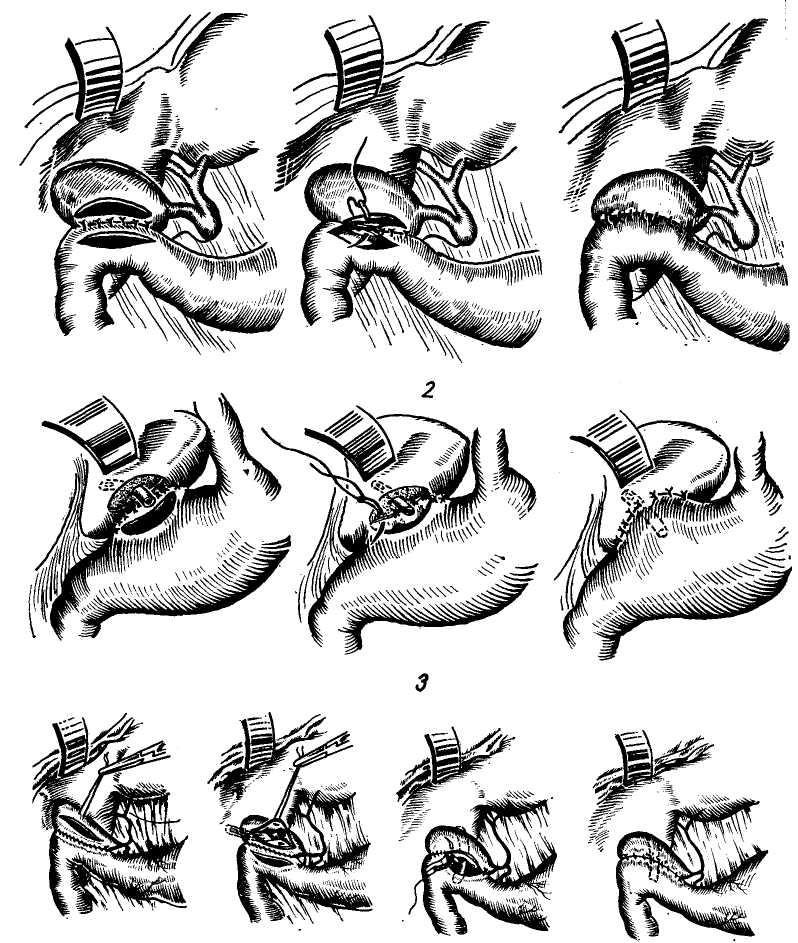
ных протоков, значительно расши- ют об оправданности применения
рил возможности хирургического ле- хирургического метода лечения,
чения этих больных. Операция, как правило, выпол-
Данные нашей клиники, охваты- няется под эндотрахеальным нарко-
вающие 15 оперативных вмеша- зом с применением мышечных релак-
тельств у детей с врожденной атре- сантов. Разрез передней брюшной
зией желчных протоков различной стенки косой в правом подреберье
локализации, также свидетельству- (Г. А. Баиров, 1968, 1970), или по-
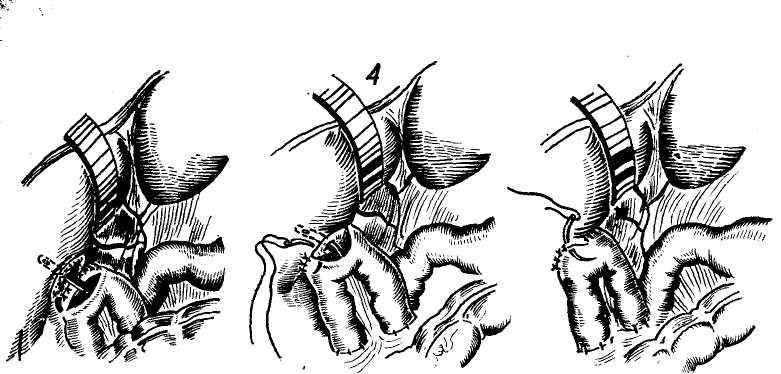
Рис. 12. Операции при различных видах атрезий желчных протоков (по Г. А. Баироеу):
1) образование соустья желчного пузыря с двенадцатиперстной кишкой; 2) образование соустья внут-рипеченочных желчных протоков левой доли печени с желудком; 3) образование соустья внутри-печеночных желчных протоков правой доли печени с двенадцатиперстной кишкой при сохранившемся рудиментарном желчном пузыре; 4) образование соустья внутрипеченочных желчных протоков
правой доли печени с тощей кишкой.
перечный в верхней части брюшной токов солевым раствором, который стенки (Schwartz, 1964). После вскры- можно вводить и после операции, тия брюшной полости берут биопсию 2. Атрезия дистального отдела печени с каждой доли для срочной общего желчного протока позволяет гистологии с целью исключения или создать отток желчи путем наложе- подтверждения внутрипеченочной ния холедоходуоденоанастомоза (см. атрезий желчных протоков и вро- рис. 47). Расширенный слепой конец жденного гепатита. Если недостаточ- холедоха выделяют на расстоянии но осмотра, производят ревизию на- 1—2 см и подшивают серо-серозными ружных желчных протоков, вводя швами к двенадцатиперстной кишке, раствор новокаина (около 1 мл) Затем после вскрытия просветов хо- подкрашенного метиленовой синь- ледоха и кишки накладывают непре- кой. По распространению раствора рывный шов атравматической иглой определяют протяженность и нали- на заднюю губу анастомоза, тот же чие просвета протоков. В этих случа- шов распространяют и на переднюю ях целесообразной является холан- губу. В соустье вставляют тонкую гиография (введение подогретого кар- дренажную трубку и переднюю по- диотраста) путем пункции тонкой верхность анастомоза ушивают рядом иглой желчного пузыря. серо-серозных швов. Величина раз- Выбор метода лечения зависит от реза кишки должна соответствовать характера порока, установленного диаметру протока, операционными методами исследо- Наличие желчного пузыря, за- вания. Здесь возможны 2 вида опера- полненного желчью, и отсутствие ций: декомпрессия проксимального дистальной части или всего холедоха отдела желчевыводящей системы и представляет возможным наложе- чреспеченочное дренирование. ние холецистодуоденоанастомоза
Методы дренирования прокси- (рис. 12,1).
мального отдела желчевыводящей си- Первым рядом швов являются се-
стемы могут быть различными. ро-серозные между желчным пузы-
1. Желчевыводящие протоки нор- рем и двенадцатиперстной кишкой,
мально развиты и гистологически Просветы желчного пузыря и дуоде-
внутрипеченочной формы атрезий нум вскрывают на протяжении 2—
нет. Производят промывание про- 2,5 см. Заднюю и переднюю губу ана-
стомоза ушивают непрерывным швом атравматической иглой. Затем переднюю губу укрепляют рядом серо-серозных швов. При ограниченной подвижности двенадцатиперстной кишки возможно создание холецисто-еюностомии на выключенной петле с заглушкой по Шалимову (см. рис. 55). Для этого берут петлю тонкой кишки, отступя 30—40 см от дуоде-ноеюнального изгиба, проводят ее позади поперечно-ободочной, и фиксируют серо-серозными швами ко дну желчного пузыря. Просветы желчного пузыря и двенадцатиперстной кишки вскрывают на протяжении до 3 см. На заднюю и переднюю губу анастомоза накладывают непрерывный шов атравматической иглой. Затем переднюю губу укрывают серо-серозными швами. На 6—10 см ниже пузырно-кишечного анастомоза накладывают брауновский энтеро-энтероанастомоз. Приводящую петлю между пузырно-кишечным и энте-ро-энтероанастомозом перевязывают или прошивают УКЛ-40 и место прошивания инвагинируют отдельными серо-серозными швами. Создают надежную заглушку. Энтеро-энтероана-стомоз фиксируют в отверстии брыжейки поперечно-ободочной кишки. Schwartz (1964) предпочитает создание оттока желчи в этих случаях путем пузырно-тонкокишечного анастомоза с выключенной петлей, соединяя дно желчного пузыря с концом тонкой кишки, а приводящий отрезок ее вшивают в бок отводящей на расстоянии 10—15 см от холецисто-энтероанастомоза.
Атрезия общего желчного протока и желчного пузыря требует создания непосредственного соустья общего печеночного, а при его атрезии печеночных протоков с желудочно-кишечным трактом. С этой целью накладывают гепатикодуоденоанасто-моз (Г. А. Баиров, 1968), гепатикое-юноанастомоз (Schwartz, 1964) и ге-патикоеюностомию с энтероанастомо-зом и заглушкой по Шалимову, которая предусматривает наложение ана-
стомоза не только в поперечном направлении, но также в косом и продольном по отношению к желчным протокам, что имеет немаловажное значение при умеренном их расширении, когда диаметр протока мал для создания достаточной ширины просвета соустья.
Атрезия всех наружных желчных протоков требует создания оттока желчи путем соединения внутрипече-ночных желчных протоков с желудочно-кишечным трактом. Варианты операций были многочисленны. Создание наружной желчной фистулы после гепатотомии с последующим превращением ее во внутреннюю фистулу, используя У-образный анастомоз (Stauss, 1951; Seligman, 1960). Dohl— Iversen и Gormsen (1943) предлагали производить широкий разрез нижней поверхности левой доли печени с У-образной энтеростомией. Long-mire и Sauford (1948) предложили поперечный разрез левой доли печени для обнаружения увеличенных желчных протоков и создания с ними У-образной энтеростомии.
Г. А. Баиров (1968, 1970) разработал методику создания раздельных анастомозов левой доли печени с желудком, правой — с двенадцатиперстной кишкой при наличии желчного пузыря и с тонкой — при его отсутствии.
Для создания печеночно-желудоч-ного соустья пилорический отдел желудка подшивают к нижней поверхности левой доли печени на протяжении 4—5 см и отступя от ее края на 2—2,5 см. Край печени иссекают и в глубину ткани на 2—3 см вводят дренажную трубку по проделанному троакаром каналу. Вскрывают желудок соответственно ране печени, край раны желудка и печени прошивают отдельными кетгуто-выми швами через все слои. Анастомоз укрепляют по передней поверхности отдельными серо-серозными швами.
Анастомоз правой доли при наличии желчного пузыря создают с ис-
пользованием его стенок. После подшивания желчного пузыря к двенадцатиперстной кишке и вскрыв его просвет, троакаром делают канал в печени, в который вставляют дре- наж. Анастомоз накладывают обыч- ным путем, но с таким расчетом, чтобы дренажная трубка осталась внутри соустья. При отсутствии желч- ного пузыря к правой доле печени подшивают петлю тонкой кишки (в 20—35 см от своего начала) и созда- ют соустье по типу печеночно-желу- дочного. Операцию заканчивают бра-уновским анастомозом.
Внутрипеченочная холангиосто- мия дает положительный результат только в случаях наличия внутрипе-ченочных желчных протоков, при их отсутствии результаты операций неблагоприятны. Так, у 30 из 40 вну-трипеченочных холангиостомий успеха достигнуть не удалось (Г. И. Ба~ иров, 1970). Только С из остальных 10 детей с наличием внутрипеченоч-ных желчных путей выжило, остальные погибли от осложнений.
Из 15 детей, находящихся на лечении в нашей клинике, 7 оказались неоперабельными (с полной атрези-ей внутрипеченочных и внепеченоч-ных желчных протоков — 6 человек; с полной атрезией внепеченочных желчных протоков при сохраненных внутрипеченочных протоках — 1). Из группы больных с атрезией вне-печеночных желчных протоков при наличии желчного пузыря (1 больной) и с атрезией только дистального отдела общего желчного протока (5) все оперированные выздоровели. Из больных с атрезией общего желчного протока при сохраненном общем печеночном и долевых протоков (2 ребенка) после операции выздоровел 1, а 1 умер в связи с поздним поступлением и развившимся тяжелым би-лиарным циррозом печени, который привел в послеоперационном периоде к необратимой печеночной недостаточности.
У наших больных предприняты следующие оперативные вмешатель-
ства: у больного с атрезией внепеченочных желчных протоков при наличии желчного пузыря наложен гепатикохолецистодуоденоанастомоз (см. рис. 12,3), с атрезией только дистального отдела общего желчного протока — холедоходуодено-анастомоз (см. рис. 57), с атрезией общего желчного протока при сохраненном общем печеночном и долевых протоках — гепатикоеюноанастомоз (см. рис. 59 в; 60 в, г).
Создание соустья грудного лимфатического протока с пищеводом (при полной атрезии вне- и внутрипеченочных желчных протоков), предложенное Williams и Dooling (1963), приводит к значительному падению уровня билирубина. Однако, как показали исследования Absolon, Pikkers и Aust (1965), такое падение является временным, вскоре он снова возвращается к исходным цифрам, кроме того, уменьшение количества лимфоцитов и протеина снижает иммунные свойства организма.
После выписки больной должен находиться под постоянным наблюдением хирурга и педиатра.
Результаты лечения со сроками наблюдений после операции 13— 14 лет (II. Ф. Левченко, 1965; Г. А. Баиров, 1970; Ladd, Gross, 1940; Schwartz, 1964, и др.) с убедительностью показали возможность оперативного лечения этой группы больных.
Пороки развития желчного пузыря и пузырного протока. Врожденные пороки желчного пузыря — явление довольно редкое и чаще обнаруживается случайно во время операции. В литературе описано около 150 подобных аномалий (Ю. Э. Вит-кинд, 1940; Л. Б. Авидон, 1952; Г. А. Баиров, 1968; Donris, 1935; Stolkind, 1939).
Двойной или добавочный желчный пузырь имеет свой проток, который впадает вместе с основным или отдельно (рис. 13). Добавочный желчный пузырь может располагаться рядом с основным, отдельно, в па-
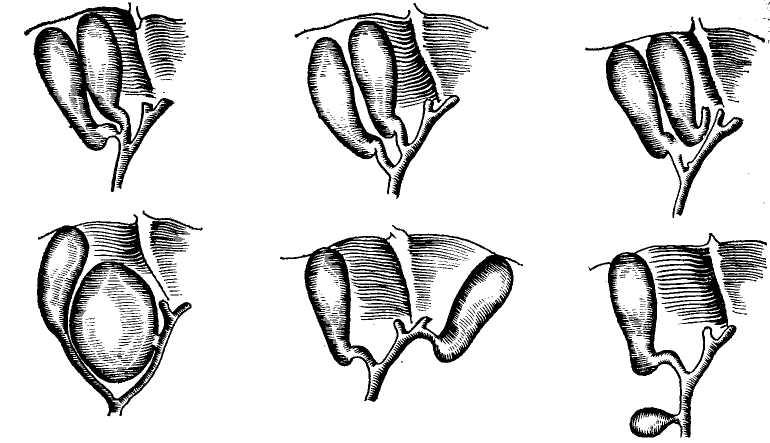
Рис. 13. Различные формы удвоения желчного пузыря (по Flannery, Gaster).
ренхиме печени, а также в толще ность может способствовать образова- печеночно-дуоденальной связки. Де- нию заворота, перегиба, в связи ти обычно жалоб не предъявляют, с чем возникает боль, а перекручива- Добавочный пузырь воспаляется ча- ние пузыря ведет к его некрозу и ще, чем основной (И. П. Греков, сопровождается тошнотой, рвотой, 1925; М. С. Маслов, 1953; А. Ф. Сме- сильной схваткообразной болью с по- шляева, 1957) и дает клинику остро- следующим развитием перитонита, го живота, симмулирует приступ ост- Дифференциальная диагностика с ост рого аппендицита. Окончательно ус- рым холециститом и аппендицитом тапавливают диагноз во время oпe- затруднительна и часто диагноз уточ- рации. няют во время операции.
Добавочный желчный пузырь Мы наблюдали 7 детей в возрасте
в ряде случаев приводит к водянке от 5 до 16 лет с подобной патологией
пузыря, которая проявляется неболь- желчного пузыря. У 3 больных желч-
шой болью в эпигастральной области, ный пузырь располагался рядом с
периодической тошнотой, рвотой, по- первым и его пузырный проток впа-
явлением эластического выпячивания дал отдельно в общий желчный;
в области правого подреберья ближе у 2 — в толще паренхимы печени пра-
к средней линии. Окончательный вой доли и его пузырный проток впа-
диагноз ставят обычно во время дал в правый печеночный; у 2 боль-
лапаротомии. Добавочный желчный ных была водянка желчного пузыря
пузырь может быть обнаружен при с облитерированным пузырным про-
холецистографии. током, соединенным с пузырным про-
Дивертикулы желчного пузыря током основного желчного пузыря,
бывают различной величины, иног- Применяли обычную холоцистэкто-
да видны на холецистограммах. В них мию с хорошими результатами, могут развиваться конкременты. Техника удаления добавочного
Подвижный желчный пузырь об- желчного пузыря или пузыря на
разуется за счет брыжейки, которая брыжейке обычная, следует только
расположена на задней поверхности иметь ввиду, что дополнительный
или у пузырного протока. Подвиж- желчный пузырь может иметь
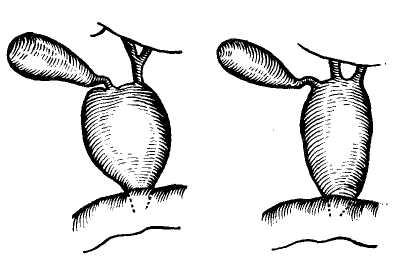
2 протока и, естественно, пере- вязка обоих обязательна. При наличии дополнительного желчного пузыря во время операции необходимо убедиться, что это образование не является кистой общего желчного протока.
Наконец, к порокам развития следует отнести дистопию желчного пузыря. Он может располагаться внутри печени, под левой долей, на задненижней поверхности печени, в горизонтальной щели. В неосложнен-ных случаях дистопия желчного пузыря не сопровождается выраженной симптоматологией и в оперативном лечении не нуждается.
Пороки развития пузырного протока редко нуждаются в хирургическом лечении, если они не ведут к нарушению оттока желчи, в противном случае начинается хронический воспалительный процесс в желчном пузыре, который проявляется чаще всего в возрасте 5—6 лет. Появляются боль в области правого подреберья, тош-нота, снижение аппетита, периодически субфебрильная температура и перемежающаяся легкая желтуха. Во всех порциях при дуоденальном зондировании наблюдается скопление лейкоцитов. Оперативное лечение показано только после безуспешной консервативной терапии, так как подобная симптоматология может быть связана с наличием у больного банального холецистита. Хорошим методом диагностики в этих случаях является внутривенная холе-цистография.
Врожденное расширение общего желчного протока (киста). С. Д. Тер-новский (1959), Vlachosi, Cassimos (1959) установили, что расширение общего желчного протока с его кистоз-ным перерождением является следствием врожденных заболеваний ди-стального отдела холедоха (перегибы, стенозы, внутренние клапаны) и ампулы большого дуоденального соска (рис. 14).
Заболевание редкое. Впервые подобную патологию общего желчно-
Рис. 14. Схема кист холедоха.
го протока описал Lawenson в 1909 г., затем в 1953 г. Gross представил описание собранных в литературе и собственных наблюдений (52), в 1970 г. Г. А. Баиров — 6 историй болезни и ряд авторов — единичные случаи данной патологии, встречающейся у больных в любом возрасте, но чаще от 3 до 10 лет.
Мы наблюдали 2 больных с врожденной кистой общего желчного протока (один — в возрасте 5 лет, другой — 16 лет). Второго трижды оперировали в других клиниках. В результате предпринятых операций больному создан наружный желчный дренаж.
По мере увеличения кисты больных начинают беспокоить боль в правом подреберьи и над пупком, чувство тяжести, перемежающаяся желтуха, периодически субфебрильная температура с ознобами, связанная с застоем желчи и присоединяющейся воспалительной реакцией. Появляются тошнота, рвота, нарушается аппетит. Растущая киста начинает отчетливо пальпироваться через переднюю брюшную стенку, опухоль плотноэластичной консистенции и, что характерно, периодически уменьшается, особенно после введения через зонд в двенадцатиперстную кишку раствора сернокислой магнезии. Уменьшение объема опухоли сопро-вождается выделением через зонд большого количества темной желчи (С. Д. Терновский, 1959). Биохимические исследования свидетельствуют о наличии механической желгухи.
Стул периодически обесцвечен, моча темная.
Киста больших размеров может самопроизвольно или под воздействием небольших травм вскрываться в брюшную полость, вызывая перитонит (резкая боль, рвота, напряжение мышц передней брюшной стенки, прогрессивное ухудшение общего состояния, положительный симптом Щеткина).
Рентгенологическое обследование часто помогает установить картину заболевания. При внутривенной хо-лецистохолангиографии определяется дополнительная тень контраста ниже желчного пузыря. Введение в желудочно-кишечный тракт взвеси бария позволяет уточнить локализацию и размеры образования. Отчетливо установить локализацию кисты и отношение ее к соседним органам в ряде случаев позволяет лапароскопия.
Лабораторные и рентгенологические исследования дают возмож-ность исключить при наличии желтухи инфекционный гепатит. Пальпа-торно (подвижность образования), рентгенологически и особенно лапа-роскопически удается отдифференцировать кисту от опухоли печени. Затруднение представляют кисты брыжейки, поджелудочной железы, ки-стозные удвоения пищеварительного тракта, водянка добавочного желчного пузыря. Часто в этих случаях вопрос решается оперативно.
В случае возникновения «острого живота», как осложнения кисты холедоха, дифференциальная диагностика до операции практически невозможна.
Оперативное лечение заключается в создании достаточного оттока желчи в кишечник, путем наложения анастомоза между расширенным общим желчным протоком и выключенной У-образно петлей тонкого кишечника у детей младшего возраста, на-
ложением соустья между кистой и двенадцатиперстной кишкой у детей старшего возраста и у взрослых. Дре нирование кисты наружу неприемле мо — быстро наступает истощение больного.
У обоих наших больных было создано соустье кисты с петлей тонкого кишечника с заглушкой по методике Шалимова.
Операцию проводят под эндотра-хеальным наркозом. Разрез брюшной стенки: верхне-срединная ла-паротомия, низкая по Федорову, или клюшкообразная по Шалимову, позволяют производить ревизию органов брюшной полости и выполнять операцию на желчных путях и пе-чепи.
При наложении холедоходуоде-ноанастомоза предварительно пунктируется киста и отсасывается содержимое, затем создается анастомоз двухрядным швом атравматической иглой с шириной соустья не менее 1,5—2 см. Обязательный дренаж, подведенный к месту анастомоза и выведенный через отдельное отверстие на боковой поверхности брюшной стенки справа. Брюшную полость перед ушиванием орошают раствором антибиотиков.
Дренаж удаляют на 4—5-й день при благоприятном функционировании анастомоза. Следует отметить, что дети переносят эту операцию тяжело и наблюдение за ребенком в первые дни должно быть особенно бдительным.
При своевременном оперативном лечении расширения общего желчного протока у детей осложнений, как правило, не бывает и прогноз вполне благоприятный. При позднем обращении, когда развиваются хо-лангит, панкреатит, цирроз печени, результаты операции менее благоприятны и требуют в дальнейшем консервативного лечения и длительного наблюдения педиатра и хирурга.
Глава четвертая
Х ИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ,
ИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ,
Холециститы
Интерес к хирургии желчнокаменной болезни возрос в 80-х годах прошлого столетия. По мере развития человек изменял свои привычки, изменился и сам образ жизни человека, его питание. Возможно, что это имеет отношение и к большему распространению желчнокаменной болезни. По данным Hess (1961), в среднем 15—18% взрослых имеют камни желчных путей. И если в начале нашего столетия на вскрытии желчные камни обнаруживали у 4—6% умерших, то сейчас эта цифра равна 13,9% — 16%. По данным немецких и американских авторов, число этих случаев еще больше.
Наиболее подвержены этому заболеванию жители Европы, Северной и Южной Америки, реже — Азии и Центральной Африки.
Сравнительно высокая частота заболевания, естественно, сказывается и на увеличении летальности от осложнений, имеющих непосредственное отношение к наличию в желчных путях камней. По данным Enderlen (1961), из 1000 умерших больных с различной патологией непосредственно от осложнений холе-литиаза погибает 8,6%, а у 7,8% он является немаловажным отягощающим фактором.
До настоящего времени ясных причин образования камней нет. Составные части желчных камней холестерин и билирубин, как известно, в желчи находятся в коллоидном
состоянии. При нарушении механизма удержания их в этом состоянии происходит образование осадка, желчь становится более концентрированной — начинают образовываться камни.
В настоящее время исследования за рубежом и отечественных авторов указывают на 3 пути, ведущие к нарушению баланса коллоидного состава желчи — это нарушение обмена веществ, воспаление стенок желчевы-водящих путей и застой желчи.
Ни одна из этих причин не может являться самостоятельной и только совокупность всех факторов чаще всего и приводит к образованию камня. Как известно, у 20% больных камни желчных путей оказываются стерильными, но это еще не говорит о том, что процесс их образования проходил без воспаления в желчном пузыре.
У ряда больных желчнокаменной болезнью не отмечается нарушения обмена холестерина, хотя у них обнаруживаются холестериновые камни, факт, который скорее всего говорит о том, что к процессу образования камней желчных путей имеет отношение не столько уровень холестерина крови, сколько одновременное нарушение концентрации жирных кислот и несвязанных желчных солей.
Более прямое отношение к образованию камней имеют нарушения, связанные с повышением концентрации билирубина крови при увеличен-
ном его образовании (гемолитические анемии и прочие). Однако осаждение билирубина, как первопричина образования камней, явление более редкое, чем осаждение холестерина.
Камнеобразование часто наступает у людей, страдающих сахарным диабетом, ожирением, гипертонической болезнью, гемолитической анемией. Подавляющее большинство больных желчнокаменной болезнью — люди с избыточным весом, 23,7% больных холелитиазисом — гипертоники. Около 32% больных с различными заболеваниями гемолитического характера (чаще это семейная гемолитическая анемия) страдают желчнокаменной болезнью.
Как правило, выкристаллизация солей происходит вокруг сформировавшегося уже «ядра», которое состоит из эпителия, микроорганизмов. Это ядро обычно трактуется как полип, который сформировывается на стенке желчного пузыря, затем он по мере роста отпадает и становится изолированным камнем. Указанный полип иногда можно определить рентгенологически.
Известно, что в состав камней желчных путей часто входит карбонат кальция, а в ряде случаев они сплошь состоят из этих солей. Изучение этого вопроса показало, что наличие кальция всегда свидетельствует о воспалительном процессе в желчном пузыре и временном закрытии пузырного протока. В обычных же условиях карбонат кальция участия в образовании камней не принимает. Известно также, что чем дольше закрыт пузырный проток, тем более массивны известковые наслоения.
Роль нарушения функции желчного пузыря и желчевыводящих путей в этиологии образования камней несомненна. Хотя клиницистам известны и такие явления, как отсутствие камней в длительно существовавшем гипотоническом или дискинетическом желчном пузыре, а также наличие их в нормально функционирующем пузыре. Образовав-
шийся камень уже сам является причиной дальнейших нарушений функции или полной закупорки желчевыводящих протоков. Жел-честаз является результатом дальнейшего прогрессирования болезни. Имеет ли при атом значение гипертония сфинктера Одди или папил-лостенозы в этиологии образования камней в желчном пузыре, до настоящего времени не выяснено. Остаются неясными и причины самостоятельного образования камней в желчных протоках — факт, который в настоящее время является неоспоримым, хотя у подавляющего большинства больных камни протоков — это результат проскальзывания их из желчного пузыря в то время, когда они имели еще очень маленькие размеры. «Растут» они в холедохе как и в желчном пузыре, по тем же причинам (воспаление, застой желчи, нарушение обмена холестерина и билирубина). Образование и рост камней осуществляется непрерывно или толчками.
Замечено, что камни с гранями имеют меньшую тенденцию к увеличению, чем камни в виде тутовых ягод.
Камни обычно делят на холестериновые, чаще всего в виде тутовых ягод (31%), пигментные (6%) и хо-лестерин-пигментно-известковые, чаще граненные, но возможны в виде тутовых ягод и яйцеобразные (63%, Hess, 1961).
О типе камня можно судить уже по обзорным рентгенограммам. Так холестериновые камни не контрасти-руются. Камни, содержащие известь, дают контрастную тень.
Камни, не содержащие большого количества известковых солей, это в равной мере относится и к камням с гранями и в виде тутовых ягод, способны к самостоятельному разрушению, однако полного химического растворения камней у человека не наблюдалось, хотя отдельные сообщения по этому поводу уже имеются. Так Way с соавторами (1972) добил-
ся исчезновения рецидивных камней в холедохе у 12 из 22 больных пу- тем промывания общего желчного протока через дренаж раствором желчной соли, содержащей холат натрия. Образование камней в желчном пузыре является началом различных заболеваний, связанных со стремлением организма избавиться от них путем выталкивания конкрементов в общий желчный проток и двенадцатиперстную кишку. В ряде случаев это удается, пока камни имеют очень малый размер, но уже одно прохождение их по желчным путям может способствовать возникновению патологии, 30—40% всех больных желчнокаменной болезнью страдают приступами печеночной колики, то есть болью, связанной с прохождением камня через узкий пузырный проток. В момент прохождения камня наступает резкое нарушение функции желчного пузыря, он не опорожняется, и при наличии в нем инфекции начинает воспаляться, а пребывание камня в пузырном протоке с полной его закупоркой вскоре приводит к серьезным осложнениям. Кратковременная же закупорка протока после прохождения камня ведет к быстрому восстановлению функции желчного пузыря. После прохождения камня колика прекращается.
Спор о том, какого размера камни могут проходить через пузырный проток, решается в пользу очень мелких камней — величиной с просяное зерно. Конкременты большей величины могут лишь закупоривать шейку или пузырный проток. Проходить же в общий желчный проток они не могут, так как просвет пузырного протока обычно очень узкий, даже без наличия изменений воспалительного характера.
Хирургическое лечение желчнокаменной болезни связано в первую очередь с проблемой лечения холециститов и непроходимости желчных протоков.
Воспаление желчного пузыря (холецистит) встречается в виде двух
клинических форм: острого процесса (острый холецистит) и хронического (хронический холецистит). В свою очередь острый и хронический процесс может развиваться как на фоне желчнокаменной болезни (острый и хронический калькулезный холецистит), так и без нее (острый и хронический «бескаменный» холецистит).
«Бескаменный» холецистит может явиться осложнением дискинезии желчных путей, паразитарной инвазии, неспецифической и специфической инфекции (туберкулез, сифилис и др.). Общим моментом для всех холециститов является участие банальной инфекции.
По данным многих авторов, до 40% больных с заболеваниями органов пищеварения составляют больные с различными формами холециститов.
Научно-методическое бюро медицинской статистики Министерства здравоохранения РСФСР указывает, что 9,5 на 1000 населения составляют больные холециститом и холангитом и 0,5 — желчнокаменной болезнью.
«Бескаменным» холециститом страдают чаще люди в более молодом возрасте (30—45 лет), в то время как частота обнаруженных камней увеличивается с возрастом. Бескаменный холецистит как и калькулезный в 2—3 раза чаще встречается у женщин, чем у мужчин.
Острый холецистит. Многие исследователи в последнее время пришли к выводу, что приступ острого холецистита является результатом хронических их изменений.
Клинические и экспериментальные исследования последних лет (В. В. Виноградов, С. И. Левина, 1970) с убедительностью показали, что в развитии острого холецистита или обострения хронического определенную роль играют сосудистые изменения в стенке желчного пузыря, которые обычно бывают связанными с общим поражением сосудов в организме при атеросклерозе, гипертонической болезни и легочной гипертен-
зии, или возникает в результате воспалительных изменений в желчном пузыре. Причем отмечено, что сосудистые изменения могут обусловливать даже резкие деструктивные изменения желчного пузыря в виде гангрены и перфорации.
Обязательно ли наличие камня в желчном пузыре для возникновения приступа. Сходность клипического течения «каменного» и «бескаменного» холецистита привело некоторых ученых к мнению, что причиной закупорки выхода из желчного пузыря всегда является камень, отсутствие же его на операции или вскрытии свидетельствует о том, что он уже успел выделиться (Caroli,1951). «Бескаменный» острый холецистит, по данным различных авторов, встречается в 6—27,7% случаев (В. Н. Стручков, 1957; С. А. Масумова, 1957; Т. П. Макаренко и Л. И. Крейцер, 1957; Ф. А. Спектор, 1959, и другие авторы).
Играет ли роль инфекция в возникновении приступа? Если она была до приступа, то играет, если ее не было, то присоединение инфекции является уже осложнением, ведущим к развитию острого воспаления желчного пузыря.
Выделить единую причину возникновения острого холецистита в настоящее время невозможно. Конкременты, застой желчи, инфекция, сосудистые расстройства — все эти причины в определенной ситуации дают начало развитию острого воспаления. В основном возникновение острого холецистита связано с острой вспышкой инфекции и закупоркой выхода из пузыря камнем, и хотя микроорганизмы определяются лишь в 63% случаев, следует считать, что в остальных случаях инфекция имела лишь кратковременный характер. При отсутствии в желчном пузыре конкрементов основной причиной острого воспаления является нарушение опорожнения его в результате перегибов шейки, сдавления ее аномальными сосудами, увеличенной
маткой при беременности. Крайне редко к этому приводят рубцовые сужения, и еще реже метастазы злокачественных опухолей. Инфициро- вание происходит уже на фоне застоя, чаще всего (около 75% по Ravdin и Brooke, 1955) — это микробы кишеч- ной флоры, изредка (около 1%)— это тифозно-паратифозная инфекция.
Без блокады выхода из желчного пузыря развитие острого холецистита — явление редкое, так как инфицированная желчь сама по себе не вызывает воспаления его стенки, если существует нормальный жел-чеотток. Воспалительные изменения желчного пузыря могут наступать и в результате гематогенного заноса. Этот путь, по мнению некоторых авторов, является основным. В этиологии некоторых острых холециститов, где не подтверждается инфекционное начало и отсутствуют камни, определенное значение приписывают реф-люксу секрета поджелудочной железы.
Ряд авторов предположили наличие аллергического генеза в возникновении острого холецистита, что было подтверждено в эксперименте на животных (De Muro и Ficari, 1960; Divella, 1963).
Таким образом, причиной возникновения острого холецистита является комплекс патологических изменений в организме, главную роль среди которых играет блок пузырного протока и инфекция.
Среди различных форм острого холецистита мы различаем следующие:
Простой (катаральный, инфиль- тративный, язвенный),
Осложненный:
а) флегмоной (флегмонозный хо лецистит) ,
б) гангреной (гангренозный холе цистит) ,
в) перфорацией (перфоративный холецистит),
г) желчным перитонитом (без ви димой перфорации),
д) околопузырным инфильтратом,
е) околопузырным абсцессом,
ж) механической желтухой, з) септическим холангитом,
и) острым панкреатитом. Острое воспаление желчного пу-зыря с нарушением оттока желчи приводит к увеличению его объема иногда до 100 см3, напряжению, с развитием высокого внутреннего давления. Пузырь становится гипереми-рованным часто с цианотичным оттенком. Серозная оболочка его приобретает тусклый матовый вид, покрывается фибрином. Слизистая оболочка становится ярко-красной, субсероза разрыхлена. Желчь «через несколько дней становится белого цвета.
В дальнейшем развитие воспалительного процесса протекает по-разному. Если острый процесс купируется полностью, все явления затихают и могут больше не повторяться, при неполном затихании воспаления процесс может приобрести хроническое течение. У ряда больных уже с самого начала заболевания процесс прогрессирует. Стенки желчного пузыря полностью инфильтруются гноем, на слизистой оболочке появляются изъязвления, в полости пузыря — гной. Желчный пузырь увеличивается в объеме, стенки его еще больше утолщаются, в них определяются мелкие абсцессы. Серозный покров становится шагреневым, покрывается желтыми фибринозными отложениями. За счет перихолецисти-та в процесс вовлекаются соседние органы и ткани, брюшина становится набухшей, гиперемированной, вокруг желчного пузыря нередко образуется плотный инфильтрат. В воспалительный процесс вовлекается печень и поджелудочная железа. Описанная картина соответствует флег-монозному холециститу или эмпиеме желчного пузыря. При маловирулентной инфекции или угасании ее с длительным сохранением блока пузырного протока эмпиема желчного пузыря может превращаться в водянку пузыря (hydrops).
Флегмонозный холецистит или
острая эмпиема при дальнейшем про-грессировании воспалительного процесса может переходить в гангренозную форму, что бывает довольно редко. Чаще встречаются частичные некрозы стенок на более или менее ограниченном участке, чаще в области дна у места давления камня. Тотальный же некроз — явление чрезвычайно редкое. Встречается он при завороте пузыря, имеющего брыжейку, когда полностью прекращается питание его стенок. Тромбоз же одной пузырной артерии не всегда может привести к полному некрозу, так как пузырная артерия является не единственным источником питания.
Сравнительно быстро и тяжело развивается картина газового холецистита (Л. Д. Линденбратен, 1953; Д. П. Пиковский, 1954). В первые 34—48 часов начала заболевания появляются признаки газовой инфекции. В желчном пузыре рентгенологически определяются газ и горизонтальный уровень жидкости. Количество газа нарастает. Распространение инфекции за пределы пузыря способствует образованию околопузырных абсцессов, которые также содержат газ. Процесс, несмотря на злокачественность течения, может остановиться под воздействием лечения. Однако скопление газа еще долго определяется рентгенологически даже после полного исчезновения клинической картины острого холецистита.
Частичные некрозы стенок при гангренозном холецистите, особенно у мест, где на стенку оказывает давление камень, могут вести к перфорациям. Встречаются они в 12% случаев острого холецистита, по данным статистики 1949 г., и в 8,3% — в последующие годы в связи с более ранним оперативным лечением и применением антибиотиков.
Перфорация может произойти в свободную брюшную полость и вызвать разлитой гнойный перитонит, может ограничиться образованием
гнойников под печенью, диафрагмой и других местах. Перфорация может произойти при тесном спаянии в результате перихолецистита, в соседние органы (печень, желудок, двенадцатиперстную кишку, толстый кишечник). Содержимое абсцесса, в том числе и камни попадают через отверстие в просвет полых органов, образуются внутренние желчные свищи. Чаще всего встречается соустье, с поперечно-ободочной кишкой. Иногда в просвет кишечника, через образовавшееся отверстие выпадают камни очень больших размеров, которые вызывают даже кишечную непроходимость (Л. А. Одес, 1928; М. А. Боргхадзе, 1949; Н. К. Митрополь-ский, 1960; А. И. Корнев, 1961, и др.). Кишечная непроходимость в связи с камнями желчных путей составляет от 2,2 до 3,4% всех видов кишечной непроходимости (И. М. Тальман, 1963).
По данным сборной статистики Мауо (1926), Bernhard (1933), Byrne (1953), охватывающей 410 больных с внутренними желчными свищами, последние распределялись следующим образом: в двенадцатиперстную кишку — 79,1%, в толстый кишечник — 16,3%, в желудок — 4,6%.
Образование внутренних свищей нельзя считать самоизлечением желчнокаменной болезни — это добавочное и опасное осложнение. Приступы тяжелой колики повторяются, прогрессирует восходящий холангит, сопровождающийся упорной лихорадкой с постепенным истощением. При рентгенологическом исследовании с барием часто в желчных путях обнаруживаются таз и барий, который задерживается в протоках значительно дольше (более 6—12 часов), чем при рефлюксе, связанном с атонией сфинктера Одди.
В ряде случаев внутренний свищ между желчным пузырем, желудком и двенадцатиперстной кишкой может образоваться в результате пенетра-ции язвы этих органов в желчный пузырь.
Е. А. Чехарина (1952), О. Я. Pax-матуллин (1957), И. М. Тальман (1963) описали образование наружных желчных свищей, в результате прорыва флегмонозного желчного пузыря в переднюю брюшную стенку. Камни желчных путей через эти свищи выходили наружу.
У ряда больных острый деструктивный холецистит осложняется перфорацией пузыря в свободную брюшную полость с последующим развитием желчного перитонита. Развитие желчного перитонита — осложнение редкое, но очень серьезное в прогностическом смысле. Так, по данным Т. А. Малюгиной (1961), из поступивших в Институт скорой помощи 107 больных в тяжелом состоянии с желчным перитонитом умерли 65 %, а из 53 больных, поступивших в удовлетворительном состоянии и в состоянии средней тяжести, умерли 11%. По данным той же Т. А. Малюгиной (1961), у 84% больных с желчным перитонитом последний явился осложнением острого холецистита, у 16% — следствием травматических повреждений или осложнений после операций. В литературе описаны также перфорации желчного пузыря при брюшном тифе, раке.
Желчный перитонит, как осложнение после операции, возникает в результате соскальзывания лигатуры с культи пузырного протока и истечения желчи из ложа желчного пузыря при наличии дополнительных мелких желчных протоков, впадающих в желчный пузырь, а также в случае просачивания желчи из холедохо-томической раны или из незамеченных повреждений желчных протоков. Описаны наблюдения перфорации холедоха на месте пролежня камнем, с последующим развитием желчного перитонита.
В 1909 г. Reutier, затем в 1910 г. Клермон и Габерер впервые сообщили о возможности развития желчного перитонита без перфорации желчного пузыря, даже при тщательном гистологическом исследовании последнего.
Этиология и патогенез этого заболевания до настоящего времени не выяснены и существуют различ- ные мнения по этому вопросу. Ряд авторов считают, что под воздействием растяжения и истончения стенка желчного пузыря становится проницаемой для желчи. А. Блэд (1917) и Т. В. Шаак (1957) установили факт увеличенной проницаемости стенки желчного пузыря при проникновении в его полость сока поджелудочной железы при острых холецистопан-креатитах.
Обычно при подобного рода перитонитах в брюшной полости находят большое количество желчи (1 л и больше), в связи с чем стали задумываться, может ли такое количество желчи излиться в брюшную полость без наличия отверстия в желчевы водящей системе. Т. Фирика и В. Мун-теану (1959), поддерживая эту точку зрения, установили при подобных перитонитах наличие микроперфорации внепеченочных желчных путей в 80—91%, холедоха — в 4—5%, пузырного протока — в 4—5%, печеночных протоков — в 1,1%. Авторы отмечают большую сложность отыскивания мелких перфоративных отверстий в воспаленных тканях и поэтому многие считают, что перфорации вовсе нет. Последняя точка зрения поддерживается многими.
Клинические и экспериментальные исследования М. М. Ковалева с соавторами (1972) и других с убедительностью подтвердили возникновение у больных с острым холециститом значительных нарушений пиг-ментообразовательной, протромбино-образовательной, антитоксической функций печени, углеводного, витаминного, холестеринового обменов, а также нарушений симпато-адренало-вой, свертывающей и аитисвертываю-щей систем.
Хронический холецистит. Острое воспаление желчного пузыря может не сопровождаться бурным развитием деструктивных изменений. У ряда больных спонтанно или в результате
медикаментозного лечения воспалительный процесс затихает, восстанавливается свободный отток желчи, острый приступ проходит иногда навсегда. Б желчном пузыре сохраняется несколько более развитым фиброзный слой с образованием между мышечными пучками соединительной ткани. В ряде случаев наступившие деструктивные изменения поддерживают постоянное хроническое воспаление желчного пузыря, давая периодически обострения. Способствуют этому в первую очередь камни желчного пузыря и постоянное наличие микроорганизмов (кишечная и тифо-паратифозная инфекция). В этом смысле не следует смешивать бациллоносительство в желчном пузыре тифозных бацилл, так как желчь является прекрасной средой для них, но, как показали исследования, воспаление желчных путей и желчного пузыря при них в обычных условиях не наступает. Такое же отношение имеет и пребывание в желчи возбудителей паратифов А и В, туберкулезных бацилл и возбудителей дизентерии. Сморщивание желчного пузыря в результате грубых деформирующих рубцов вместе с склеротическими изменениями пузырного протока создают нарушения нормального желчетока и способствуют прогрессированию хронического воспаления.
В это время образуются плотные спайки с соседними органами и нередко с передней брюшной стенкой. При разъединении таких спаек часто обнаруживаются прикрытые перфорации, микроабсцессы. Стенка желчного пузыря становится плотной, толстой (до 1 см). Серозный покров тусклый в спайках, местами покрыт сальником. Слизистая оболочка частично заменена рубцами, иногда с изъязвлениями. Нервные волокна в стенке желчного пузыря подвергаются дегенеративным изменениям с образованием в толще стенок множественных невром. В силу обширных рубцовых изменений желчный
пузырь
иногда приобретает форму песочных
часов.
Камни,
как правило, в пузыре расположены
свободно, желчь в большинстве
случаев инфицирована, с большой
примесью гноя.
Такой
желчный пузырь, содержащий
камни и инфицированную желчь, представляет
собой постоянный источник
инфекции для всей желчевы-водящей
системы и печени, а также создает
постоянную угрозу повторных
воспалений и закупорок общего желчного
протока.
Как
уже отмечалось, острая эмпиема
желчного пузыря при известных
условиях может приобретать хроническое
течение, длительная закупорка
пузырного протока или шейки
желчного пузыря ведет к значительному
увеличению его объема. Содержимое
становится буровато-серого,
иногда зеленоватого цвета, с большим
количеством микроорганизмов.
Постепенно билирубин из желчи всасывается
и жидкость становится прозрачной,
а порой и стерильной, но
иногда, в связи с выпадением большого
количества углекислого кальция
и накопления масс слущенного эпителия,
содержимое желчного пузыря
становится молочно-белого цвета
и по ошибке может быть принято за
гной — заключение о наличии эмпиемы
будет неверным. Вопрос в
этих случаях решается микроскопией.
Здесь
же следует указать, что жидкость,
наполняющая желчный пузырь
при его отключении, это продукт
слизистых желез пузыря, но не «белая
желчь», которую мы находим в
печеночных протоках и холедохе при
их длительной закупорке — здесь эта
прозрачная жидкость является секретом
печени, хотя и не содержит желчных
пигментов (Раррег, Schaf-fner,
1957).
Развивающаяся
водянка желчного пузыря
может существовать длительное
время ничем себя не проявляя, кроме
пальпации образования туго-эластической
консистенции, округ-
По данным Hess (1961), лишь 10% случаев закупорки шейки желч- ного пузыря и пузырного протока ведет к образованию водянки или эмпиемы, в остальных случаях камень возвращается в просвет пузыря, если его размер не позволил пройти в желчный проток и последний приобретает возможность опорожняться. Подобные ситуации могут повторяться и редко (1 раз за время болезни) и часто. При многократных закупорках развивается хронический холецистит, который у половины больных инфицируется, Постоянное воспаление приводит к утолщению стенок, их склеротическому и фиброзному перерождению с образованием рубцово-сморщенного пузыря.
В результате длительного хронического воспаления возможна и полная облитерация желчного пузыря, независимо от наличия в нем камней. Такой атрофический желчный пузырь резко уменьшается в размере и оказывается почти полностью погруженным в печень, стенки его становятся очень плотными. Обнаружить такой пузырь можно случайно на вскрытии или при рентгенологическом исследовании. Существует и гипертоническая форма омелотворения желчного пузыря, он достигает величины детской головки. Случаи полного обызвествления или омелотворения редки и описываются как находки (С. П. Федоров, 1918; А. Ф. Гред-жев, 1956).
К воспалительным изменениям и прохождению камней не остается безучастным и пузырный проток. В основном это рубцово-атрофиче-ские изменения, приводящие к истончению его стенок и в ряде случаев к расширению просвета, а иногда и к полной его облитерации.
В процессе воспаления желчный
пузырь плотно припаивается к хо- ледоху и выделить пузырный проток не представляется возможным, иногда между желчным пузырем и холе-дохом в подобной обстановке образуется соустье, через которое камни могут непосредственно попадать в холедох. Иногда при значительных рубцово-атрофических изменениях пузырного протока последний исчезает вовсе и шейка пузыря непосредственно соединяется с холедохом меньшим или большим отверстием. Отсутствие пузырного протока в результате воспалительных явлений, а наблюдается и врожденное отсутствие его, создает неожиданную, а порой и опасную обстановку во время холецистэктомии, особенно для малоопытных хирургов.
На основании вышеизложенного различные формы хронического холецистита можно сгруппировать следующим образом, основываясь на клинико-морфологических данных.
1. Первично - хронический холе цистит.
2. Хронический рецидивирую щий, неосложненный холецистит.
3. Хронический рецидивирующий холецистит осложненный: а) нару шением проходимости желчных про токов; б) септическим холангитом;
в) облитерирующим холангитом;
г) панкреатитом; д) гепатитом и би- лиарным циррозом печени; е) во дянкой желчного пузыря; ж) скле розированием желчного пузыря; з) околопузырным хроническим аб сцессом.
На основании только клинических признаков можно выделить 3 основные формы хронического холецистита: 1) стертая, 2) кардиаль-ная и 3) болевая. П. И. Зимин (1970) выделяет еще латентную форму (обнаружение конкрементов случайной рентгенограммой, на операции или секции). По нашему мнению, эта форма должна сливаться со стертой, так как практически человек, имеющий камень в желчном пузыре, а
следовательно болеющий желчнокаменной болезнью, не может не предъявлять хотя бы нехарактерных жалоб.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ
И ВОСПАЛЕНИЯ ЖЕЛЧНОГО ПУЗЫРЯ
Как отмечает И. М. Тальман (1963), 75—90% людей, страдающих камнями желчного пузыря, из них 20% имеющие их в холедохе, часто не предъявляют никаких жалоб и чувствуют себя удовлетворительно. Безусловно, целесообразным являлось бы лечение людей именно в этот бессимптомный период, но тогда пришлось бы проводить поголовное обследование всего населения, что пока практически невыполнимо, и поэтому врачу приходится сталкиваться в основном с осложнениями желчнокаменной болезни. Нередко уже даже во время первого приступа болезни находят камни довольно больших размеров. И все же в этот бессимптомный период удается выявить некоторые признаки, свидетельствующие о болезни.
Диспепсические расстройства могут возникать периодически или наблюдаться постоянно. Эти же расстройства могут отмечаться и в промежутках между приступами болезни и после единственного приступа. Человек начинает выбирать блюда, избегая яйца, острого, жареного, жирного, ограничивает количество пищи — это приносит облегчение. Неприятные ощущения наблюдаются обычно после еды через 15—30 минут и могут продолжаться 2—3 часа. Отрыжка (частая и звучная) пищей, иногда воздухом. Часто бывает чувство горечи во рту, снижение аппетита, больные жалуются на обильное образование газов в кишечнике, запоры. Достаточно перейти такому человеку на молочно-растительную диету, как эти явления через 1 — 3 дня проходят. Тягостные явления
возникают также и после обильного питья. Указанные явления связаны с рефлекторно-функциональными или сопутствующими воспалительными изменениями со стороны желудка и двенадцатиперстной кишки. Нередко вскоре присоединяются соответствующие нарушения функции печени и поджелудочной железы.
Появление боли при заболевании желчных путей является результатом дальнейшего прогрессирования болезни. Локализация боли наблюдается одинаково часто как в подложечной области, так и в области правого подреберья. Изредка первоначальная боль может возникать под правой лопаткой, за грудиной, но всегда она через некоторый период времени локализуется в область правого подреберья. Стойкая боль, иногда довольно сильная в эпига-стральной области, свидетельствует о сопутствующих изменениях в желудке. Сопутствующий колит проявляется болью в нижней части живота или около пупка; опоясывающая боль, начинающаяся в левом подреберье, свидетельствует о панкреатите. Боль, возникающая при заболевании желчных путей, часто ирра-диирует в правую ключицу, лопатку, плечевой сустав, плечо, гораздо реже в левую половину грудной клетки — в область сердца и за грудину (что создает впечатление стенокардии). При наличии сопутствующих заболеваний почек и мочевого пузыря, при гинекологических заболеваниях воспалительного характера боль часто иррадиирует в область нижней части живота, в паховую область, поясницу.
По характеру боли, ее интенсивности, частоте и длительности можно в известной степени оценить и характер патологического процесса. Так, дискинезия желчных путей характеризуется распирающей болью, колющей, реже жгучей. Возникает она кратковременно и периодически, больные ощущают общую слабость, бледнеют, появляется холодный пот,
чувство онемения конечностей, головная боль и головокружение. Болевой приступ часто купируется самостоятельно, облегчение приносит применение грелки и спазмолитических средств. Вне приступа больные чувствуют себя вполне здоровыми. Часто боль провоцируется эмоцио- нальными расстройствами.
Желчнокаменную болезнь сопровождает боль острая,сильная,схваткообразная, вне приступа больные чувствуют себя вполне здоровыми. Приступ боли может длиться часами, возникает без видимых причин, нередко ночью, сопровождается рвотой, которая в отличие от заболеваний желудочно-кишечного тракта, не приносит облегчения; оно, как правило, наступает лишь после применения наркотиков.
Развитие острого калькулезного холецистита сопровождается острой распирающей длительной болью, повышением температуры, рвотой, чувством горечи во рту, характерной иррадиацией. Усиление боли происходит вскоре после приема пищи (жареной, жирной, иногда после газированных напитков, острых приправ). Она нередко усиливается при физической нагрузке, тряске, охлаждении. Возникновение острой кинжальной боли в животе нередко свидетельствует о перфорации желчного пузыря.
Хронический калькулезный холецистит характеризуется тупой ноющей болью, иногда сопровождающейся приступами желчной колики.
Нередко хронический холецистит сочетается с тяжелым спастическим колитом, который сам по себе прино-, сит немалые неприятности, но может и являться следствием хронического воспаления желчного пузыря, с лечением которого могут исчезнуть и явления колита.
При постановке диагноза хронического холецистита всегда следует помнить о необходимости исключения сходных по клинике заболеваний печени, таких как хронический гепа-
тит, холангит, цирроз, дискинезия желчных путей, а также заболевания соседних органов (язва желудка и двенадцатиперстной кишки, дивер-тикулит, дуоденальный отек, подвижная двенадцатиперстная кишка, панкреатит, грыжа пищеводного отверстия, болезни почек) и целый ряд других заболеваний.
Объективные клинические данные. Начиная с измерения температуры, осмотра и кончая глубокой пальпацией при определенной тщательности исследования, удается выявить ряд характерных для заболевания печени и желчной системы симптомов, которые помогают еще до применения специальных методов поставить правильный диагноз.
Появление температурной реакции свидетельствует о наличии воспалительных изменений в желчном пузыре. Более стойкое повышение температуры от субфебрильных до высоких цифр (38—39°) с ознобом и потом говорит о возникновении осложненных форм острого холецистита.
Осмотр больного позволяет выявить желтушность кожных покровов и склер. Появление желтухи указывает на осложнения со стороны хо-ледоха механического характера (отек и набухание в области периам-пулярной зоны, закупорка конкрементами), а также на наличие гепатита или панкреатита.
Учитывая, что почти 40% острых калькулезных холециститов сопровождаются камнями холедоха, желтуха при остром холецистите — явление не редкое.
Осмотр также дает возможность отметить следы расчесов, наличие пигментации (частое применение грелок), расширение подкожной венозной сети и др. Осмотр живота в положении лежа позволяет иногда выявить выпячивание в правом (увеличенный желчный пузырь или печень) или в левом подреберье за счет увеличенной селезенки. Следует обратить внимание на участие различных отделов брюшной стенки в дыхании
и выявить отставание и щажение, что свидетельствует о патологии, чаще воспалительного характера в этой части брюшной полости.
Поведение больного — характерно, особенно во время желчной колики. Резкое беспокойство, больной стонет, кричит, мечется в постели, старается прижать верхнюю половину живота подушкой, не щадя живота, чем он и отличается от больного с прободной язвой желудка, у которого давление на живот вызывает резкое усиление боли. Беспокойство сменяется относительным покоем. Лишь когда к неутихающей колике присоединяется тяжелый воспалительный процесс, распространяющийся на брюшину — движение, крик, глубокий вздох еще больше усиливает боль и больной перестает двигаться — развивается тяжелый шок, нарастает интоксикация, проявляющаяся небольшими нервными подергиваниями, а у больных в более тяжелом состоянии супорозным состоянием и комой.
Пальпация даже поверхностная позволяет выявить напряжение мышц передней брюшной стенки в области правого подреберья при остром холецистите и обострении хронического. Стойкое напряжение и положительный симптом Щеткина—Блюмберга свидетельствует о вовлечении в процесс брюшины. Более четко выявить распространение, локализацию и степень болезненности позволяет перкуссия передней брюшной стенки кончиками полусогнутых пальцев правой кисти.
Пальпацию обычно проводят в различных положениях больного: лежа на спине, на левом и правом боку, стоя и сидя. Нормальный желчный пузырь не прощупывается и поэтому его обнаружение (симптом Кур-вуазье) свидетельствует о патологии в пузырном протоке или холедохо-панкреатической зоне (камень холедоха, стеноз или рак фатерова соска, отек или рак головки поджелудочной железы). Рак желчного пузыря паль-
пируется в виде плотного образования в правом подреберье, но вместе с тем подобное образование может определяться при раке и эхинококке печени, а также опухоли правой почки.
Одним из характерных признаков холецистита является болезненность при пальпации в области желчного пузыря, особенно при вдохе (симптом Кера). Иногда этот симптом легче удается получить при исследовании больного в положении сидя. В ряде случаев поколачивания локтевой стороной кисти по реберной дуге справа вызывает болевую реакцию (симптом Грекова—Ортнера). В ряде случаев бывает симптом Мюс-си — болезненное ощущение при надавливании на п. phrenicus между ножками грудино-ключично-сосковой мышцы справа. Симптом Мэрфи — при выпячивании живота или глубоком вдохе, когда пальпирующая рука касается желчного пузыря, возникает резкая болезненность при его воспалении. Симптом Лепене — болезненность при поколачивании в правом подреберье, особенно на вдохе.
Вполне понятно, что чем выражен-ней воспалительный процесс, тем легче выявить болевые симптомы. При хроническом процессе выявить их сложнее — для этого требуется определенный навык.
При вовлечении в процесс поджелудочной железы (холецистопанкре-атих), который встречается в 15— 30% заболеваний желчных путей, при глубокой пальпации отмечается исчезновение пульсации брюшной аорты (симптом Воскресенского) и появление боли в левом реберно-по-звоночном углу (симптом Мейо—Робсона), боль, возникающая при толчкообразных движениях снизу вверх и спереди назад, поставленной поперек живота руки (симптом Чухри-енко).
Клиника хронического «бескамен-ного» холецистита мало чем отличается от таковой при «каменном» холецистите. Главным образом проявля-
ются симптомы желудочных расстройств с изменением общего состояния. Характерна периодичность 1 — 3 дня, затем несколько недель светлого промежутка. Боль появляется после различных погрешностей в диете, возникает чаще ночью в виде тягостных ощущений в области правого подреберья, в подложечной области, изжоги, вздутие живота, тошноты, иногда возникает настоящая печеночная колика. У ряда больных повышается температура, появляется субиктеричность склер и темная моча, менее интенсивное окрашивание стула.
Из нарушений общего состояния отмечается мигрень, снижение трудоспособности, бессонница, иногда исхудание, нарушение менструального цикла у женщин, сердцебиения, одышка при физических напряжениях, экстрасистолия.
СПЕЦИАЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИ
Сюда относятся в первую очередь методы рентгенологического исследования, которые почти у 90% больных желчнокаменной болезнью позволяют поставить правильный диагноз.
Обзорный рентгеноснимок брюшной полости дает возможность у 10— 20% больных (И, М. Тальман, 1963; Л. Д. Линденбратен, 1961) обнаружить камни в желчном пузыре. Безусловно, это зависит не только от опыта рентгенологов и методики исследования, но во многим и от состава самих конкрементов. Простой рентгеноснимок может быть положительным только при наличии камней, состоящих из большого количества извести. В этих случаях получается гомогенная тень по форме конкрементов. Чисто пигментные и холестериновые камни тени не дают, но камни смешанного типа (имеющие в своем составе примесь извести) дают тень определенной формы, Учитывая, что

Puc. J5. Холецистограммы больных желчнокаменной болезнью.
известь распространяется по периферии, тень получается в виде кольца или полумесяца. Расположение камней правильной формы в виде виноградной грозди или цепочки впереди от позвоночника в боковой проекции свидетельствует о том, что эти камни принадлежат именно желчному пузырю, а не мочевой системе.
Еще большими диагностическими возможностями располагает холеци-стография — метод, позволяющий судить не только о наличии конкрементов в желчном пузыре, но и его функции.
При помощи холецистографии можно оценить как концентрационную способность, так и выделительную (в смысле опорожнения) функцию пузыря, а фиксирование этого процесса на кинопленку дает возможность рассмотреть его в динамике.
Отсутствие контрастирования желчного пузыря свидетельствует о наличии патологии в пузырном протоке (отсутствие просвета, непоступление желчи в связи с отсутствием проходимости печеночного протока); наличии эмпиемы или водянки желчного пузыря; плотном выполнении желчного пузыря конкрементами; резком нарушении функции печени (цирроз, желтуха с билирубином сыворотки крови более 3 мг%); полном нарушении концентрационной способности желчного пузыря.
В то же время получение густой тени желчного пузыря на рентгенограмме без изображения конкрементов не исключает их наличия. У таких больных снимки необходимо производить в различных положениях тела, в период опорожнения желчного пузыря. В ряде случаев присутствие камней можно определить по наличию дефекта наполнения, просветлениям, иногда создающим картину ячеистого строения желчного пузыря (рис. 15). У некоторых больных пузырьки газа в кишечнике создают впечатление просветлений от наличия камней, однако эти просветления при снимках в различных проекциях всегда находятся вне тени желчного пузыря, чего нельзя сказать о просветлениях, вызванных камнями,
Холецистографией не во всех случаях удается четко определить наличие конкрементов, хотя приступы печеночной колики свидетельствуют об их наличии, в этих случаях можно прибегать к поискам камней в фекальных массах. Обычно делают это на протяжении 3 дней после колики путем промывания и просеивания через мелкое сито кала. Чаще обнаруживаются фасеточные мелкие камни, реже мелкие камни округлой формы типа конопляного зерна, обнаружение крупных конкрементов свидетельствует о наличии соустья желч-
ного пузыря с желудочно-кишечным трактом (Pavel, 1954). Не следует забывать, что инкрустированные остатки пищи, медикаментов также могут быть похожими на камни желчных путей, поэтому химическое исследование их па содержание холестерина и билирубина обязательно. В некоторых случаях обнаружение песка также свидетельствует о патологии желчных путей (И. М. Таль-ман, 1963).
Рентгеноконтрастные методы
исследования помогают иногда и в диагностике хронического «бескаменного» холецистита — слабая тень пузыря в результате изменений слизистой оболочки и нарушения концентрационной способности, замедление срока эвакуации, неполное опорожнение пузыря свидетельствует о воспалительном процессе.
Здесь же следует отметить, что получение нормального изображения желчного пузыря не является отрицанием хронического холецистита при наличии соответствующей клинической картины.
Некоторые исследователи придают большое значение дуоденальному зондированию. Получение мутной, вязкой желчи в порции В или даже, если она прозрачна, то изменение ее цвета в зеленоватый (частичное превращение билирубина в биливердин из-за повышения кислотности содержимого желчного пузыря под влиянием инфекции), сочетающееся с возникновением тянущей боли в области желчного пузыря после зондирования, считают достоверными признаками хронического холецистита. Имеют значение и обнаружение в желчи хлопьев, кристаллов холестерина, желчного песка после дачи желчегонных средств, особенно если порция А у этого же больного не имела их, увеличение до 30—40 лейкоцитов и больше.
Специальные методы исследования применимы у больных с хроническими формами холецистита. В сочетании с клиническими данными
они почти во всех случаях позволяют правильно поставить диагноз и определить показания к лечению. Более сложную задачу представляет правильная диагностика острого воспаления желчного пузыря, когда хирургу приходится в сравнительно короткий срок поставить правильный диагноз, а также решить вопрос о срочности оперативного лечения. Сложность состоит еще и в том, что примерно у половины больных приходится проводить тщательную дифференциацию симптомов для исключения острой хирургической патологии других органов брюшной полости и в первую очередь острого панкреатита. Hess (1961) вообще считает, что у подавляющего большинства эти заболевания в остром периоде не дифференцируются. Однако применение консервативных методов лечения при остром серозном панкреатите (по мнению большинства хирургов на XXI Всемирном съезде хирургов) и оперативных при остром холецистите и деструктивных формах холецистопанкреатитов требует установления правильного до-операционного диагноза. Внезапный приступ сильной боли в области правого подреберья, бурное начало с резким беспокойством больного, мучительная рвота с примесью желчи, бледность лица, умеренная желтушность склер и кожных покровов, ригидность передней брюшной стенки в правом подреберье и эпигастрии, иногда, наоборот, мягкий живот — все это объединяет симптомы этих 2 заболеваний. И все же, острый панкреатит характеризуется более выраженной картиной шока и коллапса, интоксикацией, более быстрым нарастанием явлений раздражения брюшины. Повторные исследования мочи и крови на диастазу помогают установлению диагноза. Если при остром холецистите помогают тепло и наркотики, то при остром панкреатите они почти бессильны. Обнаружение болезненности опоясывающего характера с резистент-
ностью и болью при исследовании в поперечном направлении эпигастрия, отсутствие отчетливой пульсации аорты, чего не отмечается при заболевании желчных путей, также помогает в дифференциальной диагностике.
К сожалению, по мнению Л. Д. Линденбратен (1953), С. С. Бакалей-никова (1959) и других, производство холецистограмм является опасным для почечной ткани в первые 7 дней острого воспаления желчных путей. Поэтому многие ограничиваются простой обзорной рентгенографией брюшной полости, на которой в ряде случаев видны желчные конкременты и контуры желчного пузыря, а также при спонтанном образовании соустья между желчными путями и пищеварительным трактом, на обзорном снимке возможно получить пневмо-холангиограмму.
Весьма нежелательной, а в ряде случаев и опасной является операция по поводу острого холецистита при наличии острого гепатита, холан-гита, цирроза печени, при которых иногда также наблюдается печеночная колика. К подобного рода неправильным заключениям приходят иногда и при дискинезиях желчных путей, ламблиозе. При выраженных явлениях раздражения брюшины, сопровождающих острый холецистит и холецистит, осложненный перфорацией, всегда возникают диагностические трудности в исключении перфоратив-ной, прикрытой и пенетрирующей язвы желудка или двенадцатиперстной кишки. У ряда больных высоко расположенный остро воспаленный червеобразный отросток, дающий резкое напряжение мышц правой половины брюшной стенки, представляет большие диагностические трудности, а иногда его вовсе нельзя отличить от острого воспаления желчного пузыря (при низком расположении, когда дно пузыря спускается к гребешку подвздошной кости). И. М. Тальман (1963) считает эту диагностическую ошибку довольно типичной при распознавании острого холецистита.
В ряде случаев при инфаркте миокарда и острой коронарной недостаточности возникает боль в области живота, сходная с болью при тяжелом приступе острого холецистита, в то же время боль, возникающая при приступе острого холецистита, иногда может иррадиировать в сердце и левую половину грудной клетки. Оба заболевания могут сопровождаться характерными для холецистита изменениями со стороны белой кроки, сильной тошнотой и рвотой. Электрокардиограмма помогает поставить врачу правильный диагноз, однако известно, что и тяжелая почечная колика может дать на ней изменения с нарушением ритма сердечных сокращений.
Не следует забывать, что и такие заболевания, как пневмония, плеврит, тромбоз мезентериальных сосудов, а также острая кишечная непроходимость могут давать сходную с острым холециститом клиническую картину.
При камне мочеточника и правой почки у ряда больных боль во время приступа почечной колики может локализоваться подобно боли при печеночной колике. Обзорный рентгено-снимок, а иногда только специальное урологическое обследование оказывает помощь в дифференциальном диагнозе.
Таким образом, при типичном анамнезе, характерной локализации боли и ее иррадиации, при возможности прощупать напряженный желчный пузырь и наличии желтухи, диагностика остгого холецистита не представляет особых трудностей. Даже при несколько атипичном развитии и течении процесса постановка правильного диагноза является сложным вопросом даже для опытного хирурга.
ЛЕЧЕНИЕ
Вопрос лечения желчнокаменной болезни при проявлении ее в виде хронического калькулезного холеци-
стита решен в пользу оперативного метода. В настоящее время смертность после холецистэктомии составляет не более 0,5—1%.
Несколько иной остается тактика при «бескаменных» хронических холециститах, здесь консервативная терапия в большинстве случаев оказывает положительный эффект и является основным методом лечения, и только при безуспешности последней на протяжении не менее 15 лет показана операция. При частых, мучительных приступах печеночной колики вопрос об оперативном лечении следует ставить раньше.
Консервативное лечение заключается в назначении соответствующей диеты, холеретических и холекине-тических средств, антибактериальных препаратов, физиотерапевтических процедур, минеральных вод.
Из питания следует исключить копченые, вяленые, острые и жареные блюда, консервы, колбасу, острый сыр, какао, шоколад, алкоголь. Можно употреблять продукты, обладающие желчегонными свойствами, если они не вызывают боль — яйца в смятку в умеренном количестве, несоленое свежее сливочное, оливковое масло, сливки, молоко, молочные продукты, мясо и свежую рыбу.
К холеретическим препаратам, увеличивающим секрецию желчи и стимулирующим образование желчных кислот, относятся дехолин, ал-лахол, холагол, холензим, холосас, олиметин, ровахол, билихол, били-крин, цветы бессмертника, кукурузные рыльца и целый ряд других препаратов.
К препаратам, увеличивающим секрецию желчи за счет водного компонента (гидрохолеретики), относится любая жидкость, обильный прием которой (водный удар — 1,5 л) способствует разжижению желчи, усилению ее выделения, а также уротропин, салициловокислый натрий, атофан, минеральная вода и др.
К лекарственным средствам, стимулирующим желчеотделение путем
повышения тонуса желчного пузыря и снижения тонуса желчных путей (холекинетики), относятся холеци-стокинин, сульфат магния, питуитрин, яичные желтки, а к препаратам, способствующим расслаблению тонуса желчных путей (холеспазмоли-тические вещества), следует отнести сульфат атропина, гидротартат пла-тифилина, экстракт белладонны, холе-литин, эуфиллин, бензацин, мета-цин, нитроглицерин, амилнитрит и другие препараты.
Хорошее лечебное действие оказывает дуоденальное зондирование, на курс лечения 10—12 процедур через 2—3 дня. Некоторые рекомендуют сочетать дуоденальное зондирование с введением в двенадцатиперстную кишку по 30—50 мл 25— 33% раствора сернокислой магнезии, подсолнечного или кукурузного масла.
Применяют также тубаж без зонда, предложенный Т. С. Демьяновым в 1948 г. Заключается он в принятии натощак 1/2 столовой ложки английской соли, растворенной в полстакане горячей воды (или 30 мл 33% раствора), после чего больной должен с грелкой лежать на правом боку 2—3 часа. Процедура повторяется 1—2 раза в неделю по 10—15 раз на курс лечения.
Во время обострения с повышением температуры и изменением картины белой крови следует прибегать к антибактериальным препаратам.
В этот же период рекомендуют жидкую диету в виде манных каш, овощных супов, картофельного пюре, нежирного молока, простокваши, чая, сока, компотов. Все продукты нужно принимать в теплом виде.
УВЧ и диатермию рекомендуют при болях. При хронических формах вне приступа предлагают санаторно-курортное лечение в Ессентуках, Железноводске, Трускавце, Карловых Варах (ЧССР) и др.
В отношении острого воспаления желчного пузыря независимо от его генеза в последние годы оправдала
себя тактика строго обоснованного дифференцированного подхода к лечению: при неосложненных формах— консервативное на протяжении 7— 10 дней с последующим обследованием и уточнением показаний к операции (без выписки из стационара или с выпиской,— если показания не убедительны); при формах осложненных перитонеальными или септическими явлениями лечение только оперативное. Такова наша тактика в решении вопроса о срочности вмешательства.
В консервативные мероприятия входит: 1. Обезболивание (проме-дол, пипольфен, таламанал, пара-нефральная, вагосимпатическая блокада и блокада круглой связки печени). 2. Антиспастические средства (платифилин, но-шпа, атропин). 3. Антибиотики. 4. Сульфаниламидные препараты при непереносимости к антибиотикам. 5. Холод на область желчного пузыря. 6. При наличии холецистопанкреатита в комплекс мероприятий должны быть включены ингибиторы — тразилол, цалол, пантрипин, зимофрен, ини-прол, контрикал, эпсилонаминокап-роновая кислота, а больным в тяжелом состоянии — желудочную гипотермию.
Оперативные методы лечения. Существуют два метода оперативного лечения холециститов: 1) холецистэк-томия с ее разновидностями в зависимости от формы и степени воспалительных изменений в желчном пузыре: от шейки; от дна; атипичная; при внутрипеченочном расположении; ушивание ложа; дренаж к культе желчно-пузырного протока; 2) хо-лецистотомия: с марсупиализацией и на расстоянии.
Холецистэктомия. Впервые «экстирпацию» желчного пузыря предложил и осуществил как лучший метод лечения желчнокаменной болезни Langenbuch в 1882 г. В дальнейшем операцию иссечения желчного пузыря — холецистэктомию стали применять чаще. Очень большую роль
в ее разработке и усовершенствовании сыграл Kehr (1894, 1913). В России первым сделал холецистэктомию Ю. Ф. Коссинский в 1886 г., А. Ф. Каблуков — в 1895 г.,
A. А. Троянов — в 1897 г. В даль нейшем холецистэктомию стали при менять все чаще, большую роль в этом сыграл А. В. Мартынов (1868— 1934), С. П. Федоров (1869—1936),
B. И. Добротворский (1869—1937), И. И. Греков (1867-1939), Б. К. Фин- келынтейн (1929) и мн. др.
Показания к холецистэктомии: хронический калькулезный холецистит, прогрессирующее острое воспаление желчного пузыря, хронический «бескаменный» холецистит при стойком бактериальном инфицировании желчного пузыря и желчных протоков, водянка и хроническая эмпиема желчного пузыря, стойкая дискинезия с нарушением сократительной и концентрационной способности, стойкое бациллоносительство, заворот желчного пузыря, паразитарное его поражение при отсутствии эффекта от терапевтического лечения, доброкачественные и злокачественные опухоли желчного пузыря.
Во всех случаях следует учитывать наличие заболеваний желудка, кишечника, сердца, желчного протока и его сфинктерального аппарата, поджелудочной железы и ее выводного протока.
Таким образом, каждый больной, в особенности пожилого возраста, представляет собой индивидуальную проблему, которую следует постоянно решать, чтобы установить наиболее правильные показания к операции.
Укладка больного. Немаловажным при операциях на желчном пузыре является и правильная укладка больного па операционном столе с использованием круглого валика (диаметр 18—20 см, длина равна ширине стола). Валик должен находиться на уровне Д12, что соответствует спереди уровню мечевидного отростка.
Под грудную клетку целесообразно подложить плоскую подушку, а операционный стол слегка наклонить вправо.
Разрез брюшной стенки производят с учетом максимального удобства для хирурга и максимального щаже-ния нервов брюшной стенки. Из многочисленных предложенных для этой цели разрезов можно рекомендовать четыре: Ридель—Кохера, Ке-ра, Рио—Бранко, клюшкообразный или срединная лапаротомия (см. рис. 92).
До последнего времени мы чаще пользовались клюшкооб разным, предложенным А. А. Шалимовым (см. рис. 92, 20,а). Этот разрез начинают от мечевидного отростка, проводят по средней линии живота на 2/3 расстояния до пупка и затем проходят косо вправо с пересечением прямой мышцы живота и оканчивают разрез на уровне пупка. В настоящее время мы чаще отдаем предпочтение срединной лапаротомии иногда с огибанием пупка справа и продолжением разреза ниже его на 2 см, (см. рис. 92, 20,6).
ТЕХНИКА ОПЕРАЦИИ
Ретроградная холецистэктомия (удаление пузыря от шейки) является наиболее рациональной. Сначала обрабатывают пузырный проток и артерию, после чего желчный пузырь удаляют из своего ложа. Холецистзктомия от шейки в неос-ложненных случаях проще и безопаснее. От этой методики следует отступать только в тех случаях, когда к этому принуждают какие-нибудь технические трудности. Начало операции от шейки представляет ряд преимуществ.
1. Сразу же после выделения пузырного протока, через него можно проводить манометрию, холангиографию, зондирование общего желчного протока и большого дуоденального соска. Полученные в этот период результаты наиболее достоверны, так как еще не нанесена большая травма, при которой иннервация, а сле-
довательно, и функция желчных путей существенно не нарушаются. Меньше потери времени для холангиографии, ибо пока удаляют желчный пузырь, уже будут получены проявленные снимки.
2. Предотвращаются условия для проталкивания мелких камней из желчного пузыря в холедох, исключая этим развитие в последующем постхолецистэктомическо-го синдрома.
3. Пузырную артерию перевязывают до иссечения желчного пузыря. Это значительно уменьшает кровоточивость при выделении желчного пузыря из его печеночного ложа.
Желчный пузырь берут двумя окоп-чатыми зажимами, одним у дна, другим у шейки. Легкой тракцией желчного пузыря хирург натягивает его шейку и делает надрез серозной оболочки печеночно-двенадцатиперстной связки по ее правому краю, несколько ниже шейки желчного пузыря, там, где предполагается пузырный проток (рис. 16,а). Жировую ткань связки раздвигают изогнутым зажимом и тупфером, пока станет видимым пузырный проток. Следуя по его нижнему краю тупфером и диссектором, пузырный проток выделяют до обнажения места подхода его к общему желчному протоку. Надо совершенно ясно отдиференцировать пузырный, общий печеночный и общий желчный протоки и место их слияния. Затем продолжая тупо и остро препарировать в пространстве между шейкой пузыря и общим печеночным протоком, выделяют всю окружность пузырного протока. Указательный палец левой руки вводят в винслово отверстие и пальпируют дистальный конец пузырного протока и холедох между указательным и большим пальцем. Внимательно ищут камни в этих протоках, затем длинный изогнутый зажим накладывают поперек пузырного протока примерно на расстоянии 5 мм от места соединения его с общим желчным протоком. Второй зажим накладывают проксимально ближе к пузырю и пузырный проток перерезают между ними (рис. 16,б,в). На культю протока накладывают двойную лигатуру, вначале шелковую или капроновую, а затем, ближе к общему желчному протоку — кетгутовую. Культю пузырного протока перевязывают только тогда, когда совершенно ясно установлено отсутствие изменений в общем желчном протоке. Если же есть сомнения, то проводят манометрию, зондирование и холангиографию через пузырный проток путем введения через него полиэтиленового катетера, затем производят перевязку пузырной артерии, ее следует искать в треугольнике Callot (рис. 17). Иногда она сразу видна или ее легко обнаружить. В других случаях ткань в области треугольника состоит из плот-пых волокон и в ней трудно выделить со-
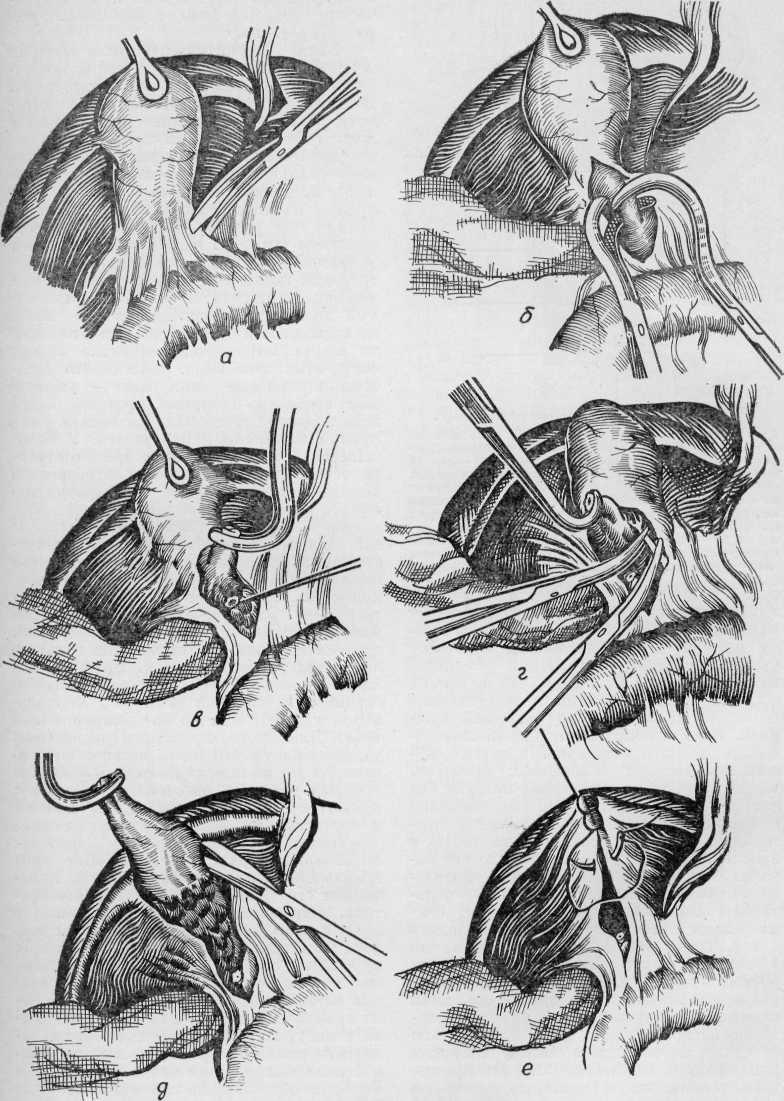
Рис. 16. Ретроградная холецистэктомия (объяснение в тексте).
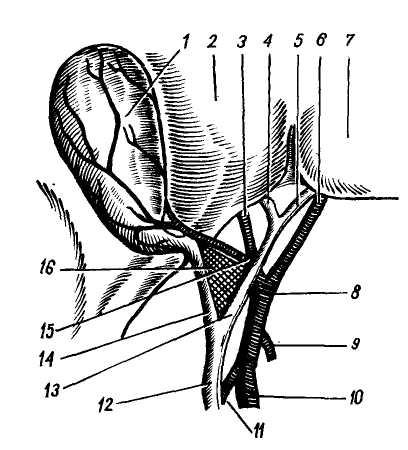
1 — желчный пузырь; 2 — правая доля печени; 3 — правая ветвь собственной печеночной артерии; 4 — правый печеночный проток; 5 — левый печеночный проток; 6 — левая ветвь собственной печеночной артерии; 7 — левая доля печени; 8 — собственная печеночная артерия; 9 — правая желудочная артерия; 10 — общая печеночная артерия; 11 — желудочно-двенадцатиперстная артерия; 12 — общий желчный проток; 13 — общий печеночный проток; 14 — пузырный проток; 16 — пузырная артерия; 16 — треугольник Кало.
суд. В таких случаях шейку желчного пузыря приподнимают и освобождают от окружающих тканей по направлению к телу пузыря. При потягивании за шейку пузыря артерия натягивается, это значительно облегчает ее поиски. Но не всякий сосуд, который находится в треугольнике Callot, будет обязательно пузырной артерией. Надо отличить ее от правой печеночной, добавочной печеночной и других аномальных сосудов и желчных протоков. Кроме того, иногда пузырная артерия бывает двойной. При малейшем сомнении в тождестве сосуда следует провести тщательную ревизию треугольника Callot и проследить данное образование до его начала. Когда пузырная артерия тщательно опознана и освобождена, на нее накладывают длинный изогнутый зажим, ближе к задней стенке пузыря и параллельно с ней. Тогда можно быть уверенным, что в зажим не будут захвачены правые печеночные артерия и проток. Второй зажим накладывают на самую стенку желчного пузыря и между зажимами пузырную артерию перерезают (см. рис. 16,г). Культю ее сразу перевязывают тонким капроном или шелком. Некоторые хирурги предпочитают выделять и зажимать пузырную артерию прежде чем перерезать пузырный проток, а другие накладывают зажим на пузырную артерию и проток совместно.
Такие приемы могут привести к хирургическим повреждениям печеночных артерий и протоков.
После перевязки пузырной артерии можно удалить желчный пузырь, его отделяют ножницами от ложа снизу вверх. При этом по обе стороны от пузыря стараются сохранить возможно более широкие полосы брюшины, чтобы потом можно пе-ритонизировать печеночное ложе. Для этого скальпелем надсекают серозную оболочку по правому и левому краям желчного пузыря, начиная от шейки. У дна желчного пузыря оба разреза подковообразно соединяются (см. рис. 16,д) и край брюшины у края печени захватывают зажимом и натягивают вверх. Маленьким тупфером или ножницами находят нужный слой и желчный пузырь вылущивают из его ложа, по возможности субсерозно. При этом почти всегда встречаются несколько мелких сосудистых стволиков. Обычно это добавочные воротные вены, роже — добавочные печеночно-пузырные протоки. Такие натягивающие тяжи надо захватить изогнутыми зажимами и перевязать.. У большинства больных мы несколько отступаем от методики классической ретроградной холецистэктомии и после пересечения пузырной артерии и пузырного протока продолжаем выделение желчного пузыря от дна. Такая методика значительно облегчает технику операции, предотвращает надрывы ложа пузыря, серозы и, обычно, проходит без «случайных» вскрытий желчного пузыря. Затем печеночное ложе покрывают тампоном, и если культя пузырного протока не была еще перевязана наглухо, снова возвращаются к ней. Просматривают проявленные к этому времени холанги-ограммы, и если они оказались нормальными, удаляют катетер из пузырного протока. Для этого скальпелем перерезают удерживающую его нить, катетер вытягивают и в тот же момент изогнутым зажимом, который держали наготове, захватывают культю пузырного протока. Ее натягивают и перевязывают, как было описано выше.
После этого приступают к перитони-зации ложа желчного пузыря. Шов ложа производят непрерывным кетгутом и начинают его вблизи культи пузырного протока, натягивая зажим, положенный у края печени (см. рис. 16,е). Хирург должен убедиться в том, что первый стежок не затянут слишком туго, так как существует опасность захватить при этом правый печеночный проток или артерию. Если края брюшины у печеночного ложа тонки и могут легко порваться, то можно захватить немного паренхимы печени, прихватывая в шов также ткань на дне ложа, чтобы не образовалось замкнутой полости. Ложе желчного пузыря должно быть полностью перитонизировано, если это возможно. Напротив, не надо применять
усилия, чтобы закрыть брюшину поверх общего желчного протока и культи пузырного протока — это деформирует гепато-холедох, а если случится просачивание желчи, то она будет скопляться за брюшиной и вызовет склерозирующий пери-холедохит с последующим рубцовым сдавлением холедоха.
Дренаж из мягкой резины помещают в область культи пузырного протока и выводят его через отдельный небольшой разрез брюшной стенки справа. При абсцессе околопузырного пространства приходится дренировать ложе пузыря несколькими тампонами, которые выводят через рану, как по наиболее короткому пути. Прежде чем наложить швы на рану, большой сальник прокладывают между нижней поверхностью печени и двенадцатиперстной кишкой.
Антеградная холецистэктомия состоит в удалении пузыря от дна к шейке и используется в тех случаях, когда наталкиваются на технические трудности во время препаровки и выделения элементов в области шейки пузыря. Такие сложности могут быть обусловлены наличием анатомических вариантов или значительными рубцовыми и инфильтра-тивными изменениями, при которых отыскать пузырный проток невозможно. Прежде считали антеградную холецистэктомию методом выбора, безопасным и верным (А. Д. Очкин, 1949; И. Н. Ищенко, 1960; Kehr, 1913), но она не оправдывает такой оценки (С. П. Федоров, 1904; И. М. Тальман, 1963; И. Литтман, 1954; Puestow, 1957; Hess, 1961). Дело в том, что при выделении желчного пузыря от дна возникает большая кровоточивость, чем при ретроградной холецистэктомии, так как пузырную артерию перевязывают только после выделения пузыря. Изливающаяся кровь заполняет операционное поле и осложняет препаровку и выделение протоков и сосудов у шейки желчного пузыря.
Если хирург решает удалить желчный пузырь от дна, то дно захватывают окончатым зажимом. Брюшину над пузырем, вблизи перехода ее на печень, надсекают скальпелем с обеих сторон (рис. 18,а). Это можно облегчить гидравлической препаровкой-иньекцией раствора но-
вокаина под брюшину. Обе линии разреза соединяют в области дна. После этого ножницами, маленьким тупфером или пальцем желчный пузырь выделяют из печеночного ложа, продвигаясь к шейке (см. рис. 18,б). Обычно такое выделение довольно кровавое, потому что пузырная артерия еще не перевязана. Кровотечение останавливают прижатием марлевого тампона, наложением зажимов и лигатур на отдельные сосуды большого диаметра.
При выделении желчного пузыря надо быть особенно осторожным у его шейки. Пузырная артерия при таком методе нередко может быть перерезана незаметно для хирурга. В таком случае надо сразу захватить ее зажимом и перевязать, к сожалению, натянутый сосуд после перерезки сильно сокращается и уходит глубоко в пе-ченочно-двенадцатиперстную связку, что существенно осложняет операцию (см. ниже). Ввиду такой угрозы манипуляции в области шейки должны быть весьма осторожными. Подтягивая дно пузыря зажимом, рассекая ткани позади его шейки, все время пальпируя и придерживаясь стенки желчного пузыря, достигают пузырной артерии и протока. Надо тщательно отдиференцировать их, прежде чем наложить зажим и пересечь. Два длинных изогнутых зажима накладывают на пузырную артерию (см. рис. 18,г) и между ними ее пересекают и перевязывают возможно ближе к желчному пузырю, чтобы вместе с ней не перевязать печеночную артерию.
Если, как это обычно бывает, в шейке пузыря лежит большой камень, его захватывают левой рукой, вводят указательный палец позади пузырного протока и на кончике пальца производят рассечение окружающих тканей и тщательно выделяют пузырный проток. Его отжимают на 5—6 мм от общего желчного протока (см. рис. 18 г,д) и пересекают. Прежде чем отжать пузырный проток необходимо точно сориентироваться, чтобы вместе с ним не прихватить и участок общего желчного протока. Желчный . пузырь удаляют, а культю пузырного протока перевязывают двойной лигатурой. Затем осуществляют перитонизацию печеночного ложа пузыря, дренаж подпеченочного пространства и шов раны брюшной стенки, как было описано выше.
Атипичная холецистэктомия с предварительным рассечением стенки желчного пузыря. В особенно трудных случаях, когда массы инфильтратов и обширные сращения окружают не только пузырь, но и шейку, пузырный и желчный протоки, а также при резких патологических изменениях стенки желчного пузыря типич-
Рис.
18. Антеградная холецистэктомия
(объяснение
в тексте).
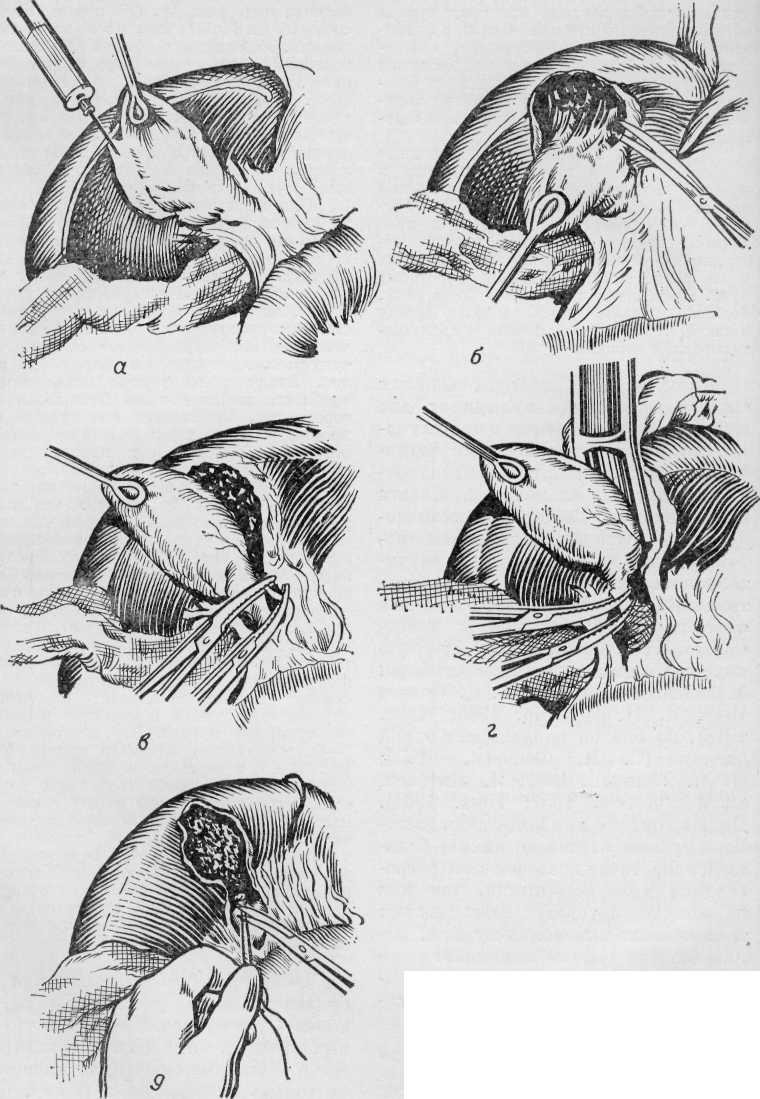
Для этой цели желчный пузырь рассекают по его продольной оси и накладывают зажимы на сильно кровоточащие края раны. В желчный пузырь вводят указательный палец левой руки и под контролем его иссекают пузырь, выделяя его ножницами или скальпелем из инфильтрата и отделяя от печени. Таким путем постепенно подходят к шейке, лигируют путем обкалывания инфильтрированную клетчатку и рассекают ее, держась у самой стенки. Обычно вместе с клетчаткой удается перевязать и ветви пузырной артерии; иногда же не удается, и при конечном рассечении клетчатки показывается струйка артериальной крови. Неперевязанную артериальую веточку захватывают зажимом и прошивают. Из просвета пузыря в пузырный и общий желчный проток вводят пуговчатый зонд, а затем тонкую полиэтиленовую трубку для холангиографии. Ориентируясь по зонду, или по данным холангиографии, выделяют, берут на зажимы, пересекают и перевязывают пузырный проток, удаляя желчный пузырь (рис. 19,а,б).
В таких случаях наиболее опасным моментом является выделение шейки, запаянной в инфильтрате. Позади нее лежат крупные сосуды, а сбоку, у начала пузырного протока, может быть припаян печеночный проток. Поэтому здесь необходима особая осторожность: надо все время держаться возможно ближе к стенкам удаляемого органа и пузырного протока и оперировать под контролем введенного в полость пузыря пальца левой руки. У больных в особо тяжелом состоянии пузырь ампутируют, оставляя шейку, слизистую оболочку выжигают или соскабливают культю протока и по возможности ложе зашивают узловатыми швами (см. рис. 19в).
Субсерозная холецистэктомия. Бывают случаи, когда двенадцатиперстную кишку нельзя отделить от желчного пузыря. В таких случаях (что бывает очень редко) можно
применить субсерозную холецистэк-томию, которую в 1892 г. описал Doyen и в 1906 г. Witzel.
Делают поверхностный надрез брюшины, покрывающей пузырь в области дна, стремясь попасть в слой между мышечной и серозной оболочкой. Иногда это удается очень легко. В то время, когда утолщенная серозная оболочка остается на соседних органах, медленно вылущивают желчный пузырь. Недостаток этого метода состоит в значительном кровотечении, потому что пузырную артерию можно перевязать только после выделения желчного пузыря. В некоторых случаях сращения в области шейки и пузырного протока менее плотные и возможно отпрепаровать треугольник Callot.
Холецистэктомия при сморщенном желчном пузыре. Иногда трудность операции состоит в том, что невозможно отыскать желчный пузырь. Хотя вся нижняя поверхность печени хорошо обнажена, но нигде не обнаруживается и следа желчного пузыря. В таком случае желчный пузырь скорее всего мал и сморщен, плотные рубцовые ткани подтягивают его к воротам печени и замуровывают полностью в глубоком печеночном ложе. Пузырный проток, как и вся печеночно-двенадцати-перстная связка, укорачивается, маленький пузырь всем своим массивом может располагаться на печеночно-желчном протоке и все это значительно усложняет операцию. Тогда надо найти верхний край двенадцатиперстной кишки и общий желчный проток. Последний в подобных случаях почти всегда бывает утолщенным, потому что, как правило, содержит камни. Затем делают пункцию холедоха и выполняют холангиографию. Ориентируясь по ее данным, маленький сморщенный пузырь удаляют только в том случае, если он содержит камни. Нередко же его оставляют па месте и ограничиваются только удалением камней холедоха.
И. Н. Ищенко (1960), Hess (1961) рекомендуют в подобных случаях экстирпацию лишь освобожденной и видимой части стенки желчного пузыря и выжигание остальной части, лежащей в печеночном ложе.
Чреспеченочная холецистэктомия. Для тех редких случаев, когда желчный пузырь совершенно не виден, расположен внутри паренхимы печени или к нему нельзя подойти со стороны нижней поверхности печени, Mirizzi в 1957 г. предложил чрес-печеночную холецистэктомию.
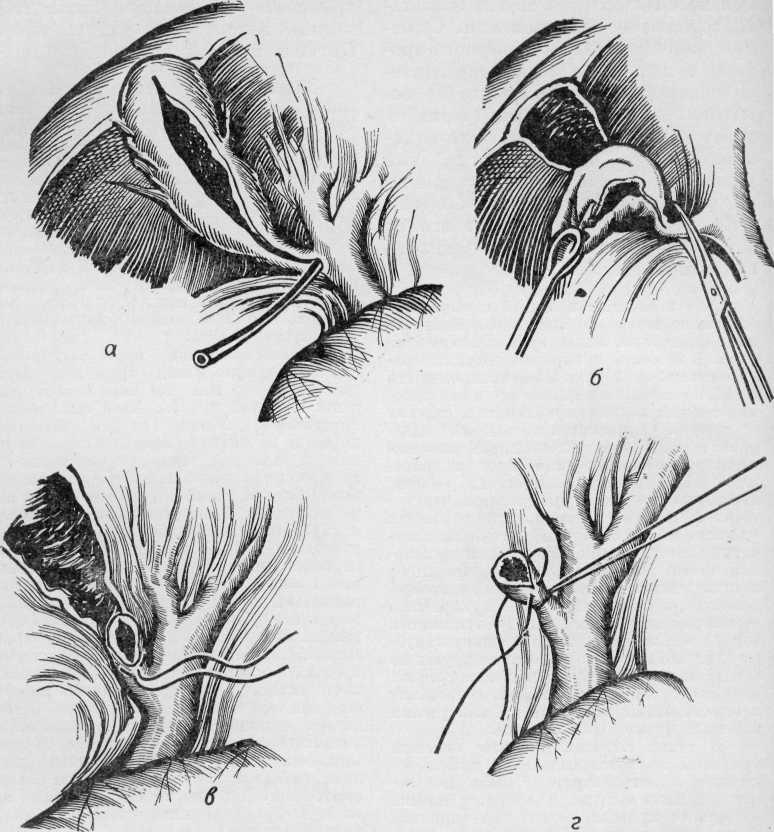
(объяснение в тексте).
Пунктируют печень со стороны верхней поверхности ее, в том месте, где предполагается желчный пузырь, чтобы уточнить его расположение. Паренхиму печени рассекают сверху по оси пузыря и обнажают его. Рассечение печени не вызывает большого кровотечения, потому что в таких случаях паренхима в зоне пузыря склерозирована и плотна. Желчный пузырь вскрывают, удаляют его содержимое и производят холецистэктомию.
Частичная холецистэктомия (муко-клаза). Иногда главная сложность состоит в том, что желчный пузырь и особенно
его шейку невозможно отделить от печени, не нанося значительного повреждения с последующим кровотечением. Тогда лучше вместо того, чтобы после холецистэктомии оставлять сильно кровоточащую рану печени, оставить на месте те участки желчного пузыря, которые приращены к ней. Ножницами и пинцетом удаляют остальные участки желчного пузыря. Около 1/ь стенки его остается на печени. Выскабливают острой ложкой или коагулируют термокаутером слизистую оболочку на остающихся участках, смазывают их йодом и поверх кладут дренаж.
Этот метод предложил в 1900 г. Мауо. С 1923 г. его под названием «мукоклаза» пропагандировал Pri-bram. Но Pribram разрушал всю слизистую оболочку желчного пузыря.
При этой операции пункцией освобождают желчный пузырь от жидкого содержимого и вскрывают от дна до шейки по передней поверхности продольным разрезом. Затем протерев изнутри пузырь сухими салфетками и устранив камни, сгустки слизи и крови, диатермокоагулятором глубоко выжигают всю слизистую оболочку пузыря и его шейки, разрез пузыря зашивают так, чтобы по линии швов стенки соприкасались между собой ввернутыми внутрь, покрытыми брюшиной поверхностями. Пузырный проток и артерию, если это возможно, предварительно перевязывают. Если перевязка невозможна, слизистую оболочку пузырного протока тоже выжигают. В результате этой операции на месте бывшего пузыря со временем образуется фиброзный тяж.
Pribram (1929) зашивал после таких операций брюшную рану наглухо, но С. П. Федоров (1931) не рисковал и вводил дренаж. Раны заживали, не оставляя свищей.
Вскрытие пузыря и выжигание его занимают меньше времени, чем холецистэктомия, и дают возможность получить излечение больных и в тех случаях, когда иссечение пузыря острым путем очень опасно или невозможно. Однако мукоклаза не является операцией выбора, и теперь ее применяют только в исключительных случаях, так как наблюдалось образование карциномы в фиброзном тяже.
Холецистэктомия при водянке и эмпиеме желчного пузыря. Иногда желчный пузырь оказывается столь напряженным, что его нелегко захватить зажимом, не перфорирован стенку. Кроме того, большие размеры напряженного пузыря затрудняют доступ к воротам. При таких условиях хирург должен аспирировать содержимое желчного пузыря. На дно его накладывают кисетный серозный шов. В центре этого гава стенку пузыря прокалывают толстой иглой, соединенной при помощи гибкой трубки с электроотсосом. Содержимое отсасывают и в момент извлечения иглы затягивают и завязывают кисетный шов, закрывая пункционное отверстие.
При водянке или эмпиеме желчного пузыря всегда надо искать камень в пузырном протоке. Если он находится возле самого устья в хо-ледох и не поддается смещению, то может быть трудно найти достаточно места для наложения лигатуры или введения трубки для холангио-графии. Тогда лучше всего надрезать стенку пузырного протока над камнем и удалить его.
Холецистэктомия при остром холецистите. Иссечение остро воспаленного желчного пузыря редко представляет большие трудности. В большинстве случаев бывают обширные рыхлые спайки, которые легко разъединяют тупо пальцем. Однако манипуляции необходимо производить осторожно, так как гиперемирован-ные ткани могут сильно кровоточить.
Туго наполненный желчный пузырь надо всегда освобождать пункцией. В некоторых случаях после вскрытия брюшной полости в области желчного пузыря обнаруживается конгломерат воспаленного, утолщенного сальника, сильно приросшего к его стенкам. Мощнее всего сращения в области дна пузыря. Здесь сальник приходится пересекать на зажимах и перевязывать, оставляя небольшой участок его на дне пузыря. При этом надо помнить, что где-то в сальнике, возможно, совсем близко от дна пузыря, проходит поперечно-ободочная кишка, которую легко повредить. Необходима осторожность, чтобы избежать этого осложнения. Перед началом отделения сальника операционное поле надо тщательно изолировать марлевыми салфетками от остальной брюшной полости, чтобы предотвратить загрязнение ее содержимым пузыря, которое может вылиться наружу из имеющейся ужо перфорации его стенки, прикрытой приращенным сальником или новой перфорации, возникающей при выделении хрупкой или некротизированной стенки желчного пузыря. Кроме того, источником загрязнения могут быть серозно-гнойная жидкость или гной, скапливающийся между печеночным лежем и желчным пузырем и отграничивающим его воспалительным валом при гнойном перихолецистите. Изливающуюся жидкость все время отсасывают. При разрыве пузыря необходимо широко вскрыть его, удалить все содержимое, продезинфицировать изнутри йодом, умеренно туго выполнить полость сухой марлей и зашить разрез пузыря наглухо шелковыми швами, захватывающими и заложенный в нем материал-
Очистив операционное поле, продолжают дальнейшее выделение пузыря, которое обычно в таких случаях производится от дна к шейке и идет довольно легко. Сильно потягивать за желчный пузырь нельзя, так как можно легко оторвать его.
При удалении остро воспаленного желчного пузыря невозможно сохранить брюшинный покров его для перитонизации ложа. Остается обнаженная и иногда кровоточащая поверхность. Это кровотечение можно остановить введением тампона в ложе пузыря на несколько минут. Если же в отдельных участках оно продолжается, то можно наложить кетгутовые матрацные швы вокруг этих участков, захватывая капсулу печени по обе стороны ложа. Такие швы нельзя завязывать слишком туго, иначе они прорежут паренхиму печени. Всегда можно остановить кровотече-чение и никогда не следует после операции оставлять в ложе желчного пузыря марлевые тампоны. Не рекомендуется также оставлять в ложе пузыря и другие гемоста-тические средства, так как наличие всяких раздражающих веществ вблизи общего желчного протока обычно приводит к прогрессирующему облитерирующему холан-гиту.
Холецистэктомия при отсутствии пузырного протока. Бывают такие состояния, когда солитарные крупные камни в области шейки желчного пузыря постепенно расширяют пузырный проток и, мигрируя, образуют полость на месте слияния пузырного протока с общим желчным и печеночным. Всякий раз, когда под массивными напластованиями в области шейки пальпируется крупный камень, следует помнить, что он может находиться на месте слияния желчных протоков, и пузырного протока вообще уже не существует — широкая ампулярная часть пузыря переходит прямо в общий желчный проток и желчный пузырь превратился как бы в дивертикул холедоха.
При подозрении на это следует разрезать над камнем стенку желчного пузыря в месте перехода его в общий желчный проток в направлении, перпендикулярном к оси гепатохоледоха и удалить конкремент. Затем оставшуюся полость тщательно исследуют визуально и зондом и в ней обычно обнаруживают 2 отверстия, вверху — общего печеночного протока, откуда поступает желчь, а внизу — меньшее отверстие ' общего желчного протока. Если же камень
находился только в шейке желчного пузыря, то из полости может быть только один ход — в пузырный проток. В сомнительных случаях не следует полагаться на данные осмотра полости, а следует ввести в в нее катетер, закрыть стенку несколькими швами вокруг него и сделать холангиогра-фию. В случае наличия общей полости на месте слияния желчных протоков через ранее сделанное отверстие в гепатохоледох вводят Т-образный дренаж Кера, резецируют желчный пузырь, но при этом оставляют часть его стенок, чтобы вокруг дре-пажа реконструировать просвет главного желчного протока.
Холецистэктомия при внутренних желчных свищах. Большинство внутренних желчных свищей до операции не диагностируют. Всегда в таких случаях бывают сильные сращения желчного пузыря с поперечно-ободочной и двенадцатиперстной кишкой. При попытке выделить желчный пузырь неожиданно вскрывается просвет свища. Если при препаровке одновременно был вскрыт просвет желчного пузыря и кишки, то наверняка есть и внутренний свищ. Главное — это своевременно обнаружить отверстие в кишке. Иногда отверстие в кишке остается незамеченным, предполагая, что надорван желчный пузырь. Поэтому каждый раз при ненамеренно вскрытом желчном пузыре следует тщательно исследовать ближайший отдел кишки, затем свищ полностью отсекают от нее. Отверстие в желчном пузыре временно закрывают швом или зажимом, а кишку (поперечно-ободочную или двенадцатиперстную) препаруют и по краю свищевого отверстия иссекают узкую полоску ее стенки в пределах здоровых тканей. Зашивают кишку всегда в поперечном направлении. Накладывают внутренний непрерывный шов из тонкого кетгута и наружный серо-серозный узловатый шов из шелка.
В этих случаях следует всегда помнить о возможном выпадении через свищевое отверстие из желчного пузыря в просвет кишки конкрементов, которые в последующем могут вызывать кишечную непроходимость. Такие выпавшие камни, особенно при больших свищевых отверстиях, говорящих за выпадение крупных камней, должны быть найдены и удалены. Не следует забывать также о том, что подобных камней может быть несколько и находиться они могут в различных отделах кишечника. После этого холецистэктомию продолжают одним из описанных способов.
Сложнее операции при редких свищах между шейкой пузыря и общим желчным протоком. После выделения шейки желчного пузыря в таком случае находят плотное спаяние ее с холедохом. Если в шейке находится камень, то над ним делают хо-лецистотомию и камень удаляют. Обычно тогда видно отверстие свища. Опасность состоит в том, что хирург сначала полагает, что вскрыл расширенный пузырный проток. При дальнейшем рассечении задней стенки свища может быть нанесена значительная травма холедоху. Как только вскрыт общий желчный проток, следует остановиться, отпрепаровать и зондировать его, попытаться изнутри найти устье пузырного протока. Затем от края свища надо отступить так, чтобы сохранить достаточно стенки желчного пузыря для реконструктивного закрытия бокового отверстия холедоха, обычно на дренаже (см. ниже).
Холецистэктомия после холецистосто-мии. Свищевой ход тампонируют и наружное отверстие его зашивают. Кожный разрез проводят так, что он веретенообразно окаймляет наружное отверстие свища. При рассечении последующих слоев брюшной стенки иссекают желчный ход, по возможности оставляя его связанным с дном желчного пузыря. Далее необходимо разделить сращения между краем печени и брюшной стенкой. После этого желчный пузырь обычно бывает достаточно подвижным и его можно удалить по одному из типичных методов.
Ошибки, опасности и осложнения при холецисгэктомии. Отрыв или повреждение пузырной артерии. Это осложнение при холецистэкто-мии встречается чаще всего, но при правильных действиях пе представляет опасности. Если пузырная артерия обрывается или выскальзывает из зажима после пересечения, то центральная культя ее может уйти глубоко в толщу печеночно-двенадца-типерстной связки под печеночный проток. Самая частая ошибка состоит в том, что хирург теряет спокойствие и пытается вслепую, в луже крови захватить сосуд зажимом. Это,
как правило, не приводит к желаемому результату, но в то же время велика опасность повредить печеночный проток или печеночную артерию.
При травмах пузырной артерии кровоточащий сосуд надо захватывать зажимом только в том случае, если он ясно виден. Следует применять только самые тонкие зажимы, позволяющие захватить лишь кровоточащий сосуд. Грубые раздавливающие сосудистые зажимы легко могут вызвать побочные повреждения, которые часто остаются незамеченными. Если же кровоточащий сосуд не виден, то сначала область его терпеливо тампонируют и затем, путем препаровки отыскивают артерию. Для этого надо выделить общий печеночный проток несколько выше, отпрепаровать серозный покров печеночно-двенадцатиперстной связки влево, чтобы обнажить место отхождения пузырной артерии от правой печеночной. При этом надо остерегаться, чтобы не принять за пузырную артерию правую печеночную артерию и не перевязать ее, что грозит ишемическим некрозом правой доли печени. Необходимо также всегда помнить об анатомических вариантах отхождения пузырной артерии и учитывать то обстоятельство, что примерно в 20% случаев начало пузырной артерии находится вне треугольника Callot. Если кровотечение обильное и мешает операции, то надо на короткое время (не более 10 минут ввиду возможности гипо-волемического шока) зажать пече-ночно-двенадцатиперстную связку вначале пальцами, а затем мягким кишечным зажимом. Для этого указательный палец левой руки или одну брапшу зажима заводят в винслово отверстие. Пережатие печеночно-две-надцатиперстной связки приводит к немедленной остановке кровотечения и можно спокойно работать в бескровном операционном поле. Представляет большую опасность it запрещается обкалывание (пришивание) кро-
воточащего участка вместо наложения зажима и лигатуры. Лишь при отрыве пузырной артерии у устья печеночной на рану накладывают шов атравматической иглой так, чтобы не сузить ее просвет.
Повреждение печеночной артерии. При сложных холецистэктомиях могут быть повреждены также правая или собственная печеночная артерии. Левая и общая печеночная артерии находятся далеко от опасной зоны и практически никогда не повреждаются. Следует иметь в виду, что перевязка общей печеночной артерии обычно не связана с существенным риском, так как артериальное кровоснабжение печени при этом может оставаться удовлетворительным благодаря наличию коллатеральных путей (желудочные, же-лудочно-сальниковые и панкреато-дуоденальные артерии). Напротив, перевязка собственной печеночной артерии грозит ишемическим некрозом всей печени или ее правой доли с летальным исходом почти в 100% случаев.
Учитывая сказанное, при повреждении собственной или правой печеночной артерии следует попытаться наложить сосудистый шов «конец в конец». Для этого вначале, при возникновении сильного артериального кровотечения, зажимают печеночно-двенадцатиперстную связку, а затем тщательно отпрепаровывают место повреждения. Если наложить шов не удается, то жизнь больного в опасности.
Повреждение воротной вены. Если во время холецистэктомии будет повреждена воротная вена, то необходимо сдавить печеночно-двенадца-типерстную связку сначала рукой, а затем мягким кишечным зажимом попытаться восстановить непрерывность сосуда наложением сосудистого шва «конец в конец». Если это невозможно, отток крови из портальной системы должен быть обеспечен наложением портокавального, сплено-ренального или мезентерикокаваль-
ного анастомоза. От наложения такого анастомоза можно воздержаться только в том случае, если перевязка воротной вены не сопровождается подъемом портального давления выше 25 мм вод. ст., что бывает при существовании естественных порто-кавальных коммуникаций вследствие имеющихся нарушений проходимости воротной вены еще до операции. Давление при этом измеряется при помощи катетеризации толстой вены брыжейки тонкой кишки. При отсутствии коллатералей перевязка воротной вены приводит к смертельному исходу в течение ближайших часов вследствие нарушений гемодинамики и гиповолемического шока.
Отрыв и перерезка пузырного протока. При сильном потягивании за желчный пузырь во время антеград-ной холецистэктомии возникает опасность отрыва пузырного протока. Перерезка пузырного протока бывает при грубых патологоанатомических изменениях в области шейки желчного пузыря. В подобных случаях крайне трудно найти культю пузырного протока, так как она сокращается и уходит глубоко в печеночно-две-надцатиперстную связку. От кропотливых поисков оторвавшейся культи пузырного протока нельзя отказаться даже в том случае, если предшествующей холангиоманометрией и холангиографией была доказана вполне нормальная проходимость общего желчного протока и фатерова сосочка — это ведет к развитию желчного перитонита. При состояниях не позволяющих продолжать операцию область культи пузырного протока хорошо дренируют. Во всех остальных случаях, невзирая на трудности, культю пузырного протока надо найти и перевязать. Эти поиски в трудных случаях может облегчить холан-гиография путем пункции холедоха. Как правило, холангиограмма дает необходимые сведения о положении культи пузырного протока. Следует иметь в виду, что результаты ма-нометрии ничего не говорят, пока
раскрыта культя пузырного протока.
Повреждение гепатохоледоха.
Главное состоит в том, чтобы сразу же заметить такое повреждение. Если повреждение правильно распознано во время операции, то обычно оно может быть легко и надежно устранено, но если оно остается незамеченным, это может стоить больному жизни. Наиболее часто повреждение гепатохоледоха возникает в случаях, когда хирург, в связи с неожиданным кровотечением из пузырной артерии пытается вслепую захватить кровоточащий сосуд инструментом.
Другой механизм повреждения главных желчных протоков состоит в следующем. Если пузырный проток идет параллельно главному желчному пути, то разделяющая их шпора на значительном отрезке состоит лишь из одной слизистой оболочки. При попытке отделить пузырный проток от гепатохоледоха до устья и возникает большая опасность повреждения. В то же время нет никакой опасности оставить такой пузырный проток на месте. Не следует опасаться в этих случаях «синдрома культи пузырного протока», если вместе с ним не будут оставлены неудаленными участки шейки желчного пузыря.
Повреждение гепатохоледоха может произойти при неосторожных попытках выделения пузырного протока спирального типа. В подобных случаях можно не только поранить, но и перерезать печеночный или общий желчный проток и этим чрезвычайно осложнить операцию. Поэтому, если не удается при выделении пузырного протока с несомненностью убедиться в месте перехода его в желчный, лучше всего сначала отсечь пузырный проток у самой шейки, сделать холецистэктомию и только после этого приступить к иссечению пузырного протока. Для того, чтобы еще более облегчить последнее, Kehr (1913) и G. П. Федоров (1931) рекомендовали зондом, введенным в пузырный проток, определить направ-
ление его и, рассекая постепенно стенку этого протока, дойти, таким образом, до места впадения его в общий желчный проток.
Даже при относительно легкой холецистэктомии могут быть пересечены аномальные печеночные протоки, впадающие в желчный пузырь или пузырный проток, о чем надо всегда помнить.
При экстирпации сморщенного желчного пузыря, при коротком пузырном протоке или ущемленном камне в нем опасность состоит в том, что хирург отсекает несколько вытянутую часть боковой стенки холедо-ха в предположении, что отсекает пузырный проток. При «легкой» холецистэктомии также возникает опасность, что подвижный гепатохоледох при натягивании желчного пузыря подтянется и перегнется и тогда лигатура может лечь на его стенку и закрыть его просвет. Если это осложнение во время операции остается незамеченным, то после операции развивается желтуха. При подозрении на перевязку общего желчного протока следует сразу же, в течение 6—7 дней, раскрыть рану и снять лигатуру. Ранняя повторная операция также необходима в случаях незамеченных повреждений желчных протоков или соскальзывания лигатуры с культи пузырного протока с обильным истечением желчи.
При антеградной холецистэктомии, когда операция протекает легко и быстро, холедох не широкий, а натягивание за желчный пузырь осуществляется сильно, то гепатохоледох отслаивается от клетчатки пече-ночно-двенадцатиперстной связки, оттягивается вправо, перегибается под углом и нижняя его часть принимает направление пузырного протока. Тогда легко может случиться, что хирург, увлеченный быстротой операции, вместо пузырного протока выделит и пересечет общий желчный проток. В особенности это бывает, когда крупный камень застрял в шейке пузыря и пузырный проток анте-
градно доступен гораздо труднее, чем полагают.
Одной из самых опасных ситуаций является та, при которой крупный желчный камень находится у слияния пузырного протока с печеночным и общим желчным. Такой камень постепенно расширяет пузырный проток и находится уже в общем желчном протоке. Если хирург не осознает всей опасности, то он неизбежно пересечет холедох. Дело в том, что если хирург предпринимает попытку ретроградной холецистэк-томии, то у нижнего полюса камня он найдет тонкий желчный проток и, полагая, что это пузырный, перерезает его. Только подходя к верхнему полюсу камня, он начинает понимать, что перерезанный тонкий проток в действительности был пустым общим желчным протоком. Но тогда уже поздно, так как главный желчный проток иссечен на протяжении 2— 3 см и восстановить его целостность весьма сложно. При боковом ранении печеночно-желчного протока можно попытаться зашить отверстие в стенке или дренировать через него проток наружу. Если же проток перерезан поперек, то остается только наложить циркулярный шов конец в конец или сделать гепатико-дуоде-но- или еюностомию, техника которых описана в соответствующем разделе. Если пузырный проток закупорен камнями, мешающими изолировать место впадения его в печеночно-желчный проток, то их пытаются протолкнуть в пузырь или удаляют путем цистикотомии.
Технической ошибкой холецистэк-томии следует считать оставление длинной культи пузырного протока. Правда, существуют противоположные мнения среди хирургов на этот счет. Большинство хирургов придерживаются правила—отсекать пузырный проток так, чтобы остающаяся культя его была как можно короче. Считают, что длинная культя, вследствие накопления в ней желчи, расширяется и увеличивается, образуя
«ложный пузырь», и что в ней реформируются камни, вызывающие рецидивы желчных колик. С другой стороны, С. П. Федоров (1931), Hess (1961) не советуют рассекать и перевязывать пузырный проток слишком близко к общему желчному, так как в таком случае может образоваться длительный желчный свищ, если лигатура соскальзывает, или рубцовое сужение холедоха, если в лигатуру попадает часть его стенки. С. П. Федоров (1931) считал, что все подобные «ложные» пузыри, которые находили при повторных операциях, зависят от неполной холе-цистэктомии, сделанной недостаточно опытным хирургом.
И все же оставление длинной культи пузырного протока является большой ошибкой. Поэтому нужно очень тщательно препаровать пузырный проток и его остаток перевязать двойной лигатурой, отступя 5—6 мм от гепатохоледоха, причем надо внимательно следить за тем, чтобы в просвете культи не оставалось ни мельчайшей крупинки желчного камня.
Перитонизация культи пузырного протока излишня и иногда даже вредна, так как попытки ее погружения швами могут вызвать сужение холедоха, а при непредвиденном просачивании желчи и скоплении ее под брюшиной печеночно-двенадцати-перстной связки разовьется фиброзный перихоледохит с рубцовым сдав-лением холедоха. Лучше оставить перевязанную культю пузырного протока свободной и подвести к ней дренаж. Перитонизацию культи пузырного протока и гепатохоледоха мы производили лишь при наличии свободно свисающих брюшинных листков печеночно-двенадцатиперст-ной связки и укрытие гепатохоледоха осуществляется свободно без натяжения ткани. Брюшинные листки сшивали тонким кетгутом.
Вскрытие двенадцатиперстной или толстой кишки. Если случайное вскрытие кишечника замечено во время операции, оно не представляет
никакой угрозы. Отверстие в кишке закрывается двумя слоями швов — поперечным непрерывным швом тонким кетгутом и рядом отдельных се-ро-серозвых швов шелковыми или капроновыми нитями.
Холецистостомия. Первый сделал холецистостомию для удаления камней Petit в 1743 г. Незадолго до холецистэктомии, а именно в 1867 г. она была вновь открыта Bobbs (Lan-genbuch, 1884). Значение холецисто-стомии в истории желчной хирургии подвергалось неоднократным переоценкам. Она получила вначале широкое применение, но после того, как Langenbuch (1884) доказал преимущества холецистэктомии, в начале XX ст. холецистостомия была почти полностью оставлена. В конце 20-х годов наступило возрождение холе-цистостомии, а в настоящее время показания к этой операции снова ограничились.
В большинстве случаев холецистостомия — это всего лишь симптоматическая мера. Удаление камней из желчного пузыря, но не удаление самого желчного пузыря, редко оправдывается. Заболевание стенки желчного пузыря остается, а камни образуются вновь. Как правило, требуется повторная операция для удаления желчного пузыря. Травма и длительность операции при холецистэктомии по поводу хронического заболевания бывают немного большими, чем опорожнение и дренирование желчного пузыря.
При остром воспалении желчного пузыря холецистостомия более оправдана, чем при хроническом, но и здесь лучше заканчивать хирургическое вмешательство в один прием, чем делать неполную операцию, которая потребует позднее повторного вмешательства. По этой причине при остром холецистите холецистэктомия является лучшей операцией по сравнению с холецистостомией. Но в некоторых избранных случаях может не оправдываться вызываемый ею риск. Особенно это относится
к остро заболевшим пожилым людям, ослабленным тяжелым воспалением желчного пузыря и другими сопутствующими заболеваниями. Если желчный пузырь окружен деревянистым инфильтратом или наступила перфорация его с образованием местного абсцесса, то холецистэктомия у ослабленных больных связана с большой опасностью для жизни. При таких условиях лучше ограничиться холецистостомией. Она может с минимальным риском устранить тяжелое состояние и сохранить жизнь больному. Когда вмешательство вследствие ошибочных показаний производят в подострой стадии холецистита, то холецистэктомия может быть слишком рискованной ввиду хрупкости тканей. В таких случаях целесообразно закончить операцию холецистостомией, а радикальное вмешательство отложить на более позднее время.
Патофизиологические и терапевтические последствия холецистосто-мии, включающей моторную функцию желчного пузыря и дренирующей его просвет наружу, весьма различны в зависимости от состояния желчных путей.
При эмпиеме и остром холецистите холецистостомия по своему эффекту похожа на вскрытие абсцесса — это немедленно устраняет гнойный очаг. Однако полного излечения холецистита не наступает. При большом числе камней в желчном пузыре некоторые из них могут оставаться и неудаленными. Камень, закупоривающий пузырный проток, как правило, не удаляется. Если впоследствии закрыть холецистостому, то инфекция вновь может вспыхнуть и тогда наступит рецидив эмпиемы. В лучшем же случае, останется хронический холецистит. К тому же, самостоятельное закрытие стомы наступает не всегда — при закупоренном пузырном протоке образуется слизистый свищ, а иногда отделяемое содержит примесь желчи вследствие наличия аномальных печеночно-пу-
зырных протоков. Кроме того, холе-цистостомия при непроходимости пузырного протока не оказывает никакого лечебного эффекта на главные желчные протоки, которые при эмпиемах у 40% больных содержат желчные камни.
Механическая желтуха и холан-гит раньше были излюбленными показаниями для холецистостомии. Но если ее производят при полной непроходимости на уровне терминального отдела общего желчного протока (камень, опухоль), то больной теряет всю желчь, а нередко и весь панкреатический сок. Желтуха проходит, но вследствие большой потери воды и электролитов состояние больного не улучшается и он не в состоянии перенести повторную операцию. Поэтому надо по возможности избегать холецистостомии при полной закупорке желчных путей: при закупорке камнем почти всегда возможна холе-дохолитотомия, при карциноме предпочтительнее сделать одномоментную радикальную операцию или же внутренний холецистоэнтероанастомоз.
Если холецистостомия при отсутствии закупорки пузырного протока устраняет механическую желтуху, то холангит, к сожалению, мало поддается лечению путем наложения свища на желчный пузырь. Дренаж в большинстве случаев недостаточен, так как холангиту сопутствует воспалительное сужение пузырного протока. Кроме того, весьма вероятно, что после закрытия холецисто-стомы наступит обострение холанги-та, пока существует низко расположенное препятствие оттоку желчи.
Ранее предлагали холецистостому для лечения дискинезий желчного пузыря. Последующие наблюдения показали, что наружный дренаж желчного пузыря при дискинезиях оказывает положительный эффект, но как только удаляют дренаж и хо-лецистостома закрывается, снова появляются жалобы. Однако в некоторых случаях дискинезий, когда диагноз во время операции остается
неясным, вполне оправдано заканчивать вмешательство «диагностической холецистостомией». Послеоперационные рентгеноманометрические исследования позволяют уточнить диагноз и выбрать правильное лечение. Холецистостомия с тонким дренажом при анатомически здоровом желчном пузыре безвредна и не вызывает ни последующих свищей, ни новых жалоб. Опыт отдельных хирургов показал, что если есть «чистый» гепатит (без сопутствующего холецистита), то временный наружный дренаж желчного пузыря обычно благоприятно действует на дальнейшее течение болезни.
Таким образом, кратко резюмируя обоснования и современные показания к холецистостомии, следует принимать во внимание следующее:
1. Холецистостомия — простая, не требующая много времени, хоро шо переносимая операция, примени мая даже при плохом общем состоя нии больного, в этом состоит ее пре имущество.
Холецистостомия — метод сим птоматической терапии и потому почти всегда представляет собой I этап хирургического лечения, в этом состоит ее недостаток.
Показания к холецистостомии, с учетом вышеизложенного, весьма ограничены. Таковыми являются: тя желый острый холецистит и эмпиема желчного пузыря у больных в по жилом возрасте при плохом общем состоянии (гангренозный холецистит является противопоказанием к холе цистостомии); ограниченный около пузырный абсцесс, когда удаление желчного пузыря грозит опасностью развития перитонита; обнаружение острого панкреатита, не диагности рованного до операции; холецисто стомия при этом возможна, так как устраняет желчную гипертензию, а после того, как пройдет острый при ступ, она позволит посредством рент- геноманометрии выяснить причины панкреатита, что имеет существенное
преимущество; неясность диагноза при лапаротомии и подозрение на дискинезию желчных путей, если операционная манометрия и холан-гиография не выявляют анатомических нарушений, а следовательно, не подтверждают показания к холеци-стэктомии, то она может быть произведена II этапом; гепатит или первичный холестатический цирроз печени; если на основании ошибочных показаний произведена лапаротомия и при этом на основании нормальной операционной холангиограммы доказано отсутствие патологии в желчных путях, следует предположить наличие вирусного гепатита или (!) первичного холестатического цирроза — можно применить холецисто-стомию. Опыт показывает, что желтуха внутрипеченочного происхождения после наложения наружного дренажа исчезает быстрее.
Техника холецистостомии. Холецисто-стомию приходится производить из такого же разреза, как и холецистэктомию. Это обусловлено тем, что решение сделать хо-лецистостомию чаще всего принимается в ходе самой операции на желчных путях, а с другой стороны, даже когда с самого начала думают о наложении свища, все же необходимо хорошо исследовать желчные пути, поджелудочную железу и соседние органы, а иногда опорожнить гнойные скопления вокруг пузыря. Лишь в редких случаях у больных в крайне тяжелом состоянии необходимо ограничиться самым минимальным вмешательством — опорожнением и наружным дренированием желчного пузыря. Тогда можно проводить операцию под местной анестезией из короткого продольного разреза над пальпируемым
дном желчного пузыря. Примерно 2/3разре-
за должна проходить выше и 1/3 ниже дна
пузыря, так как после опорожнения пузырь уменьшается в размерах и его дно смещается кверху.
Типичная холецистостомия. После обнажения желчного пузыря так же, как при холецистэктомии, отделяют припаянные к нему органы и разделяют сращение так, чтобы открыть пузырь, его шейку и печеночно-двенадцатиперстную связку. Брюшину, покрывающую пузырный и общий печеночный протоки не рассекают, но протоки очень внимательно исследуют путем их ощупывания снаружи.
Для пузырного протока такого исследования вполне достаточно, но мелкие камни в общем желчном протоке могут ускользнуть от ощупывания. Все же отсутствие в анамнезе указаний на желтуху позволяет у большинства больных исключить камни желчного протока. Далее обращают внимание на инфильтраты и увеличенные лимфатические железы в области шейки пузыря и пузырного протока. Как и при всякой другой операции на желчных путях, обязательно ощупывание поджелудочной железы. Затем, прежде чем вскрыть пузырь, тщательно отграничивают салфетками его дно, чтобы предупредить возможное инфицирование брюшной полости содержимым желчного пузыря. Салфетки закладывают в определенном порядке: снизу они покрывают поперечно-ободочную кишку и ее брыжейку, слева — желудок и двенадцатиперстную кишку, сверху и справа отграничивают поддиафрагмальное пространство и правый боковой канал. Кроме того, при незаросшем отверстии Винслова, туда закладывают марлевый тампон, чтобы закрыть доступ в сальниковую сумку.
После того, как пузырь обложен со всех сторон, на дно его, на достаточном расстоянии от поверхности печени, накладывают серозный кисетный кетгутовый шов диаметром 1,5—2 см. Как можно более толстой иглой, соединенной посредством резиновой трубки с отсасывающим аппаратом, прокалывают желчный пузырь в центре кисетного шва и опорожняют его. Затем иглу извлекают, но кисетный шов еще не затягивают. Отверстие на месте прокола расширяют скальпелем или ножницами. Наконечником отсасывающего аппарата удаляют остаток жидкости. Все камни и детрит удаляют с помощью корнцанга и ложечек (рис. 20 а,б). При наличии множественных мелких камней в полость пузыря вводят полоску марли: при извлечении ее удаляют все камни, которые могли бы остаться незамеченными. Когда при дальнейшем вытирании полости пузыря убеждаются, что содержимого больше нет, смазывают слизистую оболочку его йодной настойкой. Затем в желчный пузырь вводят указательный палец левой руки и тщательно исследуют его просвет до шейки и начала пузырного протока, чтобы убедиться в отсутствии камней, которые могли бы препятствовать оттоку желчи. Особое внимание надо уделить поискам и удалению камней из шейки (гартмановского кармана) и пузырного протока. В случаях когда камни не удается извлечь пальцем, корнцангом или ложечкой, если они сидят очень плотно в шейке или пузырном протоке, то пальцами правой руки, введенными в брюшную полость, стараются вытолкнуть их обратно в пузырь и удалить ложечкой или корнцангом. Если и это не удается, так как камни слишком
ж
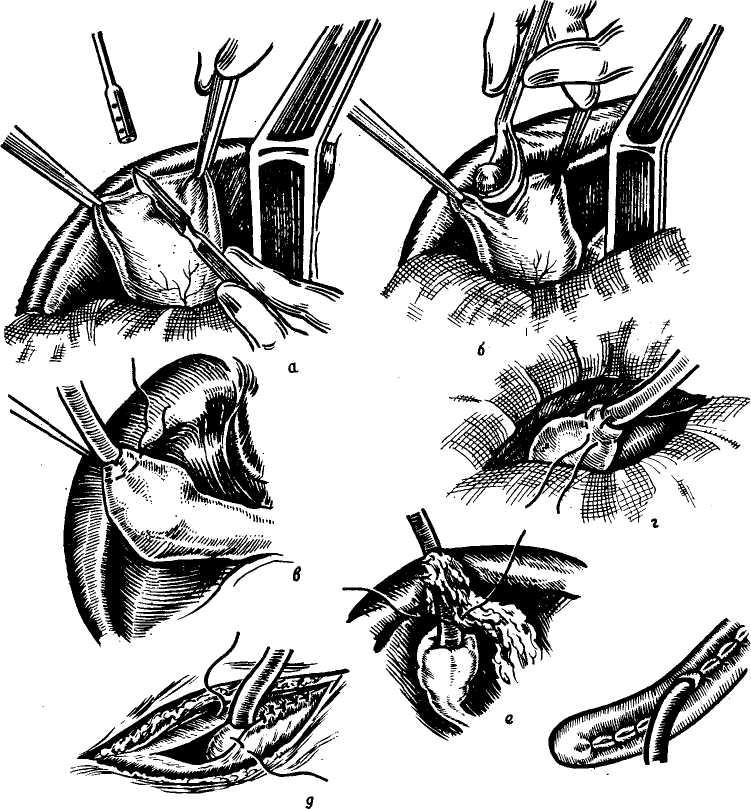
плотно ущемлены или находятся в дивертикуле и не поддаются никаким манипуляциям, то прибегают к вскрытию разрезом шейки пузыря или пузырного протока (цистикотомия) и извлечению камней. При этом надо соблюдать все меры предосторожности, чтобы предупредить возможность проникновения одного из камней через пузырный проток в общий желчный. Ощупыванием протоков снаружи убеждаются в удалении камней и затем разрез шейки или пузырного протока ушивают, но так, чтобы не вызвать его сужения. Вообще же в подобных случаях лучше прибегнуть к удалению желчного пузыря. В трудных случаях, когда операция должна быть закончена как можно быстрее, удаляют только
легко доступные камни, а ущемленные можно оставить, потому что обычно после хо-лецистостомии в будущем надо произвести холецистэктомию.
После удаления всего содержимого из пузыря, начинают создавать стому. Через отверстие в дне пузыря достаточно глубоко в его просвет (на 5—7 см) вводят катетер Петцера крупных размеров с дополнительными боковыми отверстиями или обычную резиновую трубку диаметром 1 см с 2—3 боковыми отверстиями вблизи кончика. Завязыванием кисетного шва дренажную трубку укрепляют в пузыре, стараясь ввернуть края разреза внутрь. Затем этот же шов обвязывают вокруг дренажа вблизи желчного пузыря, чтобы удержать
катетер на желаемом уровне и облегчить вворачивание внутрь стенки желчного пузыря при наложении следующего кисетного шва (см. рис. 20е).
Второй кисетный шов накладывают вокруг первого (см. рис. 20г) и завязывают, надавливая на дренажную трубку, чтобы ввернуть внутрь серозную оболочку желчного пузыря.
Если стенка его резко утолщена или частично некротизирована, то может оказаться невозможным ввернуть внутрь дно желчного пузыря кисетными швами. При таких условиях желчный пузырь следует закрыть вокруг трубки отдельными швами, укрепляя катетер на месте завязыванием на нем одного или двух швов. Перед закрытием брюшной полости надо убедится в том, что дренажная трубка находится в просвете пузыря, то есть, что поступает его содержимое. Дело в том, что незаметно трубка может проскользнуть между слизистой оболочкой и мышечной и не дренировать желчный пузырь.
При зашивании париетальной брюшины желчный пузырь циркулярно у места вхождения дренажной трубки подшивают отдельными кетгутовыми швами к ее краям, чтобы уменьшить опасность просачивания содержимого пузыря в брюшную полость (см. рис. 205,е). Для прочности желчный пузырь несколькими швами прикрепляют к апоневрозу задней стенки влагалища прямой мышцы живота. Эти швы ни в коем случае не должны проникать в просвет пузыря. Надо следить также за тем, чтобы не вызвать перекрута шейки и натяжения желчного пузыря. Нельзя подшивать желчный пузырь к мышцам и коже, чтобы потом не образовался незаживающий губовидный свищ. Затем ио-слойно зашивается разрез брюшной стенки до дренажа. Дренаж прикрепляют к коже одним или двумя шелковыми швами (см. рис. 20ж), чтобы не сместился. Как правило, дренажная трубка должна оставаться в желчном пузыре 2—3 недели.
Если вокруг желчного пузыря имеется выраженный воспалительный процесс или приходится опасаться загрязнения брюшной полости, то в подпеченочное пространство перед закрытием брюшной полости через отдельный прокол брюшной стенки вводят дренаж из трубки, окутанной перчаточной резиной.
Холецистостомия при сморщенном желчном пузыре. Если желчный пузырь так сильно сморщен, что его нельзя без сильного натяжения подвести к брюшной стенке, от холеци-стостомии лучше отказаться в пользу холецистэктомии.
Но в случае крайней необходимости иногда приходится накладывать холецисто-
стому и на маленьком сморщенном желч-ном пузыре. Пузырь отграничивают салфетками, вскрывают, очищают от содержимого и вшивают в него толстостенный дренаж (тщательно и герметично). Хотя проведение дренажпой трубки через свободную брюшную полость (операция Pappert) и не представляет опасности, так как окружающие органы в течение нескольких часов изолируют дренажную трубку от свободной брюшной полости, все же в подобных случаях лучше дно пузыря и дренажную трубку на всем протяжении брюшной полости укутать большим сальником со всех сторон, закрепляя его в таком положении несколькими швами (см. рис. 20е).
Холецистостомия при перфорации желчного пузыря. Если в желчном пузыре обнаруживается перфорационное отверстие в области дна, то оно может быть использовано для наложения холецистостомы. В этом случае надо тщательно очистить гнойную полость в области пузыря, удалить выпавшие в нее камни. Затем перфорационное отверстие расширяют путем иссечения его некротических краев и опорожняют желчный пузырь. Наложить кисетный шов в таких случаях бывает нелегко из-за хрупкости стенки пузыря, поэтому нужна особая осторожность.
Далее операцию осуществляют по обычному типу. По окончании операции в околопузырное пространство через отдельный разрез брюшной стенки вводят перчатно-трубоч-ный дренаж. Рану брюшной стенки обрабатывают обычным путем — зашивают послойно до дренажа.
Диагностическая чреспеченочная холецистостомия. При неясных данных холецистостомия может понадобиться для того, чтобы посредством послеоперационных рентгеномано-метрических исследований поставить верный диагноз. Постоянная фиксация желчного пузыря к брюшной стенке в подобных случаях может вызвать дополнительные жалобы. Чтобы избежать этого, Hess в 1961 г. предложил чреснеченочную холеци-стостомию.
Тонкий троакар у края реберной дуги проталкивают через брюшную стенку, за-
тем под контролем зрения, через ткань печени так, чтобы ввести его в желчный пузырь со стороны его печеночного ложа. Длина канала внутри печени должна быть 2—3 см. Затем соответствующий канюле троакара резиновый или полиэтиленовый катетер вводят через ее просвет в желчный пузырь, а канюлю удаляют. Ткань печени плотно охватывает катетер, так что не бывает просачивания крови и желчи. Катетер надо ввести настолько глубоко, чтобы он примерно на 4 см выступал в просвет желчного пузыря. Иначе он может выскользнуть из него, когда больной начнет вставать. К коже катетер прикрепляют одним или двумя шелковыми швами. Удаляют его не раньше, чем через 6 дней. К этому времени между поверхностью печени и париетальной брюшиной уже образуются сращения, надежно препятствующие просачиванию желчи в брюшную полость.
Идеальная холецистостомия (хо-лецистостомия, холецистендиз). Эта
операция состоит из вскрытия желчного пузыря, удаления камней и зашивания его с погружением в брюшную полость. Впервые такую операцию предложил в 1874 г. Wells. С успехом ее сделал в 1883 г. Meredith, и операция получила его название. Courvoisier назвал ее «Cho-lecystendysis», a Mc Burney — «идеальной холецистостомией». Идеальной эту операцию считали потому, что полагали, будто она восстанавливает вполне нормальные физиологические отношения. Но Kehr (1913) полностью отверг эту операцию, а С. П. Федоров весьма критически относился к ней, так как опыт показал, что после нее наблюдается довольно много рецидивов. Для выполнения этой операции «надо иметь стечение особо благоприятных обстоятельств; воспалительные изменения стенок пузыря должны быть ничтожны, пузырный проток не изменен и свободно проходим, а в пузыре одиночные или в малом числе большие камни» (С. П. Федоров).
«Идеальной холецистостомии» присущи следующие недостатки. Шов на желчном пузыре ненадежен и может разойтись при его наполнении. Именно по этой причине 5 больных из первых 8 оперированных погибли от желчного перитонита. При мно-
жественных камнях можно случайно просмотреть камень, а при хроническом воспалении слизистой оболочки, которое не проходит от одного вскрытия желчного пузыря, камни всегда образуются вновь.
В настоящее время «идеальная холецистостомия» проводится крайне редко. Пожалуй, единственным заболеванием, при котором достаточно удалить камни и наложить шов на желчный пузырь, является врожденная гемолитическая желтуха. При ней камни образуются в здоровом пузыре. После удаления их желчный пузырь будет нормально функционировать, но рецидивы все же вероятны, если не будет устранено нарушение обмена веществ. После спленэктомии новые камни не образуются.
А. А. Шалимов в 1969 г. предложил выполнять идеальную холеци-стостомию у больных с ожирением одновременно с выключением из пищеварения 1/3 тонкого кишечника в расчете, что одновременно с потерей веса исчезнут и условия нарушения обмена с образованием камней. После 3 выполненных операций у всех больных спустя 3—4 года рецидива камней не обнаружено, состояние их хорошее.
Техника холецистостомии, в соответствии с указаниями С. П. Федорова, состоит в следующем.
Так как в подходящих случаях желчный пузырь обычно свободен от сращений и хорошо подвижен, его без труда выводят за пределы раны брюшной стенки, делают разрез на дне, опорожняют, удаляют камни и обследуют полость пальцем. Надо быть абсолютно уверенным в отсутствии камней общего желчного протока и в хорошей проходимости пузырного протока. Разрез пузыря ушивают двумя рядами швов тонкой кишечной иглой: первый — тонким кетгутом, второй — серозо-серозный — тончайшим капроном или шелком. Манипуляции на желчном пузыре должны быть предельно щадящими, на стенку его ни в коем случае нельзя накладывать зажимы, при наложении швов не прокалывать слизистую оболочку пузыря. После зашивания его полностью погружают вместе с печенью в брюшную полость и наглухо зашивают разрез брюшной стенки.
Мы наблюдали 1628 больных с холециститами различных форм, среди них 765 поступили по поводу острого холецистита и 858 — по поводу хронического.
Среди 765 больных, поступивших в клинику с диагнозом острого холецистита, 745 (97,39%) подвергли консервативному лечению и только 20 (2,61%) больных были оперированы по срочным показаниям. После проведения на протяжении 1—14 дней необходимых консервативных мероприятий, операция оказалась показанной еще у 320 больных. Таким образом, оперативному лечению было подвергнуто 340 больных (43,1%), 425 больных (59,6%) были выписаны из стационара в связи с отсутствием у них неотложных показаний или отказа от операции.
Среди поступивших 80% (612 больных) составляли женщины и 20% (153 больных) — мужчины.
У 340 оперированных больных при исследовании желчных пузырей были обнаружены следующие формы воспаления: хронический холецистит — 216 больных (63,5%); обострение хронического холецистита— 85 больных (25,1%); флегмонозный холецистит — 28 больных (8,3%); гангренозный холецистит — 7 больных (2,1%); перфоративный холецистит— 4 больных (1,0%).
На операции у 190 больных (56%) отмечалось поражение только желчного пузыря, у 150 (44%) — воспаление желчного пузыря сочеталось с другими заболеваниями желчных путей — холедохолитиаз у 20,1%, поражение фатерова соска — у 6 %, поражение поджелудочной железы — 17% больных.
Камни в желчном пузыре были обнаружены у 309 больных (91%).
Характер операций, произведенных по поводу острого холецистита, представлен в табл. 3. Следует указать, что из 20 больных, подвергшихся экстренным операциям, погибло 5, в то время, как на 320 отсроченных операций, несмотря на большой объем вмешательств у ряда больных,— умерли 2 (0,6%).
Летальность при остром холецистите зависит не только от патологических изменений в желчных путях, но и часто связана с различными сопутствующими заболеваниями, на фоне которых протекает острое воспаление желчного пузыря. Причина летальности и характер послеоперационных осложнений представлены в табл. 4.
Как видно из данных табл. 4, наиболее частой причиной смерти была сердечно-сосудистая недостаточность, особенно у людей старше 60 лет при экстренных операциях.
Характер операций при остром холецистите и их исходы
Таблица 3
|
Характер операций |
экстренные |
Количество операций | ||
|
отсроченные |
всего |
с летальным исходом | ||
|
Холецистэктомия Холецистостомия Холецистэктомия, холедохотомия с глухим швом Холецистэктомия, дренаж желчных протоков Холецистэктомия, холедоходуодено-анастомоз Холецистэктомия, сфинктеропластика Холецистэктомия и другие операции |
11 2 3 4 |
225 64 2 10 15 4 |
236 2 67 . 6 10 15 4 |
3 2 1 1 |
|
Итого |
20 |
320 |
340 |
7 (2,06%) |
Таблица 4
Причина летальности и характер послеоперационных осложнений при остром холецистите
|
Причины летальности |
Операции |
Всего |
Из них | |
|
и послеоперационные осложнения |
экстренные |
отсроченные |
больных |
умерли |
|
Перитонит Кровотечение Панкреонекроз Печеночная недостаточность Легочные осложнения Тромбозы и эмболии Нагноение ран Прочие |
1 1 1 1 1 |
2 3 1 15 23 4 |
3 3 2 1 15 1 24 4 |
2 2 1 1 |
|
Итого |
8 |
50 |
58 |
7 |
Легочные осложнения (у 15 больных — 4,4%) — удел людей пожилого возраста, к летальным исходам не привели, но требовали много внимания и заботы в послеоперационном периоде.
Таким образом, при лечении больных с острым холециститом оправданным является консервативное ведение неосложненных его форм в течение 10—15 дней, что снижает летальность и уменьшает техническую сложность вмешательства.
По поводу хронического холецистита в клинике находилось 858 больных, из них у 96 (11,2%) камни в желчном пузыре при обследовании обнаружены не были, 750 из 762 больных с калькулезным холециститом подвергнуто оперативному лечению, не оперированы 12 больных из-за тяжести сопутствующих заболеваний.
Из 750 оперированных больных женщины составляли 84,3%. Возраст больных колебался от 15 до 84 лет. Одиночные камни были обнаружены у 11,5%, множественные — у 88,5% больных. Около 11% больных имели стертую форму клинического течения. У остальных 89% больных преобладала болевая форма.
Длительное хроническое воспаление при калькулезном холецистите у оперированных больных привело у 90 (12%) к образованию водянки
желчного пузыря, у 75 (10%) — к склерозированию пузыря вплоть до образования рубцового тяжа, у 15 больных — к пролежню его стенки с образованием внутриорганных свищей.
У 15 больных (2%) наряду с камнями в желчном пузыре был обнаружен рак.
Осложнения со стороны желчных протоков были обнаружены у 150 больных (20%). Механическая желтуха у этой группы больных наблюдалась в анамнезе у 88% и к моменту операции была у 36% больных. Признаки холангита при наличии холе-дохолитиаза отмечены у 20% больных, рубцовый стеноз фатерова соска — у 89 (10,5%) больных, оперированных по поводу калькулезного холецистита, из них при холедохоли-тиазе — у 53 (35%) человек.
Явления холецистопанкреатита, подтвержденные на операции, отмечены нами у 130 больных (16%), причем среди них у 19 (14%) одновременно отмечен холедохолитиаз.
Среди оперированных у 98 больных (13%) на основании клинических и гистологических исследований биопсийного материала были обнаружены цирротические изменения печеночной паренхимы и у 15 больных (2%) — явления гепатита.
Основной операцией при хроническом калькулезном холецистите
является холецистэктомия, а при формах осложненных холедохолити-азом, стенозом фатерова соска — операции, направленные на коррекцию нормального желчетока, которые будут рассмотрены в следующей главе.
По поводу хронического «бескаменного» холецистита в клинике наблюдалось 96 больных, из них оперировано 20 человек (21%) в связи с частыми рецидивами воспаления и выраженным болевым синдромом. Остальные 76 человек (79%) после обследования были переданы терапевтам для консервативного лечения.
Основной операцией во всех случаях являлась холецистэктомия с исследованием через культю пузырного протока проходимости и нормального желчетока в холедохе (ма-нометрия, дебитометрия, кинохолан-гиоскопия, холангиография). В результате проведенных операционных исследований у 6 больных был обнаружен первичный стеноз сфинктера Одди, у 5 — гипертония сфинктера Одди, у 3 — ламблиозный холецистит, у 1 — туберкулезное бациллоносительство, у 2 — обнаружены лишь хронические изменения в стенке желчного пузыря и у 3 больных изменений в желчном пузыре и желчных протоках не обнаружено. Летальных исходов при операциях по поводу «бескаменного» холецистита не было.
Таким образом, общая летальность среди оперированных больных по поводу холецистита составила 2,06% на 340 операций. Анализ причин летальности у этих больных показал, что возникшие осложнения имели место у больных с острым холециститом, которые поздно поступили для хирургического лечения (более 5 дней и с момента заболевания), а возраст больных был более 60 лет. Эти данные аналогичны данным литературы. Так, Б. С. Розанов (1967) отмечает, что среди больных моложе 60 лет летальность при операциях по поводу острого холецистита состав-
ляет 2,6%, в то время как среди больных старше 60 лет — 26,4%. Примерно такие же сведения представляют Т. В. Шак (1959), Б. А. Петров (1965) и др. Как свидетельствуют данные международной статистики, частота осложнений, а следовательно и летальность находятся в прямой зависимости от длительности заболевания и соответствует от 25 до 50% (А. А. Шалимов и соавт., 1970). В связи с чем можно сказать, что основным моментом в улучшении исходов оперативного лечения воспалительных заболеваний желчного пузыря и в первую очередь острого холецистита является ранняя госпитализация этих больных в хирургические стационары, однако еще и до сих пор 75% этих больных (А. А. Шалимов и соавт., 1970) продолжают лечиться в терапевтических стационарах. В то же время Л. И. Роман и соавторы (1970), проведя анализ результатов лечения у больных с холециститами, показали, что хорошие отдаленные результаты консервативными методами лечения достигаются лишь у 4,8% больных, в то время как оперативное лечение, несмотря на возникновение у ряда больных «постхолецистэктомическо-го синдрома», о чем речь будет идти ниже, дает хороший результат у 63,2% больных.
Постхолецистэктомический синдром. К сожалению, не каждая операция по удалению желчного пузыря при калькулезном или «бескаменном» холецистите приносит благоприятный результат. От 5 до 64%, а в среднем 30% (С. П. Федоров, 1934; И. М. Тальман, 1963; Н. М. Кон-чаловская, 1964, и др.) больных продолжают страдать приступами желчной колики, тупой болью в области печени, лихорадкой, диспепсическими и другими расстройствами. Во многих случаях эти явления бывают и не связанными с произведенной операцией, а в некоторых случаях вовсе не связаны с патологией печени и желчевыводящих путей. Тем не ме-
нее эта проблема остается хирургической и связана, по мнению Mallet— Guy и соавторов (1970), с допущенными хирургом ошибками, а именно: недостаточной диагностикой, неполноценным хирургическим лечением или несовершенной техникой операции. Лишь у 0,2% больных они связывают эти явления с отсутствием желчного пузыря.
На основании данных литературы и собственных наблюдений мы представляем классификацию постхоле-цистэктомического синдрома следующим образом.
I. Нарушения, зависящие от ос новного патологического процесса, неустраненного полностью при хо- лецистэктомии: 1) оставление кам ней в желчных протоках и в редких случаях истинный рецидив камней; 2) стенозирующий воспалительный процесс в общем желчном протоке.
II. Нарушения, зависящие от по явления осложнений вследствие дли тельного выжидания с операцией при желчнокаменной болезни: 1) холан- гит, холангитические абсцессы, хо- лангиогепатит; 2) хронический пан креатит, лимфаденит; 3) дискинезия сфинктера Одди (гипертония, гипо тония), дискинезия желчных прото ков.
Нарушения, непосредствен но зависящие от произведенной опе рации: 1) синдром недостаточности желчного пузыря; 2) синдром культи пузырного протока; 3) панкреатит, панкреатопатия; 4) невриномы, со- лярит, соляргия; 5) мезентериальный лимфаденит, лимфангоит; 6) спаеч ный процесс, стенозирование обще го желчного протока, послеопера ционные рубцы и грыжи.
Нарушения, зависящие от со путствующего поражения других ор ганов: 1) язвенная болезнь желудка и двенадцатиперстной кишки, хро нический гастрит; 2) хронический панкреатит; 3) хронический колит и энтероколит; 4) хронический гепа тит и цирроз печени; 5) мезентери альный лимфаденит; 6) диафрагмаль-
ная грыжа; 7) почечнокаменная болезнь, нефроптоз, пиелит; 8)соля-рит, невралгии, спондилез; 9) пищевая аллергия; 10) дискинезия сфинктера Одди и желчных протоков; 11) не совсем изученные или неизвестные причины боли.
Как видно из приведенной классификации, существует огромное количество причин для рецидива боли в постхолецистэктомическом периоде, но вместе с тем, хирург никогда не должен забывать, что главной причиной является недостаточная диагностика поражения в дооперацион-ном и операционном периодах. В настоящее время есть достаточно средств и методов диагностики, чтобы избежать этих ошибок.
Неполное устранение причин патологии во время первой операции занимает ведущее место в развитии постхолецистэктомического синдрома и составляет около 50% всех больных (В. В. Виноградов, 1962; П. И. Напалков, 1965; В. М. Ситен-ко и А. И. Нечай, 1972; Mallet-Guy, 1960; 1970; Hess, 1961; Caroli, 1961, и др.). Сюда в первую очередь относятся «забытые» во время 1-й операции камни (в 37,3% — Hess, 1961 и 36% — Mallet—Guy и соавт., 1970). Не исключается и повторное образование их в желчных протоках, но это явление более редкое. Mallet-Guy и соавторы указывают, что «забытые» камни часто проявляют себя ранними рецидивами (между 17— 30-м днем после вмешательства), длительностью желчного свища. По внешнему же виду, полученного нами после повторной операции, можно судить о происхождении последнего, так как многогранные, треугольной формы, вид тутовой ягоды, многофа-сетчатость характеризуют камни пузырного происхождения и свидетельствуют о том, что это именно «забытые» камни, просмотренные во время предыдущего вмешательства.
Стенозирование протоков как результат холелитиаза и воспаления проявляются в 2 формах: в виде
стриктур протоков, которые встречаются у 16,6% больных (В. М. Си-тенко и А. И. Нечай, 1972) и в виде стеноза большого дуоденального сосочка, встречающегося в 29,4% (Hess, 1961).
Сужение протоков может быть как самостоятельное, так и при операционной травме (боковое ранение, рубцовое изменение, как результат перихолецистита, иногда в результате длительного дренирования в условиях инфицирования). Стриктуры могут быть высокими и низкими, различной степени протяженности. Для них характерно длительное скрытое течение.
Результатом вышеупомянутых нарушений является стаз желчи в протоках, что с одной стороны способствует рецидиву камней, а с другой— ведет к развитию цирроза печени.
Около 20% больных с «постхо-лецистэктомическим синдромом» поступают для повторного лечения в связи с имеющимися у них холанги-тами, холангитическими абсцессами печени, холангиогепатитами, хроническим рецидивирующим панкреатитом, дискинезиями сфинктера Од-ди и желчных протоков. Как выяснилось, этот контингент больных поздно подвергался первичной операции и оперировался уже, имея осложнения, которые хирурги стремились излечить только холецистэкто-мией. Как правило, такое решение вопроса не приносит успеха. Удаление желчного пузыря может принести полное излечение только в том случае, если отсутствуют другие причины, порождающие вышеперечисленные заболевания. В первую очередь следует исключить стеноз сфинктера Одди. Лишь у 2% больных, по данным Mallet —Guy и соавторов (1970), можно допустить наличие необходимых психопатологических факторов, ведущих к развитию рецидива боли, во всех остальных случаях всегда имеются определенные органические изменения, которые и следует искать, чтобы добиться хоро-
ших результатов (В. В. Виноградов, 1962; Hess, 1961; Kaisser, 1962).
Гипертоническое и гипотоническое состояние сфинктера Одди, как и дискинезия желчных протоков, чаще всего имеются еще до 1-й операции, холецистэктомия в этих случаях чаще усугубляет эти состояния вследствие травмы нервных волокон и образования спаек и рубцов (А. М. Ногаллер, 1969).
Нарушения, связанные с непосредственно выполненной холецистэк-томией, составляют всего 10% и в последнее время не рассматриваются как существенные причины в развитии «постхолецистэктомическо-го синдрома».
Синдром недостаточности желчного пузыря, описанный Chiary и Pavel еще в 1925 г. проявляется в 2 формах: 1) гипертоническое и 2) гипотоническое состояние сфинктера Одди в связи с отсутствием желчного пузыря, степень наполнения которого у здоровых людей регулирует тонус сфинктера Одди и желчных протоков. В первом случае развивается внутрипеченочная желчная гипер-тензия с переходом в цирроз, во втором — поступление недостаточно ко-центрированной желчи в кишечник, что ведет к развитию дисбактериоза и ферментативной недостаточности кишечника с нарушением усвоения жиров и жирорастворимых витаминов (Chiary, Pavel, 1936; 1962; Haf-fer, 1965; Voegt, 1963, и др.).
Длинную культю пузырного протока обнаружил Mallet—Guy с соавторами (1970) у 132 больных из 407 повторных операций, но лишь у 7 человек (2%) она оказалась единственной причиной рецидива боли. Длинная культя пузырного протока, как и оставленная часть пузыря, примыкающего к ней, является причиной рецидива только в тех случаях, когда имеются: воспалительные изменения, скопления гноя, конкременты. Безусловно, в смысле рецидива конкрементов такая культя пузырного протока особенно с час-
тью желчного пузыря подлежит при повторной операции удалению.
Панкреатиты как результат холе-цистэктомии и причина рецидива боли встречаются в среднем у 13,1% больных (Hess, 1961). Однако не следует забывать, что еще в большем проценте случаев во время холеци-стэктомии не диагностируют стеноз сфинктера Одди и тем более стеноз устья вирсунгова протока, что ведет к обострению, а порой и вспышке тяжелого панкреатита.
Операционная травма, связанная с холецистэктомией, иногда приводит к развитию неврином, симптомов ганглионеврита брюшной полости (солярит, соляргия, гипогастраль-ный синдром), которые обусловливают рецидивы боли в послеоперационном периоде, ведут к дискинетиче-ским расстройствам и вегетативно-сосудистой дистонии.
Pribram (1960) высказал мнение, что рецидив боли после холецистэк-томии возникает в связи с активизацией инфекции в лимфатических узлах брыжейки. Действительно, в некоторых случаях подобные изменения обнаруживаются (А. М. Но-галлер, 1969).
Спаечный процесс, если он не ведет к стенозированию желчных протоков, вряд ли играет существенную роль в развитии тяжелого «постхо-лецистэктомического синдрома». По нашему мнению, спаечный процесс чаще ведет к смещению соседних с желчным пузырем органов, и в первую очередь двенадцатиперстной кишки, что и способствует нарушению их функции, возникновению боли и диспепсических расстройств.
Примерно в 20% случаев причины, вызывающие «постхолецистэкто-мический синдром» обусловлены различными заболеваниями, сопутствующими холециститам и прогрессирующими после холецистэктомии. Заболевания эти перечислены в приведенной выше классификации и, как правило, не требуют повторных оперативных вмешательств, но помнить о
них и диагностировать их нужно, даже тогда, когда холецистэктомию производят в срочном порядке.
Из всего сказанного видно, что сам термин «постхолецистэктомиче-ский синдром», появившийся впервые в американской литературе, не является удачным, так как он объединяет целый ряд заболеваний, не связанных с холецистэктомией, тем не менее он широко вошел в обиход хирургических терминов. Mallet— Guy в 1970 г. заменил его термином «синдром после холецистэктомии», который более соответствует действительности, но пока не получил широкого распространения.
Диагностическая задача у больных, перенесших холецистэктомию, направлена на решение одной проблемы — нуждается ли больной в повторной операции или нет. Не следует отказывать больным в повторном вмешательстве, если к нему есть хотя бы небольшие клинические предпосылки. Длительное консервативное лечение этой группы больных весьма неблагоприятно сказывается на исходе хирургического лечения, в связи с развитием у них необратимых изменений печеночной паренхимы и желчных протоков.
Основным показанием к операции является желчестаз как признак препятствия к нормальному току желчи.
К клиническим проявлениям жел-честаза относятся: печеночная колика; желтуха; кожный зуд; длительное незаживление или рецидив наружного желчного свища; усиление или появление симптомов холангита и ангиохолита.
Печеночная колика появляется вскоре после операции, иногда спустя несколько недель или месяцев и является достоверным признаком препятствия току желчи.
Желтуха, симптом не постоянный, но достоверный, если учесть, что появление ее немедленно после операции является результатом случайного лигирования холедоха, на 2— 4-й день уже говорит о «забытсм>
камне или послеоперационном остром панкреатите, через 6—8 недель — о сывороточном вирусном гепатите, через 2—3 месяца — о стенозе большого дуоденального соска. «Забытый» камень может вызвать желтуху в различные сроки.
Кожный зуд (появление его или рецидив) особенно в первые 2—3 недели после операции, даже без приступов печеночной колики или желтухи свидетельствует о нарушении проходимости по желчным протокам.
При наличии или рецидиве желчного свища вопрос решается более просто в связи с возможностью проведения дебитометрии и кинохолан-гиоскопии.
Воспаление желчных протоков косвенно, но часто и убедительно говорит о наличии желчестаза.
Рентгенологические методы исследования являются наиболее ценными и позволяют путем внутривенной хо-лангиографии определить расширения внутри- и внепеченочных желчных протоков, наличие препятствия току желчи в виде камней, стенозов, а также увеличения культи пузырного протока. М. Я. Пекерман и А. Ф. Петров (1972) предлагают использовать томографические исследования, которые, по их мнению, дают более достоверные сведения.
Обязательным является применение рентгенологических исследований во время оперативных вмешательств как первичных, так и повторных. Mallet — Guy и соавторы (1970) справедливо указывают на необходимость этого исследования, наряду с манометрией, в самом начале операционных поисков, используя культю пузырного протока, и, если последний отсечен плотно к хо-ледоху, то путем введения канюли через минимальную супрадуоденаль-ную холедохотомию (1,5—2 мм).
Перед рентгенографией целесообразно пользоваться телевизионной рентгеноскопией, которая позволяет дифференцировать функциональные и органические изменения.
Гипертоническое состояние сфинктера Одди рекомендуют определять путем измерения давления в холе-дохе до и после новокаиновой блокады блуждающих нервов вдоль малой кривизны желудка. Отсутствие изменения давления свидетельствует об органических изменениях сфинктера Одди.
В ряде случаев при наличии расширенного общего желчного протока помогает выяснение причины желчной гипертензии при помощи холе-дохоскопии гибким фиброхоледохо-скопом.
Увеличение сывороточного билирубина, повышение щелочной фосфа-тазы, задержка выделения бромсуль-фалеина или бенгальской розы, меченной радиоактивным йодом — наряду с клинической и рентгенологической картиной помогают установить наличие желчестаза.
Фракционное дуоденальное зондирование помогает в оценке состояния сфинктера Одди и выявлении его стенозирования. Интересными в этом плане являются исследования (Н. И. Махов и Ю. А. Травкин, 1972) фракций желчи после введения в вену 5 мл 0,4% раствора индигокар-мина (по предложенному Г. И. Дих-тенко, 1971, ускоренному методу хроматического дуоденального зондирования). Оказалось, что при значительном расширении холедоха, ложного желчного пузыря и стенозе сфинктера Одди выделяется окрашенная в сине-зеленый цвет желчь, несмотря на то что у этих больных уже была произведена холецистэкто-мия. Появление окрашенной желчи у этих больных свидетельствует о желчестазе, подтвержденном на операции. Метод заслуживает внимания, но пока еще не получил должного распространения.
Исследование наряду с желчевы-делительной системой желудка, печени, поджелудочной железы, кишечника и других органов, для выясне-нения сопутствующих патологий при лечении больных с «постхолецистэк-
томическим синдромом» должно являться обязательным в каждом отдельном случае.
Лечение больных с постхолеци-стэктомическим синдромом. Как видно из вышеуказанных данных, больше половины больных нуждаются в повторном оперативном лечении, и только та часть у которых не удается установить каких-либо органических изменений или если рецидивы боли не настолько мучительные и больные отказываются от вмешательства, следует прибегать к консервативным методам лечения, но если болевой синдром не удается ликвидировать, больного подвергают повторной операции. Не следует проводить консервативное лечение длительно, а путем совместного наблюдения хирурга и терапевта решать вопрос об операции как можно раньше.
Повторные операции обычно заключаются в удалении камней желчных протоков, сфинктеропластике, холедо-ходуодено- или холедохоеюностомии, которые будут изложены в следующей главе.
Лечение больных с рецидивом боли после холецистэктомии следует проводить в хирургических отделениях, оборудованных современной диагностической аппаратурой.
Другие заболевания желчного пузыря. Холестероз. Achoff в 1905 г., Mc Carty в 1910 г. впервые описали особую форму поражения желчного пузыря, при котором слизистая оболочка его напоминала собой землянику. В дальнейшем было установлено, что пятнышки светло-желтого цвета, которые возвышаются над поверхностью слизистой оболочки величиной с булавочную головку, а реже и несколько больше, являются отложением в слизистой оболочке эфиров холестерина и одновременно нейтральных жиров. Не всегда эти изменения видимы на глаз, в ряде случаев жировые образования определяются только микроскопически в эпителии и в подслизистом слое.
К процессу образования этих отложений, несомненно, имеют пря-
мое отношение нарушения жирового обмена в сочетании с нарушениями опорожнения желчного пузыря органического или функционального характера, а также воспалительные изменения и наличие камней.
По данным сборной статистики зарубежных авторов, основанной на 13 686 патологоанатомических исследованиях трупов, холестероз желчного пузыря обнаружен у 10% больных (Berendes, 1923; Ahlin, 1938; Freers, 1940; Feldmann и Feldmann, 1955; Borkowski, 1956). По данным отечественных авторов, холестероз желчного пузыря составил 11% всех вскрытий и 32,6% случаев исследования желчных пузырей, удаленных во время операции.
Холестероз — находка операционная и показанием к операции должны являться клинические данные, характерные для хронического холецистита. Если во время операции клинически и объективно желчный пузырь нормальный — ситуация требует осторожного подхода к решению вопроса о холецистэктомии, и в тех случаях, где не определяется никаких существенных изменений, удалять желчный пузырь нельзя, тем более, что в послеоперационном периоде болеют именно те люди, которые перенесли удаление неизмененного желчного пузыря.
Цисцитит или болезнь шейки желчного пузыря. У места соединения его шейки и пузырного протока расположены клапан и сфинктер Люткинса — система, которая подвержена влиянию функциональных и морфологических изменений всей желчевыводящей системы. Эта область является регулятором наполнения и опорожнения желчного пузыря, что имеет огромное значение в патологии всей желчной системы, не говоря уже о самом желчном пузыре. Вначале А. Нана с соавторами (1960), а затем Roux и соавторы (1961) установили, что расстройства в этой области имеют всегда органическую основу и обычно сочетаются
с наличием конкрементов, хотя иногда изменения в инфундибулярно-шеечном отделе и не связаны с камнями. При указанной патологии мы рекомендовали холецистэктомию с тщательным иссечением пузырной шейки. Результат операции обычно благоприятный.
Туберкулез желчного пузыря проявляется на фоне туберкулезного поражения всего организма и впервые описан Simonds в 1908 г. В настоящее время описано около 26 наблюдений. Чаще процесс развивается на фоне существующего холецистита. Показана холецистэктомия.
Сифилис желчного пузыря чаще встречается в сочетании с сифилитическим поражением печени, чем, собственно, и проявляется клинически. У большинства больных лечение специфическое.
Бруцеллез желчного пузыря — заболевание редкое, протекает как хроническое воспаление желчного пузыря.
Заворот желчного пузыря может произойти только в том случае, когда он охвачен по всей окружности брюшиной и имеет подобие брыжейки (аномалия которая наблюдается примерно у 4—5% людей). Способствует завороту свисание пузыря, наличие в нем камней, переполнение его желчью и снижение эластичности тканей. Заворот происходит на 360°, а иногда на несколько оборотов вокруг продольной оси и вокруг своей шейки. В этих случаях нарушается крово-отток и кровообращение. Следствием этого является полное или частичное омертвение желчного пузыря. Чаще страдают женщины в возрасте 60— 80 лет.
Всего, по данным литературы, описано около 180 случаев заворота желчного пузыря.
Клинически — резкая боль в правом подреберье, напряжение мышц передней брюшной стенки больше справа, рвота, задержка стула и газов. Иногда пальпируется напряженный желчный пузырь.
Диагноз ставят во время операции — холецистэктомии. Сначала раскручивают желчный пузырь, чтобы не повредить втянутой в ножку заворота части общего печеночного и общего желчного протока. При своевременной операции исход благоприятный.
Паразитарные заболевания желчных путей. Аскаридоз. В настоящее время описано около 76 случаев аскаридоза печени и желчевыводящих протоков. Это заболевание является, как правило, осложнением аскаридоза кишечника и представляет серьезную опасность для больного.
Опыт операций на желчных путях показал, что аскариды прижизненно через большой дуоденальный сосок двенадцатиперстной кишки из кишеч-ника заползают в холедох, а -оттуда проникают в желчный пузырь и печеночные протоки. Количество их может быть различным, от 1—2 до большого скопления. Чаще они локализуются в гепатохоледохе и реже в желчном пузыре и внутрипеченоч-ных желчных ходах. В ряде случаев в ядрах желчных камней обнаруживались яйца аскарид. Проникновение паразитов чаще наблюдается при недостаточности сфинктера Одди.
Клинически аскаридоз желчной системы проявляется приступами печеночной колики с явлениями выраженного холангита и желтухой. Убедительным в уточнении диагноза являются яйца аскаридов (глистов), полученные в желчи при зондировании, а также в пунктированной желчи во время операции. Во избежание рецидива попадания аскарид в холедох необходим курс противоглистного лечения. Оперативное лечение заключается в холецистэктомии и ревизии общего желчного протока. Некоторые рекомендуют наружное его дренирование, которое дает возможность отхождению ненайденных во время операции аскарид.
Ламблиоз. Одним из довольно частых паразитов кишечника чело-
века являются ламблии (Lamblia intestinalis).
Обычным местом обитания ламблий у человека является двенадцатиперстная кишка, откуда их можно получить с дуоденальным содержимым, но встречаются ламблии и в толстом кишечнике, где они инцистируются и в таком виде могут быть обнаружены в кале. Обнаружить же сами ламблии можно только при поносах.
В настоящее время твердо установлена возможность проникновения ламблий в желчевыводящую систему и скопления их в желчном пузыре. Это установлено не только на основании получения их в порции В, но и по наличию их в удаленном желчном пузыре. Пребывание паразитов в желчной системе вызывает длительные холангиты и холециститы.
Ламблиоз желчного пузыря часто вызывает приступы печеночной колики, типичной для желчнокаменной болезни или острого холецистита. Больные часто попадают в клинику по скорой помощи и иногда подвергаются ненужной операции. Дифференциальная диагностика сложна, если в анамнезе нет указаний на ламблиоз, но о подобном поражении хирург должен всегда помнить и подвергать больного оперативному лечению только после наблюдения и твердого убеждения в правильности диагноза. Безусловно, если имеются жизненные показания с нарастанием деструкции желчного пузыря, операция неизбежна. Во всех же других случаях, в которых отсутствуют данные, прямо говорящие о наличии желчнокаменной болезни, операция не должна быть срочной. При подозрении на ламблиоз необходим предварительный курс специфической терапии.
Правильная и ранняя постановка диагноза и противоламблиозное лечение в большинстве случаев приносит положительный результат. Наиболее распространенным средством лечения является акрихин по 0,1 г 3
раза в день в течение 10 суток, затем делается перерыв на 5 дней и снова препарат применяют в течение 5 дней. Такой курс лечения повторяется еще 1—2 раза. При обнаружении ламблий через 2—3 месяца курс лечения повторяют. После повторного лечения они обычно исчезают. Лечение сочетают с одновременным многократным промыванием двенадцатиперстной кишки растворами сернокислой магнезии. Из других средств следует отметить осарсол по 0,25 г 4 раза в день.
Заражение двуусткой. Печеночная двуустка (distoma hepatica) и ее разновидности — сибирская и кошачья двуустка являются паразитами, которые вызывают хронический ангиохолит, гепатит, цирроз печени. Печеночная двуустка относится к плоским червям-сосальщикам. Промежуточным хозяином является речная рыба. В желудочно-кишечный тракт человека попадают цисты паразита с водой, а зародыши из кишечника проникают в печень и желчные пути. Пребывание паразита проявляется приступами печеночной колики, нередко сопровождающимися желтухой. В большинстве случаев паразит является операционной находкой. Пребывание паразита часто сочетается с обнаружением в желчном пузыре камней и гноя, сам же паразит может располагаться в расширенном холедохе.
Эметин является наиболее эффективным средством лечения опистор-хоза, особенно в начальных стадиях заболевания.
Эхинококк желчных путей. Чаще всего встречается эхинококк желчного пузыря. Поражение наружных желчных протоков всегда вторично. Встречаются подобные поражения 0,5—3,3% случаев заболевания желчных путей (Б. К. Финкиль-штейн, 1924; А. Г. Сосновский, 1950, и др.).
Прорыв эхинококковой кисты в протоки сопровождается приступом печеночной колики, тошнотой, рво-
той, желтухой, ахоличным стулом, обострением холангита с высокой лихорадкой и ознобами. Нередко наблюдаются закупорки протоков, протекающие с тяжелым холангитом, холециститом.
Диагностика иногда облегчается указанием на наличие у больного эхинококка печени или операции по этому поводу, обнаружению в испражнениях обрывков хитиновой оболочки и дочерних пузырей. В большинстве же случаев устанавливается диагноз холецистита холедо-холитиаза.
Наличие септического холангита, гепатита, часто множественного поражения печени делают прогноз очень серьезным. Летальность при этом поражении высокая.
Лечение оперативное, направлено на восстановление свободного оттока желчи, ликвидацию паразита и хорошее дренирование гнойной полости, если она есть. Для этой цели необходимо вскрыть холедох и удалить оттуда дочерние кисты, обрывки тканей эхинококка и затем дренировать его. Нередко производят и холецистэктомию, а при поражении желчного пузыря удаление его становится неотъемлемой частью оперативного вмешательства. Если позволяет общее состояние больного, одномоментно производят и дренирование кисты печени или ее удаление. Некоторые ограничиваются дренированием кисты и через нее налаживают отток желчи, считая, что этого достаточно для полного выздоровления.
Глава пятая
Х ИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ НЕПРОХОДИМОСТИЖЕЛЧНЫХ
ПРОТОКОВ
ИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ НЕПРОХОДИМОСТИЖЕЛЧНЫХ
ПРОТОКОВ
Во время каждой операции по поводу желчнокаменной болезни и воспалительных заболеваний желчных путей задача хирурга состоит не только в удалении желчного пузыря как очага камнеобразования и инфекции, но и в тщательном выявлении и устранении любых препятствий к оттоку желчи в кишечник. Многочисленные работы последних лет подчеркивают, что хирургическое лечение главного желчного протока находится в центре внимания ученых и практических хирургов, но многие вопросы и положения по-прежнему остаются спорными и нерешенными. Продолжается дискуссия о том, когда необходима холедохото-мия, как лучше ее заканчивать — глухим швом или наружным дренажем холедоха, что предпочтительнее — холедоходуоденостомия, холе-дохоеюностомия или прямые трансдуоденальные вмешательства на конечном отделе общего желчного протока.
Мало разработанной остается проблема лечения высоких стриктур желчных путей.
Полагая, что дальнейшее развитие хирургии желчных протоков зависит прежде всего от улучшения диагностики и выбора наиболее адекватной оперативной тактики, мы и остановимся здесь на обсуждении этих проблем.
Схематически нарушения проходимости желчных протоков могут
быть классифицированы следующим образом.
A. Обтурационная непроходи мость: 1) камни; 2) сгустки крови; 3) паразиты.
Б. Непроходимость при заболевании стенки желчных протоков: 1) врожденные аномалии; 2) воспалительные заболевания; 3) травматические повреждения; 4) рубцовые стриктуры; 5) опухоли.
B. Непроходимость вследствие внепротоковых заболеваний, вовле кающих в процесс желчные протоки: 1) воспалительные заболевания; 2) спайки; 3) увеличенные лимфатиче ские узлы; 4) злокачественные опу холи.
Поскольку врожденные аномалии, гемобилия, паразитарные и опухолевые поражения желчных протоков освещены в специальных главах нашей работы, мы эти виды патологии в настоящей главе не рассматриваем.
Нарушения проходимости желчных протоков за счет сдавления спайками и увеличенными лимфоузлами следует относить к чрезвычайно редким явлениям и всегда лучше искать более реальную причину заболевания.
Предметом рассмотрения в данной главе остаются внутрипротоко-выё нарушения проходимости, вызванные камнями, нарушения вследствие воспалительных заболеваний, травматических повреждений и руб-
Таблица 5
Характер оперативного метода лечения в зависимости
от уровня проходимости желчных протоков
(1959—1973 гг.)
|
Оперативный метод |
Число оперированных |
Число умерших |
Летальность в % |
|
При непроходимости на уровне собственно пече- |
|
|
|
|
ночных протоков и их бифуркации: |
|
|
|
|
Резекция стриктуры с билиобилиарным анас- |
|
|
|
|
томозом |
5 |
|
. |
|
Комбинированные гепатикоеюностомии |
15 |
— |
— |
|
Операция Лонгмайра |
3 |
— |
— |
|
При непроходимости общего печеночного протока |
|
|
|
|
и супрадуоденальной части холедоха: |
|
|
|
|
Холедохотомия с глухим швом холедоха |
186 |
4 |
2,1 |
|
Холедохотомия с дренажом Вишневского |
69 |
12 |
17 |
|
Пластика стриктуры |
5 |
— |
— |
|
Резекция стриктуры с анастомозом протока |
|
|
|
|
конец в конец |
15 |
— |
— |
|
Билиодигестивные анастомозы |
28 |
1 |
— |
|
Травмы протоков: |
|
|
|
|
Анастомоз конец в конец |
9 |
1 |
— |
|
Холедохоеюностомия |
1 |
— |
— |
|
При непроходимости дистального отдела холедоха: |
|
|
|
|
Трансдуоденальная сфинктеротомия и сфинк- |
|
|
|
|
теропластика |
166 |
6 |
49,6 |
|
Трансдуоденальная дилатация сфинктера Одди |
29 |
1 |
|
|
Холедоходуоденостомия |
27 |
1 |
|
|
Всего |
568 |
26 |
4,6 |
цовых
стриктур желчных протоков и,
наконец, нарушения вследствие
внепротоковых
воспалительных заболеваний.
В
зависимости от уровня непроходимости
и в соответствии с оперативно-тактическими
и оперативно-техническими
задачами мы разделили все виды
непроходимости желчных протоков
на 3 типа: 1) непроходи-мость
дистального отдела холедоха;,
непроходимость
супрадуоденаль
ной
части холедоха и общего пече
ночного
протока (гепатохоледоха);
непроходимость
собственно пече
ночных
протоков от ворот печени до
их
соединения в общий печеночный.
Такое
подразделение обусловлено
существованием некоторых общих
принципов
оперативного лечения каждого
из видов непроходимости.
Однако
не следует забывать, что нарушения
проходимости желчных протоков
могут быть одновременно
МЕТОДЫ ОПЕРАТИВНОГО ЛЕЧЕНИЯ
Операционный разрез при хирургических вмешательствах на желчных протоках должен не только давать хороший доступ, но и позволять провести тщательное обследование остальных органов для исключения заболеваний, симулирующих поражение желчных путей. В то же время разрез должен быть по возможности менее травматичным.
На основании многолетних исследований мы пришли к заключению, что перечисленным требованиям наилучшим образом отвечает клюшкооб-разный разрез по Шалимову, или срединная лапаротомия.
Если больной перенес операцию на желчных путях, то предпочтение отдают разрезу с иссечением старого послеоперационного рубца.
После вскрытия брюшной полости тщательно рассекают и разъединяют пальцами и тупферами сращения, чтобы сделать хорошо видимыми желчный пузырь и печеночно-двенад-цатиперстную связку. При повторных операциях нужно быть особенно осторожным, чтобы не повредить органы, спаянные с париетальной брюшиной. Переднюю поверхность печени, сальник, желудок и поперечно-ободочную кишку осторожно отделяют от брюшной стенки.
Печеночный изгиб толстой кишки, двенадцатиперстная кишка, желудок и сальник бывают плотно сращены с нижней поверхностью печени. Эти органы необходимо отделить от печени острым методом. Лучше всего начинать его вдоль переднего края печени, справа налево. Отделение производят достаточно далеко кзади, чтобы подойти к винслову отверстию. Часто наблюдаются плотные спайки между двенадцатиперстной кишкой, пузырным ложем и воротами печени. Здесь необходима наибольшая осторожность, чтобы при отделении двенадцатиперстной кишки не нарушить ее серозный покров и не вскрыть желчные протоки и кровеносные сосуды.
Часто дооперационный диагноз поражения желчных протоков недостаточно обоснован, и поэтому на операции хирург должен установить, имеются ли патологические изменения главных желчных путей, большого дуоденального соска и других органов.
Для этого производят тщательную ревизию органов брюшной полости. Пальпируют желчный пу-
зырь, чтобы определить наличие в нем камней, их количество и размеры, оценивают размеры, внешний вид и консистенцию печени, пальпируют желудок и начальную часть двенадцатиперстной кишки, имея в виду возможность язвенной болезни, тщательно исследуют пищеводное отверстие диафрагмы, для исключения диафрагмальной грыжи. Далее исследуют селезенку и почки. После этого приподнимают поперечно-ободочную кишку и осматривают все толстые и тонкие кишки, червеобразный отросток, а также исследуют органы малого таза. Такое широкое исследование следует проводить систематически, чтобы не пропустить сопутствующие заболевания.
Тракцией за круглую связку печень подтягивают книзу и кпереди. От этого внепеченочные пути и связанные с ними сосуды приближаются к передней брюшной стенке, становятся более доступными для дальнейшего исследования.
Между печенью и печеночным изгибом толстой кишки, двенадцатиперстной кишкой и правой почкой прокладывают большую влажную салфетку, поверх нее накладывают печеночное зеркало. Вторую салфетку прокладывают между печенью и дистальным отделом желудка и двенадцатиперстной кишки. Ассистент, стоящий напротив хирурга, слева от больного, сильно оттягивает желудок и двенадцатиперстную кишку книзу, положив указательный палец слева, а остальные 3 справа от общего желчного протока.
Затем хирург захватывает шейку желчного пузыря окончатым зажимом, слегка потягивает за нее и начинает препаровку ножницами. Действуя тупым и острым методом, вскрывает брюшину над пузырным протоком и сдвигает ее в стороны. Препаровку продолжают книзу вдоль пузырного протока до его устья. Рассекают брюшину поверх общего желчного протока, подводя под нее изогнутый зажим и раздвигая его бран-
ши. Диссекция продолжается до тех пор, пока не будет совершенно изолирован пузырный проток и станет хорошо видимым то место, где он впадает в общий желчный проток.
При этом оценивают ширину пузырного протока (в норме имеет диаметр, равный толщине спички) и общего желчного (диаметр последнего равен 4—8 мм). Расширение пузырного протока и множественные камни в желчном пузыре свидетельствуют о свободном их прохождении в общий желчный проток. Диаметр последнего свыше 10 мм рассматривается как признак его расширения вследствие желчной гипертензии. Если же диаметр холедоха колеблется от 8 до 10 мм, то необходимо дальнейшее тщательное исследование, так как вероятно наличие препятствия к оттоку желчи, скорее всего на уровне сфинктера Одди.
Следует иметь в виду, что нормальный калибр общего желчного протока при одновременном увеличении желчного пузыря еще не исключает возможность патологии сфинктера Одди. Желчный пузырь обладает функцией предохранительного клапана, расширяясь, он играет де-компрессивную роль и предохраняет протоки от расширения.
После осмотра хирург помещает указательный палец в винслово отверстие, пальпирует дистальный отрезок пузырного протока и холедох между указательным и большим пальцами, внимательно ищет камни, которые могут быть мелкими и очень подвижными, замазкообразную желчь, нечетко пальпируемую, а также определяет пальпаторно толщину стенки общего желчного протока и ее напряжение. Хирург должен точно отди-ференцировать общий желчный проток. При воспалении и повторных операциях это иногда сложно, так как проток по внешнему виду мало отличается от воротной вены. Хорошим ориентиром может быть культя пузырного протока после бывшей холецистэктомии, которую следует
найти во время диссекции и иссечь, если она слишком длинная. При сомнении хирург аспирацией желчи при помощи шприца и иглы должен подтвердить свою уверенность, что он имеет дело с общим желчным протоком.
При склеротическом желчном пузыре небольших размеров и симптомах холедохолитиаза следующим этапом операционной диагностики является исследование терминального сегмента холедоха и поджелудочной железы. Для этого, как и для последующей сфинктеропластики, необходима мобилизация двенадцатиперстной кишки по Кохеру. Нормальный большой дуоденальный сосок не прощупывается, фибротиче-ски измененный — пальпируется в виде отчетливого уплотнения. Камни сосочка определяются довольно четко. Можно попытаться сместить их кверху в холедох, но форсировать это мероприятие не следует. Рак соска иногда довольно трудно отличить из рубцового стеноза и камня, но при известном опыте и настороженности это вполне возможно.
На основании своего опыта и данных литературы мы считаем, что осмотр и осторожная пальпация желчных протоков и поджелудочной железы являются точными методами операционной диагностики. Однако на результаты этих исследований влияют многие факторы. Если головка поджелудочной железы плотная и узловатая, то определить камни в дистальном отделе холедоха трудно. Точность исследования понижается также из-за плотных спаек после предыдущих хирургических вмеша-тальств и воспалительных процессов. Поскольку успех хирургического вмешательства целиком зависит от точности диагноза и полноты оперативного пособия, то вполне оправдано применение любых других способов, которые помогают это осуществить. В этом отношении наибольшее диагностическое значение имеют холангиоманометрия, дебито-
метрия желчных путей, холангиогра-фия, холедохоскопия, зондирование протоков в проксимальном и дисталь-ном направлениях и, наконец, холе-дохотомия.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ НЕПРОХОДИМОСТИ
ДИСТАЛЬНОГО ОТДЕЛА
ОБЩЕГО ЖЕЛЧНОГО ПРОТОКА
Основной причиной непроходимости дистального отдела общего желчного протока является патология области большого дуоденального соска и панкреатической части холедоха.
Патологические изменения в области большого дуоденального соска обычно заключаются в сужении его просвета и ограничении подвижности мускулатуры сфинктера Одди. Для обозначения этих изменений предложено несколько терминов-синонимов: папиллосклероз, папиллосте-ноз, стенозирующий папиллит, первичный иктерогенный папиллит, контрактура сфинктера Одди, фи-бротический оддит, склерозирующий оддит, заболевание сфинктера Одди, стеноз сфинктера Одди, стенозирующий оддит, доброкачественный стеноз большого дуоденального соска, терминальный холедохит, сфинктерит и другие изменения.
Мы придерживаемся мнения Hol-1е (1960), согласно которому среди заболеваний сосочка необходимо различать заболевания мускулатуры и слизистой оболочки. Возможно также поражение всей стенки сосочка с вовлечением в процесс слизистой оболочки и мускулатуры одновременно. Исходя из этого, мы полагаем, что наиболее общими определениями являются стенозирующий оддит или стеноз сфинктера Одди. В понятие «стенозирующий папиллит» мы вкладываем более узкий смысл и этот термин считаем применимым только для тех редких в клинике случаев, когда патологический процесс лока-
лизуется лишь в слизистой оболочке сосочка, но еще не распространяется на сфинктер Одди.
В отношении частоты этой патологии единого мнения не существует. По данным Hess (1961), частота па-пиллостенозов составляет 29,4% случаев всех заболеваний желчных путей не опухолевого характера, а при холедохолитиазе — 51,7% случаев. Другие исследователи, напротив, подчеркивают относительную редкость этой патологии. Так, по данным Mallet—Guy (1962), она имелась у 7,2% больных при операциях на желчных путях. В то же время Mallet—Guy (1962) говорит о 73% случаев дискинезий (из всех заболеваний сфинктера Одди) и видит в этом одну из этиологических предпосылок для возникновения органических стенозов.
В некоторых случаях стеноз сфинктера Одди может быть и без каких-либо явных патологических изменений во всем желчном дереве. В таких случаях говорят о первичном стенозе сфинктера. Hess (1961) различает 10% первичных стенозов без желчных камней и 90% вторичных, сочетающихся с холелитиазом.
Стеноз сфинктера Одди чаще бывает у женщин, чем у мужчин, соотношение составляет 2,3 : 1. Это состояние может наблюдаться в любом возрасте, но чаще всего между 50 и 70 годами жизни.
Хотя клинически стенозирующий папиллит не вызывает сомнений, патологическая картина его является неоднородной и трудной для диагностики, так как отсутствуют его характерные признаки. Изменения могут быть в пределах от переходящего воспалительного отека до плотного рубцового кольца.
Заслуживает внимание то обстоятельство, что при гистологическом исследовании кусочков фатерова соска, иссеченных при операциях по поводу его стеноза, не всегда определяются патологические изменения. Так, А. И. Нечай и С. А. Калашни-
ков у 3 из 17 больных при сужении терминального сегмента холедоха не выявили никаких морфологических изменений. Acosta и соавторы (1970) при исследовании биопсийных образцов, иссеченных у 25 больных, с достоверным диагнозом стеноза в области сфинктера Одди, у 8 больных получили нормальные данные.
При так называемом папиллите, Holle (1960) нашел папилломатозные утолщения и гиперпластическое или атрофическое воспаление слизистой оболочки сосочка и ее клапанообраз-ных складок с их рубцовым перерождением, сморщиванием и потерей клапанной функции. Это, по мнению Holle (1960), является причиной регургитации кишечного содержимого с развитием хронического панкреатита. Автор обращает внимание, что размер разрушений клапанов в ампуле идет почти параллельно степени тяжести заболевания желчных путей, и считает, что локализованный в слизистой оболочке хронический стено-зирующий папиллит всегда является вторичным.
Чаще, однако, определяются аде-номатозные разрастания и кистозное перерождение папиллярных желез, образование рубцов, фиброз (склероз) сфинктера Одди и ангиоматозные расширения сосудов со значительным преобладанием аденоматозного про-низывания мышечного аппарата (рис. 21). При фиброзе толстые кол-лагеновые пучки разделяют и замещают сфинктерную мышцу.
В каждом препарате обнаруживают различную степень острого или хронического воспаления, однако преобладает какой-либо один из нескольких патологических признаков, что позволило Acosta и соавторам (1970) классифицировать папиллит следующим образом: язвенный, гра-нулематозный, аденоматозный и фиброзный, или склерозирующий. Авторы пришли к заключению, что папиллит является хроническим заболеванием, возникающим на почве повторных острых приступов воспа-
Рис. 21. Микрофотограмма фатерова сосочка при стенозе сфинктера Одди.
лительных заболеваний желчных путей и поджелудочной железы.
Szeleczky и Megyeri (1970) выделяют изменения стромы (воспалительный отек, инфильтрация, фиб-роаденоз, фиброаденомиоматоз) и мышечных элементов (замещение руб-цовой тканью, гиалиновая дегенерация, увеличение нервных элементов в мышечной субстанции). По клиническим и патоморфологическим признакам авторы предлагают различать 3 вида доброкачественных стенозов большого дуоденального соска: хроническое воспаление его при сравнительно нормальной анатомической структуре, гиперплазия желез в области сфинктера, гипертрофия мускулатуры сфинктера (с хронической воспалительной инфильтрацией или без нее). Чаще всего встречается гиперплазия желез (44,9%), иногда сочетается с гипертрофией мышц сфинктера.
А. И. Нечай и С. А. Калашников (1964), а также Fodisch и Marzoli (1964) при гистологическом исследовании ампулярной зоны у умерших от заболеваний, не связанных с поражением билиопанкреатической зоны, обнаружили, что нормальная структура сосочка встречалась у больных только в детском и молодом возрастах. В возрасте старше 30—-40 лет в слизистой оболочке сосочка найдены полипозные разрастания и избы-
Рис. 22. Наиболее частые типы стеноза сфинктера Одди (по ТаиЬеr).
точная складчатость. Определялась воспалительная инфильтрация слизистого и подслизистого слоев лимфоцитами и плазматическими клетками, новообразование капилляров и заметное сужение просвета сосочка новообразованной соединительной тканью. Нередко обнаруживались гипертрофия или атрофия и соединительнотканное преобразование мускулатуры сфинктера, а также явное увеличение числа желез, кистозное их расширение, дискомплексация железистых долек и лимфоидно-плазмати-ческая инфильтрация.
Несомненно, что такое возрастное сужение большого дуоденального соска имеет определенное патогенетическое значение в развитии желчнокаменной болезни вследствие затруднения оттока и застоя желчи. Это аналогично экспериментальным данным Imamogl и соавторов (1957), которые вызывали образование желчных камней посредством неполной стриктуры терминального сегмента общего желчного протока.
Этиология стеноза сфинктера Одди все еще остается не вполне ясной. По-видимому, наиболее частой причиной развития воспалительной реакции и склерозирующих процессов являются камни большого дуоденального соска.
Кроме того, стеноз сфинктера Одди может быть проявлением фиброза, наблюдаемого при хроническом холангите.
Папиллит в узком смысле слова может быть следствием острого дуоденита, результатом операционной травмы при удалении камней общего желчного протока, бужировании сосочка, резекции желудка и др.
Doubilet и Mulholland (1956) утверждали, что фиброз сфинктера Одди бывает только тогда, когда воспалительная реакция сочетается с вколоченным камнем или нижний конец холедоха повреждается во время ди-латации зондами, ложками и т. д. Любое другое сужение в этом месте, по их мнению, обусловлено спазмом сфинктера Одди. Спазм в этом месте может вызывать даже механическую желтуху (А. А. Шалимов, 1957). Однако, как подчеркивал Cattell с соавторами (1962), в большинстве случаев встречается явный фибро-тический стеноз. Он бывает и тогда, когда нет камней общего желчного протока и не было никакого предшествующего хирургического вмешательства.
Иногда стеноз может локализоваться только в слизистой оболочке у устья большого дуоденального соска. В таких случаях имеется почти точечное отверстие в самой слизистой оболочке на верхушке соска, расширение ампулы и образование «общего канала». Однако стенозирующий процесс вовлекает и сфинктерную мускулатуру, причем бывают следующие формы стеноза (рис. 22): стеноз сфинктера ампулы с застоем в обеих протоковых системах и образованием «общего канала»; стеноз всех 3 отделов сфинктера Одди с изолированным застоем в обеих протоковых системах; стеноз, поражающий только сфинктер холедоха и вызывающий застой желчи, без застоя в про-токовой системе поджелудочной железы; изолированный стеноз сфинктера вирсунгова протока с развитием хронического панкреатита, без застоя в желчных путях; стеноз сфинктера холедоха и ампулы при изолированном впадении общего желчного и вирсунгова протоков, в таких случа-
ях возникает застой желчи без хронического панкреатита.
Как уже упоминалось, стеноз сфинктера Одди формируется чаще всего как осложнение желчнокаменной болезни. Но, с другой стороны, и сам стеноз способствует образованию камней. Так образуется своеобразный порочный круг, отягощающий течение заболевания. Стеноз и спазм сфинктера Одди приводят к нарушениям анатомического и функционального соотношения между системами желчных и панкреатических протоков, вызывают развитие холангиогепатита и хронического или острого панкреатита. Развитию панкреатита способствует, кроме застоя панкреатического сока, также рефлюкс концентрированной и инфицированной желчи, который обусловлен существованием «общего канала» при наличии стойкого препятствия в области сфинктера ампулы.
Наряду с билиопанкреатическим рефлюксом при определенных обстоятельствах могут создаваться условия для ретроградного забрасывания в желчные пути панкреатического сока — панкреатобилиарный рефлюкс (Bevilacqua и Gallili, 1967).
Сфинктер Одди регулирует динамику и давление желчи и секрета поджелудочной железы. Анатомические и функциональные нарушения этого образования приводят к развитию патологических процессов в печени, желчных путях и поджелудочной железе, что необходимо учитывать при выборе методов лечения. В большинстве случаев механизм этих нарушений можно рассматривать как последовательную цепь процессов: временный спазм — стойкий спазм— воспаление — рубцевание. Часто они встречаются одновременно у одного и того же больного и входят в общее понятие «стенозирующий оддит», «стеноз сфинктера Одди» или «стеноз большого дуоденального соска».
От стеноза сфинктера Одди следует отличать так называемые тубу-лярные стенозы дистальной, а точ-
нее — интрапанкреатической части холедоха. Этот вид патологии является результатом сдавления общего желчного протока фибротической тканью поджелудочной железы при хроническом псевдотуморозном панкреатите. По нашим данным, тубу-лярные стенозы являются редкой патологией, их частота относится к частоте стенозов сфинктера Одди, как 2 : 100. Тубулярные стенозы, как и стенозы сфинктера Одди, практически никогда не приводят к полной облитерации протока, если одновременно нет закупоривающего камня. В дифференциально-диагностическом отношении это является главным отличием от опухолей большого дуоденального соска и головки поджелудочной железы, которые быстро приводят к тотальной и стойкой непроходимости протока.
Основными методами хирургического лечения непроходимости ди-стального отдела общего желчного протока в настоящее время являются: трансдуоденальная сфинктеропласти-ка, холедоходуоденостомия и холе-дохоеюностомия.
ТРАНСДУОДЕНАЛЬНАЯ СФИНКТЕРОПЛАСТИКА
Еще Langenbuch в 1884 г., всего через 2 года после сообщения о первом успешном удалении желчного пузыря, высказал идею о трансдуоденальном рассечении большого дуоденального «дивертикула» в случаях рубцового стеноза и для удаления камня общего желчного протока, а также при глистной инвазии. Эта операция была впервые произведена Mс Burney в 1891 г. В 1898 г. Мс Burney уже сделал трансдуоденальную сфинктеротомию без швов 6 больным.
Kocher в 1894 г. использовал такой же путь для удаления камней из дистального отдела холедоха, но считал, что края разреза слизистых оболочек его и двенадцатиперстной киш-
ки должны быть сближены наложением кетгутовых швов. Называл он эту операцию ампулодуоденостоми-ей. Наложение швов на слизистую оболочку холедоха и двенадцатиперстной кишки Kehr (1898) считал безусловно показанным во избежание образования дуоденального свища. С. П. Федоров (1934) также вскоре пришел к выводу о преимуществе трансдуоденальной сфинктеротомии при непроходимости большого дуоденального соска и называл эту операцию трансдуоденальной холедохо-томией. В 1960 г. В. А. Жмур и В. Ш. Работников, изучая вопрос хирургического лечения хронического рецидивирующего панкреатита, установили, что независимо от причин, вызывающих поражение большого дуоденального соска, надежное предупреждение рецидивов панкреатита возможно только после устранения изменений в сосочке, особенно если они носят органический характер. Исходя из этого, авторы при стенозе или стойком спазме большого дуоденального соска производили прямые вмешательства на сфинктере Одди и пришли к заключению, что трансдуоденальная сфинк-теротомия является перспективной операцией.
Большой вклад в изучение спорных вопросов сфинктеротомии внес Н. А. Захаров (1962-1964, 1967). Автор является сторонником трансдуоденальной сфинктеротомии, причем особо подчеркивает роль длины разреза сфинктера в предупреждении рестеноза, накладывает кетгутовые швы на стенку ампулы и слизистую оболочку кишки и вполне обоснованно выступает против транспапиллярного дренажа. На основании личного опыта (28 трансдуоденальных операций с 3 летальными исходами) Н. А. Захаров (1967) установил, что более рациональными по сравнению с простой папиллотомией являются резекция треугольного лоскута из передней стенки сосочка вместе со сфинктером и тщательный шов сли-
зистых оболочек. Трансдуоденаль- ную супрапапиллярную холедохо-дуоденостомию автор не рекомендовал, так как эта операция при стенозах сфинктера Одди не разгружает поджелудочную железу и при отсутствии дополнительного панкреатического протока ведет к возникновению рецидивирующего панкреатита. Трансдуоденальное ретроградное расширение сосочка автор считает порочной операцией.
Н. А. Захаров (1967) видоизменил и усовершенствовал примененную в 1953 г. Giletta ретродуоде-нальную внеслизистую сфинктерото-мию. Однако при стенозах сфинктера Одди в сочетании с холедохолитиа-зом; при ущемлении камня большого дуоденального соска и папиллитах лучшей операцией он считал трансдуоденальную пластику папиллы с холецистэктомией без холедохото-мии и внутрихоледохальных дренажей.
Я. Р. Бялык (1964, 1968) разработал методику внутренней папилло-томии без вскрытия двенадцатиперстной кишки. Он изобрел оригинальный папиллотом и получил удовлетворительные результаты, применив свой метод при лечении осложненных холециститов и холецистопан-креатитов.
К. Т. Овнатанян и В. В. Минин (1969) отмечали, что из всех существующих способов оперативных вмешательств при заболеваниях большого дуоденального соска лучпше отдаленные результаты дает частичная сфинктеротомия и супрапапил-лярная холедоходуоденостомия.
Начиная со времен применения трансдуоденального вмешательства на фатеровом сосочке и до настоящего времени, эта операция является спорной. С одной стороны, определяются показания к трансдуоденальной папиллотомии (В. И. Петров и О. Б. Порембский, 1964; В. В. Виноградов и Э. В. Гришкевич, 1966, и др.), с другой,— получив ряд неудовлетворительных результатов,
многие отказались от этого метода, или резко сузили показания к нему (Б. С. Розанов и 3. А. Топчиашвили, 1967; А. Н. Напалков и Н. А. По-стряков, 1968; А. Т. Лидский, 1968; Б. В. Петровский и соавт., 1969; Н. И. Махов и соавт., 1970; В. П. Захаров, 1972; П. И. Кальченко и соавт., 1973; В. В. Виноградов и соавт., 1973; Edelmann и Schonbuch, 1973; Нерр, 1973, и др.).
Разделяя точку зрения противников трансдуоденальной сфинкте-ротомии, Н. И. Махов и соавторы (1969, 1970), в противоположность сфинктеротомии, широко применяют бужирование при стенозирующем воспалении большого дуоденального соска и сфинктера Одди. Проведя сравнительное изучение инструментального расширения сфинктера Одди и трансдуоденальной сфинктероплас-тики (1967—1970), мы убедились, что насильственное расширение сфинктера дистальной части холедо-ха не отвечает целям, поставленным перед лечением. Эти данные подтверждены работами А. X. Шаманова (1967—1969), который на основании клинического и экспериментального материала показал преимущества трансдуоденальной сфинктероплас-тики. Ведущие хирурги Москвы — 0. Б. Милонов, Б. А. Петров, Н. И. Махов, И. Б. Розанов, А. М. Джава-дян, Э. И. Гальперин, В. С. Маят, 3. А. Топчиашвили — дали отрицательную оценку папиллосфинктеро-томии и ее практическому применению в клинике.
Недостаточно изученная сущность заболевания терминального сегмента холедоха, существование действительных и воображаемых сложностей и опасностей самого вмешательства и недостаточное количество исследований относительно его отдаленных результатов является причиной того, что принцип пластического восстановления не находит себе должного применения. И тем не менее удельный вес оперативных вмешательств на большом дуоденаль-
ном соске в последние годы увеличился. Так, по данным Ilaurado и Frias (1969), среди операций на желчных путях 42,5% составили сфинктеротомии. Они изучили результаты трансдуоденальных папиллостомий у 55 больных, получили удовлетворительные результаты через 6 месяцев, 2 года после операции у 88,2% больных и при этом не имели ни одного летального исхода. Leggeri и соавторы (1972), выполнили сфинктеротомии у 100 больных, хотя в последние годы несколько сузили показания к этому методу. Возрастает интерес к этому вмешательству и в нашей стране (М. В. Данилов и соавт., 1973; Л. Д. Витебский, 1973). На основании своего опыта и данных литературы, мы хотели бы объективно показать, что пластические операции на конечном отделе общего желчного протока, поскольку они основаны на физиологических принципах, дают хорошие результаты.
С 1959 по 1973 г. включительно трансдуоденальное рассечение сфинктера Одди мы произвели у 166 больных. Летальный исход был у 6 больных (3,6%), 70 больных ко времени операции были старше 50 лет, а 25 — старше 60 лет.
У 53% больных к моменту поступления в клинику была желтуха или указания на нее в анамнезе. У 12% больных имелась так называемая субклиническая желтуха — повышение показателей сывороточного билирубина без видимой желтушной окраски кожи и конъюнктив, у 35% — нри поступлении и в анамнезе ее не было.
Раньше перенесли от 1 до 2 операций на желчных путях в сроки от 1 месяца до 15 лет 59 больных (32%). Холецистэктомия произведена у 31 из этих больных, холецистоеюносто-мия — у 10, холедоходуодено- или еюностомия — у 12, холецистостомия или наружное дренирование холедоха — у 6 больных. Хирургические вмешательства были первичными у
Патологические состояния у больных, перенесших трансдуоденальную сфинктеротомию и сфинктеропластику
Таблица 6
|
|
Число |
Из них с пан- |
|
Патологическое состояние |
больных |
креатитами |
|
При 107 первичных вмешательствах: |
|
|
|
Первичный стеноз сфинктера Одди |
|
|
|
(без желчных камней) |
17 |
8 |
|
Стеноз сфинктера Одди с камнями: |
|
|
|
желчного пузыря |
30 |
15 |
|
желчного пузыря и холедоха |
15 |
7 |
|
желчного пузыря, холедоха |
|
|
|
и большого дуоденального соска |
7 |
1 |
|
желчного пузыря и большого дуодеоналыюго соска |
13 |
5 |
|
холедоха |
9 |
3 |
|
холедоха и большого дуоденального соска |
11 |
2 |
|
большого дуоденального соска |
3 |
3 |
|
Подозрение на рак большого дуоденального соска (в этих |
|
|
|
случаях были и камни желчного пузыря) |
2 |
2 |
|
При 59 повторных вмешательствах • (включая операцию |
|
|
|
в 3-й раз): |
|
|
|
После холецистэктомии: |
|
|
|
Стеноз сфинктера Одди |
18 |
9 |
|
Стеноз сфинктера Одди и камни холедоха |
4 |
|
|
Стеноз сфинктера Одди и камни большого дуоденаль- |
|
|
|
ного соска (в одном из этих случаев был наружный |
|
|
|
свищ остатка желчного пузыря) |
9 |
4 |
|
После холецистэктомин и холедоходуодено-или еюностомии: |
|
|
|
Стеноз сфинктера Одди |
8 |
3 |
|
Стеноз сфинктера Одди, камень холедоха и стеноз |
|
|
|
анастомоза |
2 |
, |
|
После холецистоеюностомии: |
|
|
|
Первичный стеноз сфинктера Одди |
7 |
3 |
|
Стеноз сфинктера Одди и камни холедоха |
3 |
|
|
После холедохоеюностомии: |
|
|
|
Первичный стеноз сфинктера Одди |
2 |
1 |
|
После холецистостомии: |
|
|
|
Стеноз сфинктера Одди и наружный желчный свищ |
4 |
1 |
|
Стеноз сфинктера Одди, наружный желчный свищ |
|
|
|
и камни холедоха |
1 |
|
|
После дренирования малой сальниковой сумки по поводу |
|
|
|
панкреонекроза: |
|
|
|
Стеноз сфинктера Одди, камни желчного пузыря |
|
|
|
и холедоха и желчно-бронхиальный свищ |
1 |
1 |
|
Всего |
166 |
66 |
107 больных (64,4%), повторными — у 53 (32%) и 3-й операцией — у 6 больных (3,6%).
С 1966 г. частота трансдуоденальной сфинктеропластики составила 14,5% по отношению к общему числу всех вмешательств па желчных путях по поводу заболеваний не опухолевого характера. Частота первичных и вторичных сфинктеропластик по отношению ко всем первичным и пов-
торным операциям за это же время составила 11 и 36% соответственно.
В табл. 6 кратко представлено перечисление патологических состояний у больных, которым произвели трансдуоденальную сфинктеротомию или сфинктеропластику.
Трансдуоденальную сфинктеротомию произвели 35 больным (21,3%), остальным (131 больной, 78,7%) сде-
лали трансдуоденальную сфинктеропластику (табл. 7, 8).
Необходимо подчеркнуть, что трансдуоденальную сфинктеротомию без швов по линии рассечения сфинк-
тера мы применяли лишь на раннем этапе нашей работы. В настоящее время, как правило, накладываем швы, то есть выполняем настоящую пластику сфинктера.
Таблица 7
Характер операций у больных, перенесших трансдуоденальную сфинктеротомию
(35 человек)
|
„ Число Характер операции больных Холецистэктомия и трансдуоденальная сфинктеротомия 11 Холецистэктомия, холедохолитотомия и трансдуоденальная сфинктеро-пластика 6 Холецистэктомия, холедохотомия и трансдуоденальная сфинктеротомия 3 Холецистэктомия, трансдуоденальная сфинктеротомия и пластика холедо-ха на транспапиллярном дренаже 1 Холецистэктомия, трансдуоденальная сфинктеротомия и холедохоеюностомия 1 Дехолецистоеюностомия, холедохолитотомия и трансдуоденальная сфинктеротомия 1 Дехоледоходуоденостомия, трансдуоденальная сфинктеротомия и пластика холедоха на транспапиллярном дренаже 1 Холедохолитотомия и трансдуоденальная сфинктеротомия 1 Холедохотомия и трансдуоденальная сфинктеротомия 1 Трансдуоденальная сфинктеротомия 1 Всего 35 |
Таблица 8
Характер операций у больных, перенесших трансдуоденальную сфинктеропластику
(86 человек)
|
„ „ Число Характер операции больных Холецистэктомия и трансдуоденальная сфинктеропластика 39 (7) Холецистэктомия, холедохолитотомия и трансдуоденальная сфинктеропластика 12 (3) Холецистэктомия, холедохотомия и трансдуоденальная сфинктеропластика 6 (1) Дехолецистоеюностомия и трансдуодепальная сфинктеропластика 2 (2) Иссечение избыточной культи пузырного протока и трансдуоденальная сфинктеропластика . 8 Холедохолитотомия и трансдуоденальная сфинктеропластика 1 Холедохотомия и трансдуоденальная сфинктеропластика 7 Трансдуоденальная сфинктеропластика и пластика холедоха на транспапиллярном дренаже 1 (1) Трансдуоденальная сфинктеропластика 10 (1) Всего 86 (15) |
Примечание. В скобках указано число больных, у которых обычная трансдуоденальная сфинк -теропластика была дополнена сфинктеропластикой вирсунгова протока.
У 37 больных после рассечения сфинктера камни большого дуоденального соска и холедоха удаляли со стороны просвета двенадцатиперстной кишки. У 38 произведена биопсия большого дуоденального соска, а у 8 больных — поджелудочной железы. У 25 больных применено дренирование холедоха тонкой хлорвиниловой трубкой, проведенной через культю пузырного протока. Дренирование вирсунгова протока произведено только у 1 больного.
У 7 больных трансдуоденальная сфинктеротомия или сфинктеропла-стика не сопровождалась холецистэк-томией. У 5 больных с билиарным циррозом печени операция дополне-на оментогепатодиафрагмопексией, а у 3 с хроническим панкреатитом — левосторонней спланхникэктомией и резекцией левого узла солнечного сплетения.
Показания к трансдуоденальной сфинктеропластике. На основании обобщения собственных наблюдений и данных литературы мы виделили следующие показания к трансдуоденальной сфинктеропластике: стойкий спазм и рубцовый стеноз сфинктера Одди; камни большого дуоденального соска; камни интрапанкре-атической и ретродуоденалыюй части холедоха; не смещаемые свободно в су-прадуоденальную часть холедоха; множественные мелкие камни внепече-ночных желчных путей; внутрипече-нОчный холангиолитиаз; мутная желчь (обломки камней, песок, замазка, слизь и гной) в холедохе при отсутствии недостаточности сфинктера Одди; хронический, подострый панкреатит, обусловленный стенозом сфинктера Одди или ущемленным камнем большого дуоденального соска; подозрение на опухоль большого дуоденального соска (ранняя стадия); остаточные и рецидивные камни желчных путей.
Обычно бывает комбинация нескольких показаний у одного и того же больного: холелитиаз и стеноз сфинктера Одди; холелитиаз,
стеноз сфинктера и панкреатит; стеноз сфинктера и панкреатит.
Показания к сфинктеропластике должны быть подтверждены различным сочетанием следующих факторов: наличие желтухи; наличие ги-перамилаземии и гиперамилазурии; расширение общего желчного протока больше 10 мм; уплотнение большого дуоденального соска; диффузное или очаговое уплотнение поджелудочной железы; повышение остаточного давления в общем желчном протоке больше 150 мм вод. ст.; снижение скорости оттока жидкости при дебитометрии желчных путей ниже 15 мл/мин при постоянном давлении перфузии 300 мм вод. ст.; стойкая картина камня в терминальном сегменте холедоха или стеноза сфинктера Одди на серии холангио-грамм; внутрипеченочный и билиопан-креатический рефлюкс при неудовлетворительной проходимости контрастного вещества в двенадцатиперстную кишку; непроходимость или чрезмерная резистентность сфинктера Одди при проведении зонда диаметром более 3 мм.
Установление нескольких из перечисленных факторов позволит хирургу уточнить диагноз и решить вопрос о трансдуоденальной сфинктеропластике.
По мнению большинства исследователей, сфинктеротомия, как и сфинктеропластика, является абсолютно показанной в двух случаях при ограниченном рубцовом стенозе сфинктера Одди и ущемленном камне большого дуоденального соска. Р. В. Кузнецов (1967) и Patel с соавторами (1969) подразделяли эти операции на 2 группы — вынужденные и тактические.
К вынужденному рассечению сфинктера Одди существует два показания, которые и являются абсолютными,— это вколоченные камни сосочка и органические стенозы сфинктера Одди. О тактической сфин-ктеротомии (сфинктеропластике) речь идет при относительных показаниях
к этой операции. Ими являются камни желчных путей при сомнительной проходимости сфинктера Одди. Кроме того, можно выделить еще «били-арные» и «панкреатические» показания к сфинктеротомии (сфикктеропла-стике).
Стеноз сфинктера Одди. Для устранения стаза желчи при затрудненном оттоке в области сфинктера Одди конкурируют 2 оперативных метода: трансдуоденальная сфинктеропласти-ка и супрадуоденальная холедоходу-оденостомия. Растяжение сфинктера широко применяемое наряду с трансдуоденальной сфинктеротомией и сфинктеропластикой здесь не обсуждается, так как теперь хорошо известны рецидивы стеноза и тяжелые последствия этой операции.
Но все ли стенозы сфинктера Одди, диагностированные на основании повышенного остаточного давления и низких показателей дебитометрии, служат показанием к сфинктеропла-стике. Ряд авторов (П. Н. Напалков, Н. А. Посрелов, 1968; Salembier, 1965), получив неудовлетворительные результаты после сфинктеротомии, пришли к выводу, что у большинства больных достаточно провести холецистэктомию, удаление камней холедоха и его дренирование. Они считают, что после подобных вмешательств даже глубокие органические изменения сфинктера Одди претерпевают обратное развитие и восстанавливается нормальная его деятельность. Хотя полностью с этим мнением согласиться нельзя, все же вполне реально, что существуют обратимые изменения в виде спазма сфинктера, отека и воспалительной инфильтрации сосочка, которые еще не распространились на мышцу. Такие изменения проходят после удаления пораженного желчного пузыря, устранения камней из общего желчного протока и его временного наружного дренирования. Однако при более распространенном процессе невозможно различить отек, который может быть обратимым, и скле-
ротический стеноз сфинктера Одди. так как рентгенологические признаки не патогномоничны. К тому же нет уверенности, что после холецистэк-томии умеренно пораженный сфинктер не будет подвергаться ретрак-тильному склерозу. Мы неоднократ но наблюдали постхолецистэктоми-ческие синдромы несколько месяцев и даже лет спустя после операции. С течением времени они становятся все более тяжелыми. Поэтому мы считаем, что радикальному рассечению подлежат все стенозы сфинктера Одди, но паллиативные меры все же допустимы в следующих случаях: при обнаружении умеренного повышения остаточного давления в холедохе (примерно до 200 мм вод. ст.) и умеренного понижения дебита (примерно до 15 мл/мин при 300 мм вод. ст.); при заметном расширении общего желчного протока; когда не обнаруживается холангит; нет сопутствующего панкреатита; нет никаких подозрений на рак фатерова сосочка.
Паллиативная операция может быть ограничена введением микродренажа холедоха через культю пузырного протока на 2—6 недель или ретрохоледохальной невротомией, которую мы применяли в качестве эквивалента селективной ваготомии сфинктера Одди. Во всех других случаях мы считаем наиболее оправданной прямую трансдуоденальпую ревизию большого дуоденального соска, при необходимости — его биопсию, а затем — сфинктеропластику.
Холедоходуоденостомию мы производим у больных с резким расширением и атонией холедоха и отсутствием одновременного поражения поджелудочной железы.
На рис. 23а представлена операционная холангиограмма, демонстрирующая стеноз сфинктера Одди как показание к трансдуоденальной сфинктеропластике.
Камни большого дуоденального соска. Вколоченный камень большого дуоденального соска хорошо паль-
а — операционная холангиограмма, стеноз сфинктера Одди; б — чрескожная чреспеченочная холангиограмма, камень большого дуоденального соска; в — чрескожная чреспеченочная холангиограмма, камень препапиллярного отдела холедоха и стеноз сфинктера Одди: г — холангиограмма через микродренаж холедоха после холецистэкто-мии и холедохолитотомии, остаточные камни холедоха; д — чрескожная чреспеченочная холангиограмма, стеноз дистального отдела холедоха при псевдотуморозном панкреатите.
пируется через невскрытую двенадцатиперстную кишку у верхушки сосочка, он неподвижен и является, по мнению хирургов, абсолютным показанием к «вынужденному» транс дуоденальному рассечению сфинктера Одди. При смещаемых камнях сосочка и подозрении на папилломатоз сфинктера Одди или его стеноз также целесообразна операция трансдуоденальным путем, она гарантирует от диагностических и тактических ошибок.
На рис. 236 демонстрируется хо-лангиограмма больного с камнем сосочка, где необходимо произвести трансдуоденальную сфинктеропла-стику.
Камни желчных путей. Камни в общем желчном протоке являются относительным показанием к трансдуоденальной сфинктеропластике. Кроме этой операции, довольно часто прибегают к 2 хирургическим методам — холедохотомии и холедо-ходуоденостомии.
Мелкие, плавающие камни холе-доха трудно удалить посредством супрадуоденальной холедохотомии, несмотря на то что предложены самые разнообразные ловушки, включая и катетер Фогарти. Они ускользают во внутрипеченочные желчные ходы, могут собираться в терминальном сегменте холедоха и вызывать симптом закупорки.
Особенно сложно с помощью супрадуоденальной холедохотомии удалять камни нижней части холедоха, его препапиллярного отдела (рис. 23в). Иногда они располагаются в ложном дивертикуле холедоха по большой кривизне его нижней части и не смещаются. Наконец, бывают камни, которые дробятся при малейшем к ним прикосновении, и полное удаление осколков затруднительно.
Удаление камней общего желчного протока преследует две цели — полное удаление камней и создание анатомофизиологических условий для беспрепятственного тока желчи
в кишечник. Последнее условие может быть выполнено только при соответствующем диаметре выходного отверстия холедоха. В большинстве случаев холедохолитиаза в мышце сфинктера имеются незначительные нарушения, иногда вызывающие стойкое сужение отверстия. С другой стороны, стеноз способствует стазу желчи, ее преципитации, формированию и росту новых камней, что приводит к рецидиву холелитиаза. Остаточные камни после первичной холе-дохолитотомии в среднем бывают у 10% больных, а это означает, что большинство из них нуждается в повторных операциях. Летальность возрастает с каждой последующей операцией.
Хотя существуют специальные методы исследования желчного дерева, большинство хирургов в основном пользуются только отдельными методами определения камней общего желчного протока — пальпацией холедоха, холангиографией, холедохо-томией и холедохоскопией, ни один из них не является абсолютно точным.
Мы разделяем мнение исследователей, считающих, что при множественных камнях холедоха и его надампулярного отдела, а также сомнительной проходимости сфинктера методом выбора является трансдуоденальная сфинктеропластика и удаление камней снизу. Этим путем камни могут быть легко обнаружены, захвачены инструментом или вымыты под давлением. В холедохотомии и наружном дренаже холедоха нет необходимости, а удаление камней трансдуоденальным путем после сфин-ктеропластики происходит легче и является более полным, чем при холедохотомии. Если не все камни удалены, широкое холедоходуоденальное отверстие позволит им свободно и безболезненно мигрировать в кишку. Даже легкая степень стеноза сфинктера сопутствующего холедохолитиа-зу, является показанием к сфинктеропластике, потому что он может быть
причиной повторного формирования камней.
Трудную проблему составляет лечение внутрипеченочного холангио-литиаза. Камни могут быть просмотрены или оказаться технически недоступными для удаления при помощи инструментов и промывания. Такие камни позднее смещаются в общий желчный проток, собираются в ампулярном отделе и вызывают закупорку (Jones, 1969; Dorobisz и соавт., 1972). Поэтому вполне логично производить сфинктеропла-стику как профилактическую операцию при неудаленных внутрипеченоч-ных камнях. Это обеспечивает свободное прохождение камней вместе с желчью в просвет двенадцатиперстной кишки.
Большинство исследователей пропагандируют трансдуоденальную сфинктеропластику при наличии в холедохе желчного песка и замазко-образной массы, которые являются признаком ампулярного стеноза, а также во время любой повторной операции по поводу остаточных или рецидивных камней.
Мы отказались от супрадуоденаль-ной холедоходуодепостомии для профилактики остаточных и рецидивных камней — они могут скапливаться в ретродуоденальном отделе ниже анастомоза и вызывать боль, воспаление и закупорку вирсунгова протока с ретенционным панкреатитом. Кроме того, камни в этом месте могут быть причиной опасных аррозивных кровотечений (Taubert, 1965). Камни так называемого слепого мешка и симптомы хронического панкреатита после холедоходуоденостомий являются показанием к повторной операции — трансдуоденальной сфин-ктеропластике с устранением хо-ледоходуоденального анастомоза.
При нечеткой картине во время операционной холангиографии лучше производить трансдуоденальную сфинктеропластику, чем накладывать анастомоз между холедохом и двенадцатиперстной кишкой или же дре-
нировать холедох наружу. Дополнительным показанием к сфинктеро-пластике является холангит с признаками стаза желчи.
Очень существенное показание к трансдуоденальному вмешательству составляет сложность в исследовании общего желчного протока путем обычной супрадуоденальной холедохотомии. Такие трудности встречаются при обширных воспалительных изменениях, а особенно при повторных хирургических вмешательствах, когда общий желчный проток резко деформирован и буквально замурован в мощных рубцовых напластованиях. Мы неоднократно сталкивались с такими случаями и поэтому трансдуоденальная ревизия хо-ледоха и пластика сфинктера легче, менее опасна и более эффективна, чем любые супрадуоденальные манипуляции на уже изуродованном протоке.
Панкреатит. Из триады взаимодействующих факторов этиологии и патогенеза острого и хронического панкреатита — временного уменьшения кровотока в железе, ее секреторного возбуждения и затрудненного оттока панкреатического секрета— главное значение у болынинства больных имеет затруднение оттока панкреатической жидкости.Провоцирующим фактором является рефлюкс желчи в вирсунгов проток.
Мы придерживаемся того мнения, что спазм и органический стеноз сфинктера Одди являются наиболее важным фактором в происхождении панкреатита. Довольно характерно для него рецидивирующее течение, хотя не менее часто встречается хронический панкреатит с постоянно длящимися симптомами. Обычно обнаруживаются поражения, вовлекающие всю железу целиком. Эти поражения колеблются от острого отека до диффузного фиброза (иногда с кальцификацией), панкреонекроза или псевдокисты.
От ретенционных панкреатитов, вызванных стенозом сфинктера Og-
ди, следует отличать 2 другие его разновидности, хирургическое лечение которых требует иного подхода. Первая — это холецистопанкреатит, сочетающийся с камнями желчного пузыря, без поражения сфинктера Одди, и обусловлен лимфогенным распространением воспалительного процесса. Этот вид панкреатита вовлекает только головку поджелудочной железы и регрессирует после холецистэктомии и санации желчных путей. Вторая разновидность — первичный (идиопатический или автономный) панкреатит. Он вызван в основном нарушениями метаболизма и развивается чаще всего у алкоголиков. Такой панкреатит характеризуется диффузным или очаговым поражением железы, которое не является результатом непроходимости устья вирсунгова протока и нередко ограничивается только левой частью тела и хвостом поджелудочной железы. Здесь мы касаемся только панкреатита, являющегося вторичным по отношению к поражениям сфинктера Одди и устья панкреатического протока. При этом обнаруживаются два типа поражений сфинктера. Первый тип — стеноз общего сфинктера ампулы и собственного сфинктера холе-доха. В таких случаях при сфинкте-ропластике устье вирсунгова протока является свободным и широко зияющим, то есть оно было лишь сдавлено в рубцовом кольце общего сфинктера, но само по себе не стенозирова-но. Это означает, что панкреатит был вызван билиопанкреатическим рефлюксом и гипертензией в панкреатических протоках, возникающих во время приступов желчной гипертен-зии. Второй тип — истинный стеноз отверстия вирсунгова протока. Чаще всего он сочетается со стенозом остальных отделов сфинктера, но изредка бывает изолированным. В таком случае панкреатит является скорее результатом препятствия, мешающего свободному оттоку из активно секретирующей поджелудочной железы.
В первом случае для устранения препятствия к оттоку панкреатического секрета достаточно произвести сфинктеропластику, во втором — она дополняется сфинктеропласти-кой вирсунгова протока. Эта операция устраняет все боли билиарного и панкреатического происхождения (В. И. Петров, 1964; Д. Г. Мамам-тавришвили, 1970; Hess, 1968; Jones и соавт., 1969, и др.).
Нарушение внешней секреции поджелудочной железы и панкреатит могут быть вызваны не только стенозом сфинктера, но и камнями терминального сегмента холедоха. В литературе есть сообщения (П. В. Кравченко и В. Е. Волков, 1962; Hollen-der, 1971) о применении трансдуоденальной сфинктеропластики в неотложном лечении острого панкреатита особенно при вколоченных камнях соска. Мы сами иногда применяли сфинктеропластику в неотложной хирургии.
В некоторых случаях панкреатита, сопровождающегося тубулярным стенозом интрапанкреатической части холедоха и резким расширением и утолщением стенок протока выше места сужения, полноценным мероприятием является сочетание трансдуоденальной сфинктеропластики с холедоходуоденостомией. Первая разгружает протоковую систему поджелудочной железы, в то время как вторая эффективно дренирует желчные пути. О целесообразности такого сочетания сообщали А. Мацковский (1966), de Rosa (1964), Sciacca (1964), Arianoff (1965), Nicora (1967). Hess (1968) комбинировал эти операции при панкреатите с тубулярным стенозом и в тех случаях, когда еще не наступила желтуха, чтобы разорвать порочный круг «стеноз сфинктера Одди — панкреатит — тубулярный стеноз холедоха».
Следует отметить, что хронический панкреатит и стеноз сфинктера Одди довольно трудно разграничить вследствие большой анатомической и функциональной близости сфинктера
и железы. Вовлечение в патологический процесс поджелудочной железы предусматривает более широкую, тотальную сфинктеропластику, иногда со сфинктеропластикой вирсунгова протока или холедоходуоденостомией.
Прочие показания. Доброкачественные и подозрение на злокачественные опухоли большого дуоденального соска в начальной стадии являются показаниями к трансдуоденальной сфинктеротомии со взятием фрагментов сосочка для биопсии. Шаблонное наложение желчно-кишечных анастомозов при опухолях несет в себе опасность — нераспознание опухолей, которые могли бы быть радикально излечены и признание за опухоль доброкачественных стенозов и камней сосочка.
Walters (1960) и Sciacca (1964) считают показанной трансдуоденальную сфинктеротомшо при дискинезии сфинктера Одди. А. В. Смирнов с соавторами (1972), напротив, считает ошибкой применение этой операции при дискинезиях.
Понятие «дискинезия» является слишком туманным, чтобы выражать какую-то клиническую сущность. Но если под этим термином понимать функциональные расстройства, расстройства мышечного аппарата холе-доходуоденального соединения, то применение трансдуоденальной сфин-ктеропластики после холецистэк-томии, по нашему мнению, может быть оправдано.
Если же говорить о стойком спазме сфинктера, то применение сфинк-теропластики не должно вызывать возражений, хотя некоторой (и весьма спорной) может быть так называемая печеночная ваготомия или холедохальная денервация (Reich, 1940; Iliescu, 1967; Shein и Bene-venato, 1969; Barrantes, 1970). Как показали наши клинические исследования, полное прерывание иннервации сфинктера Одди является технически сложным и его эффект бывает временным, очевидно, вследст-ствие регенерации нервов.
Droin и Dopoto (цит. по Н. В. Волковой, 1969) являются сторонниками систематической сфинктеротомии и рекомендуют делать ее после каждой холецистэктомии. Профилактическая сфинктеротомия, по их мнению, предупредит развитие перемежающейся или длительной окклюзии вирсунгова протока из-за повышения давления в холедохе после потери желчного пузыря с его функцией предохранительного клапана. Это мнение мы не разделяем.
Осложненная гидатидная киста печени у отдельных больных также может быть показанием к трансдуоденальной сфинктеропластике (Коu-rias и соавт., 1969). Осложнениями, при которых показана эта операция, являются прорыв кисты в крупные желчные ходы и стойкий послеоперационный желчный свищ.
В одном случае мы с успехом применили трансдуоденальную сфинктеропластику для лечения желчно-бронхиального свища, сформировавшегося вследствие холедохолитиаза и панкреонекроза с перитонитом.
Противопоказания. Абсолютные противопоказания к трансдуоденальной сфинктеропластике встречаются крайне редко. К ним относятся резко выраженные дуоденостазы и, возможно, деструктивные формы острого панкреатита. Скорее можно говорить о состояниях, при которых эта операция не рекомендована или невыполнима.
Мы не рекомендуем сфинктеропластику при первичной операции, когда имеется один или несколько крупных камней общего желчного протока, чистая желчь, абсолютно свободная проходимость сфинктера Одди и отсутствии вторичного поражения поджелудочной железы. В подобных случаях методом выбора является продольная холедохолитото-мия.
При фиброзе головки поджелудочной железы с тубулярным стенозом нижнего отдела холедоха трансдуоденальная сфинктеропластика не
в состоянии обеспечить надежное дренирование желчи, если стеноз распространяется более чем на 2,5 см от отверстия большого дуоденального соска, так как рассечение всего суженного участка оказывается невозможным (см. рис. 23д). В таких случаях мы рекомендовали наложение обходного холедоходуоденаль-ного анастомоза. Обходное анасто-мозирование является более предпочтительным и при атонии холедоха с его резкой дилатацией (более 2,5 см в диаметре). Если при этом существуют показания и со стороны поджелудочной железы, то, как указано выше, холедоходуоденостомию следует сочетать с трансдуоденальной сфинктеропластикой для разгрузки панкреатических протоков. Если имеется стенозирование вирсунгова протока, то его пластика также становится сложной и опасной, когда суженный участок занимает более 1,5—2 см от устья этого протока. Тогда показана латеральная или каудальная панкреатоеюно-стомия.
Не показана сфинктеропластика и при множественных стриктурах панкреатического протока.
Относительными противопоказаниями для трансдуоденальной сфинк-теропластики являются тяжелые случаи дискинезии, грубые воспалительные изменения стенки двенадцатиперстной кишки, создающие опасность возникновения дуоденального свища после дуоденотомии, преклонный возраст и тяжелое состояние больного.
Как видно, противопоказания не очень четко определены в настоящее время.
В заключение необходимо подчеркнуть, что трансдуоденальную сфинктеропластику может выполнить хирург, достаточно осведомленный в анатомии и физиологии желчных путей и поджелудочной железы, специально подготовленный и обладающий хорошей оперативной техникой.
ТЕХНИКА ТРАНСДУОДЕНАЛЬНОЙ
СФИНКТЕРОТОМИИ И СФИНКТЕРОПЛАСТИКИ
Предложено четыре основных способа сфинктеротомии: транехоледо-хальная; ретродуоденальная; изолированным трансдуоденальным путем; комбинированным, транехоледохаль-ным и трансдуоденальным путем.
Первые 2 способа не получили широкого распространения из-за их недостатков, и поэтому на них мы не будем останавливаться. Большинство хирургов применяют открытое трансдуоденальное рассечение сфинктера Одди, иногда с треугольной его резекцией, с последующим шовным соединением слизистых оболочек двенадцатиперстной кишки и общего желчного протока или без него.
Изолированная трансдуоденальная сфинктеротомия. После дуоденотомии осторожно расправляют складки слизистой оболочки на задней стенке двенадцатиперстной кишки и отыскивают большой дуоденальный сосок. Желчь, выходя из отверстия, указывает место его нахождения. Обнаружение сосочка может быть облегчено посредством инъекции раствора метиленовой синьки в культю пузырного протока или хо-ледох.
Заднюю стенку двенадцатиперстной кишки вблизи от сосочка захватывают 2 зажимами или нитями-держалками и подтягивают к разрезу передней дуоденальной стенки. Отверстие сосочка и его ампулу расширяют тонким пуговчатым зондом, а затем дилататором Bokes или расширителями Гегара, после чего желобоватый зонд вводят через папиллу в терминальный сегмент холедоха. Желобоватый зонд ротируют лате-рально и по желобу вводят скальпель с острым лезвием, направленным вверх. Проталкивая скальпель по желобку, производят рассечение сфинктера необходимой длины в положении стрелки на 10—11 часов (рис. 24). Вместо скальпеля можно
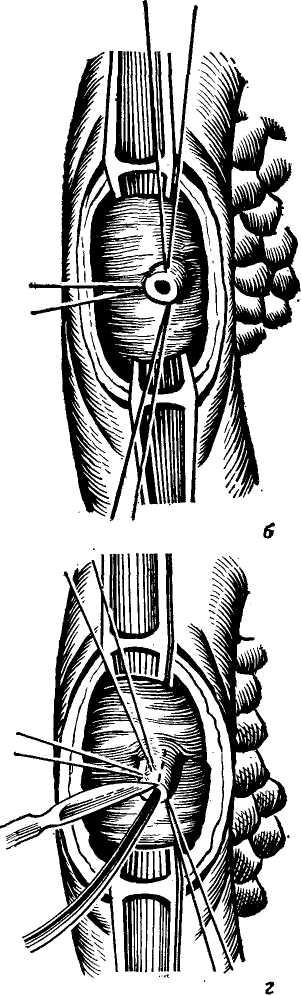
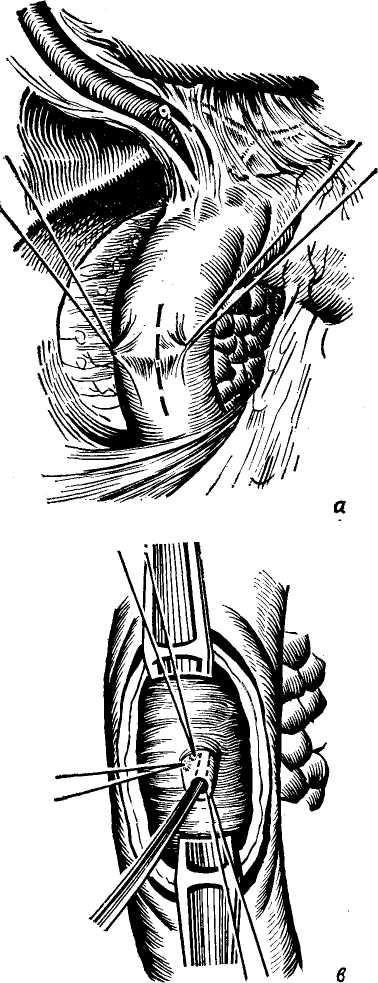
зонду.
использовать тонкие остроконечные ножницы. Roux (1954) использовал специальный инструмент, позволяющий сделать сфинктеротомию и одновременно иссечь треугольный ку-
сочек сфинктера для гистологического исследования (рис. 25).
Практические затруднения при сфинктеротомии изолированным
трансдуоденальным путем состоят в
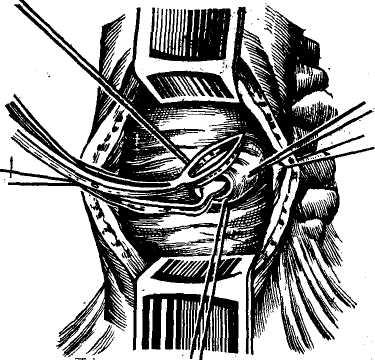
 Рис.
24. (продолжение)
Рис.
24. (продолжение)
том, что иногда трудно найти сосочек. Кроме того, ретроградное зондирование холедоха угрожает травмированием вирсунгова протока и образованием ложных ходов.
По нашему мнению и большинства других специалистов, изолированный ретроградный подход к большому дуоденальному соску следует применять только как последний из возможных методов. Методом выбора он может быть лишь при ущемленных камнях сосочка в случаях повторных операций, так как найти сосочек в таких случаях нетрудно.
Комбинированная трансдуоденальная сфинктеротомия — наиболее часто используемый метод. Он позволяет легко обнаружить область сфинктера Одди и безопасно провести сфинктеротомию. При этом методе необходимо сочетать супрадуоде-нальную холедохотомию и дуоденото-мию. Посредством холедохотомии вводят какой-нибудь полугибкий инструмент (зонд, расширитель, катетер и др.), который проталкивают книзу до тех пор, пока он не пройдет область сосочка. Проникая в двенадцатиперстную кишку, инструмент приподнимает изнутри ее переднюю стенку и таким образом точно

указывает, где следует произвести вскрытие кишки. Дуоденотомия может быть сделана минимальной.
Кохер применял сфинктеротомию при камнях большого дуоденального соска под названием «трансдуоденальная холедохотомия» и «трансдуоденальная, или внутренняя холе-доходуоденостомия». По существу, эти операции соответствуют сфинкте-ротомии и сфинктеропластике.
Рис. 25. Сфинктеротомия по Roux.
Кохер рекомендовал мобилизовать двенадцатиперстную кишку по
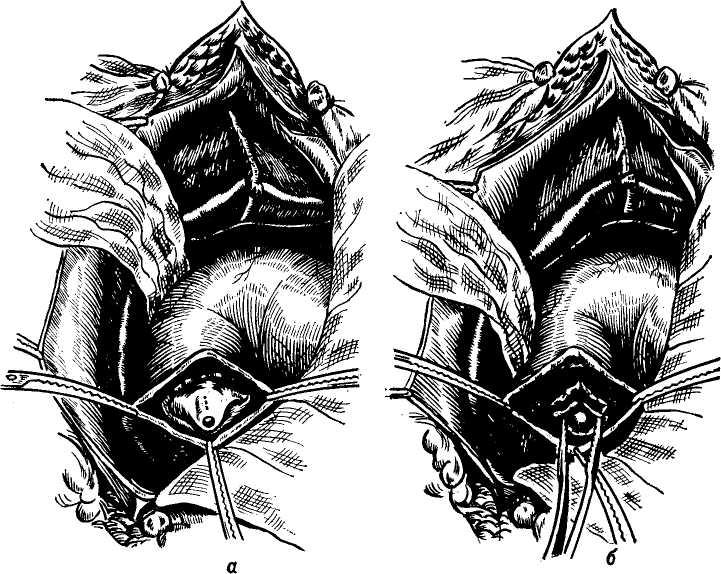
а — поперечная дуоденотомия над камнем, ущемленном в большом дуоденальном соске; б — па-
пиллотомия и удаление камня.
описанному им способу, чтобы подведенным под нее средним пальцем левой руки поднять кверху область сосочка вместе с камнем, в то время как указательный и большой пальцы сверху и снизу удерживают кишку и фиксируют камень. Переднюю стенку двенадцатиперстной кишки вскрывают над камнем (рис. 26а), слизистую оболочку задней дуоденальной стенки рядом с камнем захватывают 2 зажимами, так как после удаления камня разрез общего желчного протока может исчезнуть в глубине. Разрез папиллы проводят на камне, начиная от отверстия сосочка. Оба края разреза прошивают 2 кетгуто-выми нитями и разводят в стороны (рис. 266). После удаления камня и ревизии желчных путей накладывают отдельные кетгутовые швы на слизистые оболочки протока и кишки, включая и края рассеченной ампулы.
Кохер полагал, что отказываться от этого заключительного шва опасно, так как могут образоваться отверстия, пропускающие желчь и кишечное содержимое в брюшную полость.; Наложение шва, по мнению автора, останавливает кровотечение. Кохер; считал также целесообразным при этой операции применять дренаж холедоха через его разрез в супра-дуоденальной части.
В случаях, когда камень прощупывается со стороны двенадцатиперстной кишки, но находится на расстоянии более 10 мм от отверстия сосочка, Кохер предложил так называемую внутреннюю супрапапилляр-ную холедоходуоденостомию. Эта операция, в сущности, является только модификацией вышеописанной. Модификация состоит в том, что заднюю стенку двенадцатиперстной кипи» и переднюю стенку общего желчного:
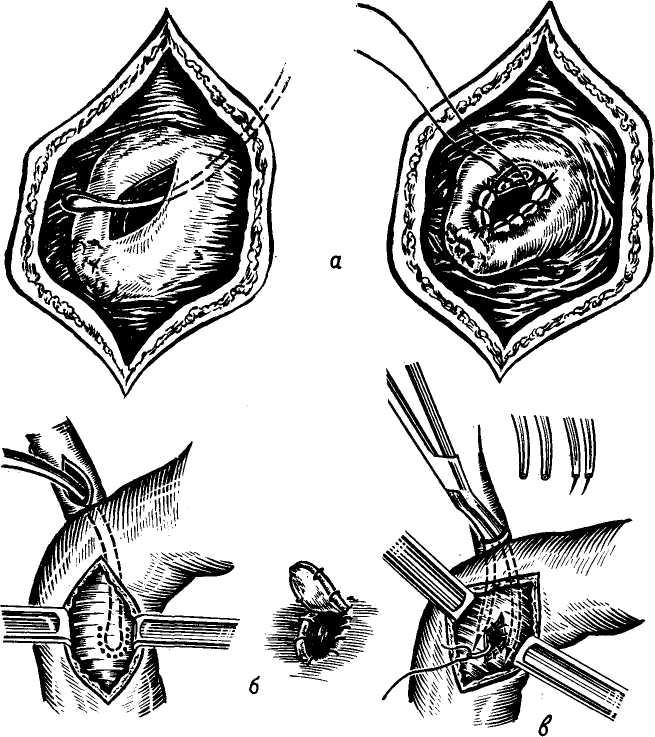
а — внутренняя супрапапиллярная холедоходуоденостомия по Кохеру; б — трансдуоденальная холедоходуоденостомия в модификации Moszkowiez; в — трансдуоденальная холедоходуоденостомия в
модификации Mirizzi.
протока рассекают на пальпируемом камне таким образом, что разрез начинается не от отверстия большого дуоденального сосочка, а отступя от него несколько кверху. Обычно при этом бывает значительное кровотечение. Поэтому после удаления камня слизистую оболочку двенадцатиперстной кишки сшивают 4 или 5 швами со стенкой холедоха (рис. 27а). Швы накладывают тонким кетгутом, захватывая по возможности меньше ткани, чтобы не повредить проток поджелудочной железы (что представляет большую опасность в данной операции).
Новые модификации этой операции предложили Moszkowiez (1972; рис. 276), Mirizzi (1955, 1957; рис. 27в), В. Е. Смирнов (1971). Однако они не получили широкого распространения.
К настоящему времени предложено много модификаций комбинированной сфинктеротомии и сфинктеропла-стики, но при описании их необходимо условно различать 2 возможностиз непроходимость большого дуоденального соска; проходимость большого дуоденального соска.
Непроходимость большого дуоденального соска. Стенозированный
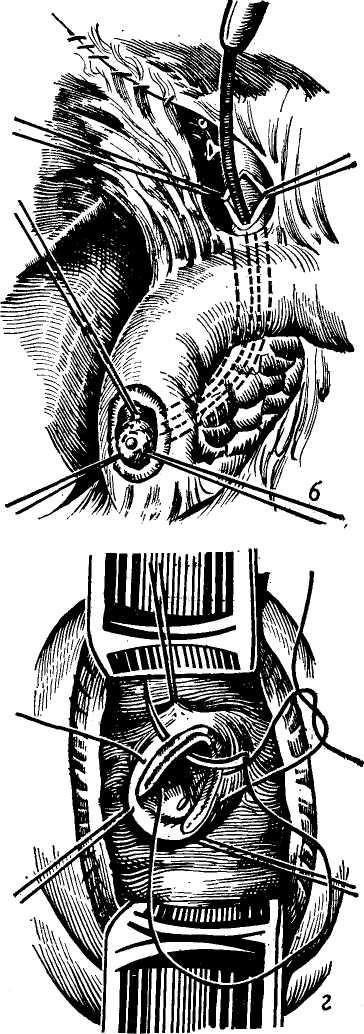
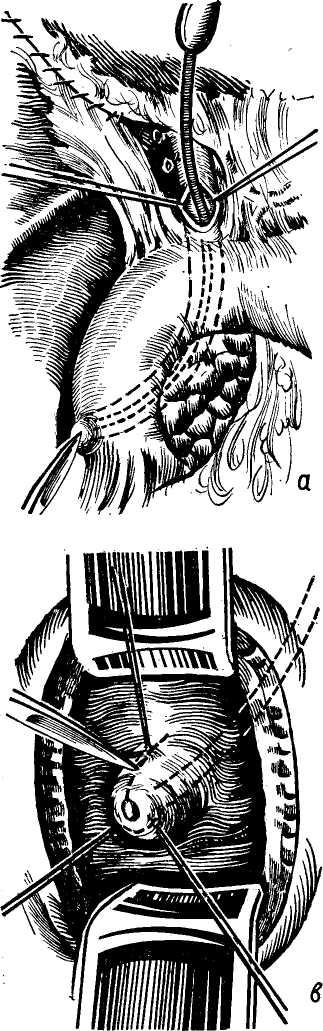
большого дуоденального соска.
сфинктер Одди настолько сужен, что пуговчатый зонд, введенный путем холедохотомии или через культю пузырного протока, не может пройти через сосочек: он отталкивает его, выпячивая переднюю стенку двенадцатиперстной кишки. Как раз в этом месте и производят небольшую дуоде-нотомию (рис. 28а). Затем находят отверстие сосочка на верхушке инструмента, вокруг которого накладывают 3 нити держалки (рис. 286). С помощью острого скальпеля делают сфинктеротомию (рис. 28в) и, если сочтут необходимым, сфинктеропла-стику (рис. 28г).
Проходимость большого дуоденального соска. Стенозированный сфинктер удается пройти пуговчатым зондом сверху. Для сфинктерото-мии в таких случаях используют несколько способов подтягивания сосочка из глубины в разрез передней дуоденальпой стенки.
Способ Ivasala—Soler—Roig. При этом используют гибкий металлический зонд длиной около 15 см. Один его конец слегка расширен в виде пуговки, а на другой можно навинтить металлический конус (они трех разных размеров). Подходящий конус выбирается соответственно калибру холедоха. На них сделаны продольные желобки длиной 1 см, облегчающие рассечение сфинктера.
После холедохотомии пуговчатый конец зонда проталкивают через сосочек и захватывают со стороны двенадцатиперстной кишки. На верхний конец зонда навинчивают один из трех металлических конусов, который еще может войти в просвет общего желчного протока (рис. 29а). Затем зонд протягивают книзу, пока металлический конус не достигнет зоны сфинктера Одди. После этого дальнейшее потягивание зонда позволяет хорошо вывести сосочек в дуоденальное отверстие (см. рис. 296). Желобок металлического конуса поворачивают так, чтобы он был обращен стрелкой на 11 часов. Скальпелем рассекают сфинктер на конусе
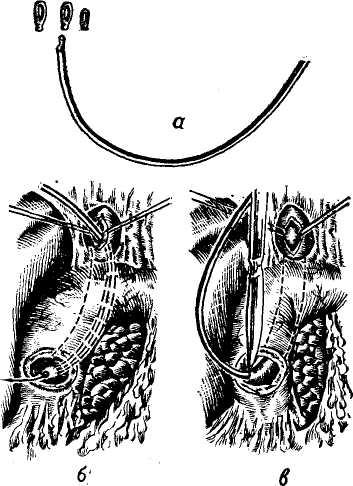
Рис. 29. Трансдуоденальная сфинктерото-мия по Ivasala—Soler—Roig.
по ходу его желобка (рис. 29е). Сфинктеротомия считается достаточной, если металлический конус проскакивает через рассеченный сосочек в двенадцатиперстную кишку. Если необходимо, накладывают шов слизистой оболочки холедоха с дуоденальной слизистой.
Способ Нерр. Инструмент, применяемый при этом способе, состоит из 2 элементов — тонкого гибкого проводника длиной 15 см с утолщениями на обоих концах и зонда Donat № 14, 16 или 18. Верхушка последнего срезана и заменена металлической оливой с гнездом для стыковки с проводником Nelaton, а противоположный конец конусовидно расширен.
После мобилизации двенадцатиперстной кишки и головки поджелудочной железы по Кохеру через холе-дохотомическое отверстие проводник вводят в двенадцатиперстную кишку и над ним делают небольшую дуоде-нотомию (рис. ЗОа, б). Верхнее утолщение проводника сочленяется с металлической оливой зонда. Проводник протягивается книзу и увлекает
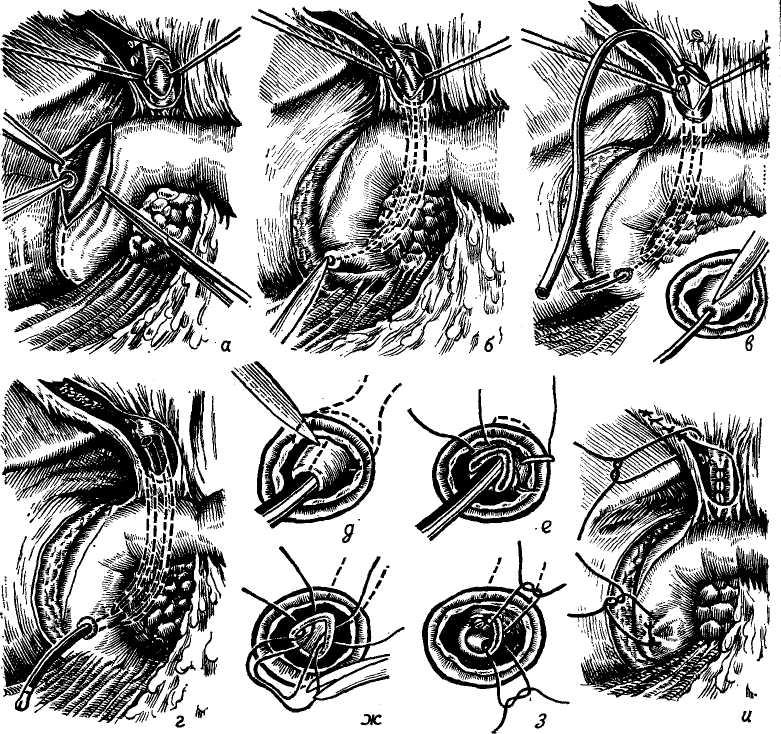
за собой зонд. Если металлический конец зонда не может пройти через большой дуоденальный сосок, то делают короткий разрез, начиная сфинктеротомию (рис. ЗОв), и устраняют препятствие. После этого зонд извлекают книзу (рис. ЗОг), пока расширенный конец его не вклинится в узкое место сфинктера (рис. 30д). Затем делают более широкую сфинктеротомию на конусовидном расширении зонда и при завершении операции сфинктеропластикой, края разреза прошивают, прокалывая насквозь также и стенки конусовидной части зонда (рис. ЗОе). Зонд вытягивают через разрез двенадца-
типерстной кишки, после чего перерезают нити и завязывают швы (рис. ЗОж, з).
Способ Berbarelli. Предназначенный для защиты вирсунгова протока от случайного повреждения во время сфинктеротомии, этот способ предусматривает проведение длинного резинового зонда путем короткой холедохотомии. Он проходит через сосочек и небольшую дуоденото-мию (рис. 31). Разрез сосочка и сфинктера делают на зонде. Тракция за оба конца его позволяет хорошо раскрыть ампулу и облегчает обнаружение отверстия вирсунгова протока.
Способ de Rosende Alves. После холецистэктомии пузырный проток интубируют для манометрии и хо-лангиографии (рис. 32а). Металлический зонд диаметром 2 мм проводят путем холедохотомии через сосочек и над его верхушкой производят дуоденотомию. К кончику зонда привязывают тонкую нить (рис. 336), один конец которой протягивают через сосочек в общий желчный проток и разрез холедоха. Затем к этой нити вместо металлического зонда привязывают зонд Nelaton № 18 (рис. 32в). Протягиванием нити книзу его низводят через холедох, и верхушка его выпячивает большой дуоденальный сосок (рис. 32г). Сосочек и сфинктер рассекают скальпелем так, чтобы зонд можно было свободно извлечь протягиванием книзу (рис. 329, е., ж). После ушивания двенадцатиперстной кишки и холедоха проводят контрольную манометрию и холангиографию через трубку в пузырном протоке (рис. 32з).
Способ Rives—Stoppa. При этом способе сфинктеротомию осуществляют на урологическом резиновом зон-
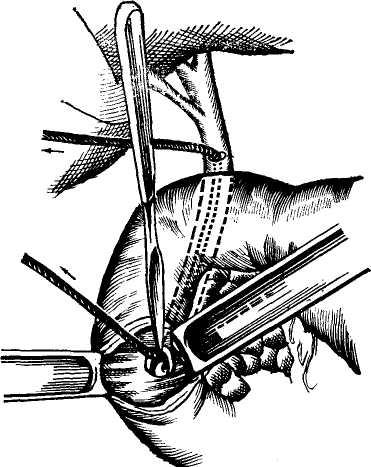
Рис. 31. Трансдуоденальная сфинктеропластика по Berbarelli.
де с помощью электроножа. Зонд вводят через пузырный проток, и поэтому отпадает необходимость вскрывать холедох. Применение электроножа выгодно тем, что обеспечи-
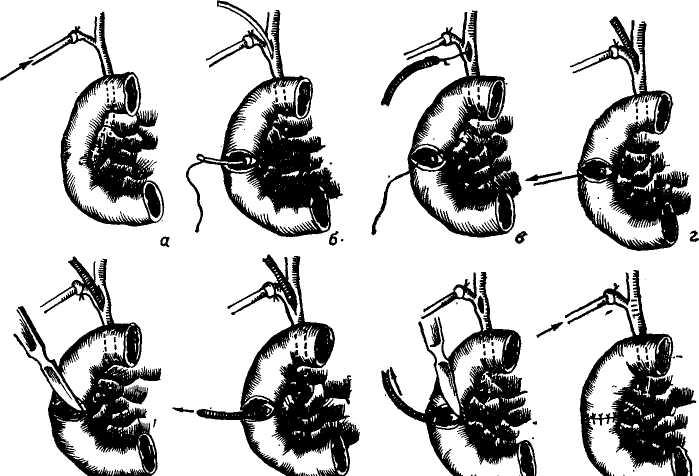
Рис. 32. «Калиброванная» трансдуоденальная сфинктеропластика по de Rosende Alves.
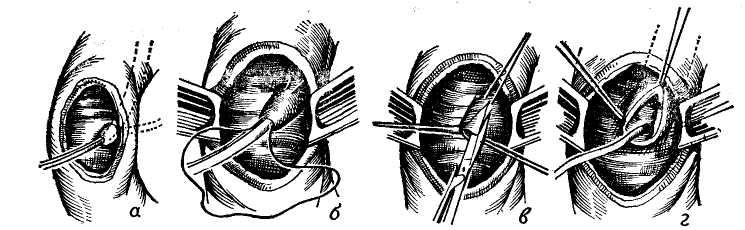
вает надежную остановку кровотечения и вызывает активное сокращение еще нерассеченных мышечных волокон, таким образом способствуя полноте сфинктеротомии.
Аналогичный способ, но с использованием холедохотомии, описал Tanberg в 1965 г.
Тотальная сфинктеропластика по Gionard — Pelissier. По мнению этих авторов, сфинктеротомия должна быть тотальной, шовное соединение слизистых оболочек является обязательным и, по возможности, всегда следует избегать холедохотомии. Применяют продольную дуоде-нотомию после мобилизации двенадцатиперстной кишки по Кохеру.
Точные границы дуоденотомиче-ской зоны определяют при помощи пальпации упругого резинового бужа диаметром 2 мм, введенного через пузырный проток. Манипулирование бужом помогает обнаружить сосочек.
Резиновый буж постепенно удаляют, а вместо него со стороны двенадцатиперстной кишки вводят тонкий желобоватый зонд, который проходит сосочек, а затем стенозирован-ный сфинктер Одди, и проникает в общий желчный проток (рис. 33а). Это легко осуществимо, даже когда сфинктер Одди резко склерозирован. Однако существует одна опасность: зонд может попасть в вирсунгов проток. Чтобы избежать этого, следует пальпировать общий желчный проток, чтобы увериться, что зонд прошел в него.
Желобок зонда позволяет провести тонкую нить с иглами на обоих концах ее до точки, где желают ограничить сфинктеротомию, то есть по крайней мере на расстояние 15 мм от отверстия сосочка (рис. 336). Натяжение этой нити показывает верхнюю границу сфинктеротомии.
Сосочек у края его отверстия прошивают 2 диаметрально противоположными нитями. Будучи натянутыми, эти нити вместе с предыдущей ограничивают треугольник, который необходимо резецировать (рис. ЗЗв). Резекцию треугольника осуществляют с помощью тонких изогнутых под углом ножниц. Если необходимо, разрез у верхушки резекции может быть продолжен для уверенности, что отток из общего желчного протока будет совершенно свободным.
Всегда отыскивают отверстие вир-сунгова протока и катетеризуют с помощью тонкой полиэтиленовой трубки, чтобы не повредить его во время слизисто-слизистого шва (рис. ЗЗг),
Нити, ограничивающие треугольник, растягивают в разные стороны, и дуоденальную слизистую оболочку тщательно сшивают со слизистой оболочкой холедоха при помощи 8—10 стежков из кетгута № 00. Предварительная катетеризация вирсунгова протока гарантирует его от сужения одним из стежков шва.
После сфинктеропластики с помощью корнцанга или ложек удаляют имеющиеся в холедохе камни. Дуоде-нотомическое отверстие закрывается 2 рядами швов.
Сфинктеропластика по Toupet. Путем холедохотомии вводят инструмент Нерр и после минимальной дуоденотомии обнажают и извлекают сосочек. Его захватывают нитями-держалками и инструмент Нерр удаляют (рис. 34). Затем в сосочек вводят нижнюю браншу специального зажима, который закрывают таким образом, чтобы он захватил верхнюю губу сосочка и сфинктерный сегмент холедоха на протяжении не менее 1 см. Особенностью этого зажима является то, что на нижней бранше его прикреплена удлиненная дуга высотой 2 мм, имеющая форму трапеции и образующая вместе с нижней бран-шей удлиненное кольцо. Производя тракцию зажимом, сосочек выводят в разрез двенадцатиперстной кишки. После этого можно легко и просто провести 3 тонкие нити, последова-
тельно проходящие снаружи внутрь, а затем изнутри наружу через стенку двенадцатиперстной кишки и стенку холедоха или общего канала. Эти нити проходят через кольцо нижней бранши зажима, который, кроме того, имеет преимущество в том, что оттесняет нижнюю губу сосочка и предохраняет вирсунгов проток от захватывания в швы.
Зажим снимают и оттягивают, увлекая 3 петли нитей. Сосочек рассекают на том месте, где был наложен зажим. Петли 3 нитей перерезают вблизи от зажима и затем завязывают каждую нить в отдельности, заканчивая сфинктеропластику.
Сфинктеропластика по Salembier. Используемый при этом способе инструмент очень гибкий и свободно, без травмы может следовать по изгибам общего желчного протока (рис.
Рис. 35. Трансдуоденальная сфинктеропластика по Salembier.
35). Предназначенный для введения посредством холедохотомии, он имеет длину 26 см (без рукоятки) и применяется при относительно больших размерах холедоха. Дистальная часть инструмента представляет собой простой гибкий зонд с тупым концом длиной 8 см и диаметром 2 мм, позволяющий пройти даже стенози-рованный сосочек. Определяют положение последнего и вскрывают двенадцатиперстную кишку над выпуклостью, обусловленной прохождением этого зонда. Затем инструмент вводят в холедох. Дистальная часть его представляет собой упор диаметром 5 мм, который задерживается в сфинктерном сегменте. Благодаря этому, при нажатии на инструмент сосочек выдвигается вперед настоль-
ко, что половина его выступает в двенадцатиперстную кишку. Это выгодно тем, что упрощает технику, и, в принципе, соответствует способу Нерр.
После описанного расширения диаметр инструмента слегка убывает на протяжении 3 см и затем следует гибкий ствол рукоятки, который служит как проводник. В расширенной средней части инструмента есть прорезь, позволяющая легко провести 2—4 нити, которые автоматически проходят все слои стенки двенадцатиперстной кишки и холедоха с 2 сторон.
Сосочек рассекают на платиновой пластинке, расположенной над прорезью. Среднюю часть инструмента удаляют, увлекая за ней петли нитей.
Последние перерезают и отгибают в стороны, используя их для шва между слизистыми оболочками двенадцатиперстной кишки и холедоха, следуя точно тем же принципам, на которых основано использование зажима Toupet. Кроме надежного гемостаза, этот способ позволяет избежать захватывания вирсунгова протока в шов, так как основание инструмента служит и защитным устройством.
Сфинктеропластика по Jones. Согласно этому способу, сфинктеропластика будет достаточной только тогда, когда разрез сфинктера будет соответствовать индивидуальной протяженности интрамурального хода холедоха — вершина разреза должна быть вне дуоденальной стенки, а самое тщательное сшивание стенок кишки и холедоха поэтому является обязательным. У всех больных, когда это возможно, и в особенности при повторных операциях на желчных путях, операцию следует проводить трансдуоденально, во избежание холедохотомии. Если же имеются сомнения в отношении анатомического ориентира, указывающего локализацию папиллы, безопаснее вскрыть общий желчный проток выше двенадцатиперстной кишки и определить папиллу посредством щадящего инструментального исследования.
На переднебоковую стенку большого дуоденального соска и интра-муральной части холедоха накладывают 2 зажима, между которыми делают разрез или клиновидное иссечение сфинктера и накладывают швы (рис. 36). При наложении зажимов требуется большая осторожность, чтобы не взять по ошибке панкреатический проток вместо холедоха, а при наложении швов особое значение имеет верхушечный стежок, предупреждающий просачивание желчи и кишечного содержимого в ретродуо-денальное пространство.
Сфинктеропластика по Niedner. По этому способу папиллу при помощи нити-держалки вытягивают кпе-
Рис. 36. Трансдуоденальная сфинктеропластика пo Jones.
реди и затем удаляют весь интраму-ральный отдел ее наподобие обрезания при фимозе. Сначала производят разрез передней стенки сосочка, после чего пришивают дуоденальную слизистую оболочку к слизистой ампуле холедоха. Затем разрез переходит на заднюю стенку сосочка и снова соединяют швами разрезы слизистых оболочек. При этом образуется выворот устья холедоха (рис. 37). По сути эта операция представляет собой ограниченную папиллэктомию.
Аналогичный способ применяют Вгасео и Gatti (1967), a Dodgar— Dehkordie (1968) для восстановления свободного оттока через большой дуоденальный сосок иссекает участок слизистой оболочки его передней полуокружности в виде полулуния, с последующим перемещением в образованный дефект близлежащего участка слизистой оболочки двенадцатиперстной кишки.
Недостатком подобных методов является то, что они сложнее других способов, а главное не учитывается то, что стеноз не ограничивается ампулярной частью, а вовлекает всю мускулатуру сфинктера.
Сфинктеротомия по Mattioli. Это новый вариант внутренней папил-лосфинктеропластики по методу Bat-tezzatti: рассечение изнутри пе-редневерхней стенки подслизистой части интрадуоденального сегмента общего желчного протока с максимальным сохранением слизистой обо-
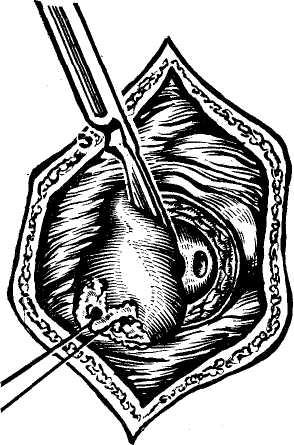
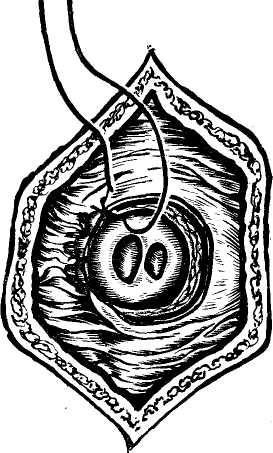
Рис. 37. Трансдуоденальная папиллэктомия по Niedner.
лочки двенадцатиперстной кишки. Вариант основан на том, что слизистая оболочка кишки, по мнению авторов, не вовлекается в воспалительный процесс и сильно кровоточит при рассечении. Изолированное рассечение сфинктера холедоха достигается проведением маленького скальпеля между зондом и стенкой сфинктера, а затем после захватывания краев разреза зажимами Алиса проверяют степень рассечения.
Рис. 38. Трансдуоденальная сфинктерото-мия по Reynolds—Balsano.
Сфинктеротомия по Reynolds— Balsano. Авторы использовали для сфинктеротомии начальные биотические щипцы Strounz 3 размеров. Метод применения инструмента показан на рис. 38.
Как видно из приведенных описаний, существует много различных вариантов сфинктеротомии и ее завершения — сфинктеропластики. Какой же технике операции следует отдать предпочтение? Чтобы ответить на этот вопрос, обсудим последовательно и в деталях несколько важных пунктов этой проблемы.
Обнажение большого дуоденального соска. Уже было указано, что прежде всего необходима широкая мобилизация двенадцатиперстной кишки и головки поджелудочной железы по Кохеру и обнажение передней дуоденальной стенки поближе к ее нижнему изгибу. Такая мобилизация облегчает операцию и в особенности последующее наложение швов на двенадцатиперстную кишку.
В некоторых случаях при повторных вмешательствах, когда после разъединения спаек нисходящая часть двенадцатиперстной кишки
оказывается деперитонизированной, может быть рекомендован подбрыже-ечный трансдуоденальный подход к большому дуоденальному соску. В таких случаях поперечно-ободочную кишку приподнимают кверху и дуо-денотомию производят в зоне здоровых тканей, непосредственно под корнем брыжейки поперечно-ободочной кишки в нижнем отделе нисходящей части двенадцатиперстной кишки, который чаще всего и бывает местом расположения соска.
Дуоденотомию всегда производят напротив соска. Поэтому прежде чем вскрыть двенадцатиперстную кишку, необходимо максимально уточнить, где он находится. В некоторых случаях его можно определить пальпацией. В особенности это легко удается при камне соска. Но даже если камня нет, сосок можно прощупывать иногда в виде маленькой зоны уплотнения. В других случаях место расположения соска может быть определено, по данным предварительной хо-лангиографии.
Некоторые авторы рекомендуют использовать анатомические ориентиры для отыскания соска. Так, Р. В. Кузнецов (1963, 1965) установил, что наиболее точным ориентиром является корень брыжейки поперечно-ободочной кишки, который пересекает нисходящую часть двенадцатиперстной кишки на 10—15 мм ниже уровня локализации соска. Именно здесь автор и рекомендует делать дуоденотомию. Это может быть использовано при чисто дуоденальном подходе к сосочку, но лучше всего искать его посредством зонда, введенного путем супрадуоденальной холедохотомии. Hess (1961) подчеркивает, что холедохотомию следует производить вблизи верхнего края двенадцатиперстной кишки, чтобы при необходимости можно было бы использовать ее для холедоходуодено-стомии.
При холецистэктомии и большой культе пузырного протока после прежней холецистэктомии нет необ-
ходимости вскрывать холедох, а зондирование сосочка производят через пузырный проток. Там, где это возможно, мы отказывались от холедохотомии, но иногда, при стенозах устья пузырного протока, делали так называемую цистикохоледохото-мию. Культю пузырного протока при этом рассекают вдоль по ее передней поверхности с продолжением разреза на переднюю поверхность общего желчного протока. При таком разрезе можно легко удалить свободные камни из желчных путей и провести зондирование протоков книзу и кверху к воротам печени. Если же оказывается необходимой холедохото-мия, то переднюю стенку холедоха прошивают 2 держалками, примерно в 3 мм друг от друга. Затем ассистент натягивает их, в то время как хирург делает маленький продольный разрез между держалками. Истекающую желчь и детрит (если он имеется) отсасывают, после чего протоки исследуют посредством зондов, ложек, дилататоров и т. д. Прочный гибкий зонд с диаметром пуговки в 3 мм пытаемся осторожно ввести вниз, в двенадцатиперстную кишку, контролируя продвижение зонда пальцами другой руки.
Зонд обычно легко проходит даже при стенозе сфинктера Одди, но если в этой зоне встречается значительное сопротивление, не следует применять насилия, так как возможно образование ложного хода. Когда инструмент минует сосок, его кончик оказывается непосредственно под передней стенкой двенадцатиперстной кишки и приподнимает ее в виде возвышения. Как раз в этом месте и следует делать дуоденотомиго.
Иногда трудно определить, прошел ли конец зонда в просвет двенадцатиперстной кишки или находится в ампуле сосочка. В последнем случае стенозированный сосочек можно вытолкнуть зондом в кишку так, что он приподнимает переднюю дуоденальную стенку. Тогда сосочек легко прощупывается и может
быть ошибочно принят за пуговчатый конец зонда. Чтобы избежать такой ошибки, следует иметь в виду, что пуговка зонда, растягивая участок передней дуоденальной стенки, истончает ее и благодаря этому дает характерный металлический блеск. Если такой блеск не определяется, то зонд не прошел через отверстие соска. В этом случае через дуоденальную стенку можно видеть слегка беловатое выпячивание соска, который отталкивается инструментом. Дуоденотомию в таких случаях производят напротив выпяченного сосочка.
Как делать дуоденотомию? Мс Burney (1891) и Kocher (1894) рекомендовали продольное вскрытие двенадцатиперстной кишки, в то время как Kher (1898) предпочитал поперечный разрез, полагая, что он менее кровоточив, потому что соответствует ходу сосудов, и более благоприятен для ушивания. С. П. Федоров, а затем В. В. Виноградов, Е. В. Смирнов, Р. В. Кузнецов, А. В. Вельский также считали поперечную дуоденотомию лучшим методом. Продольную дуоденотомию предпочитают Vosschulte (1961), Та-ubert (1965), Goinard — Pelissier (1967). Hess (1968) применяет как продольную, так и поперечную дуоденотомию, отдавая предпочтение последней. Maingot (1964) рекомендовал косую дуоденотомию.
К. Т. Овнатанян и В. В. Минин (1969), исходя из того, что дуодено-томия — «весьма существенная деталь оперативного лечения желчека-менной болезни», изучали вопрос, какой она должна быть. Они справедливо отметили, что поперечный разрез, при всех его преимуществах, все же имеет и недостатки — «место разреза часто трудно совместить с точным расположением фатерова сосочка». В подобных случаях иногда приходится прибегать к Т-образному продолжению разреза вверх или вниз. Последующее закрытие кишки в этих случаях неизбежно приводит
к деформации, а иногда и к стенози-рованию ее и при этом возникает значительно большая угроза развития дуоденального свища. Продольная же дуоденотомия, по данным авторов,, дает хорошее обнажение сосочка, но если разрез кишки приходится продлить вверх или вниз, то закрытие его в поперечном направлении сложно, а продольное ушивание неизбежно приводит к сужению-кишки. Поэтому К. Т. Овнатанян и В. В. Минин (1969) как и Maingot (1964), рекомендуют косую дуоденотомию. По их мнению, она дает широкое поле для обозрения слизистой оболочки задней дуоденальной стенки и выявления большого дуоденального соска. В то же время при ушивании этого разреза, как утверждают авторы, не возникает деформации и сужения просвета кишки.
Мы придерживались следующего мнения. При комбинированном подходе, когда большой дуоденальный сосок удается точно определить с помощью зонда, дуоденотомия должна быть минимальной по протяженности, а будет ли она поперечной, косой или продольной, не имеет существенного значения, так как небольшой разрез легко ушить, в каком бы направлении он ни проходил. Мы всегда делали продольную дуоденотомию в том месте, где конец зонда определялся через кишечную стенку.Предварительно по обеим сторонам предполагаемого разреза накладывали по одной держалке. Нижний конец разреза должен быть на некотором расстоянии от места прикрепления брыжейки поперечно-ободочной кишки — это облегчает последующее ушивание дуоде-нотомического отверстия.
Преимущество продольной дуоде-нотомии состоит в том, что при необходимости разрез может быть продлен до 2—3 см. Bartelett и Мс Dermot (1957), а затем и Hess (1961) применяли разрез длиной 4 см. Кишку не следует широко вскрывать в проксимальном направлении, так как сосочек чаще всего находится
ниже. Продольный разрез не вызывает кровотечения большего, чем поперечный. Кровоточащие сосуды тщательно перевязывают тонким кетгутом, дуоденальное содержимое ас-пирируют. Доступ к соску обеспечивают разведением краев разреза дуо-' денальной стенки с помощью 2 ре-тракторов Фарабефа, помещенных в верхний и нижний углы дуоденотоми-ческого отверстия. Кверху и книзу в просвет кишки могут быть введены марлевые тампоны, высушивающие операционное поле и закупоривающие приводящий и отводящий сегменты двенадцатиперстной кишки, предохраняя операционное поле от загрязнения желудочным и кишечным содержимым.
Пуговчатый зонд в сосочке позволяет легко обнаружить его после дуо-денотомии. Если же зонд не удалось заранее провести через сосочек, то отверстие его надо найти на верхушке инструмента. Под прямым визуальным контролем сосочек выталкивают с помощью зонда в разрез двенадцатиперстной кишки, и отверстие обнаруживают на нижнем склоне па-пиллы. Когда оно найдено, зонд под контролем зрения осторожно проталкивают через сосок в двенадцатиперстную кишку.
По обеим сторонам от соска накладывают нити-держалки на заднюю дуоденальную стенку, чтобы подтянуть ее и фиксировать у дуоде-нотомического отверстия. Нити должны пройти достаточно глубоко, чтобы захватить не только слизистую оболочку, но и мышечную оболочку кишки, иначе они легко прорезываются. Третью держалку накладывают на задненижнюю полуокружность (губу) большого дуоденального соска или, если это невозможно, под нею. Подтягиванием за нити-держалки область соска легко выводится в дуоденальное отверстие, после чего сосок становится хорошо доступным для любых операций на нем.
Поиски соска затруднены при изолированном трансдуоденальном под-
ходе. Особенно трудно обнаружить малоизмененный или нормальный сосок — он легко теряется в многочисленных складках дуоденальной слизистой оболочки. Может быть использована прямая пальпация через разрез двенадцатиперстной кишки, но она не всегда дает эффект. Принимаемое за сосок уплотнение может оказаться долькой поджелудочной железы. Осторожно манипулируя ретрак-торами Фарабефа, следует расправить складки слизистой оболочки, это облегчает поиски соска. Характерным ориентиром считают продольную слизистую складку, но ее не всегда удается видеть. Обнаружение соска может быть облегчено выдавливанием желчи из желчного пузыря или введением метиленовой синьки в холе-дох. Leger (1958) сформулировал следующее правило: большой дуоденальный сосок находится обычно всегда ниже того места, где его ищут.
После обнаружения соска, вокруг него накладывают 3 нити-держалки.
Сфинктеротомию мы осуществляли следующим образом. Пуговчатый конец зонда выводили в дуодено-томическое отверстие и к нему привязывали тонкую, но прочную нить из капрона. Эту нить захватывают зажимом с тонкими изогнутыми губками так, чтобы они были как бы продолжением хода нити (рис. 39). Затем, извлекая зонд, протягивают нить кверху, чтобы кончик зажима проник в отверстие большого дуоденального соска. При дальнейшем протягивании нити зажим проникает в ампулу соска, а затем в интраму-ральную часть холедоха, на глубину 2—2,5 см. Чтобы сосок вместе с задней дуоденальной стенкой при этом не уходил в глубину, ассистент фиксирует его с помощью держалок.
Затем зажим достаточно широко раскрывают в поперечном направлении, чтобы расширить отверстие соска и стенозированный сфинктер до состояния, позволяющего свободно
ввести лезвие тонких ножниц. Разрез сфинктера делают в правом верхнем квадрате, в направлении стрелок на 10—11 часов. Постепенно рассекая кольцо сфинктера изнутри кнаружи, одновременно раскрываем зажим. Когда сфинктерное кольцо полностью рассечено, зажим широко раскрывают, и тогда мы уверены, что сфинктеротомия сделана достаточно полно. Последовательное применение этого метода надежно защищает вирсунгов проток от случайного повреждения.
Рассечение сфинктера бескровно, но если из какого-то мелкого сосуда возникает кровотечение, его следует зажать тонким зажимом.
Окончательный гемостаз достигается наложением холедоходуоденального шва.
В тех случаях, когда провести пугов-чатый зонд в двенадцатиперстную кишку не удается, мы поступали следующим образом. Фиксируя область сосочка с помощью держалок, постепенно удаляли пуговчатый зонд, в то время как снизу по его ходу вводили тонкий желобоватый, который проходит сосочек, суженный сфинктер Одди и проникает в общий желчный проток. Зонд вводится легко, даже если сфинктер сте-нозирован.
Однако при этом имеется опасность— зонд часто может пойти в вирсунгов проток легче, чем в общий желчный.
Об этом следует всегда помнить, так как грубое травмирование вирсунго-ва протока создает угрозу развития послеоперационного панкреатита. Чтобы избежать такой ошибки, следует придерживаться направления терминального сегмента холедоха и, продвигая зонд вперед, пальпатор-но определить, действительно ли он в общем желчном протоке.
Желобок в зонде позволяет провести лезвие тонких ножниц и уже в безопасности сделать нам сфинкте-ротомию.
Длина разреза сфинктера — один из наиболее спорных вопросов. Так, В. В. Виноградов, Е. В. Смирнов, В. И. Петров и О. Б. Порембский применяют папиллотомию, которая, судя по их описаниям, в действительности соответствует истинной папил-лотомии или ограниченной сфинк-теротомии. Аналогичные пределы — 6—10 мм — рекомендуют de Resen-de (1960), Maingot (1964), Hivet и соавторы (1969).
Ограничение протяженности
сфинктеротомии до минимума в некоторых случаях дало неудовлетворительные непосредственные и отдаленные результаты. Простая папил-лотомия и малая сфинктеротомия —
операции с риском рецидива стеноза вследствие последующего рубцевания. Многие из исследователей считают необходимой у большинства больных более обширной сфинктеротомии — протяженностью от 10 до 15 мм (Olivier и соавт., 1963; Taubert, 1965; Kourias и Tierreris, I960; Bra-asch и Me Cann, 1967; Patel и соавт., 1969). При таком способе, который соответствует так называемой умеренной сфинктеротомии, разрез проходит через общий и собственный сфинктер холедоха, но сохраняет верхнюю часть волокон его сфинктера. Это, по мнению авторов, восстанавливает проходимость сфинктера, но частично сохраняет его замы-кательную функцию, предотвращая дуоденобилиарный рефлюкс.
Третья группа исследователей (Jones и соавт., 1958; Bartlett и Nordi, 1960; Gounard—Pelissier, 1960; Vosschulte, 1961; Prichle и Kraft, 1963; de Rosa, 1964; Fritsch, 1965; Heiss и соавт., 1968; Marchal, 1969) придерживаются принципа тотальной сфинктеротомии и применяют разрезы от 15 до 25 мм, чтобы гарантировать рассечение и экстрамура льной части сфинктера. В противном случае, по мнению авторов, существует опасность рецидива стеноза. При такой сфинктеротомии всегда возникает рефлюкс дуоденального содержимого в желчные пути и в некоторых случаях в вирсунгов проток. Однако авторы убедительно доказывают, что такой рефлюкс не имел нежелательных последствий у наблюдавшихся ими больных. Hess (1961) на более раннем этапе своих исследований был сторонником тотальной сфинктеротомии. И все же, он пришел к выводу, что не всегда следует стремиться к перерезке всего сфинктера, но всегда необходимо рассекать весь суженный участок. Hess (1961), как и некоторые другие хирурги (Riddell и Kirtley, 1959; А. Мацковский, 1966) теперь считают, что лучшим способом предохранения от неадекватной сфинктерото-
мии является применение зондов Soler—Roing, Hepp, Lasala, Suarez или Bokes диаметром 8 — 10 мм, которые должны легко проходить через сосочек после сфинктеротомии.
Мы думаем, что длина разреза не может быть критерием адекватности сфинктеротомии, так как протяженность интрамурального хода протока имеет значительные индивидуальные различия, а разрез как раз и должен быть проведен через всю суженную часть сфинктера. В противном случае остается опасность неполного устранения стеноза.
Рассечение экстрамуральных волокон собственного сфинктера холедоха не является обязательным, если там нет стеноза, но, с другой стороны, разрез должен обязательно достигнуть самого широкого участка общего желчного протока. Это значит, что после сфинктеротомии отверстие в соске должно быть равно диаметру общего желчного протока. Чем больше разрез сфинктера, тем больше гарантия профилактики рестеноза и отхождения просмотренных камней-Исходя из этих соображений, мы полагали, что протяженность разреза сфинктера должна быть равной в среднем около 15 мм, но если стеноз распространяется выше, то и разрез сфинктера должен быть продолжен кверху. Это продолжение делается постепенно, так, чтобы быть уверенным, что нет повреждения поджелудочной железы.
В некоторых случаях обнаруживается, что в соске вколочен мелкий камень или есть стриктура, локализованная только в пределах слизистой оболочки у отверстия соска. В таких случаях мы ограничивались простой папиллотомией, если конечно, ампула нормальна и не сужено устье общего желчного протока. Во всех остальных случаях мы прибегали к более широкому разрезу сфинктера.
В отдельных случаях, когда возникает подозрение на раковое поражение, мы иссекали клиновидный
сегмент соска для гистологического исследования.
После рассечения сфинктера вставляли конец зажима в образовавшееся щелевидное отверстие и раздвигали его края, чтобы определить размер выполненной сфинктеротомии. При достаточно широкой сфинктеротомии желчь и детрит свободно вытекают в двенадцатиперстную кишку и отсасываются ассистентом. Камень, если он имеется в холедохе, удаляли корнцангом или простым выдавливанием книзу через расширенное отверстие большого дуоденального соска. После этого общий желчный проток обследовали ретроградно расширителями или ложками и вводили полиэтиленовую трубку для промывания желчных путей теплым раствором новокаина.
Сфинктеропластика. В последние годы сфинктеротомию мы в обязательном порядке завершали сфинкте-ропластикой — шовным соединением слизистых оболочек холедоха и двенадцатиперстной кишки по краям рассеченного сфинктера. Это облегчает гемостаз и укрывает линию разреза мышечного слоя сфинктера, уменьшая размеры последующего рубца.
Необходимость шва в настоящее время оспаривается отдельными хирургами (Riddell и Kiitley, 1959; Olivier и соавт., 1963; Maingot, 1964; Braasch и Mс Cann, 1967). Это вызвано тем, что при наложении швов возникает опасность ранения вирсунго-ва протока с последующим развитием острого панкреатита. Кроме того, наложение швов способствует отечности, воспалению и последующему склерозу в области сфинктера. На основании этого многие авторы отказались от сфинктеропластики, кроме особых случаев, связанных прежде всего с кровотечением и рестенози-рованием после предыдущей сфинктеротомии (Vosschulte, 1961; Hess, 1961; Kourias и Tierris, 1966). Однако приверженцы обширной сфинктеропластики применяют сами и настоятельно рекомендуют накладывать
от 6 до 9 швов (Iones и соавт., 1958; Nordi, 1960; Barteett и Nordi, 1960; Goinard—Pelissier; Reichll и Kraft; de Rosa, 1964; Taubert, 1965; Marc-hal и соавт., 1968).
Cadili и Somariva (1962) на основании опытов на собаках с гистологическим исследованием терминального отдела общего желчного протоку после сфинктеропластики сделали заключение, что при правильно выполненной сфинктеропластике с тщательным ушиванием слизистых оболочек общего желчного протока и двенадцатиперстной кишки достигается стойкое расширение протока на месте пластики без рубцовых сужений, свойственных простой сфинктеротомии.
Hess (1961) долгое время отказывался от шва слизистых оболочек, но поскольку у 2 больных после простой сфинктеротомии он наблюдал повторное стенозирование, то пересмотрел свою точку зрения и теперь считает более безопасным соединять швами края слизистой общего желчного протока и двенадцатиперстной кишки.
Особенно тщательное наложение швов требуется у верхушки разреза, потому что при правильно проведенной сфинктеротомии разрез может выходить за пределы дуоденальной стенки. Если не наложить шов, то возможно образование свища на задней стенке двенадцатиперстной кишки с развитием ретроперитонеальной флегмоны.
Лишь при ограниченной или умеренной сфинктеротомии можно последовать совету Vossehulte (1961)! если сшивание слизистой оболочки общего желчного протока и двенадцатиперстной кишки невозможно произвести анатомически, не применяя насилия, то лучше от этого отказаться, чем попыткой наложения шва повредить стенку и слизистую оболочку желчного протока и способствовать образованию нежелательного рубца.
Чтобы избежать прошивания вир-сунгова протока, предварительно
следует найти его отверстие и осторожно вставить в него пуговчатый зонд или полихлорвиниловый катетер, помня о том, что зондирование вирсунгова протока часто ведет к развитию острого панкреатита. Устье вирсунгова протока обычно удается обнаружить после сфинктеротомии, раздвигая зажимом края сосочка и рассматривая заднюю стенку ампулы. Оно чаще всего располагается в непосредственной близости от отверстия большого дуоденального соска, в направлении стрелки на 5 часов и обнаруживается по выделению бесцветного панкреатического сока. В норме отверстие вирсунгова протока совершенно свободно пропускает зонд или катетер диаметром 3 мм.
Определив таким образом отсутствие сужения в терминальной части вирсунгова протока, приступают к наложению швов. Легче всего наложить нижние швы по обеим сторонам рассеченного соска. Подтягивая потом за эти швы, как за держалки, раскрывают поле для наложения более высоких швов. Для них может быть использован тонкий кетгут или шелк, применяемый в сосудистой хирургии. Мы использовали тонкие нити из капрона. После завязывания всех швов нити обрезают.
Следующим этапом является закрытие дуоденотомического отверстия. Для этого мы использовали поперечные двухрядные швы (непрерывный вворачивающий шов Конне-ля из тонкого кетгута и серозно-серозные П-образные швы из тонкого капрона). Для удобства наложения швов натягивали нити-держалки, одну влево, другую вправо и превращали дуоденотомическое отверстие из продольного в поперечное. Для дополнительной перитонизации линию швов укрывали брыжейкой поперечно-ободочной кишки.
Очень важным мероприятием в профилактике дуоденальных свищей и острого панкреатита является послеоперационная декомпрессия кишки. Для этого вводили через нос зонд
в двенадцатиперстную кишку и оставляли его на 3—4 дня.
Вопрос о необходимости дренирования желчных путей после вмешательств на большом дуоденальном соске трансдуоденальным путем является спорным. Cattell (1947) предложил применять Т-образный дренаж с длинной ветвью, которую проводят транспапиллярно в двенадцатиперстную кишку (рис. 40а). На этой части дренажа должно быть достаточно много боковых отверстий для оттока желчи и сока поджелудочной железы. По мнению ряда авторов, такой дренаж хорошо способствует постоянному зиянию большого дуоденального соска и защищает его от отека и последующего рубцо-вого стеноза. Отдельные авторы накладывали такой дренаж на срок от 3 (Berger и соавт., 1968) до 12 месяцев (Hess, 1961).
Следует, однако, указать, что при всех его преимуществах, транспапиллярному дренажу присущи серьезные недостатки. Во-первых, он создает условия для рефлюкса дуоденального содержимого по дренажу, иногда этот рефлюкс может быть значительным, с потерей до 2—3 л ценной жидкости в сутки. В подобных случаях транспапиллярный дренаж действует как наружный дуоденальный свищ, опасности которого хорошо известны каждому хирургу.
Hess отмечал угрожающую форму этого осложнения (12 на 212 случаев применения транспапиллярного дренажа по способу Cattell).
Во-вторых, транспапиллярный дренаж создает значительную угрозу развития послеоперационного панкреатита вследствие того, что дренажная трубка может перекрывать устье вирсунгова протока и вызывать стаз панкреатического секрета.
Mollowitz, чтобы устранить первый из отмеченных недостатков, предложил вводить в двенадцатиперстную кишку рядом с Т-образным дренажом тонкую поливиниловую тру-
9
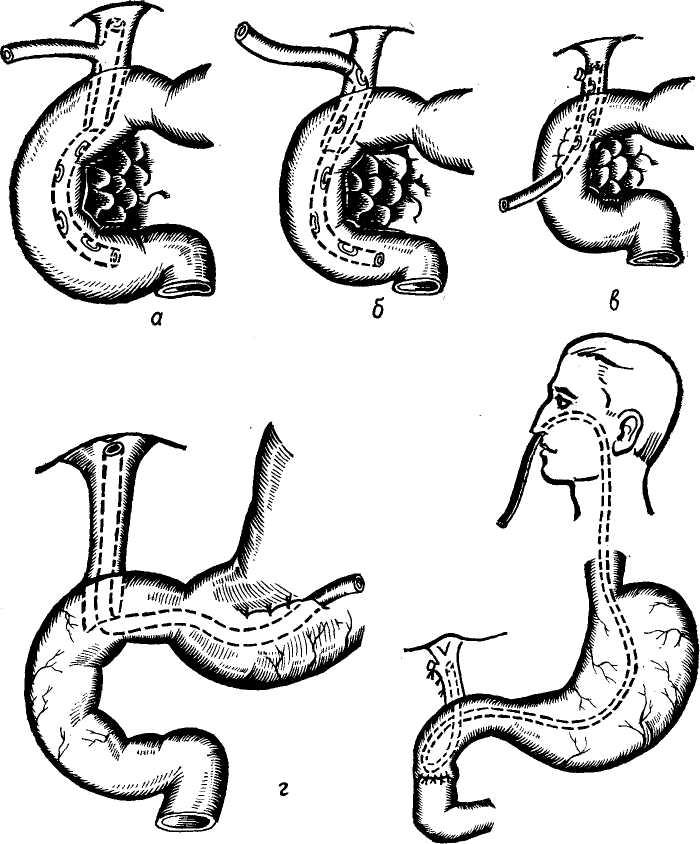
бочку, предназначенную для реин-фузии кишечного отделяемого. Это предложение, однако, не устраняет вторую опасность — возникновения послеоперационного панкреатита. Эту методику применяют в редких случаях лишь немногие хирурги.
Dogliotti предложил транспапиллярный дренаж в виде простой трубочки с множественными боковыми отверстиями. Дренаж выводят наружу через холедохотомическое от-
верстие, как показано на рис 406. О применении этого способа часто сообщается в нашей литературе, но следует признать, что он не имеет каких-либо преимуществ про сравнению с дренажем Cattell.
Voelcker в 1911 г. описал способ транспапиллярного дренирования, при котором используют катетер Не-латона с множественными боковыми отверстиями, выводимый наружу через прокол дуоденальной стенки на-
подобие гастростомии по Вицелю (рис. 40е). Чтобы избежать опасности возникновения дуоденального свища, Calmers предложил выводить наружный конец дренажа через стенку желудка (рис. 40г), a Bailey — через желудок, пищевод и носовой ход (рис. 403).
Преимущество дренажа Voelcker и его модификаций состоит в том, что холедохотомическое отверстие может быть зашито наглухо и дренажная трубка нигде не проходит через стенку протока. Однако имеется тот недостаток, что усложняется выведение наружного конца дренажа, а внутренний конец легко закупоривается или выпадает из холе-доха. Главным недостатком по-прежнему остается опасность послеоперационного панкреатита, и поэтому указанные способы не нашли широкого распространения.
В настоящее время транспапиллярное дренирование большинством хирургов не применяется. Основная причина отказа — развития острого панкреатита у ряда больных с летальными исходами. По данным В. С. Савельева и В. М. Могучева (1973), при применении транспапиллярных дренажей она составляла 30,3%, М. В. Данилов и соавторы (1973) вовсе отказались от этого вида дренирования. По сообщению Sci-асса, на 214 случаев сфинктеротомии операция с транспапиллярным дренированием произведена у 158 больных, без дренирования — у 56. В I группе последующее стенозирова-ние наблюдалось в 3 раза реже, чем во второй, но в I группе умерли 10 больных, из них 6 — в связи с характером оперативного вмешательства, в то время как во II — случаев смерти не было. Hess (1966) на основании собственного опыта сомневается в том, что транспапиллярный дренаж может предотвратить ресте-ноз папиллы, даже при длительном применении. Напротив, дренаж легко вызывает острый послеоперационный панкреатит.
Рис. 41. Постоянный скрытый дренаж по И. А. Брегадзе и А. И. Иванову.
Наконец, следует упомянуть о погружном (потерянном) транспапиллярном дренаже, который в прошлом был особенно излюбленным при пластике желчных протоков (рис. 41). Теперь ввиду его больших недостатков и опасностей почти все хирурги полностью отказались от применения погружного дренажа. Главным недостатком является то, что дренажная трубка, из какого бы материала она не была сделана, быстро закупоривается желчными солями, детритом или слизью и сама становится причиной непроходимости желчных путей, тяжелого восходящего холангита, несостоятельности швов холедоха и желчных свищей. Эти осложнения всегда требуют повторной операции в то время как при применении наружных дренажей для их профилактики достаточно простого промывания или удаления трубки за наружный конец. С другой стороны, погружной дренаж может преждевременно покинуть свое место и спонтанно отойти, что не соответствует поставленным перед ним задачам. И, на-наконец, по-прежнему остается угроза послеоперационного панкреоне-кроза вследствие сдавления и обтура-ции отверстия вирсунгова протока. Е. В. Смирнов и О. Б. Поремский в 1965 г. сообщали о 6 летальных исходах (125 папиллотомий), причем все они были связаны с применением
скрытого транспапиллярного дренажа.
Многие зарубежные авторы, производящие ограниченные или умеренные сфинктеротомии, предпочитают все же оставлять в общем желчном протоке тонкий Т-образный дренаж, если была сделана холедохотомия. Этот дренаж служит в качестве «предохранительного клапана», но большее значение он имеет как диагностический микродренаж, предназначенный для послеоперационных измерений давления и холангиографии. Это особенно важно в тех случаях, когда хирург не уверен, что из желчной системы удалены все камни. Дренаж удаляют на 10—14-й день, но Вга-asch и Me Cann (1967) оставляют его до 6—8 недель.
Сторонники тотальной сфинктеро-пластики считают, что при широком рассечении сфинктера и наложении швов между общим желчным протоком и двенадцатиперстной кишкой нет необходимости дренировать общий желчный проток, в особенности, если операция сделана чисто дуоденальным путем. Fritsch (1965) на основании специальных методов исследований после трансдуоденальной сфинктеротомии показал, что при рационально проведенной сфинктеротомии (15—22 мм) с частичным сохранением функции сфинктера Одди отпадает необходимость в обязательном одновременном наружном дренировании общего желчного протока.
Все же мало сторонников первичного закрытия холедоха. Gones и соавторы во всех случаях холедохо-томии используют тонкую Т-образную трубку с короткими ветвями, несмотря на то, что делают тотальную сфинктеропластику. Hess (1968) не советует глухой шов холедоха после сфинктеротомии. Правда, пишет он, вполне возможно первичное закрытие холедоха, если достигнут совершенно свободный отток желчи. Но при стенозах сфинктера Одди всегда надо предполагать наличие инфекции
желчных путей, а поэтому представляется более безопасным систематически дренировать холедох Т-образным дренажом с короткими ветвями. Преимущества идеальной холедохо-томии, по мнению автора, не велики, а риск в случае недостаточности шва или холангита большой. С другой же стороны, Т-образный дренаж, если он правильно применен, вряд ли имеет какие-либо недостатки.
В нашей стране Т-образный дренаж после сфинктеротомии не применяют, но все больше распространено дренирование холедоха через культю пузырного протока. По данным Е. В. Смирнова и В. С. Мжельского, у 57 из 91 больного после сфинктеротомии без дренажа холедоха наблюдалось повышение уровня амилазы в сыворотке крови и моче и другие симптомы послеоперационного панкреатита, в то время как после такой же операции, но с применением дренажа общего желчного протока, признаки панкреатита отмечены лишь у 4 из 34 больных.
У большинства наших больных мы не применяли никакого дренирования общего желчного протока, тем более транспапиллярного, лишь в 20 из последних операций было применено дренирование через культю пузырного протока. «Для этого использовали тонкую (3 мм) хлорвиниловую трубку, применяемую во время операционной холангиоманометрии, де-битометрии и холангиографии. Трубку укрепляли в культе пузырного протока 2 лигатурами, следя за тем, чтобы конец ее был расположен препапиллярно, а не прошел бы в двенадцатиперстную кишку. Другой конец трубки выводили наружу через отдельный прокол брюшной стенки так, чтобы сама трубка прошла вдоль ложа желчного пузыря, и прикрепляли ее к коже шелковым швом.
В случаях с цистикохоледохото-мией разрез протока аккуратно ушивали до трубки с помощью атравма-тической иглы.
В конце операции через эту трубку повторяли измерения остаточного давления и дебита, таким образом еще раз контролируя полноту сфинк-теротомии.
В послеоперационном периоде проводили контрольные измерения. Пережатие трубки начинали с 4-го дня. На 12—13-й день выполняли кинохолангиографию, а на следую-ющий день трубку удаляли простым вытягиванием. Желчь по ходу этого микродренажа после его удаления не выделялась, отверстие заживало через 1—2 дня. Не наблюдалось каких-либо осложнений, связанных с дренированием холедоха по этому способу.
Главной предпосылкой для применения такого дренажа было проведение исследований для оценки функционального состояния сфинктера Одди после его пластики. Но, как показали наши наблюдения, при использовании микродренажа послеоперационный период протекает спокойнее. Учитывая это, а также возможность надежного послеоперационного контроля и выявления случайных упущений в выполнении операции, можно считать очень полезным применение микродренажа холедоха через культю пузырного протока после трансдуоденальной сфинк-теропластики, в особенности когда нет полной уверенности, что удалены все камни из желчных путей или рассечен весь и без излишней травмы стенозированный сегмент сфинктера. Если же после сфинктеропластики есть совершенно свободный отток желчи в двенадцатиперстную кишку, то применение микродренажа холедоха не показано.
Всегда ли при трансдуоденальной сфинктеропластике необходима холецистэктомия. На этот вопрос мы отвечаем утвердительно, даже если желчный пузырь является почти нормальным. Поскольку наполнение и сокращение желчного пузыря регулируется сфинктером Одди, то после сфинктеротомии пузырь превра-
щается в подобие пассивного желчного дивертикула, в котором поддерживается воспаление и могут формироваться камни. Этим и объясняется необходимость холецистэктомии после каждой сфинктеропластики.
Дренаж вирсунгова протока. Dou-bilet и Mulholland (1948) после трансдуоденальной сфинктеротомии и сфинктеропластики применяли транспапиллярный дренаж вирсунгова протока (рис. 42а). Особенно горячо пропагандирует подобный дренаж Hess (1961). Он считает, что дренаж является профилактикой послеоперационного панкреатита и заслуживает самого широкого применения.
Техника этой операции состоит в следующем. В устье вирсунгова протока после трансдуоденальной сфинктеротомии вводят тонкую хлорвиниловую трубку на глубину около 3 см. Чтобы она не выпадала, ее прикрепляют швом к краю фатерова сосочка или к дуоденальной стенке под ним. Другой конец трубки выводят через общий желчный проток рядом с его дренажом и прикрепляют швом к коже. При этом необходимо внимательно следить за тем, чтобы дренажная трубка не была случайно извлечена из вирсунгова протока и, чтобы она нигде не перегнулась под углом, что вызвало бы ее непроходимость. Вытекание по трубке панкреатического сока показывает, что она помещена правильно. Дуоденото-мическое отверстие закрывается после установления дренажа.
Leger (1958) предложил выводить наружный конец дренажной трубки через особый прокол передней стенки двенадцатиперстной кишки, ниже ду-оденотомического отверстия (рис. 42б). На месте выхода трубки иа дуоденальной стенки формируется косой канал по Витцелю длиной около 2 см. Затем эту трубку выводят наружу через прокол брюшной стенки и прикрепляют к коже. Ту часть трубки, которая проходит через свободную брюшную полость, стараются окружить сальником, но это не является необходимым. Ни в коем случае не следует прикреплять двенадцатиперстную кишку к париетальной брюшине.
Как и большинство других хирургов, мы не применяли после трансду-
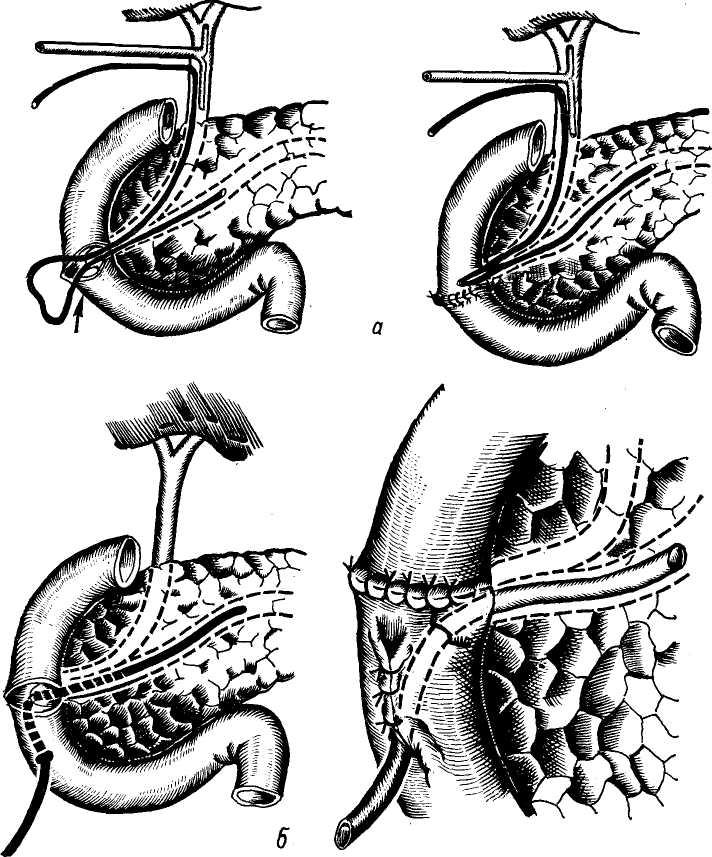
Рис. 42. Дренаж- вирсунгова протока: а — по Doubilel: б — по Zeger:
оденальной сфинктеропластики дренаж вирсунгова протока, за исключением редких случаев.
Пластика устья вирсунгова протока. Как уже подчеркивалось, после рассечения сфинктера Одди необходимо отыскать отверстие вирсунгова протока и тщательно исследовать его, чтобы определить, нет ли какого-нибудь нарушения проходимости главного панкреатического
протока. Это особенно необходимо при повышении уровня сывороточной амилазы и наличии изменений поджелудочной железы, обнаруживаемых на лапаротомии.
В норме отверстие вирсунгова протока свободно пропускает зонд или катетер диаметром 3 мм. Если же обнаруживается стеноз этого отверстия, то должны быть приложены все усилия, чтобы устранить его.
Рис. 43. Пластика устья вирсунгова протока.
Обычная сфинктеропластика, какой бы широкой она ни была, оказывается недостаточной, так как патологические изменения, вызывающие сужение ампулы, распространяются так, что включают и терминальный сегмент панкреатического протока, то есть ту часть сфинктера Одди, которая составляет собственный сфинктер вирсунгова протока. Более того, возможен изолированный стеноз отверстия вирсунгова протока, без стеноза ампулы (Hess, 1966; Acosta и со-авт., 1970). В таких случаях через кишечное отверстие удается ввести только самый тонкий зонд, причем характерно, что вслед за удалением этого зонда из вирсунгова протока под давлением вытекает несколько капель панкреатического сока, иногда с примесью беловатых крошечных цилиндров, представляющих слепки мельчайших панкреатических канальцев.
Необходимо помнить, что зондирование панкреатического протока должно быть проведено с максимальной осторожностью, так как любая излишняя травма может вызвать вспышку панкреатита.
При стенозировании отверстия вирсунгова протока необходимо выполнить не только обычную сфинкте-ропластику, но и применить пластику отверстия панкреатического протока. Эта операция упоминается в литературе под разными названиями:
резекция шпоры между общим желчным и панкреатическим протоками, рассечение (или иссечение) перегородки между дистальными отделами общего желчного и панкреатического протоков, сфинктеротомия вирсунгова протока, У-образная сфинктеротомия, двойная сфинктеротомия. Ее применяют Д. Г. Мамамтавришвили (1970), Hess (1965), Gones и соавт. (1969), Acosta и соавт. (1970) и другие.
Техника этой операции состоит в следующем. После удаления пуговчатого зонда или катетера в отверстие вирсунгова протока на глубину в среднем около 1 см вводят лезвие тонких ножниц. Проток разрезают вдоль его продольной оси в том месте, где имеется шпора между общим желчным и вирсунговым протоком. Это соответствует переднезаднему квадранту отверстия. В этом месте нет панкреатической паренхимы, поэтому не существует опасности поранить поджелудочную железу. При необходимости из указанной шпоры удаляют клин ткани с основанием около 2 мм (рис. 43). Фактически этот клин является частью перегородки, разделяющей нижние концы общего желчного и вирсунгова протока. Удаление его расширяет отверстие панкреатического протока и, кроме того, дает материал для биопсии. Слизистая оболочка панкреатического протока сближается со слизистой общего желчного протока и ампулы тонкими узловатыми швами (от 3 до 5).
Очень важно, чтобы разрез захватывал на всем протяжении участок стеноза. Безопасно рассекать панкреатический проток до 1,5 см от его отверстия. Если же стеноз более распространенный или локализован в нескольких местах (что необходимо проверить операционной панкреато-
графией), то мы предпочитали наложить обходные панкреатоеюнальные анастомозы по методу Duval (1961) или Puestow (1965), если только не показана резекция поджелудочной железы.
Когда операция сделана без излишней травмы, нет необходимости прибегать к наружному дренированию вирсунгова протока. Лишь в сомнительном случае мы с успехом применили дренаж вирсунгова протока по модифицированному методу Leger.
У одного больного мы встретились с редкой патологией — стенозирова-нием устья вирсунгова и санторини-ева протоков. Мы ограничились пластикой вирсунгова протока, но, ретроспективно оценивая это наблюдение, можно сказать, что дополнительная пластика санториниева протока была бы целесообразней. Bart-lett и Nordi в 1960 г. описали редкий случай, когда санториниев проток являлся главным протоком поджелудочной железы и его отверстие было сильно стенозировано. Произведена пластическая операция на отверстии этого протока, и у больного прекратились симптомы рецидивирующего панкреатита.
Если отверстие вирсунгова протока после трансдуоденальной сфинк-теротомии не удается найти в ампуле или на верхушке большого дуодена-нального сосочка, то следует искать его на малом сосочке двенадцатиперстной кишки. Это крошечное анатомическое образование можно определить по оттоку панкреатического секрета.
Patel и соавторы (1969) описывают сфинктеротомию вирсунгова протока «слева направо» при помощи сфинктеротома Leger. Это возможно только при значительном расширении вирсунгова протока. После вскрытия его в области тела поджелудочной железы, панкреатографии и возможной экстракции панкреатических камней сфинктеротом с закрытой гильотиной проводят по протоку в сторону головки поджелудоч-
ной железы и затем в область большого дуоденального соска. Надавливая на рукоятку инструмента, его тупой конец проталкивают через сосочек под контролем пальпации через стенку двенадцатиперстной кишки. Раскрывая гильотину и затем извлекая сфинктеротом, производят резекцию сфинктера вирсунгова протока. Сообщений о клиническом применении подобной методики мы не обнаружили.
В кратком последовательном изложении наша стандартная техника трансдуоденальной сфинктеропласти-ки состоит в следующем: холецистэк-томия и ушивание пузырного ложа; интубация культи пузырного протока и измерение остаточного давления, дебитометрия и операционная холан-гиография; мобилизация двенадцатиперстной кишки и головки поджелудочной железы, пальпаторное исследование желчных путей, фатерова сосочка и головки поджелудочной железы; удаление камней и детрита (если он есть) из желчных путей через культю пузырного протока или холедохотомическое отверстие; проведение трехмиллиметрового пугов-чатого зонда через культю пузырного протока или холедох и через частично стенозированный сфинктер Одди; короткая продольная дуоде-нотомия на передней стенке нисходящей части двенадцатиперстной кишки, в точке, противоположной пу-говчатому концу зонда; наложение 3 держалок в области большого дуоденального соска; расширение отверстия и ампулы большого дуоденального соска снизу для того, чтобы способствовать прохождению пугов-чатого зонда сверху, если его не удалось провести перед дуоденотомией; укрепление прочной нити на пуговча-том конце зонда и захватывание ее изогнутым зажимом с длинными тонкими браншами; протягивание нити кверху с помощью обратного хода пуговчатого зонда для проведения конца зажима через отверстие большого дуоденального соска на глуби-
ну около 20 мм; раскрытие зажима и разведение его браншей для максимального растягивания отверстия сосочка; проведение одного лезвия тонких ножниц через отверстие большого дуоденального соска вверх, в общий желчный проток, на глубину 10—20 мм; рассечение сфинктера (или иссечение клина его ткани) на протяжении 10—20 мм в направлении стрелки на 10—11 часов; определение отверстия вирсунгова протока у края большого дуоденального сосочка и осторожное введение в него пуговча-того зонда; сближение слизистых оболочек общего желчного протока и двенадцатиперстной кишки 7—9 тонкими узловатыми швами по линии рассечения сфинктера; определение ширины отверстия вирсунгова протока и, если необходимо, катетеризация его и панкреатография; дилата-ция отверстия вирсунгова протока (если оно стенозировано зажимом) «москит» для того, чтобы ввести одно лезвие остроконечных ножниц на 5— 10 мм в вирсунгов проток; рассечение устья вирсунгова протока или иссечение клина ткани из перегородки между дистальными концами холе-доха и вирсунгова протока длиной 5—10 мм; наложение 3—5 тонких узловых швов между слизистыми оболочками общего желчного и вирсунгова протоков; промывание общего желчного протока с помощью введенной снизу хлорвиниловой трубки; закрытие дуоденотомического отверстия в поперечном направлении непрерывным швом из тонкого кетгута через все слои и П-образными серо-серозными швами с дополнительной перитонизацией брыжейкой поперечно-ободочной кишки; введение тонкой хлорвиниловой трубки в культю пузырного протока и перевязка его на этой трубке. Ушивание холедохо-томического отверстия (если была сделана холедохотомия); контрольная холангиоманометрия и дебитометрия; выведение второго конца хлорвиниловой трубки через отдельный прокол брюшной стенки в правом под-
реберье и прикрепление ее к коже; дренирование подпеченочного пространства резиновой трубкой, обвернутой перчаточной резиной, и выведение дренажа через отдельный небольшой разрез брюшной стенки в правом фланке; закрытие разреза брюшной стенки.
Необходимо подчеркнуть, что следует очень строго придерживаться всех деталей оперативной техники при трансдуоденальной сфинктеро-пластике. Тогда эта операция будет достаточно безопасной и обеспечит хорошие непосредственные и отдаленные результаты. Эту операцию должны производить высококвалифицированные хирурги в специализированных лечебных учреждениях.
Последствия трансдуоденальной сфинктеропластики. Для изучения функционального состояния рассеченного сфинктера Одди мы провели послеоперационные измерения остаточного давления в общем желчном протоке и дебита через трубку в культе пузырного протока; послеоперационную холангиографию под контролем рентгенотелевидения и кинохо-лангиографию.
Измерения остаточного давления и дебита производили во время опе рации — до и после сфинктеропла- стики, а затем на 1, 2, 3, 7 и 14-й день после нее. Для оценки способ ности сфинктера Одди к сокращению, измерения, производимые на 13-й день, повторяли после внутривенного введения 5 мг сернокислого морфи на. Всего таким образом исследова но 16 больных, перенесших трансду оденальную сфинктеропластику. У всех в послеоперационном периоде проводили прямую (через трубку) холангиографию под контролем рент- генотелевизионного наблюдения, а у 12 больных, кроме того, сделали ки- нохолангиографию до и после инъек ции морфина.
Аналогичные исследования проведены у 15 больных после холецистэк-томии и у 10 — после холецистэк-томии, дополненной селективной
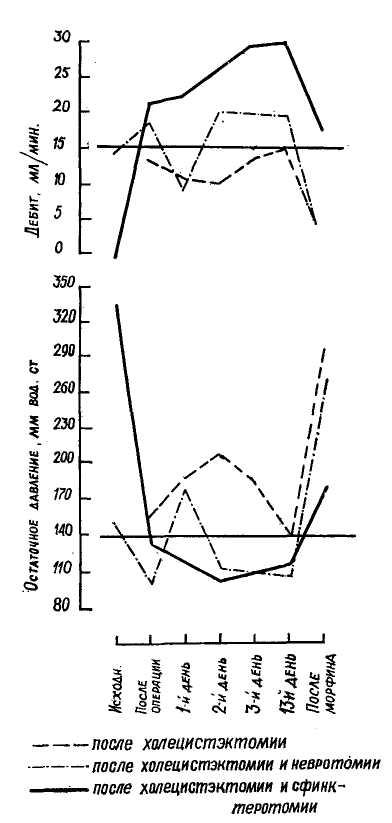
ретрохоледохальной невротомией. Показанием к дренированию пузырного протока после холецистэктомии было повышение остаточного давления и уменьшение дебита, которое можно приписать легкому стенозу или спазму сфинктера Одди.
На основании статистической обработки результатов проведенных исследований построен график (рис.
44) динамики изменения остаточного давления и дебита в послеоперационном периоде после некоторых видов вмешательств на желчных протоках. Из данных графика вытекает, что трансдуоденальную сфинктеропла-стику производили при очень высоком остаточном давлении и низком дебите, но эти показатели нормализовались сразу же после операции и оставались в пределах нормальных величин на протяжении всего послеоперационного периода. Селективную ретрохоледохалъную невротомию производили при показателях, лишь умеренно отклоняющихся от нормы. После нее обнаружено некоторое снижение остаточного давления и легкое увеличение дебита. Однако, к исходу первых суток давление в холедохе значительно превышало норму, но еще через день давление и дебит определялись на нормальном уровне в течение всего послеоперационного периода. В противоположность этому, одна холеци-стэктомия, сделанная при наименее выраженных отклонениях давления и дебита, не привела их к нормализации на протяжении всего времени изучения, хотя микродренаж холе-доха и оставался открытым все это время.
Внутривенное введение морфина у больных после простой холецистэктомии или холецистэктомии с ретрохоледохальной невротомией вызывает быстрый и резкий подъем остаточного давления в холедохе, сохраняющийся в течение 1 часа и более. Дебит после введения морфина у этих больных снижается почти до нуля. Напротив, после сфинктеропластики введение морфина вызывает лишь кратковременный и слабо выраженный подъем остаточного давления и не такое резкое снижение дебита. Это временное повышение давления и уменьшение дебита обусловлено, по-видимому, рефлюксом дуоденального содержимого в холедох, так как вентильный механизм устранен сфин-ктеропластикой.
На основании этих данных можно считать, что трансдуоденальная сфинктеропластика стойко снижает сопротивление патологического сфинктера Одди. Поэтому в наружном профилактическом дренировании хо-ледоха после сфинктеропластики нет никакой необходимости. Ретрохоле-дохальная невротомия может быть применена взамен сфинктеропластики при легких степенях стеноза и спазма сфинктера, но самостоятельного значения как метода лечения, она, по-видимому, не имеет. Простая холецистэктомия с временным наружным микродренажом холедоха даже при легких поражениях сфинктера Одди не оказывает нормализующего действия на его тонус.
После адекватной трансдуоденальной сфинктеропластики сохраняется ритмическая деятельность сфинктер-ного сегмента холедоха, но ритм сокращений явно изменен — фаза раскрытия удлиняется, а фаза сокращения укорачивается по сравнению с нормой. Введение морфина мало изменяет характер холедоходуоденаль-ного оттока. Перистальтические сокращения двенадцатиперстной кишки после тотальной сфинктеропластики вызывают интермиттирующий реф-люкс контрастного вещества вверх, в общий желчный проток, что свидетельствует о нарушении запира-тельной функции сфинктера Одди.
При быстром введении контрастного раствора после сфинктеропластики не определяется видимое расширение проксимального сегмента холедоха и больные не испытывают никаких болевых ощущений. Ни разу после трансдуоденальной сфинктеропластики мы не наблюдали реф-люкса контрастного вещества в вир-сунгов проток. Это еще раз подтверждает наличие собственного сфинктера вирсунгова протока.
В противоположность только что описанной картине, после простой холецистэктомии или селектив-вой ретрохоледохальной невротомии отчетливо определяются перисталь-
тические сокращения сфинктерного сегмента с порционным поступлением контрастного вещества в двенадцатиперстную кишку. После введения морфина отток в двенадцатиперстную кишку при обычном давлении прекращается, а повышение перфу-зионного давления сопровождается видимой дилатацией холедоха и выраженными субъективными симптомами — коликообразной болью в животе и тошнотой.
Послеоперационное бариевое исследование желудка и двенадцатиперстной кишки в сроки от 2 месяцев до 2 лет после трансдуоденальной сфинктеропластики было произведено у 47 больных. У 19 из них отмечено наличие газа в желчных путях (рис. 45а), и рефлюкс бария в холе-дох (рис. 45б). Рефлюкс был незначительным и очень кратковременным. Эти симптомы мы рассматривали как доказательство адекватности сфинктеропластики. Холангит не развился ни в одном из случаев с наличием рефлюкса. Это можно объяснить отсутствием какого-либо стаза в желчных путях благодаря хорошему их дренированию в двенадцатиперстную кишку.
Приведенные данные позволяют сказать, что правильно сделанная трансдуоденальная сфинктеропластика не сопровождается рубцовым сужением вновь сформированного холе-доходуоденального соустья.
ОСЛОЖНЕНИЯ И ЛЕТАЛЬНОСТЬ
Операционные осложнения транс-дуоденальной сфинктеропластики могут быть разделены на 2 группы: наступающие при обнаружении большого дуоденального сосочка и связанные с самой сфинктеропластикой.
Наиболее частым осложнением у больных I группы является образование ложного хода. Он возникает при перфорации холедоха инструментом, вводимым для зондирования большого дуоденального сосочка свер-
Рис. 45. Послеоперационное исследование с бар ием;
а — газ в желчных протоках после трансдуоденальной сфинктеропластики; б — рефлюкс бария в желчные протоки после трансдуоденальной сфинктеротомии.
ху. Нерр (цит. по Patel и соавт., 1969) на 1753 случаях сфинктеротомии наблюдал это осложнение у 17 больных (1%). Как правило, перфорация происходит в терминальном сегменте холедоха, и зонд (или другой инструмент), пройдя через ложный ход, проникает в просвет двенадцатиперстной кишки выше сосочка. Если используемый инструмент тонкий, то лечение этого осложнения не представляет сложностей: отыскав отверстие сосочка, сфинктеротомию проводят так, чтобы соединить оба отверстия. Иногда для этого необходимо произвести довольно длинный разрез. Необходимо тщательно сопоставить швами стенки холедоха и двенадцатиперстной кишки для ликвидации этого отверстия.
При использовании более грубого инструмента возможна тяжелая травма. Мы наблюдали отрыв большого дуоденального сосочка при его зондировании и были вынуждены завершить операцию холедохоеюно-стомией.
Сфинктеропластика изолированным трансдуоденальным путем также сопряжена с опасностью обра-
зования ложного хода. При неаккуратном зондировании отверстия сосочка зонд может проникнуть в под-слизистый слой двенадцатиперстной кишки вдоль холедоха и выйти в свободную брюшную полость или за-брюшинное пространство. Мы дважды наблюдали подобное осложнение. В одном случае ложный ход был ушит при сфинктеропластике без дальнейших осложнений, но в другом случае образовался дуоденальный свищ и забрюшинная некротическая флегмона, ставшая причиной летального исхода.
Осложнения сфинктеротомии и сфинктеропластики: образование сквозного дефекта в задней дуоденальной стенке при слишком глубоком рассечении собственного сфинктера холедоха, а также прошивание вирсунгова протока с последующим панкреонекрозом, который является грозным послеоперационным осложнением.
Истинную частоту «чистого» послеоперационного панкреатита трудно установить, так как у многих больных он развивается как обострение хронического рецидивирующего. Раз-
витию этого осложнения способствуют послеоперационный дуоденальный стаз и прямая травма терминального сегмента холедоха, вирсунгова протока и ткани поджелудочной железы.
Исследуя амилазу, липазу и трипсин в дооперационном периоде и в первые дни после операции, мы обнаружили довольно частые функциональные и органические изменения поджелудочной железы после вмешательства на общем желчном протоке и сфинктере Одди.
После трансдуоденальной сфинк-теропластики амилаза сыворотки и мочи была повышена у 12 больных (10%). Одна из них умерла в результате панкреонекроза. Можно предполагать, что причиной его в этом случае была техническая погрешность — случайное прошивание вирсунгова протока.
Диагностика острого панкреатита после сфинктеропластики трудна, особенно в ранние сроки после операции. Прогрессирующее падение артериального давления, олигурия, возбуждение, частая рвота или большое количество отсасываемого из желудка содержимого должны наводить на мысль о развитии этого осложнения. Систематическое исследование панкреатических ферментов в первые послеоперационные дни может дать хирургу полезные сведения о состоянии поджелудочной железы и дать возможность своевременно предупредить послеоперационный острый панкреатит.
Многие авторы преувеличивают опасность панкреатита, относя его к специфическим осложнениям трансдуоденальной сфинктеропластики. Полностью согласиться с этим мнением нельзя. Ведь послеоперационные панкреатиты в хирургии были известны еще до введения операций на сфинктере и не так уж редко. После простой холедохотомии Hess находил острый панкреатит у 9,8%, Mil-lbourn — у 9%, a Block — даже у 13,8% больных (цит. по Hess, 1966).
Каждому опытному хирургу хорошо знакомы случаи панкреонекроза даже после простых резекций желудка и других несложных операций. Маигег при 674 операциях на желудке у 27% больных и при 1032 вмешательствах на желчных путях у 18% больных отметил повышение уровня амилазы в моче. Сопоставление приведенных данных свидетельствует о том, что послеоперационные панкреатиты после сфинктеротомии и сфинктеропластики встречаются не чаще, чем после других вмешательств на желчных путях.
Следующим осложнением, на которое особенно указывают противники трансдуоденальной сфинктеротомии, являются дуоденальные свищи, связанные с дуоденотомией.
Hess (1961) наблюдал 2 больных с дуоденальным свищом с летальным исходом из 113 больных, которым была произведена трансдуоденальная сфинктеротомия. В обоих случаях автор отметил недостаток техники. Stiller (1963) также описал два случая с недостаточностью шва двенадцатиперстной кишки, но с полным правом ссылался на то, что эта опасность существует и при супрадуоденальной холедоходуоденостомии.
Мы наблюдали недостаточность швов двенадцатиперстной кишки у 4 больных. У 1 больного свищ был небольшим и зажил самостоятельно. У 2 — развился перитоните летальным исходом. У 2 остальных больных дуоденальный свищ сочетался с панкреонекрозом и ложным ходом с забрюшинной флегмоной, которые послужили причиной летального исхода.
Во всех этих случаях причина образования дуоденального свища была связана с техническими погрешностями во время операции. Можно утверждать, что при хорошей технике и правильном двухрядном шве нет опасности образования дуоденального свища. Niedner (1956) не имел этого осложнения при выполнении 52 операций, Heiss (1965) — при 138
операциях. Полезным профилактическим мероприятием является систематическая аспирация желудочного и дуоденального содержимого в первые 3—5 дней после операции.
В качестве возможного осложнения необходимо иметь в виду кишечное кровотечение из дуоденального разреза или из разреза сфинктера. Wense (1970) описал 2 больных с тяжелыми кровотечениями после сфинктеротомии. Мы, применяя шов по линии разреза сфинктера, ни разу не сталкивались с подобным осложнением.
Желудочный стаз собственно нельзя назвать осложнением, так как он развивается в каждом случае вследствие частичной дуоденальной непроходимости в первые послеоперационные дни. Аспирация желудочного содержимого по зонду поэтому является необходимой у каждого больного и устраняет стаз в течение 3—4 дней. Продолжительность симптомов желудочного стаза в большой степени зависит от техники ушивания дуоденотомического разреза. Дуоденальные стенозы, вызванные неадекватным ушиванием двенадцатиперстной кишки, очень редки, но им благоприятствует слишком длинная вертикальная дуоденотомия и грубое ушивание.
Частота поздних холангитов после сфинктеротомии специально изучена Lataste и Lenriot (1967). На 120 сфинктеротомии они отметили 5 больных с тяжелым холангитом, потребовавшим повторного вмешательства. Характерно, что сфинкте-ротомия у этих больных была сделана при атоничном и резко расширенном холедохе, то есть при условиях, когда мы сфинктеропластику не рекомендуем. Авторы не обнаружили в этих случаях препятствия к оттоку желчи в виде камней или рестеноза, но выявили значительное увеличение диаметра общего желчного протока. У 3 больных на реопе-рации наложен холедоходуоденаль-ный анастомоз и у 2 — холедохо-
еюноанастомоз с отличными резуль-тами.
Kourias и Fierris (1966) также наблюдали холангит с гепатитом, тяжелый у 2 больных и умеренный у 2 больных. Все 4 больных вылечены без повторных операций.
Приступы умеренного холангита в отдаленном периоде мы отмечали у 3 больных. Холангитические симптомы удавалось ликвидировать проведением консервативной терапии в условиях стационара, и повторное хирургическое вмешательство не потребовалось. Ни разу не отмечено холангита у тех больных, у которых имелось широкое холедохо дуоденальное сообщение при свободном дуоденоби-лиарном рефлюксе. На основании этого мы считали, что опасность такого рефлюкса и восходящего холангита преувеличена. Холангит является следствием недостаточного дренирования холедоха после неполных сфинктеротомии. Можно утверждать, что чем шире сфинктеропластика, тем меньше опасность послеоперационного холангита.
Явно незначительной представляется опасность истинного рестеноза сфинктера Одди (Taubert, 1965; Boh-mig и соавт., 1971). Нашим 2 больным чаще применяли неадекватную сфинктеротомию, чем истинное ресте-нозирование. И все же рестеноз может встречаться вопреки всем предосторожностям, ибо он встречается при любых других операциях с наложением анастомоза. Удовлетворительные результаты при рестенозе вполне могут быть достигнуты повторной тотальной сфинктеропластикой (Nordi и Acosta, 1966).
Поскольку показания и техника вмешательства еще очень разнообразны, единая оценка результатов трансдуоденальной сфинктеропластики едва ли возможна. Все же находим полезным привести табл. 9.
Мы произвели 166 операций трансдуоденальной сфинктеротомии и сфинктеропластики и было всего 6 летальных исходов (3,6%), из них
Таблица 9
Летальность после трансдуоденальной сфинктеротомии и сфинктеропластики
