
Химические свойства:
Металлического протактиния
Металлический
протактиний был впервые получен Гроссе
и Агруссом бомбардировкой электронами
с энергией 35 кэв в высоком вакууме
пятиокиси протактиния, нанесенной на
медную мишень. А также термическим
разложением галогенидов протактиния
(хлорида, бромида и иодида) на вольфрамовой
нити при повышенной температуре и
давлении 1·
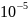 -
1·
мм рт. ст. Металлический протактиний
получен восстановлением РаF4
парами бария или кальция при 1400-1500 ͦ С.
Имеются данные, что протактиний
осаждается в виде тонкой пленкой на
металлических пластинах (Zn,
Al,
Mn
и др.) из разбавленных растворов HF
и H2SO4.
Легко
реагирует
с
водородом при 250-300 ͦ С, образуя черный
гидрид РаН3,
изоструктурный
с UН3.
С
иодом металлический протактиний образует
летучие соединения, которые не были
идентифицированы. Протактиний не
образует амальгамы.
-
1·
мм рт. ст. Металлический протактиний
получен восстановлением РаF4
парами бария или кальция при 1400-1500 ͦ С.
Имеются данные, что протактиний
осаждается в виде тонкой пленкой на
металлических пластинах (Zn,
Al,
Mn
и др.) из разбавленных растворов HF
и H2SO4.
Легко
реагирует
с
водородом при 250-300 ͦ С, образуя черный
гидрид РаН3,
изоструктурный
с UН3.
С
иодом металлический протактиний образует
летучие соединения, которые не были
идентифицированы. Протактиний не
образует амальгамы.
Металлический протактиний бурно реагирует в первый момент с 6Н НСl, но за тем реакция быстро прекращается. Добавление HF вначале способствует растворению протактиния, однако реакция также быстро прекращается. При этом металл покрывается гелеобразно пленкой. В смеси HF и НСl металлический протактиний не растворяется.
Соединения протактиния
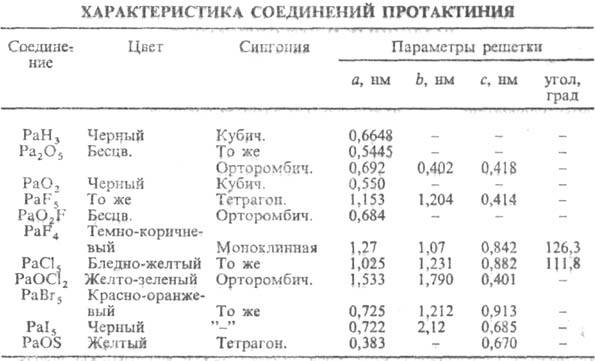
Пятиокись протактиния, Ра2О5. Широко используется в аналитической химии этого элемента в качестве устойчивой весовой формы. Ра2О5 получают при нагревании на воздухе гидроокиси протактиния при 500 ͦ С или оксалата при 600-800 ͦ С. А также при прокаливании двуокиси протактиния в токе кислорода при 1100 ͦ С. Нагреванием Ра2О5 в вакууме, а также восстановлением пятиокиси водородом были получены низшие оксиды протактиния.
Двуокись протактиния РаО2. Была получена при восстановлении РаСl5 порошком металлического цинка, а также при действии водорода на РаО2 , при температуре 1550 ͦ С. РаО2 легко окисляется на воздухе при температуре выше 180 ͦ С.
Пентафторид протактиния РаF5. Получен взаимодействием РаF4 с фтором при 700 ͦ С. Вычесленная теплота образования пентафторида протактиния составляет 500 ккал/моль.
PaО2+4HF= PaF4+2H2О
Оксифторид протактиния Ра2ОF8. Образуется при нагревании РаF5·Н2О при 160 ͦ С, а также при действии F2 или смеси HF и O2 на Ра2О5.
Пентахлорид протактиния РаСl5. Образуется при действии на Ра2О5 фосгена при 550 ͦ С или смеси хлора и четыреххлористого углерода при 300-400 ͦ С. Получали РаСl5 также действием хлора и ССl4 на Ра2О5 и С при температуре 525 ͦ С. Недавно РаСl5 был получен обработкой свежеосажденной гидроокиси протактиния тионилхлоридом при комнатной температуре.
2РаС15 + Н2 = 2РаС14 + 2НС1
Бромиды, иодиды. Были получены при действии на металлический протактиний, пятиокись и пентахлорид протактиния бромирующих. При взаемодействии Ра2О5 c AlBr3 получен красно-желтый пентабромид протактиния РаBr5. Пары бромидов реагируют с смесью Ра2О5 и С при температуре 600-700 ͦ С с образованием двух бромидов, которые могут быть разделены возгонкой на РаBr5 и РаОBr3.
Оксисульфид протактиния. При действии смеси H2S и CS2 на РаСl5 при 900 ͦ С или на Ра2О5 при 1200 ͦ С получен желтый нелетучий Ра0,95ОS
Карбид протактиния. Восстановлением РаF4 металлическим барием в графитовом тигле при 1400 ͦ С получен продукт с предполагаемым составом РаС.
Нитрид протактиния. При действии газообразного NH3 на РаСl5 или РаСl4 при 800 ͦ С и давлении 540 мм РТ. ст. получено желтое вещество предполагаемого состава РаN2 , нелетучее при 800 ͦ С.
Гидрид протактиния. Металлический протактиний реагирует с водородом при 250-300 ͦ С, образуя черный гидрид РаН3.
