
Введение
Актино́иды (актини́ды) — семейство, состоящее из 14 радиоактивных химических элементов III группы 7-го периода периодической системы с атомными номерами 90—103.
Данная группа состоит из тория, протактиния, урана, нептуния, плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, менделевия, нобелия и лоуренсия. Актиний часто для удобства сравнения рассматривается вместе с этими элементами, однако к актиноидам он не относится[1]. Термин «актиноиды» был предложен Виктором Гольдшмидтом в 1937 году[2].
Химия протактиния до последнего времени было мало разработана. Это объясняется специфическими свойствами данного элемента. С одной стороны, малая распространенность протактиния требует особых избирательных методов определения. С другой стороны, легкая гидролизуемость протактиния, сравнимая с гидролизуемостью его химических аналогов - ниобия и тантала, часто приводит к образованию смешанных полимерных соединений протактиния с некоторыми элементами, в результате чего он теряет свою химическую индивидуальность и становится трудноуправляемым.
Целью данной курсовой работы является: изучить теоретические сведенья, основные ядерно-химические свойства данного актинида. Рассмотреть методы и технологию получения, а так же способы его выделения. Изучить метод экстракции и выполнить расчеты.
Общие сведения элемента
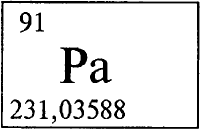
ПРОТАКТИ́НИЙ (лат. Protactinium, от греч. «протос» — первый и актиний). Pа - радиоактивный химический элемент. Расположен в группе IIIB в седьмом периоде периодической системы. Электронная конфигурация трех внешних слоев атома 5s2p6d10f26s2p6d 17s 2. Первый элемент в семействе актиноидов, в невозбужденном атоме которого имеются 5 f-электроны. В соединениях проявляет степени окисления +3, +4, +5 (валентности III, IV или V). В степенях окисления +3 и +4 ведет себя как актиноид. В степени окисления +5, (наиболее характерной), ведет себя как ниобий и тантал. Радиус нейтрального атома протактиния 0,163 нм, радиусы ионов Pа4+ 0,0944 нм, Pа5+0,090 нм. Энергия ионизации нейтрального атома 5,9 эВ. Электроотрицательность по Полингу 1,14.
Протактиний – чрезвычайно мало распространенный в природе радиоактивный элемент. В периодической системе он расположен между торием и танталом. В последнее время, согласно актинидной концепции, протактиний вместе с торием и двенадцатью другими следующими за ними элементами объединяют в одну группу с актинием.
Протактиний — один из немногих элементов, существование которых предсказано почти за полвека до его открытия... Он один из немногих элементов с двойственным химическим характером: в одних случаях, в одном валентном состоянии, он подобен элементам V группы ниобию и танталу, а в других — актиноидам. Протактиний — элемент, для которого пока не нашли практического применения.
Как член актинидного ряда протактиний привлекает внимание с чисто научной стороны. По своей природе и химическому поведению протактиний является одним из наиболее интересных тяжелых элементов.
Благодаря очень сильной склонности к гидролизу в растворах, протактиний часто теряет свои индивидуальные свойства при выделение из природных объектов, в которых содержание его составляет исключительно малую величину. Поэтому его нередко заслужено называют «трудноуправляемым» элементом. Из пяти с половиной тонн богатой богемской урановой смоляной руды можно получить полграмма относительно чистого протактиния.
История открытия
Располагая химические элементы в периодической системе, Д. И. Менделеев оставлял, как известно, пустые места для еще не открытых элементов. Осталось свободным и место между торием и ураном — двумя самыми тяжелыми из всех известных тогда элементов. Предположив, что атомный вес нового элемента будет около 235, а химические свойства аналогичны свойствам тантала, Менделеев назвал его экатанталом. Экатантал оказался протактинием. Первые сообщения об открытии протактиния появились в 1917 году
В 1913 г. Фаянс и Гёринг открыли в продуктах распада урана изотоп UX2 (234-Pa) с периодом полураспада около 1 мин., названный из-за короткого времени жизни «бревием» (от лат. brevis — «короткий» или «краткий»). Затем Блек, Ган и Мейтнер обнаружили сходство свойств UX2 с танталом. В 1918 г. Ган и Мейтнер в урановой смолке и, независимо от них Содде и Кренстон, открыли долгоживущий изотоп протактиния, названного так потому, что он являлся предшественником актиния.
В 1927 были выделены первые 2 мг чистого соединения протактиния — оксида Ра2О5 Гроссе, который изучил основные химические свойства элемента и установил его атомный вес, который равный 231.
Гайсинский и Буиссьер изучили общие и электрохимические свойства элемента и в 40-х годах установили возможность существования протактиния в четырехвалентном состоянии.
В связи с интенсивным развитием урановой промышленности появилась возможность выделения весьма значительных количеств Ра-231 из технологических отходов. Мэддок детально изучил распределения протактиния в технологических продуктах уранового завода и указал ряд возможных источников выделения элемента. В 1960 г. в Англии было выделено более 130 грамм протактиния-231, что расширило возможности дальнейшего изучения свойств этого элемента. Примерно в то же время значительные количества протактиния были выделены в Советском Союзе.
В
последнее время интерес к протактинию
сильно вырос, что связано с проблемой
ториевого реактора, а также и с возможным
применением элемента для получения
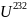 , который может быть использован для
создания изотопных источников тока и
для других целей.
, который может быть использован для
создания изотопных источников тока и
для других целей.
К 1988 в мире из урановых руд было выделено около 150 г протактиния.
Нахождение в природе
Протактиний
– крайне малораспространенный элемент.
Даже у долго живущего природного изотопа
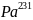 (Т=32480 лет) продолжительность жизни
ничтожно мала по сравнению с возрастом
Земли. Этот изотоп постоянно образуется
при распаде
(Т=32480 лет) продолжительность жизни
ничтожно мала по сравнению с возрастом
Земли. Этот изотоп постоянно образуется
при распаде
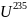 и
находится с ним в радиоактивном
равновесии. По мере распада
в земной коре пропорционально уменьшается
и содержания протактиния. Например, 4,5
миллиарда лет назад содержания протактиния
было в 16 раз больше, чем в современную
геологическую эпоху. Общее содержание
протактиния в земной коре согласно
оценке содержания урана, определяемого
в 1,3·
и
находится с ним в радиоактивном
равновесии. По мере распада
в земной коре пропорционально уменьшается
и содержания протактиния. Например, 4,5
миллиарда лет назад содержания протактиния
было в 16 раз больше, чем в современную
геологическую эпоху. Общее содержание
протактиния в земной коре согласно
оценке содержания урана, определяемого
в 1,3·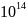 т,
составляет 4,4·
т,
составляет 4,4·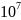 т.
По последним данным, содержание
протактиния в земной коре соответствует
1·
т.
По последним данным, содержание
протактиния в земной коре соответствует
1·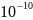 %
по массе. Содержания протактиния в
горных породах вулканического
происхождения составляет 0,8·
%
по массе. Содержания протактиния в
горных породах вулканического
происхождения составляет 0,8·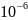 г/т, а в железных метеоритах 0,02·
г/т.
По другим сведеньям, граниты содержат
0,46·
г
на 1 т породы, а каменные метеориты
0,035·
г/т.
Радионуклиды
протактиния входят в состав естественных
радиоактивных рядов урана-235 и урана-238
(ядерные изомеры 234-Ра, Т1/2
=
6,7 часа и менее устойчивый 234-Pa). В 1 т
урана в урановых около 0,3 г протактиния-231.
г/т, а в железных метеоритах 0,02·
г/т.
По другим сведеньям, граниты содержат
0,46·
г
на 1 т породы, а каменные метеориты
0,035·
г/т.
Радионуклиды
протактиния входят в состав естественных
радиоактивных рядов урана-235 и урана-238
(ядерные изомеры 234-Ра, Т1/2
=
6,7 часа и менее устойчивый 234-Pa). В 1 т
урана в урановых около 0,3 г протактиния-231.
Физические свойства
Протактиний
— светло-серый металл, по твёрдости
приближающийся к урану. Металлический
протактиний существует в двух модификация
При температуре 2К обладает
сверхпроводимостью. Металлический
протактиний кристаллизуется в
тетрагональной сингонии. При 1170 ͦ С
существует объёмно-центрированная
кубическая модификация. Протактиний
на воздухе обычно покрывается тонкой
плёнкой монооксида. Плотность 15,37 г/
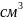 ,
tпл
около 1570°C, t кип.=4500
ͦ С.
,
tпл
около 1570°C, t кип.=4500
ͦ С.
Токсические свойства
Как
и все α-излучатели со сравнительно
небольшим периодом жизни,
представляет опасность для организма.
При попадании в организм он склонен
накапливаться в почках и костях.
Максимальное безопасное количество
протактиния при попадании внутрь
организма человека составляет 0,03 мккюри,
что соответствует 0,5 мкг
.
Протактиний-231, содержащийся в воздухе
в виде аэрозолей, в 2,5·
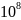 раз токсичнее, чем синильная кислота(при
одинаковых их концентрациях). Поэтому
все работы с весовыми количествами
проводятся в специальных изолированных
боксах.
раз токсичнее, чем синильная кислота(при
одинаковых их концентрациях). Поэтому
все работы с весовыми количествами
проводятся в специальных изолированных
боксах.
Ядерно – химические свойства
